沈梓力 李美芹 邱甜 吴燕燕 吴月燕 谢晓鸿


摘要:通过性状的统计分析和开发的SSR多态位点的统计分析,筛选以粉红泡泡(母本)和白鹤(父本)杂交育种产生的F1代的优良新品种,以期作为今后开发推广的一种新型种质资源。采用表型分析结合SSR分子标记分析的方式,对杜鹃亲本及F1代的49份种质的遗传多样性进行系统评价和分类分析。表型性状结果表明,花色的变异系数最大,为54%;叶片绒毛变异系数最小,为25%。表型性状聚类分析结果表明,亲本及F1代聚为7个类群,第1类包含2个个体,第2类包含2个个体,第3类包含4个个体,第4类包含17个个体,第5类包含4个个体,第6类包含9个个体,第7类包含13个个体。分子聚类结果表明,亲本及F1代共聚成6个类群,第1类包含13个个体,第2类包含7个个体,第3类包含7个个体,第4类包含8个个体,第5类包含15个个体,第6类包含1个个体。据SSR标记的聚类与表型性状聚类具有一定的相关性但并不完全一致。
关键词:杜鹃花;表型性状;SSR标记;种质资源
中图分类号: S685.210.24文献标志码: A
文章编号:1002-1302(2019)18-0177-05
收稿日期:2018-05-27
基金项目:浙江省宁波市重大科技专项(编号:2014C11002);浙江省“生物工程”重中之重学科学生创新计划(编号:CX2017012)。
作者简介:沈梓力(1993—),男,浙江温州人,硕士研究生,研究方向为食品化学工程与安全控制。E-mail:747643963@qq.com。
通信作者:谢晓鸿,硕士,高级农艺师,研究方向为观赏植物应用研究。E-mail:285300628@qq.com。
杜鹃花(Rhododendron simsii L.)属杜鹃花科(Ericaceae)杜鹃花属(Rhododendron),是我国十大名花之一。我国是杜鹃花的起源地之一,具有丰富的种质资源,但是我国新种质资源的开发起步较晚,造成我国种质资源相对匮乏的局面[1]。目前,多利用杂交育种的方式选育优良植株,这类植株具有观赏性高的特点,但难以确保基因的多样性,可能会对进一步的育种工作造成影响。因此,利用表型性状结合分子标记技术筛选优良新种质是杜鹃花选育的有效途径。表型多样性的研究主要是通过科学有效地采样、合理有效的数学统计方法[2],根据形态性状、生理生化性状等变异较稳定的性状,揭示群体的遗传规律和变异大小,客观评价其遗传多样性。目前,许多学者利用表型性状研究生物多样性,在甜瓜(Cucumis melo L.)[3]、大蒜(Allium sativum L.)[4]、菊花(Chrysanthemum×morifolium Ramat.)[5]、水稻(Oryza sativa)[6]、猕猴桃(Actinidia spp.)[7]、孔雀草(Tagetes patula L.)[8]、板栗(Castanea mollissima Bl.)[9]等植物中得到了应用。基因多样性鉴定多依据植株基因组的重要作用位点的多样性进行鉴定,确定植株基因的多样性。
简单重复序列(simple sequence sepeat,简称SSR)即微卫星DNA(microsatellite DNA),是广泛存在于真核和原核生物基因组中1~6个核苷酸基元串联重复而成的DNA序列[10],是基于PCR技术建立起来的第2代分子标记技术,该标记主要根据生物中SSR位点的多寡来判断不同生物个体的基因多样性,从而判断物种的多样性及丰富性,具有多态性高、共显性、通用性高、可靠性且重复性高等特点[11],常用于遗传连锁图谱的构建、遗传多样性的检测、基因定位及分子标记辅助选择等。
目前,有学者利用表型性状结合分子标记技术研究生物遗传多样性,在五节芒(Miscanthus floridulus)[12]、棉属(Gossypium Lin.)[13]、紫薇(Lagerstroemia indica)[14]、杜鹃(Rhododendron L.)[15-16]等植物中均有报道,但利用表型性状结合SSR标记创制杂交F1代杜鹃花种质资源的研究尚未见报道。开展杜鹃花种质资源创制,对于杜鹃花优良种质资源的收集、保存、评价和利用具有重要意义。因此,本研究以白鹤和粉红泡泡杂交F1代为基础,结合形态标记和SSR分析,开展了杜鹃花种质资源的创制研究,旨在为杜鹃花的新种质创制、生产应用以及杜鹃花种质资源的发展提供科学依据。
1?材料与方法
1.1?试验材料
试验母本白鹤与父本粉红泡泡于2011年4月进行杂交,2016年9月进行试验,田间试验基地为浙江省宁波市北仑万景杜鹃良种园,从获得的100株F1代中随机抽取49株作为试验材料。
1.2?试验方法
1.2.1?表型性状的选取与编码
收集亲本及F1代49株植株的叶片并编号挂牌,对表型性状进行统计。以杜鹃花数量分类[17]与杜鹃花品种资源和构建分类体系的调查研究[18]为基础。选取园艺植物的10个性状进行统计(表1),主要分为株型、分枝特性、枝条颜色、叶片颜色、绒毛特性、叶缘、花冠类型、花冠形状、花色以及花缘进行性状统计和测量。
1.2.2?基因组DNA提取
采用改良CTAB法[19]提取基因组DNA,采用BIO-RAD Smart Spec Plus核酸纯度仪和1.0%琼脂糖凝胶电泳检测所提取DNA的完整性和纯度,根据检测结果将可用DNA样品稀释至50 ng/μL,保存于-20 ℃冰箱中备用。
1.2.3?SSR分析
选用本试验开发的10对多态性SSR引物对亲本及F1代49份材料的基因型进行检测。PCR反应总体系为10 μL,包括1 μL 1×Buffer(含Mg+)、0.8 μL0.2 mmol/L dNTPs、1 μL 0.25 mmol/L上下游引物、0.1 μL0.5 U DNA polymerase以及0.5 μL 50 ng/μL DNA模板,加6.6 μL ddH2O補齐体系。反应在Eppendorf公司生产的Mastercycler普通梯度PCR仪上进行。反应程序:94 ℃预变性4 min;94 ℃变性40 s,56 ℃退火40 s,72 ℃延伸1 min,35个循环;72 ℃延伸7 min;4 ℃保存。PCR扩增产物利用聚丙烯酰胺凝胶电泳(PAGE)检测,EB染色,紫外凝胶成像系统(Bio-rad Gel Doc XR+)成像观察。
1.3?数据处理与分析
对表型数据进行统计整理后,遗传距离利用Pearson相关系数进行转化后表示;统计整理SSR位点信息,利用SPSS 19.0软件进行聚类分析方法计算并建立表型及基因分类树状图[20]。
2?结果与分析
2.1?主要性状分析
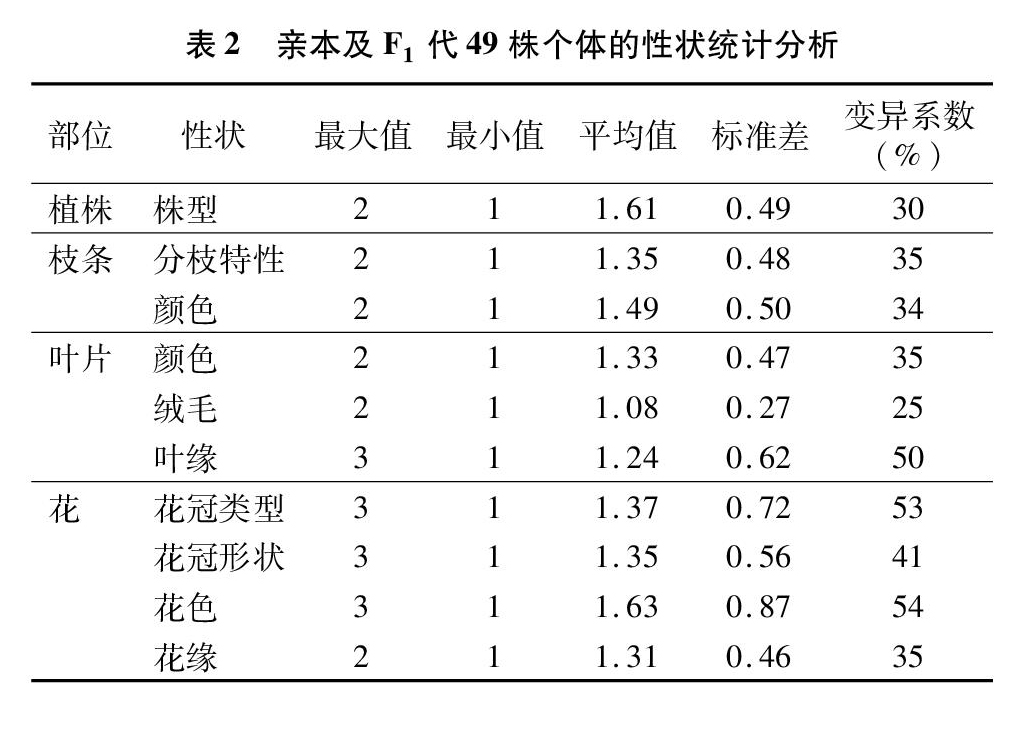
由表2可知,杂交后代出现了一定程度的遗传变异,个体间也出现了明显的性状差异。其株型、枝条、叶片、花等均出现一定比例的性状分化,49株子代植株中,质量性状中植株株型的变异系数为30%;枝条分枝特性变异系数为35%,颜色变异系数为34%;叶片颜色变异系数为35%, 绒毛变异系数为25%,叶缘变异系数为50%;花的变异系数相对较大,花冠类型变异系数为53%,花冠形状变异系数为41%,花色变异系数为54%,花缘变异系数为35%。
2.2?杜鹃花F1代表型性状相关性分析
基于遗传相似系数矩阵,用SPSS 19.0软件对亲本和49份材料进行聚类分析,获得10个性状的聚类图。由图1可知,F1代表型性状主要聚为7个类群,第1类包含2个个体,分别为粉红泡泡和87;第2类包含2个个体,分别为白鹤和6;第3类包含4个个体,分别为白鹤36、64、49和51;第4类包含17个个体,分别为70、79、75、55、65、58、38、63、66、71、25、91、27、19、48、69和86;第5類包含4个个体,分别是21、32、14和31;第6类包含9个个体,分别是46、89、20、44、16、34、15、7和90;第7类包含13个个体,分别是10、50、24、5、52、18、9、22、40、11、35、17和26。在第1类中,87号植株与粉红泡泡聚为一类;第2类中,6号个体与白鹤聚为一类;第3类中,64号植株花为玫红色,与其他3个个体存在很大差异,但是在株型上有很大的相似性;第4类中的17个个体中,种质分类最为混乱,发生花色变异的植株大多聚在这一类,表明该聚类种质性状复杂,极有可能发生一定程度的变异,因此可以作为新种质资源选育的分类点;第5类中,花型和花色均有一定程度的变异,可作为候选新种质的类别;第6类聚类中,植株从属性和花色属性上都与母本白鹤相似,发生了极少量的变异,因此不宜作为新种质的开发类别;第7类中花属性发生了变异,可作为候选新种质的类别。
2.3?SSR标记的多态性
利用试验开发的10个标记对49个后代及亲本进行多态性筛选,共扩增出23条多态性条带,多态性条带数为2~4个(表3)。
2.4?杂交F1代聚类分析
通过UPGMA进行聚类分析表明,亲本和F1代49份种质共聚成6个类群,第1类包含13个个体,分别为63、64、66、86、5、9、11、87、粉红泡泡、24、32、46和48;第2类包含7个个体,分别为34、71、19、7、31、14和75;第3类包含7个个体,分别为58、69、10、27、50、44和65;第4类包含8个个体,分别为9、白鹤、16、35、51、22、40和70;第5类包含15个个体,分别为79、89、26、21、18、25、38、52、90、15、17、20、36、49和91;第6类包含1个个体,为55号(图2)。
以质量性状为基础,结合Pearson相关系数的聚类结果和SSR分子标记聚类结果,选取观赏价值高且遗传多样性高的品种作为候选种质。55号种质花冠类型为单瓣,花冠形状为碟型,花色为粉色,花缘为波状,综合了亲本的生物学性状且出现了一定程度的变异,基于Pearson相关系数的聚类结果显示55号种质聚到第4类,基于SSR分子标记的聚类聚到第6类,表明55号杂交种质具有较高的性状差异和遗传差异。64号杂交种质花冠类型为重瓣,花冠形状为碟型,花色为玫红色,花缘为波状,在花冠类型和花色方面出现了一定程度的变异,基于Pearson相关系数的聚类聚到第3类,与亲本白鹤聚为一类,基于SSR分子标记的聚类聚到第1类,与亲本粉红泡泡聚为一类,表明64号杂交种质是亲本植株的杂交种质,变异系数相对较小,但观赏性状相对较高。因此,具有较高的观赏性状和一定遗传差异的55号和64号杂交种适合作为候选新品种。经过表现型的观察和对比亲本表现型与F1代49份种质,发现55号(图3)、64号新种质(图4)。这2种新种质的性状稳定且遗传性优良,因此可以将这2种新种质从中挑选出来,作为新品种进行推广。
3?讨论与结论
目前,许多学者利用表型性状的改变来衡量植株变异[21-24],但是表型变异需要长期的积累过程才能逐步形成,难以及时反馈生物的变异信息,且是基因和环境因子共同作用的结果。因此,利用表型性状结合分子标记对生物变异进行统计分析,是衡量生物变异及基因多样性的一个重要手段[25]。分子标记聚类具有更高的灵敏度。利用分子标记技术研究杜鹃花种质的遗传多样性,可以不受环境、发育时期和器官等的限制,从基因组水平上揭示其遗传变异的程度,且在早期就可进行新品种的鉴定[26]。
在杜鹃花实际生产过程中,优良种质资源大多根据表型性状进行筛选,在生产过程中会造成选育失败以及种质的性状不稳定的现象。在实际生产过程中,利用更为科学的手段进行种质资源的选育成为解决新种质选育所面临问题的关键。因此,利用分子标记技术结合表型性状的差异进行选育是相对更为科学的选育体系。这为杜鹃花的选育工作提供了更为科学的依据。
本研究对F1代49份种质以及亲本的10个表型性状的聚类分析研究表明,供试材料的表型性状相似程度高的样本聚为一类,通过此表型聚类结果可知,利用Person相关系数进行表型聚类具有极高的应用价值。表型聚类结合分子标记聚类分析结果表明,两者聚类结果不完全一致,具有一定的差异。这可能是因为所选SSR位点的覆盖率以及SSR位点的作用位点的不同而具有一定的差异。但是通过表型聚类结合分子聚类对生物变异进行分析,具有更高的应用价值以及现实意义。
参考文献:
[1]吴?荭,杨雪梅,邵慧敏,等. 杜鹃花产业的种质资源基础:现状、问题与对策[J]. 生物多样性,2013,21(5):628-634.
[2]郝?蕾,张国盛,穆喜云,等. 北沙柳种质资源居群表型多样性[J]. 西北植物学报,2017,37(5):1012-1021.
[3]熊姜玲,赵光伟,徐志红,等. 甜瓜柄蔓夹角主基因+多基因遗传分析[J]. 中国农学通报,2016,32(34):55-61.
[4]王海平,李锡香,沈?镝,等. 基于表型性状的中国大蒜资源遗传多样性分析[J]. 植物遗传资源学报,2014,15(1):24-31.
[5]李仁伟,王?晨,戴思兰,等. 菊花品种表型性状与SRAP分子标记的关联分析[J]. 中国农业科学,2012,45(7):1355-1364.
[6]从夕汉,施伏芝,阮新民,等. 东南亚62个籼型水稻亲本SSR遗传多样性分析[J]. 核农学报,2016,30(5):859-868.
[7]汤佳乐,黄春辉,吴?寒,等. 野生毛花猕猴桃果实表型性状及SSR遗传多样性分析[J]. 园艺学报,2014,41(6):1198-1206.
[8]傅巧娟,李春楠,陈?一,等. 基于表型性状的孔雀草种质遗传多样性分析[J]. 植物遗传资源学报,2015,16(5):1117-1122,1127.
[9]江锡兵,汤?丹,龚榜初,等. 基于SSR标记的板栗地方品种遗传多样性与关联分析[J]. 园艺学报,2015,42(12):2478-2488.
[10]Annicchiarico P,Nazzicari N,Ananta A,et al. Assessment of cultivar distinctness in alfalfa:a comparison of genotyping-by-sequencing,simple-sequence repeat marker,and morphophysiological observations[J]. The Plant Genome,2016,9(2):1-12.
[11]李美芹,潘叶羽,钱萍仙,等. 杜鹃花EST-SSR标记的开发及遗传多样性分析[J]. 植物生理学报,2016,52(3):356-364.
[12]艾?辛,蒋建雄,肖?亮,等. 荻与五节芒种间杂交F1群体主要农艺性状的遗传及相关性分析[J]. 草地学报,2017,25(4):814-822.
[13]叶祯维,邓晓英,石玉真,等. 杂交棉中棉所70后代分離群体产量品质的表型变异分析[J]. 棉花学报,2016,28(1):1-10.
[14]贺?丹,唐?婉,刘?阳,等. 尾叶紫薇与紫薇F1代群体主要表型性状与SSR标记的连锁分析[J]. 北京林业大学学报,2012,34(6):121-125.
[15]Caser M,Akkak A,Scariot V. Are rhododendron hybrids distinguishable on the basis of morphology and microsatellite polymorphism?[J]. Scientia Horticulturae,2010,125(3):469-476.
[16]Marczewski T,Chamberlain D F,Milne R I. Hybridization in closely related Rhododendron species:half of all species-differentiating markers experience serious transmission ratio distortion[J]. Ecology and Evolution,2015,5(15):3003-3022.
[17]周兰英,王永清,张?丽,等. 46种杜鹃花属植物表型性状的数量分类[J]. 林业科学,2009,45(8):67-75.
[18]周?泓. 杜鹃花品种资源多样性研究及品种分类体系构建[D]. 杭州:浙江大学,2012:1-109.
[19]Siegel C S,Stevenson F O,Zimmer E A. Evaluation and comparison of FTA card and CTAB DNA extraction methods for non-agricultural taxa[J]. Applications in Plant Sciences,2017,5(2):1-7.
[20]王琼琼,薛志慧,林伟东,等. 不同茶树种质间稀土元素积累差异研究[J]. 园艺学报,2017,44(6):1198-1206.
[21]夏国华,朱先富,俞春莲,等. 不同地理种源大别山山核桃坚果表型性状和脂肪酸组分分析[J]. 果树学报,2014,31(3):370-377.
[22]冯晶晶,刘?磊,郑?峥,等. 醋栗番茄Solanum pimpinellifolium遗传多样性分析[J]. 植物遗传资源学报,2017,18(4):611-619,628.
[23]郑?昕,孟?超,姬志峰,等. 脱皮榆山西天然居群叶性状表型多样性研究[J]. 园艺学报,2013,40(10):1951-1960.
[24]蒋会兵,宋维希,矣?兵,等. 云南茶树种质资源的表型遗传多样性[J]. 作物学报,2013,39(11):2000-2008.
[25]罗?凯,卢会翔,吴正丹,等. 中国西南地区甘薯主要育种亲本的遗传多样性及群体结构分析[J]. 中国农业科学,2016,49(3):593-608.
[26]吴则东,江?伟,马龙彪. 分子标记技术在农作物品种鉴定上的研究进展及未来展望[J]. 中国农学通报,2015,31(33):172-176.
- 初中数学发展性作业设计
- 高中数学函数中求最值需要注意的问题
- 浅议高中数学有效教学的内涵、特征
- 高中数学学习方法的总结
- 做好初高中数学衔接教学
- 新课改基础上的高中数学试卷讲评课有效教学模式的构建浅议
- 初探高中数学课堂教学情境的创设
- 导学互动教学模式在初中数学教学中的有效运用探究
- 高中数学平面向量问题图式的探讨
- 如何在初中数学教学中渗透数学思想
- 浅谈初中数学课堂情景教学
- 高中数学中的平面几何例解与分析
- 数形结合在初中数学教学中的运用探析
- 巧用提问优化课堂
- 中职数学教学模式改革相关问题的探讨
- 以教学情境为引导提升初中数学教学有效性
- 浅谈高中数学课堂提问有效性
- 矩阵在解线性方程组中的应用研究
- 浅析高中数学考试的技巧及时间分配
- 高中数学化归思想在工程中的应用
- 运用导数巧解不等式
- 高中数学“用面积定义正弦”的解题研究
- 高中数学数列问题的解题技巧探究
- 对如何提高初中生数学学习情感的认识和思考
- 巧用知识分类降低高中数学学习难度
- came-back
- came back
- came-by
- came down
- came-down
- came forward
- came-forward
- came in
- convincibilities
- convincibility
- convincing
- convincingly
- convincingness
- convincingnesses'
- convincingnesses
- convincingness's
- convivial
- convivialists
- convivialities
- conviviality
- convivially
- convocation's
- convoluted
- convolutedly
- convolutedness
- 藩台
- 藩司
- 藩国
- 藩国、藩镇
- 藩国的国王
- 藩地
- 藩垣
- 藩墙
- 藩宣
- 藩屏
- 藩属
- 藩属国
- 藩属国或外国使臣入朝,贡献方物
- 藩库
- 藩扞
- 藩捍
- 藩条
- 藩柴
- 藩王
- 藩盾
- 藩篱
- 藩篱之
- 藩篱之鷃
- 藩篱草
- 藩维