邵乐 李健 秦枫 潘孝青 翟频 张霞 孙雪峰 杨杰
摘要:为提高规模化兔场生产效率,以幼兔为试验对象,设计了一种智能饲喂机器人,比较不同饲喂模式对幼兔生长发育及IGF-1表达量的影响。选取90只35日龄新西兰幼兔,随机分为3组,分别为对照组、试验Ⅰ组和试验Ⅱ组,预试期3 d,正饲期21 d。对照组由人工饲喂,2次/d,试验Ⅰ组机械化饲喂,2次/d,试验Ⅱ组智能化饲喂,3次/d。结果表明,与对照组相比,试验Ⅱ组平均日增质量提高15.9%,差异显著(P<0.05);试验Ⅱ组小肠指数显著提高14.6%(P<0.05);试验Ⅱ组肝脏质量、肝臟指数分别显著提高26.0%和20.6%(P<0.05,P<0.05);试验Ⅱ组粗蛋白质表观消化率显著升高14.1%(P<0.05);试验Ⅰ组和试验Ⅱ组血清免疫球蛋白G、免疫球蛋白M、免疫球蛋白A、白蛋白、球蛋白、谷草转氨酶、谷丙转氨酶含量均无显著差异;试验Ⅱ组中的IGF-1表达量显著升高(P<0.05)。由此可见,智能化饲喂可以降低料质量比,提高饲料粗蛋白消化率,增加体脏器官质量,促进肠黏膜发育,维持肠道健康,生产效率明显优于人工对照组。
关键词:智能饲喂;幼兔;生长性能;IGF-1基因
中图分类号:S829.1 ??文献标志码: A ?文章编号:1002-1302(2020)23-0167-05
幼兔断奶阶段自身各个器官尚未发育完全,受采食、饲料及环境变化的影响,破坏了肠道微生物区系的平衡及机体相关免疫功能,导致肠道疾病高发,生长速度明显降低,同时大多数兔场主要依赖人力,劳动强度大、技术水平低等制约了生产效率的提高。因此,选择合适的饲喂模式对规模兔场幼兔的生长发育有重要影响。
国外智能化饲喂设备开发很多,其应用也获得巨大成功,包括荷兰Velos设备[1-2]、美国Osborne设备[3-5]、法国Elistar设备等[4],引领了畜牧业智能设备发展方向。我国家畜养殖装备尤其是智能设备研究基础薄弱,整机可靠性和智能化程度不高,核心部件和高端产品依赖进口,导致设施养殖场的硬件投入大,成本回收期长。而核心养殖设备尤其是作业机器人严重缺乏,导致畜牧业综合生产力较低,成本居高不下[6]。熊本海等研究表明,自动饲喂器有效地解决了妊娠母猪的精细化饲养技术,但国内智能化饲喂在家兔产业的应用却鲜有报道[7]。
江苏省农业科学院畜牧研究所自主研发基于单片机控制的自走式、省力化喂料机器人,具有专用轻量化、自主驱动、轨道式展臂多层自动落料的功能,实现定点、定时、定量柔性化投喂的效果。本试验使用了新型的自动饲喂机器人,与兔场结构布局结合,与家兔的生理、生长及行为相结合,从满足动物福利角度出发,形成设备与动物的相互适应,随日龄动态增长控制系统饲喂幼兔。本试验探讨其对幼兔生长性能、IGF-1基因表达量的影响,为幼兔生长阶段实施智能化饲喂提供理论基础及技术支撑。
1 材料与方法
1.1 试验时间与地点
试验时间为2019年3月28日至2019年4月18日。预饲期3 d,正试期21 d。试验在江苏省农业科学院兔场进行。
1.2 试验设计
将随机选取的90只新西兰幼兔分为3组,每组3个重复,每个重复10只。试验期间,每笼2只饲养,饲料统一,自由饮水。对照组为人工饲喂,2次/d,分别为07:00、17:00。安排1名优秀饲养员进行人工饲喂。试验Ⅰ组机械化饲喂,2次/d,时间模拟人工对照组,早上(投料比例40%),下午(投料比例60%)。试验Ⅱ组采用智能化饲喂,3次/d,分别为07:00(投料比例30%),15:00(投料比例30%),20:00(投料比例40%),依据幼兔生长曲线,随日龄动态增长而增加饲喂量。预饲期3 d,试验周期为21 d。试验结束后对兔采血并进行屠宰。
1.3 测定指标及方法
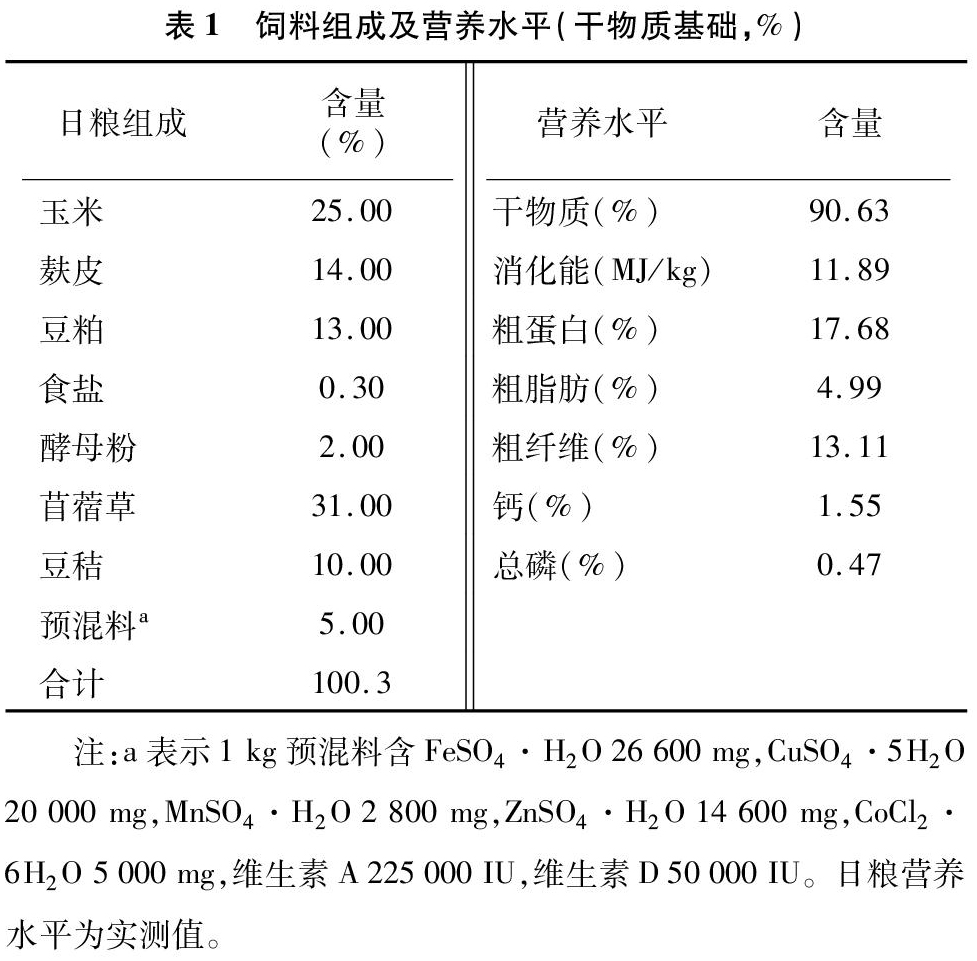
1.3.1 饲料营养测定 测定饲料中常规营养成分:粗蛋白(CP),粗脂肪(EE)、干物质(DM)、粗纤维(CF)、钙(Ca)、磷(P),测定方法参照《饲料分析与检测》[8]。
1.3.2 生长性能测定 记录正饲期投料量,及时收集剩料,风干后回称,统计正饲期各组实际消耗量。每周四上午空腹称质量,记录0、1、2、3周体质量。计算平均日采食量:记录每周投料量和剩料量的差值后,除以各组试验兔的数量和天数,得出平均日采食量,统计3周数据求得均值,得到全期的平均日采食量。平均日增质量:个体日增质量=(实验兔的末质量-初质量)/试验天数,统计各组均值。料质量比:料质量比=平均日采食量/平均日增质量。每天记录腹泻兔耳号,统计腹泻天数,计算腹泻率。
腹泻率=∑(腹泻兔数量×腹泻天数)/(试验兔数量×试验天数)×100%。
1.3.3 营养物质消化率测定 采用全收粪法,常规分析日粮及兔粪中营养物质成分。营养物质的表观消化率计算公式:
日粮养分表观消化率=摄入日粮养分量-排出粪便养分量摄入日粮养分量×100%。
1.3.4 内脏器官指数测定 试验末期称质量结束后,各组随机选取6只,致死后分别将内脏器官依次取下,用水洗净,再用滤纸吸干后称质量。内脏器官指数的计算公式如下:
内脏器官指数=内脏器官质量/体质量×1 000。
1.3.5 消化道小肠(空肠)测定 宰杀后,立即打开腹腔,按照解剖学特征小心剥离出小肠,测定小肠的长度及质量,再取空肠组织。通过HE染色,采用捷达图像进行分析,测定绒毛高度、肠壁厚度和隐窝深度。
1.3.6 血液生化指标测定 幼兔屠宰前采血,取血清测定总蛋白、白蛋白、球蛋白、谷丙转氨酶、谷草转氨酶、IgG、IgA、IgM含量,所用试剂盒均购自南京建成生物工程研究所。
1.3.7 肝脏样品中IGF-1表达量的测定 对照组,试验Ⅰ组和试验Ⅱ组分别采集8只兔的肝脏样品,利用Trizol试剂提取总RNA,以1 μg总RNA为模板进行反转录(Prime ScriptTM RT Master Mix),-20 ℃ 保存待用。采用荧光定量PCR(SYBRTM Premix Ex TaqTM Ⅱ),对上述3组中兔的肝脏IGF-1的mRNA表达量进行测定,GAPDH为内参,定量引物参考文献[9]。PCR扩增体系:10 μL SYBR Premix Ex TaqⅡ,0.5 μL正向引物,0.5 μL反向引物,0.4 μL ROX,2 μL cDNA模板,6.6 μL灭菌水,共20 μL。扩增条件:预变性 95 ℃ 2 min;95 ℃ 10 s,60 ℃ 30 s,72 ℃ 30 s,40个循环。根据荧光曲线的CT值利用2-ΔΔCT法算出基因的相对表达量。
1.4 统计分析
经Excel 2013整理数据后,采用SPSS20.0统计软件检验分析,结果以“平均值±标准误”(x±s)表示,P<0.05表示差异显著。
2 结果与分析
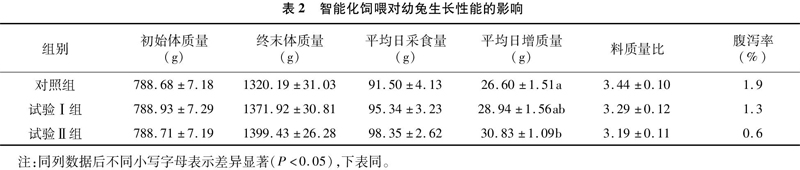
2.1 智能化饲喂对幼兔生长性能的影响
由表2可知,试验Ⅱ组平均日增质量和对照组相比显著提高15.9%(P<0.05);试验Ⅱ组料质量比和腹泻率最低,分别比对照组降低7.3百分点和1.3百分点,但差异均不显著(P>0.05)。
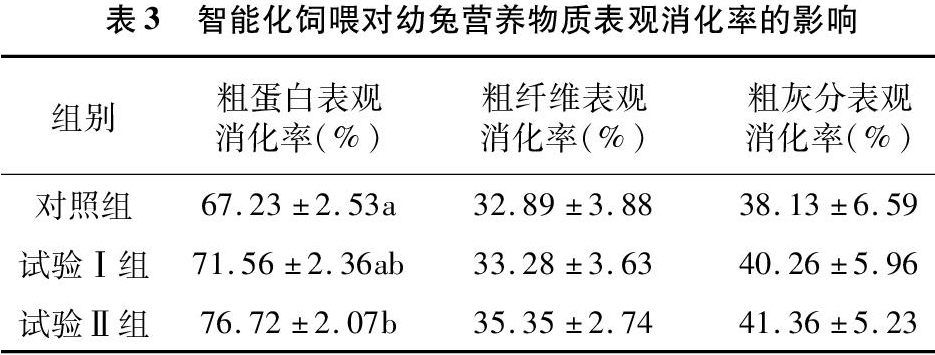
2.2 智能化飼喂对幼兔营养物质表观消化率的影响
由表3可知,粗蛋白质表观消化率试验Ⅱ组与对照组相比显著升高了14.1%(P<0.05)。粗纤维和粗灰分表观消化率与对照组相比,试验Ⅰ组、试验Ⅱ组无明显变化。
2.3 智能化饲喂对幼兔体脏器官质量的影响
由表4可知,试验Ⅱ与对照组相比,组肝脏质量、肝脏指数分别显著提高了26.0%(P<0.05)和20.6%(P<0.05)。试验组Ⅱ、试验组Ⅰ和对照组相比,心脏质量、胃质量、脾脏质量有增高趋势,但差异不显著(P>0.05)。
2.4 智能化饲喂对幼兔小肠长度、质量及空肠发育的影响
由表5可知,试验Ⅱ组与对照组相比,小肠指数显著升高了14.6%(P<0.05);与对照组相比,试验Ⅰ组和试验Ⅱ组小肠长度分别提高4.6%和6.1%,肠壁厚度分别提高7.7%和9.8%,绒毛高度分别提高0.4%和1.3%,隐窝深度分别降低5.3%和6.7%,绒毛高度/隐窝深度分别提高6.0%和8.5%,但差异均不显著(P>0.05),但绒毛高度、绒毛高度/隐窝深度有趋势性增高,隐窝深度有趋势性降低。
2.5 智能化饲喂对幼兔血液生化指标的影响
由表6可知,与对照组相比,试验Ⅰ组和试验Ⅱ组IgG、IgA、IgM、ALB、GLB、AST、ALT含量均无显著变化(P>0.05)。ALT和AST含量试验Ⅱ组比对照组分别高7.5%和8.2%,有增高趋势。
2.6 智能化饲喂对幼兔肝脏IGF-1表达水平的影响
饲养期结束后,对对照组、试验Ⅰ组和试验Ⅱ组兔的肝脏IGF-1进行定量PCR,由图1可知,试验Ⅰ组中的IGF-1比对照组表达稍高,但差异不显著(P>0.05);试验Ⅱ组中的IGF-1表达量均显著高于对照组与试验Ⅰ组(P<0.05)。
3 讨论
3.1 智能化饲喂对幼兔生长性能的影响
断奶后幼兔贪食严重、消化能力低、消化负担重、极易出现腹泻,影响正常生长发育。本试验智能化饲喂机器人运用笼位精准标定装置和运动探测判定装置,开展个性化柔性饲喂。结果发现,试验Ⅱ组平均日增质量比对照组显著提高15.9%,试验Ⅱ组料质量比和腹泻率均最低,分别比对照组降低7.3%和1.3%,说明智能饲喂3次/d的饲喂方式饲料转换率更高。这主要是因为试验Ⅱ组幼兔每次采食完饲料几乎无剩余,动态投料量不但能够满足幼兔生长需求,而且有效解决了仔兔贪食问题,降低了腹泻率,从而保护了幼兔肠道健康,生长发育也最好。
3.2 智能化饲喂对幼兔营养物质表观消化率的影响
消化代谢试验可用来测定饲料养分及能量被动物消化利用的程度。粪氮是饲粮蛋白质进入动物体内未能被消化道吸收的部分,受饲料蛋白质水平的影响很大[10]。本次研究发现,虽对照组、试验Ⅰ组和试验Ⅱ组的饲料营养水平一致,但粗蛋白质表观消化率试验Ⅱ组比对照组显著升高了14.1%(P<0.05)。有可能因为试验Ⅱ组少食多餐的模式,容易促进胰液分泌,增强营养物质的消化吸收,因此提高了粗蛋白表观消化率。Schneider研究得出,在动物生长中,通过增加饲喂次数,可明显提高消化率[11],本结果与之相似。
3.3 智能化饲喂对幼兔内脏器官质量的影响
本试验发现,试验Ⅱ组、试验Ⅰ组和对照组中心脏质量、胃质量、脾脏质量变化比较,差异不显著。而试验Ⅱ组肝脏质量、肝脏指数分别比对照组显著提高26.0%(P<0.05)和20.6%(P<0.05)。肝脏是体内最大的消化代谢器官。肝脏代谢底物含量及类型的改变影响着肝脏代谢活性[12]。陈守云等研究发现,肝脏质量随着肝脏代谢活性增加而增加,当体内营养水平升高时,流经肝脏的血液中营养物质含量及肝脏组织蛋白质沉积均升高[13]。试验Ⅱ组增加1次采食后,幼兔通过对养分消化吸收率、能量分配、贮存形式等途径影响肝脏增质量。
3.4 智能化饲喂对幼兔小肠长度、质量及空肠发育的影响
小肠是吸收的重要器官,可以吸收大部分的糖类、蛋白质和脂肪。小肠结构与功能是否正常决定了营养物质能否被充分消化与吸收[14]。幼兔采食固体饲料过程中,饲料容易导致小肠绒毛萎缩和隐窝加深,容易对生长及健康造成不利影响[15]。肠道黏膜绒毛高度与细胞数量呈正相关,黏膜隐窝深度体现了细胞成熟率,绒毛高度/隐窝深度比值综合反映小肠的功能状态,以上指标均可表明小肠消化能力是否受损。本研究表明,小肠指数试验Ⅱ组与对照组相比显著提高了14.6%(P<0.05),但是小肠长度、肠壁厚度、绒毛高度和绒毛高度/隐窝深度比值相互间有增高趋势,隐窝深度有降低趋势。这说明试验Ⅱ组和试验Ⅰ组、对照组相比,幼兔肠道发育良好,有可能是因为智能饲喂模式傍晚增加1次投喂,满足了幼兔夜间采食的需求,更加符合家兔的生物学习性,有效地促进了肠道对营养物质的吸收。
3.5 智能化饲喂对幼兔血液生化指标的影响
血清总蛋白对于修补组织和提供能量起了重要作用,因此,血清总蛋白含量越高说明机体蛋白质合成能力越强。体液免疫应答中最主要的因子之一是免疫球蛋白。本结果表明,与对照组相比,试验Ⅰ组和试验Ⅱ组白蛋白、球蛋白及各种血清免疫球蛋白均无明显变化。一般来说,谷丙转氨酶和谷草转氨酶等细胞内酶活性受细胞膜的屏障限制,不易逸出。细胞膜的通透性因为细胞受到损伤时,开始升高,血清酶活性也会随之显著升高[16]。试验 Ⅱ 组中AST和ALT含量,相比对照组和试验 Ⅰ 组有升高趋势,但差异不显著。分析诱发机体转氨酶升高的原因可能是幼兔有时会处于饥饿刺激状态,或者长期采食亢奋造成一定影响,其机理有待进一步研究。
3.6 智能化饲喂对幼兔肝脏IGF-1表达水平的影响
胰岛素样生长因子(insulin-like growth factors,IGFs)是一种肽类物质,具有促生长作用,又叫生长素介质,可通过生长激素诱导靶细胞产生,主要包括IGF-1和IGF-2[17-23]。IGF可提高蛋白质的净增率,促进动物生长发育。本次结果显示,试验Ⅱ组中的IGF-1表达量均高于对照组与试验Ⅰ组,差异显著(P<0.05)。刘静波等研究表明,降低饲喂频率可能通过上调激活IGF-1通路和下调MSTN受体表达促进骨骼肌生长和机体蛋白质沉积[24],本试验结果与之不完全一致。而Gazzaneo等发现,采食-禁食循环可促进猪骨骼肌蛋白质的合成[25]。本研究试验Ⅱ组的幼兔每次采食行为耗时最短,而且每次采食欲望最旺盛,这也验证了Gazzaneo等的观点,通过少食多餐能够更加促进机体内蛋白质的合成,生长发育也最好。
4 小结
一种适合幼兔采食需求的饲喂机器人,可以达到定时、定点、定量的柔性化、智能化饲喂效果。与传统人工饲喂相比,智能化饲喂能够达到降低料质量比、提高饲料粗蛋白消化率。增加体脏器官质量、促进肠黏膜发育、维持肠道健康,提高生产效率的作用。综上,本试验条件下,试验Ⅱ组饲喂效果明显优于人工对照组。
参考文献:
[1]杨 亮,熊本海,曹 沛,等. 妊娠母猪自动饲喂机电控制系统设计与试验[J]. 农业工程学报,2013,29(21):66-71.
[2]National Hog Farmer. Loose sow housing gets top billing[EB/OL].(2011-01-19)[2014-05-15]. http://nationalhogfarmer.com/genetics-reproduction/sow-gilt/loose-sow-housing-gets-top-billing-0115.
[3]Korthals,Rodney L. Tactical animal management[J]. Resource,2003,10(7):9-10.
[4]Pigtek. Maximize feed efficiency,gain management flexibility[EB/OL].(2013-07-30)[2014-05-15]. http://choretimehog.com/products.php?product_id=494.
[5]Mundigo. TEAM electronic sow feeding[EB/OL].(2013-04-09)[2014-05-15]. http://mundigo.com.au/wp-content/uploads/2013/04/130409-1-Mundigo-Flyer-TEAM-ESF.pdf.
[6]趙一广,杨 亮,郑姗姗,等. 家畜智能养殖设备和饲喂技术应用研究现状与发展趋势[J]. 中国农业文摘(农业工程),2019,31(3):26-31.
[7]赵一广,杨 亮,郑姗姗,等. 家畜智能养殖设备和饲喂技术应用研究现状与发展趋势[J]. 智慧农业,2019(1): 20-31.
[8]杨 胜. 饲料分析及饲料质量检测技术[M]. 北京:北京农业大学出版社,1993.
[9]张永翠,李福昌. 蛋氨酸对肉兔氮代谢、血清激素及肝脏胰岛素样生长因子-Ⅰ mRNA基因表达的影响[J]. 山东农业大学学报,2009,40(1):65-69.
[10]Spreadbury D. Proceedings:protein and amino acid requirements of the growing meat rabbit[J]. The Proceedings of the Nutrition Society,1974,33(2):56A.
[11]Schneider J D,Tokach M D,Goodband R D,et al. Effects of restricted feed intake on finishing pigs weighing between 68 and 114 kilograms fed twice or 6 times daily[J]. Journal of Animal Science,2011,89(10):3326-3333.
[12]Baldwin R L,Mcleod K R,Klotz J L,et al. Rumen development,intestinal growth and hepatic metabolism in the Pre-and postweaningruminant[J]. Journal of Dairy Science,2004,7:55-65.
[13]陈守云,徐海涛.动物蛋白质周转代谢特点及调控因素[J]. 饲料研究,2010(3):10-13.
[14]杨 杰,翟 频,白文霞.丙氨酰谷氨酰胺二肽对仔兔生长性能、小肠黏膜形态及抗氧化性能的影响[J]. 江苏农业学报,2009,25(3):583-586.
[15]秦 枫,潘孝青,邵 乐,等. 延胡索酸对夏季幼兔生长性能、空肠发育及血清抗氧化和免疫指标的影响[J]. 动物营养学报,2018,30(3):1103-1109.
[16]袁中彪,陈代文.精氨酸的免疫作用[J]. 饲料工业,2003,24(3):11-14.
[17]李赵志,严昌国,张立春,等. 吉林梅花鹿IGF-I基因启动子区单核苷酸多态性分析[J]. 安徽农业科学,2010,38(13):6729-6730,6738.
[18]胡 薇,孟星宇,田玉华,等. 鹿茸顶端组织IGF1R基因的部分cDNA克隆及差异表达[J]. 东北林业大学学报,2011,39(9):108-111,131.
[19]董 飚,王 健,段修军,等. 番鸭IGF-I基因克隆及其在肌肉组织发育中的表达规律[J]. 江苏农业学报,2018,34(1):93-98.
[20]Thieme R,Ramin N,Fischer S,et al. Gastrulation in rabbit blastocysts depends on insulin and insulin-like-growth-factor 1[J]. Molecular and Cellular Endocrinology,2012,348(1):112-119.
[21]Matsumoto R,Fukuoka H,Iguchi G,et al. Accelerated telomere shortening in acromegaly;IGF-I induces telomere shortening and cellular senescence[J]. PLoS One,2015,10(10):e0140189.
[22]Hu A K,Yuan H H,Wu L L,et al. The effect of constitutive over-expression of insulin-like growth factor 1 on the cognitive function in aged mice[J]. Brain Research,2016,1631(31):204-213.
[23]Yue M,Tian Y G,Wang Y J,et al. Associated analysis of single nucleotide polymorphisms found on exon 3 of the IGF-1 gene with Tibetan miniature pig growth traits[J]. Genetics and Molecular Research,2014,13(1):1263-1269.
[24]劉静波,曹山川,杨 勇,等. 饲喂频率对哺乳仔猪生长性能和骨骼肌蛋白质合成的影响[J]. 动物营养学报,2019,31(7):3049-3057.
[25]Gazzaneo M C,Orellana R A,Suryawan A,et al. Differential regulation of protein synthesis and mTOR signaling in skeletal muscle and visceral tissues of neonatal pigs after a meal[J]. Pediatric Research,2011,70(3):253-260.张敬峰,董永毅,卢凤英,等. 江苏部分地区水禽主要细菌性疾病监测与分析[J]. 江苏农业科学,2020,48(23):172-174.
- 父母需让话语充满正能量
- 在家上学:一个值得商榷的教育选择
- 如何抓紧那渐行渐远的风筝线
- 孩子,你为什么长不大?
- 积极心理学理念下用多媒体构建高效课堂
- 积极心理健康教育在特殊青少年中的应用研究
- 森田疗法的核心理念在中学心理咨询中的应用探析
- 尖子生巅峰学习状态与卓越考试效能的元认知培养模式
- 从发展心理学的角度破解男生教育困惑的干预策略
- 以高峰情操状态衔接潜意识行为改变人格
- 过度倾诉与倾诉癖的形成、危害与临床治疗
- 用元认知干预技术七天把“阿斗”塑造成“栋梁”
- 心理课堂中小组讨论低效化的对策探索
- 中学心理健康教育课程资源的开发路径与利用策略
- 心理课引入电影的思考
- 丝带技术在心理咨询中的应用研究
- 浅议焦点解决模式对问题学生教育的启示
- 班主任请家长需“六思”
- 新潜意识观在高三师生偶发事件处理中的应用
- 普通小学教师成为心理干预技术专家型教师
- 从来情商最可贵
- 初心育生,方得始终
- 道德认知发展的阶段性
- 为孩子的心灵打开另一扇窗
- 借力冲突情境,提升应变能力
- nonwashable
- nonwasting
- nonwastings
- nonwatertight
- nonwavering
- nonweakness
- nonweaknesses
- non-welsh
- non-welshes
- nonwestern
- nonwesterns
- nonwetted
- nonwhaling
- non-white
- nonwinged
- nonwinner
- non-winner
- nonwinners
- nonwinning
- nonwithdrawable
- nonwithering
- nonwoody
- nonwool
- nonwork
- non-worker
- 说不出原因地生气发怒
- 说不出口
- 说不出好话来
- 说不出来的怒火
- 说不出来的苦
- 说不出来道不出来
- 说不出毛病
- 说不出的才是真苦,挠不着的才是真痒
- 说不出的才是苦,挠不着的才是痒
- 说不出的苦
- 说不出的苦楚
- 说不出话
- 说不出话来
- 说不出话来,哑口无言
- 说不出道不出
- 说不出,难以用言语表达
- 说不到
- 说不到一条道上
- 说不响
- 说不好的话
- 说不完
- 说不完,道不尽
- 说不定
- 说不定要靠它
- 说不尽