侯宗海 王光飞 马艳 梁永红 仇美华

摘要:以辣椒疫病发生严重的大棚土壤为研究对象,研究不同温度下淹水对不同辣椒疫霉数量病土辣椒疫病的防控效果,并对土壤常规微生物数量、辣椒疫霉数量进行动态分析,此外,也分析了与防病反应相关的植物生理指标。结果显示,土壤淹水会明显减少土壤中真菌、放线菌和辣椒疫霉的数量,而对细菌有增殖作用,这种现象在环境温度为35℃/30℃时更为明显。温度设置为30℃/25℃时,自然病土保湿处理病情指数在55%以上,淹水20、35d对自然病土防效均为100%。自然病土接种辣椒疫霉孢子1000个/g后保湿处理病情指数在80%以上,淹水25、35d防效分别为38.3%、28.3%。35℃/30℃下自然病土保湿和淹水处理均无发病,接菌病土保湿处理病情指数为8.3%~11.7%,而淹水处理无发病。与防病反应相关的植物生理指标与病情指数呈显著或极显著正相关,这些进一步证实了温度偏高时淹水防控效果更佳,而淹水天数设为20d即可。
关键词:土壤;淹水温度;辣椒疫霉;防控效果
中图分类号:S436.418.1+9文献标志码:A
文章编号:1002-1302(2020)22-0111-05
作者简介:侯宗海(1977—),男,江苏丰县人,高级农艺师,主要从事土壤肥料研究。E-mail:xftfz@163.com。
通信作者:马艳,博士,研究员,主要从事植物营养与废弃物资源化利用研究。E-mail:myjaas@sina.com。
将病土进行淹水处理以抑制土传病害发生是一种常见的防病农艺措施[1-3]。有多位学者对淹水防控土传病害进行了研究,Pullman等的研究显示,夏天长时间淹水可有效抑制棉花黄萎病,这与其显著削减土壤中大丽轮枝菌病原菌相关[4]。丝核菌、镰刀菌、青枯假单胞菌等土壤病原菌也能被淹水措施控制[5-7]。Stolzy等研究表明,淹水措施能有效防治病原真菌引起的病害,但不能防治疫霉等低等卵菌土传病害[1]。也有研究表明,短期淹水反而能加快、加重疫霉引起的病害[8-9]。但在江苏省淮安市辣椒生产基地,有些农户将大棚土壤进行淹水以防控辣椒疫霉(PhytophthoracapsiciL.)引起的病害,并取得了一定的效果,但防控效果不稳定。可见,土壤淹水对辣椒疫病是有防效的。
土壤中辣椒疫霉的生存和致病性与土壤温度密切相关[10-11],因此推测不同温度下的土壤淹水处理对辣椒疫病的防效具有差异性。鉴于实际生产中淹水措施主要在夏季进行,所以本试验以不同浓度辣椒疫霉土壤为试验对象,人为模拟2种夏季田间温度环境,以研究不同温度下土壤淹水对辣椒疫病的防控效果。此外,我们在不同淹水温度的基础上设置淹水时间变量,以进一步判定淹水对辣椒疫病是否具有防控作用,并明确何种淹水条件下防控效果最佳。另外,通过对土壤常规微生物和辣椒疫霉进行动态定量分析,以明确淹水措施是否能改变土壤微生物,是否能减少土壤辣椒疫霉的数量,以及两者的联系。病情指数是不同条件下的淹水是否具有防控效果的最佳指标,但具有随机性和误差性。因此通过测定植株与防病反应相关信号物质的含量,可以更精确判定不同淹水条件对辣椒疫病的防控效果。
1材料与方法
1.1试验材料
在淮安市盐河镇辣椒大棚取试验土壤,大棚辣椒种植年限为8年,辣椒疫病严重。土壤基本性状为:有机质含量31.53g/kg、全氮含量4.55g/kg、全磷含量1.45g/kg、全钾含量11.74g/kg,pH值7.42。供试辣椒疫霉病菌为该棚辣椒病株分离所得。供试辣椒品种为洛椒5号。
1.2试验方法
将土壤与草炭以体积比5∶1混合,并加入10g/kg的有机肥。土壤设置不同的辣椒疫霉接种浓度、水分管理和温度处理:辣椒疫霉接种浓度分别为0、1000个/g;水分管理分别为保湿20d(对照1)、淹水20d、保湿35d(对照2)及淹水35d;温度处理分别为30℃/25℃和35℃/30℃。30℃/25℃即30℃、12h,25℃、12h,间隔交替。35℃/30℃即35℃、12h,30℃、12h,间隔交替。共计16个处理。环境温度通过气候箱设置。2012年3—4月在气候箱的塑料箱(长、宽、高分别为0.4、0.2、0.2m)中进行淹水或保湿处理,淹水结束后将土壤摊开,置于阴暗通风处快速晾干后分装到5个塑料盆中(长、宽、高分别为0.25、0.12、0.12m),每盆移栽3棵辣椒苗。总计15棵辣椒苗,每5棵為1个重复。盆栽地点为江苏省农业科学院温室。
分别在淹水前、淹水后4、9、18、27、35d和移栽后10、20d取土,以接种辣椒疫霉孢子1000个/g(干土)的保湿35d组和淹水35d组为分析对象,分析土壤中常规微生物和辣椒疫霉的数量动态变化。在辣椒发病前,各处理均取顶端第4、5张叶测定与植株防病反应相关的信号物质。移栽20d后统计辣椒病情指数。
1.3测定项目及方法
1.3.1土壤常规微生物数量真菌、细菌和放线菌数量测定采用试管梯度稀释涂平板法[12]。
1.3.2土壤中辣椒疫霉数量采用MP公司的FastDNA试剂盒提取土壤DNA。采用qPCR技术测定辣椒疫霉菌数量,特异引物为CAPFW(5′-TTTAGTTGGGGGTCTTGTACC-3′)和CAPRV1(5′-CCTCCACAACCAGCAACA-3′)[13]。[JP3]qPCR试剂盒为TaKaRa公司的SYBRpremixExTaq[12]。将标准土样DNA(接种10、40、160、640、2560、10240个/g辣椒疫霉孢子的6个土样提取的DNA)与待测土样DNA同时上机扩增,根据标准曲线计算出待测样品疫霉数量。
1.3.3与辣椒植株防病反应相关信号物质的测定测定辣椒叶片内几丁质酶活性、超氧阴离子产生速率和过氧化氢含量[14]。几丁质酶活性采用显色法,以1g叶片1h分解胶体几丁质产生N-乙酰氨基葡萄糖的微克数表示。O-2·测定采用羟胺氧化反应法。H2O2含量测定采用Ti(Ⅳ)-H2O2比色法。
2结果与分析
2.1土壤及辣椒根际常规微生物数量动态变化
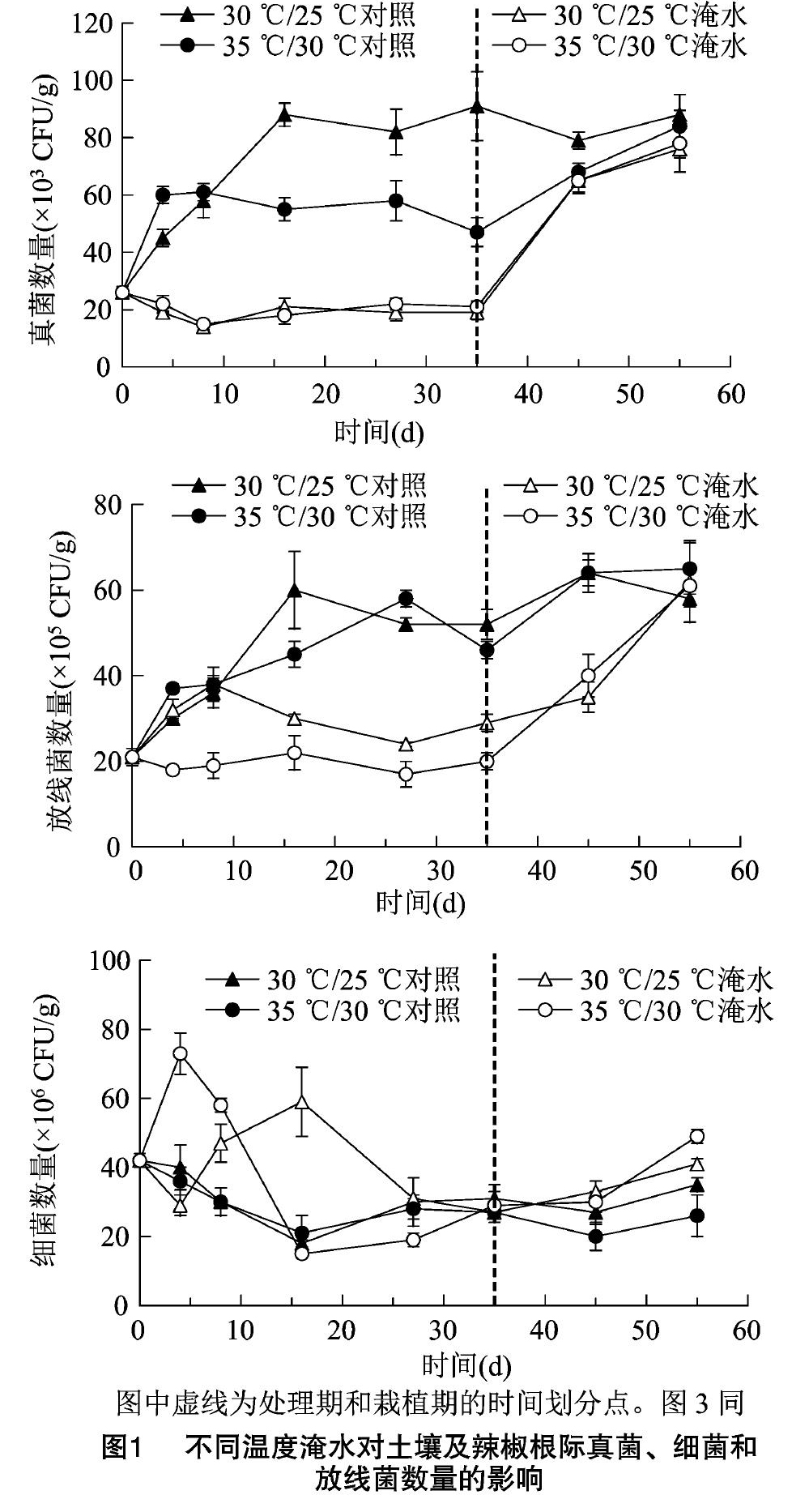
从图1可以看出,不同温度淹水处理下,土壤的真菌、细菌和放线菌数量的变化趋势各不相同。
土壤处理前8d,在2种温度下真菌变化趋势一致,即淹水组真菌数量明显下降,而对照真菌数量明显增加。随后,30℃/25℃对照组真菌数量继续上升,最后维持在88×103CFU/g左右,而35℃/30℃对照组开始逐渐下降,处理结束时真菌数量为47×103CFU/g。30℃/25℃淹水组和35℃/30℃淹水组在淹水处理8~35d真菌数量基本维持在19×103CFU/g左右。栽植辣椒后,30℃/25℃对照组真菌数量下降,降幅较小,其余组真菌数量明显增加,栽植20d各组真菌数量相当。
30℃/25℃对照组、35℃/30℃对照组和30℃/25℃淹水组的放线菌数量在8d内都有较大的上升,而35℃/30℃淹水组数量有所下降。随后,对照组数量继续上升,而30℃/25℃淹水组数量开始下降。处理结束时,30℃/25℃淹水组与35℃/30℃淹水组放线菌数量的比值是1.45。辣椒栽植后,对照组放线菌数量有一定的增加,而淹水组放线菌数量则猛增至对照组水平。
处理期2种温度下,对照组的细菌数量变化一致,在前17d内下降较快,随后维持不变。淹水组的细菌数量变化较为复杂,但都有一个高峰和低峰,低峰值与同期相应对照组的数值相差较小,高峰值是同期对照组值的2倍及以上。辣椒栽植后,对照组细菌数量变化较小,淹水组细菌数量呈现上升趋势。
2.2土壤及根际辣椒疫霉数量动态变化
[JP3]6个标准样DNA进行扩增后,用ABI7500绘制标准曲线,如图2所示,R2=0.991,扩增效率为91.4%,在规定的90%~110%范围内。熔解曲线为单峰,符合RT-PCR要求。因此,定量检测结果可靠。
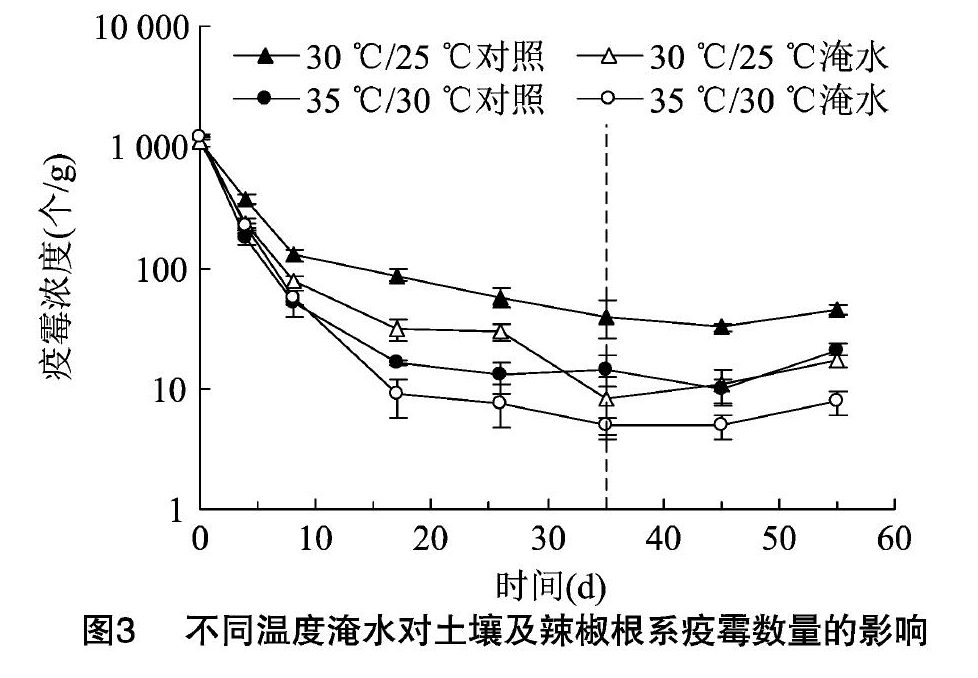
接种1000个/g辣椒疫霉孢子的病土在土壤处理期和辣椒栽植期的土壤辣椒疫霉数量变化趋势见图3。土壤接入辣椒疫霉后,大部分辣椒疫霉在处理期前9d内死亡。分别比较30℃/25℃对照组、35℃/30℃对照组和30℃/25℃淹水组、35℃/30℃淹水组,可知,2种处理的辣椒疫霉在35℃/30℃下的生存率都小于30℃/25℃。处理结束时,30℃/25℃对照组与35℃/30℃对照组的土壤辣椒疫霉数量比值是2.73,30℃/25℃淹水组和35℃/30℃淹水组比值是1.65。另外,比较同一温度处理下的对照组和淹水组,可知,淹水能加重土壤辣椒疫霉数量的削减。处理结束时,30℃/25℃下,对照组土壤中疫霉的浓度是淹水组的4.89倍,而35℃/30℃下,对照组土壤中疫霉的浓度是淹水组的2.95倍。栽植辣椒后,对照组和淹水组辣椒疫霉数量都有一定的增加。
2.3辣椒叶片中与植株防病反应相关的信号物质
由表1可知,30℃/25℃下,无论是对照组还是淹水组,接种1000个/g辣椒疫霉孢子的病土组与不接种辣椒疫霉孢子的病土组相比较,前者的3种植物信号普遍大于后者,这说明3种植物信号能确切反应植物与防病相关生理指标的变化,尤其是超氧阴离子产生速率和几丁质酶活性。淹水20d组和淹水[KG*8]35d[KG*8]组植物中的几丁质酶活性和超氧阴离子产生速率显著低于对照1组和对照2组,另外,淹水20d组与淹水35d组相比,3种植物信号基本一致,所以可以看出淹水20d与淹水35d对疫病有防控效果,且两者效果相当。
35℃/30℃各组的植物信号值普遍小于30℃/25℃组的对照1组和对照2组,而和30℃/25℃组的淹水20d组和淹水35d组的植物信号值相当,这与35℃/30℃组各处理都不发病或发病低相关。35℃/30℃组的对照组植物信号值略大于对应淹水组,这应该与土壤处理后对照组疫霉数量低于淹水组相关。
2.4辣椒疫病病情指数
由表2可知,环境温度设置为35℃/30℃时,接种辣椒疫霉孢子浓度为1000个/g的对照組病情指数为8.3%~11.7%,而其余处理辣椒的病情指数都为0。环境温度设置为30℃/25℃时,各处理病情指数差异显著。自然病土保湿处理不同时间后栽植辣椒,辣椒的病情指数为56.7%~58.3%。淹水20d或35d后栽植,辣椒病情指数都为0。由此可见,在本试验条件下自然病土淹水20d就能达到对辣椒疫病100%的防效。接种辣椒疫霉孢子浓度为1000个/g的病土保湿处理不同时间后,病情指数为81.7%~83.3%。淹水20、35d再栽植辣椒,对应的病情指数分别为38.3%、28.3%,防效分别为53.1%、66.0%。因此可以看出,对于重病土淹水对辣椒疫病也有良好防控效果,且淹水35d的防效比20d略高,但两者无显著差异。
3讨论与结论
本试验常规微生物的数量变化说明了淹水对土壤真菌、放线菌和细菌产生很大的影响。淹水能明显减少土壤真菌和放线菌数量。淹水对细菌的影响较为复杂,在一定的淹水时段能明显增加土壤细菌数量。由此可见,淹水能明显改变土壤微生物区系。Unger等的研究表明,20℃下24d的淹水处理对森林土壤微生物区系有较大的影响[15];Wilson等的研究显示,17~20℃下56d的淹水处理后,温室土壤微生物群落结构有显著的变化[16],本文的试验结果与之相符。晾土后栽植辣椒,土壤中不利微生物生长因素消除,所以土壤真菌、放线菌数量上升至对照组水平。淹水土壤中的辣椒疫霉数量、真菌数量、放线菌数量的变化规律在一定程度上相似,即在淹水期逐渐减少,栽植辣椒后有所上升。35℃/30℃下保湿处理中后期,真菌数量开始逐渐减少,这说明35℃/30℃下不利于真菌的生存,所以可以推测35℃/30℃会降低辣椒疫霉的生存率。
通过比较分析不同温度下对照组和淹水组土壤辣椒疫霉的存活率,可以明确不同温度的淹水对土壤辣椒疫霉存活率产生的影响。在本试验土中,淹水处理可一定程度削减土壤辣椒疫霉数量,且35℃/30℃下效果更好,这与淹水后土壤生物性状和理化性状的变化相关。前人研究报道,淹水对土传病害有防效,可能与土壤微生物区系的变化及抗病微生物的增加有关[1,17],抗病微生物是否增加还有待于进一步研究。淹水期间短期激发增殖的某些细菌种类可能对辣椒疫霉抑制具有贡献。本研究证实了土壤微生物发生了明显的变化,这必然对土壤辣椒疫霉的存活率和致病性产生不可忽视的影响。土壤淹水后氧化还原电位降低,氧气含量减少,对病原菌有害物质增加等也是土壤病原菌数量减少的重要原因[18]。温度较高时微生物呼吸需要更多的氧气,35℃/30℃下[JP3]淹水较30℃/25℃下淹水除氧速率快且含氧量低,所以病原菌在35℃/30℃下更能被淹水处理抑制[1]。在本试验中35℃/30℃对照组比30℃/25℃对照组辣椒疫霉存活率低,这说明了30~35℃环境下不利于辣椒疫霉的生存。所以35℃/30℃下淹水土壤辣椒疫霉存活率低,温度对其产生的影响也是原因之一,这与35℃/30℃下的真菌数量明显少于30℃/25℃下相吻合。
植物受到病原真菌、细菌、线虫等浸染后均可产生并积累H2O2和超氧阴离子。两者在植物抗病反应中起着重要的作用[19-21]。几丁质酶是可诱导的病程相关蛋白,可抵抗病原菌的侵染[22]。统计分析各组的病情指数和3种植物信号,结果显示两者是密切相关的。超氧阴离子产生速率、几丁质酶活性与辣椒病情指数呈极显著正相关,相关系数分别为0.929、0.898(P<0.01),过氧化氢含量与辣椒病情指数的呈显著正相关,相关系数为0.554(P<0.05)。30℃/25℃下各淹水组3种植物信号明显小于对应30℃/25℃对照组,这说明土壤淹水后辣椒植株受到的辣椒疫霉侵染少,H2O2和超氧阴离子产生和积累较非淹水组少,几丁质酶也不被诱导,这与Esra等的研究报道[23-24]相符。所以,可以从植物信号中看出淹水措施对辣椒疫病有防控作用。35℃/30℃各组植物信号数据与病情指数相符合,数据普遍较低,且差异不显著。这在一定程度上说明了35℃/30℃下不利于辣椒疫霉的生存和其对辣椒的侵染。
环境温度设置为25~30℃时,对于自然连作土而言,淹水20、35d都能达到100%防效。对于接种1000个/g辣椒疫霉孢子的重病土而言,淹水35d的防效仅比淹水20d高10%。在实际生产中,保护地并没有35d及以上的空闲时间,所以采用淹水措施时可以适当缩短至20d左右。在本试验条件下,30~35℃下淹水20d即可100%防控自然病土和重病土辣椒疫病。鉴于本试验为室内模拟试验,所以不能保证在田间实施后会有一样的效果,但可以确定利用淹水防治辣椒疫病时,应优选气温最高的月份。25~30℃下接种辣椒疫霉孢子1000个/g的土壤淹水处理后的病情指数为28.3%~38.3%,可见利用淹水措施防控辣椒疫病具有一定的不稳定性。另外,即使是35℃/30℃淹水组,在淹水后土壤中仍存在一定数量的辣椒疫霉。之所以不致病,可能是辣椒疫霉数量没有达到致病浓度,或者辣椒疫霉致病力被削弱。所以,考虑到田间土壤状况更为复杂,在田间利用淹水措施防控辣椒疫病时,有必要结合其他有效防控措施。
参考文献:
[1]StolzyLH,SojkaRE.Effectsoffloodingonplantdisease[M]//Floodingandplantgrowth.NewYork:AcademicPress,1984:221-264.
[2]StoverRH.Floodingofsoilfordiseasecontrol[M]//MulderD.Soildisinfestation.Netherlands:ElsevierScientificPublishingCompany,1979:19-28.
[3]KimSI,KimHH,SeongBJ,etal.Influenceofsoilfloodingwithorganicmattersamendmentonreducingtherootrotdiseaseandcontentofginsenosidesinginsengcrops[J].PlantaMedicaInternationalOpen,2017,4(S):S1-S202.
[4]PullmanGS,DeVayJE.EffectofsoilfloodingandpaddyricecultureonthesurvivalofVerticilliumdahlideandincidenceofVerticilliumwiltincotton[J].Phytopathology,1981,71(12):1285-1289.
[5]顧和平,袁星星,陈新,等.高温浸泡土壤对连作大棚土体修复和病害防治的效果[J].江苏农业科学,2013,41(7):348-351.
[6]UlacioD,NassH,PinedaJB,etal.ViabilityofRhizoctoniasolaniKuhnAG1-IAunderfloodingconditions.Ⅰ.Mycofloraassociatedto[JP3]thepathogeninOryzasalivatissue[J].Bioagro,1998,10(2):40-47.
[7]MatheronME,PorchasM.EvaluationofsoilsolarizationandfloodingasmanagementtoolsforFusariumwiltoflettuce[J].PlantDisease,2010,94(11):1323-1328.
[8]BowersJH,MitchellDJ.Effectofsoil-watermatricpotentialperiodicfloodingonmortalityofpeppercausedbyPhytophthoracapsici[J].EcologyandEpidemiology,1990,80(20):1447-1450.
[9]WilcoxWF,MircetichSM.EffectsoffloodingdurationonthedevelopmentofPhytophthorarootandcrownrotsofcherry[J].Phytopathology,1985,75(12):1451-1455.
[10]郑小波.疫霉菌及其研究技术[M].北京:中国农业出版社,1997:103-104.
[11]王光飞,马艳.抗甲霜灵辣椒疫霉菌的环境适合度[J].微生物学报,2015,55(5):627-634.
[12]SilvarC,DuncanJM,CookeDE,etal.DevelopmentofspecificPCRprimersforidentificationanddetectionofPhytophthoracapsiciLeon[J].EuropeanJournalofPlantPathology,2005,112(1):43-52.
[13]王光飛,马艳,常志州,等.淹水改良土壤性状及对辣椒疫病的防效研究[J].水土保持学报,2013,27(2):209-214.
[14]张治安.植物生理学实验指导[M].北京:中国农业科学技术出版社,2004.
[15]UngerIM,KennedyAC,MuzikaRM.Floodingeffectsonsoilmicrobialcommunities[J].AppliedSoilEcology,2009,42(1):1-8.
[16]WilsonJS,BaldwinDS,ReesGN,etal.Theeffectsofshort-terminundationoncarbondynamics,microbialcommunitystructureandmicrobialactivityinfloodplainsoil[J].RiverResearchandApplications,2011,27(2):213-225.
[17]李世昌,刘梅娟,何随成,等.淹水对人参锈腐病菌(Cylindrocarpondistructans)和人参根腐病菌(Fusariumsp.)的影响[J].特产研究,1984(2):13-14.
[18]KatanJ.Physicalandculturalmethodsforthemanagementofsoil-[JP3]bornepathogens[J].CropProtection,2000,19(8/9/10):725-731.
[19]饶力群,官春云,罗泽民.过氧化氢、水杨酸与植物抗病性关系的研究进展[J].湖南农业大学学报,2000,26(1):9-14.
[20]Mejía-TenienteL,Durán-FloresBA,[HJ2.1mm]Torres-PachecoI,etal.Hydrogenperoxideprotectspepper(CapsicumannuumL.)againstpeppergoldenmosaicgeminivirus(PepGMV)infections[J].PhysiologicalandMolecularPlantPathology,2019,106:23-29.
[21]郭泽建,李德葆.活性氧与植物抗病性[J].植物学报,2000,42(9):881.
[22]程笑笑,冯自力,冯鸿杰,等.真菌源几丁质酶在植物抗真菌病害中的应用[J].植物保护,2017,43(3):29-35.
[23]EsraK,Ay
瘙塂enS,CemilI[DD(-*2][HT6]·[DD)],etal.Defenceresponsesinleavesofresistantandsusceptiblepepper(CapsicumannuumL.)cultivarsinfectedwithdifferentinoculumconcentrationsofPhytophthoracapsiciLeon[J].ScientiaHorticulturae,2011,128(4):434-442.
[24]SandeepVR,JohnsonGK,BalajiS,etal.DifferentialinductionofchitinaseinPipercolubrinuminresponsetoinoculationwithPhytophthoracapsici,thecauseoffootrotinblackpepper[J].SaudiJournalofBiologicalSciences,2009,16(1):11-16.
- 额济纳的胡杨林
- 桑烟缭绕格尔登
- 发现古塔
- 喜饶嘉措功垂汉藏的爱国老人
- 张贤亮远去的“堡主”
- 吴胜明我是个没有时间老去的人
- 黄日新和他的“胶囊公寓”
- 郑柏峪重返查干诺尔
- 折转人生
- 开启依法治国的新阶段
- 群众办事动动嘴 干部代理跑跑腿
- “余热”的差距
- 女婿有多亲?
- 郭宜品会“坦白从严抗拒从宽”吗?
- 滕海川跑路背后
- 平型关立碑记
- 兴修民心堤防 共筑洛南美梦
- 商南茶为什么这样好?
- 华阴市农综办认真抓好农村扶贫产业贴息贷款工作
- 华阴市农综办全力开展整村推进连片开发扶贫工作
- 军魂永在心间
- 让南水北调工程真正成为双赢工程
- 蔡金空难70年追记
- 色达:苦修者的天堂
- 南怀瑾:入川觅“剑仙”出川成大德
- shout/scream/hurl abuse at
- shout²
- shout¹
- shove
- shoved
- shovel
- shoveled
- shoveling
- shovelled
- shovellike
- shovelling
- shovels
- shovelware
- shovel²
- shovel¹
- shover
- shovers
- shoves
- shoving
- show
- showable
- showance
- show and tell
- show-and-tell
- showbiz
- 雄古
- 雄句
- 雄名
- 雄哉
- 雄哲
- 雄唬
- 雄唱雌和
- 雄固
- 雄国
- 雄图
- 雄士
- 雄壮
- 雄壮威武
- 雄壮宽广
- 雄壮强盛
- 雄壮有力的马
- 雄壮的声音
- 雄壮的样子
- 雄壮的气势
- 雄壮绵延的样子
- 雄壮美丽
- 雄壮美好
- 雄壮而伟大
- 雄壮而宽广
- 雄壮而猛烈