金文丽 王艳 隆旭红 刘光斌 谢静
摘要:目的探索3种不同抑菌性的耳用制剂微生物限度检查方法。方法依据2015版《中国药典》第四部通则1105、1106及1107中,需氧菌总数、霉菌与酵母菌总数及控制菌的检查法做验证。结果微生物计数法验证试验中,试验组的5种添加菌回收比值均在0.5—2限度内;控制菌均能被检出。结论通过对3种不同抑菌性的耳用制剂微生物限度检查方法验证,建立的3种不同的检查法,能够保证检验结果的正确可信。
关键词:微生物限度检查;方法验证;耳用制剂
中图分类号:R927.1 文献标志码:A
药品的微生物限度检查是药品安全性检验的重要指标之一,按照《中国药典》2015年版四部规定,供试品进行微生物限度检验时,应对供试品的微生物计数方法和控制菌检查方法进行适用性验证,以确证所建立的方法能用于该产品的菌落计数和控制菌检验。本文中3种耳用制剂均为酒钢医院生产的院内制剂,在进行微生物限度检验方法验证试验时,由于抑菌性强弱不同,经过反复试验,最终采用三种不同的方法进行检验,非常具有代表性。
1仪器与材料
1.1仪器
Alphaclean 1300型超净工作台(力康精密科技)、HFsafel200LC型生物安全柜(上海力申)、HPX-Ⅲ-300型生化箱(上海跃进)、HMX-Ⅲ-300型霉菌箱(上海跃进)、LMQ.C-100EP型立式灭菌锅(山东·新华医药器械股份有限公司)、Htysteritest601型集菌仪(杭州·泰林生物)、一次性薄膜过滤器(批号:2019111101)等。
1.2试验菌种
(1)金黄色葡萄球菌[cMCC(B)26003];(2)枯草芽孢杆菌[cMCC(B)63501];(3)铜绿假单胞菌[cMCC(B)10104];(4)白色念珠菌[CMCC(F)98001];(5)黑曲霉[CMCC(F)98003];均从中国食品药品检验研究院购得。
1.3培养基
(a)胰蛋白胨大豆琼脂培养基(190729)、(b)胰蛋白胨大豆肉汤培养基(190813)和(c)沙氏葡萄糖琼脂培养基(190826),均由北京陆桥生产;(d)pH7.0无菌氯化钠一蛋白胨缓冲液(20190604)、(e)沙氏葡萄糖液体培养基(20180714)、(f)甘露醇氯化钠琼脂培养基(20180305)和(g)溴化十六烷基三甲铵琼脂培养基(20180402),均由青岛海博生物公司生产。上述培养基均按药典要求进行了适应性试验。
1.4供试品
硼酸滴耳液(批号:201908142,201908145,201908147);碳酸氢钠滴耳液(批号:201907182,201907183,201907185);氯霉素滴耳液(批号:201908193,201908194,201908195),以上样品均为酒钢医院药学部生产。
2方法与结果
2.1菌悬液的制备
取1.2项下菌种(1)金黄色葡萄球菌、(2)枯草芽孢杆菌、(3)铜绿假单胞菌的新制培养物至(a)胰蛋白胨大豆肉汤培养基中,33℃C培育18—24h,以(d)pH7.0氯化钠一蛋白胨缓冲液按照10倍逐级稀释制备l mL含菌量103—104、102一103、0—102cfu的菌悬液;接种(4)白色念珠菌的新培养物至(e)培养基中,23℃培育1—2天,以0.9%氯化钠无菌液按照10倍逐级稀释制备lmL含菌量103—104、102一103、0—102cfu的菌悬液;以适量(5)黑曲霉的培养物转种至(c)培养基试管斜面,23℃培育5—7d,滴加3—5mL 0.9%氯化钠无菌液,以洗脱孢子,滤出孢子菌悬液(以纱布过滤菌丝)至灭菌的试管里,以0.9%氯化钠无菌液按照10倍逐级稀释制备lmL含孢子数103—104、102—103、O一102cfu的孢子菌悬液。需氧菌计数用(1)、(2)、(3)、(4)和(5)作为试验菌;霉菌和酵母菌计数用(4)和(5)作为试验菌;控制菌的试验菌株为(1)和(3)。所有菌种均为第3代。
2.2供试液的制备
用上述供试品各10mL,分别加到无菌锥形瓶内,再加(d)缓冲液至100mL,混匀,制成1:10的供试液。验证试验分3次独立完成,其试验组分别采用上述供試品平行做3次。
2.3微生物计数方法适用性试验
2.3.1需氧茵总数
(1)平皿法
试验组:取碳酸氢钠滴耳液1:10的供试液各9.9mL,依次加到5支无菌试管内,加入1mL含103—104cfu菌量的各试验菌菌悬液0.1mL,使含菌量不超过100cfu,混匀,吸取1mL,加到无菌平皿中。倾注约20mL的(a)培养基,轻轻混合均匀,置凝,33℃培育3—5d,每种菌液注2皿,计试验组菌数。
(2)培养基稀释法
试验组:硼酸滴耳液采用培养基稀释法。方法同(1)项,不同之处是以1mL含菌量不超过100cfu的供试液,依次加到5个平皿中,即0.2mL·皿-1,各菌液平行2组,1mL的5个平皿菌落数之和为试验组菌落数。
(3)薄膜过滤法
试验组:氯霉素滴耳液采取微孑L薄膜过滤法。取1:10供试液1mL,进行薄膜过滤,用0.9%氯化钠无菌液冲洗5次,每次100mL,于第5次时分别添加各试验菌(不超过100cfu)1mL,使每膜1:10样液中所含有菌数不超过100cfu,过滤,取下薄膜,面向上贴在(a)培养基上,培养,计数,即为试验组菌落数。
2.3.2霉菌和酵母菌总数(平皿法)
(1)试验组:取上述各制剂的1:10供试品溶液各9.9mL,分置于2支无菌试管,再加人每mL含菌量为103—104cfu的试验菌悬液0.1mL,混匀,使含菌量不超过100cfu,取1mL,置于培养皿内,每菌注2皿,倾入约20mL的(c)培养基,轻轻混合均匀,置凝,23~C培育5—7天,点计菌落数,即为试验组菌落数。按相同方法测定菌液组、样品对照组及阴性对照组的菌数。
(2)供试品对照组:吸取1:10的样品溶液,用(d)缓冲液替代菌液与各试验组同法操作。
(3)菌液对照组:取(d)缓冲液替代供试液,同各试验组试验,添加各试验菌。
(4)阴性对照组:用同批配制、灭菌的(d)缓冲液1mL代替供试品,同各试验组试验。
2.3.3计算
需氧菌总菌落数、霉菌与酵母菌总菌落数回收比值计算公式:回收比值=(试验组平均菌数一样品对照组平均菌数)÷菌液对照组平均菌数。
2.4控制菌检查
2.4.1金黄色葡萄球菌
碳酸氢钠滴耳液、硼酸滴耳液采用常规法。取“2.2”项下制备好的1:10样液9.9mL和1mL含菌量为103—104cfu的(1)菌悬液0.1mL,使含菌量不超过100cfu,接种至100mL(b)培养基中,混匀,33℃培养24h;氯霉素滴耳液采用薄膜过滤法,取“2.2”项下制备好的1:10供试液10mL,用薄膜过滤,用0.9%氯化钠液冲滤膜5次,每次100mL,冲到第5次时添加(1)菌懸液(不大于100cfu)1mL,过滤,取出滤膜,接入100mL(b)培养基中,混匀,33℃培育24h。将培养物在(f)平板上分离接种,33~C培养18—72h。
2.4.2铜绿假单胞菌
均采用常规法。取“2.2”项下制备好的1:10供试液9.9mL和每mL含菌量为103—104cfu的(3)菌悬液0.1mL,接种到100mL(b)培养基中,混匀,33℃培育24h。将此培养物在(g)培养基平板上分离接种,33℃培育18—72h。
2.5结果
依据药典要求,计数方法适用性验证试验的结果判断为回收比值应在0.5—2范围内;控制菌检查适用性验证试验的结果判断为应能检验出所添加阳性菌的相对应的反应特点。
2.5.1需氧菌总茵落数计数、霉菌与酵母茵总菌落数计数适用性验证试验结果
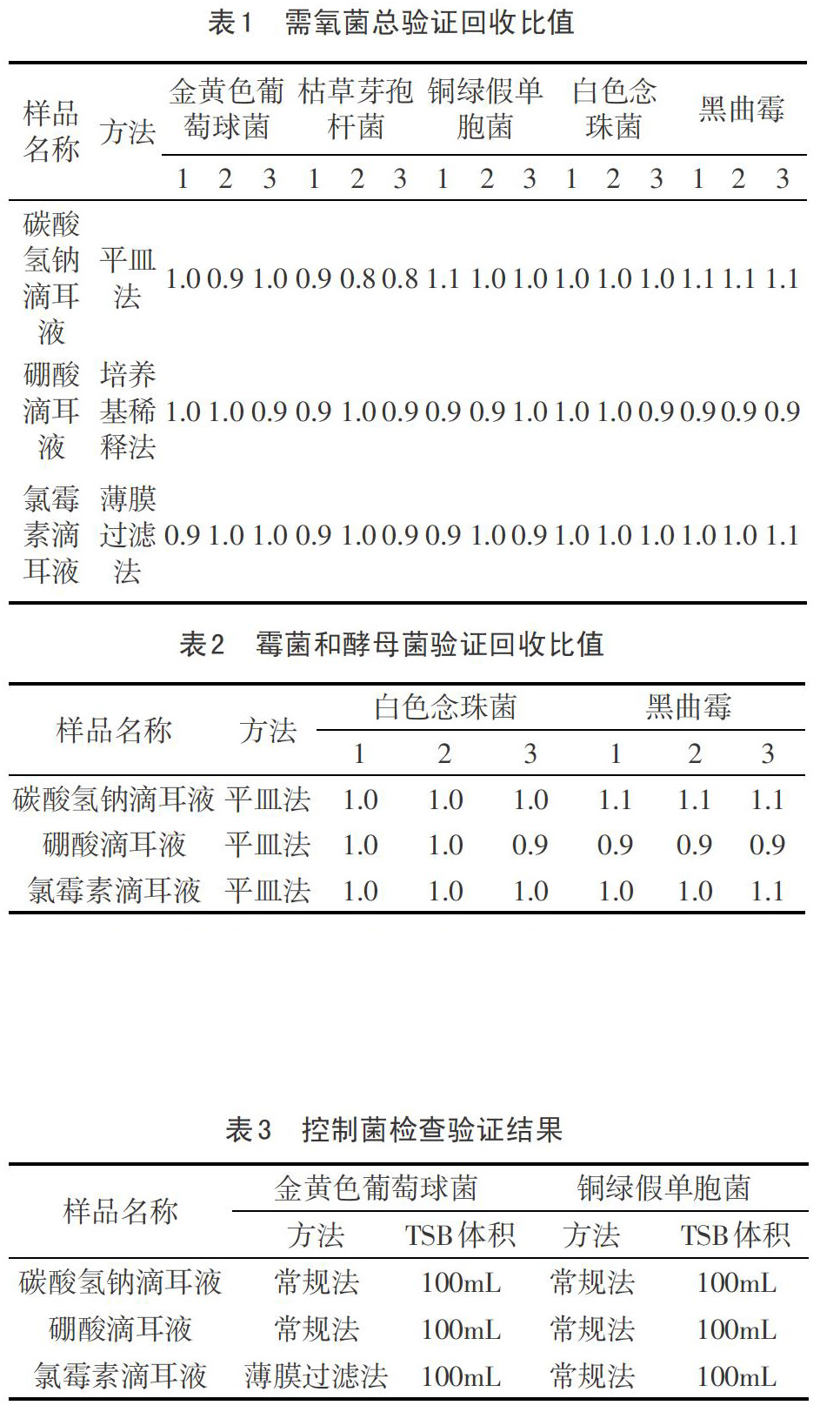
如表1,表2结果表明,所采用的方法,各试验菌的回收比均在0.5—2之内,阴性组未见菌落生长,证明方法适用。
2.5.2控制菌检验方法适用性验证试验结果
如表3,采用的方法及(b)培养基的体积,在两种控制菌检查的方法适用性验证试验中,试验组能够检验出所加试验菌相应反应特征,供试品比照组及阴性比照组未有菌落长出,说明方法可行。
3讨论
由于硼酸滴耳液制备工艺是用70%乙醇作为溶剂,有一定抑菌性,在进行需氧菌总数测定试验过程中,先用平皿法进行预实验当中,(2)菌的回收比值小于0.5,故方法不可行。在采用培养基稀释法进行预实验时,各试验组所加入的试验菌回收比值,都在0.5—2之内,最终采用培养基稀释法进行检验。
氯霉素滴耳液,属于含抗生素类制剂,抑菌性较强,在采用平皿法进行需氧菌总菌落数测定时,(1)和(2)菌均未被检出,(3)菌的回收比值低于0.5,(4)和(5)菌回收比值在0.5—2限度内,故平皿法不可行;再采用薄膜过滤法,用0.9%氯化钠溶液冲洗5次,每次lOOmL,做验证试验时,各添加的试验菌株回收比值都在0.5—2限度之内,所以能采用薄膜过滤法进行检验。
反复参考各文献,经过多次方法验证试验,所用方法能明显的去除或减少制剂中抑菌成分的干扰,从而使检验方法正确,检验结果准确可靠。
- 浅谈社会教育中的古筝教育优化
- 赛课网络平台混合式教学在居住空间设计的应用
- 动画艺术工作室课程体系建构及教学实践研究
- 大学音乐教育中流行音乐引入的价值探讨
- 当前江苏高职院校艺术设计专业人才培养模式存在的问题、原因及对策研究
- 大学英语听力课堂上预制语块现状调查和培养策略研究
- 浅谈动画专业实践教学方法改革的实践与研究
- 针对市场需求高校动漫专业教育该如何变革
- 结合绘本《多肉庄园》谈高校的动漫教学
- 河南高校公共基础课《曲式与作品分析》教学改革初探
- 戏曲英语教学模式初探
- 如何培养幼儿舞蹈学习兴趣
- 试论高校开展校园话剧艺术活动在思想政治教育中的意义与价值
- 体育电视节目对大学生体育教学的影响研究
- 从艺术要素看样板戏
- 从合作原则的违背解读《认真的重要性》中人物的婚恋思想
- 董榕及其剧作研究述论
- 小议《元曲选》中的“死科下”
- 浅谈话剧表演中的语言技巧
- 领跑时间的人性
- 浅谈呼吸对舞台发声的作用
- 低成本创新舞美助推剧场运营
- 戏剧舞台灯光艺术创新分析
- 同历史远去的白鹿
- 浅谈恩施南剧《女儿寨》的创作
- yetis
- yet to come
- yet²
- yet¹
- yew
- yews
- y-fronts
- yha
- yiddish
- yiddisher
- yiddishes
- yield
- yieldable
- yielded
- yieldings
- yields
- yields to maturity
- yield to
- yield to maturity
- yieldtomaturity
- yield to sth
- yield²
- yield¹
- yikes
- yippee
- 记叙式杂文
- 记叙散文的写作
- 记叙文
- 记叙文写作常用词语
- 记叙文写作常用词语/一、表示事件用语
- 记叙的方法
- 记号
- 记号字
- 记号笔
- 记号,标志
- 记号,符号
- 记吃不记打
- 记名
- 记名于名册
- 记名在册,以备录用或治罪
- 记名符
- 记在大地上的史诗
- 记在心上
- 记大过
- 记奏
- 记姓名
- 记存
- 记存在心
- 记实
- 记实式日记