巧设多种真实情境,提升素养教学质量
熊宗齐


摘要:设计真实而富有价值的教学情境,是促进学科核心素养形成与发展的关键环节。借助高考评价体系对化学情境的划分标准,在课堂教学中,以乙醇为例,设计整合多种真实教学情境,触发学生思维,提升关键能力,形成和发展化学学科核心素养。
关键词:真实情境 ?教学设计 ?乙醇
一、问题提出
《普通高中化学课程标准2017年版》(以下简称2017课程标准)强调“真实、具体的问题情境是学生化学学科核心素养形成和发展的重要平台,为学生化学学科核心素养提供了真实的表现机会,教师在教学中应注重创设真实而富有价值的问题情境,促进学生化学学科核心素养的形成和发展。”《中国高考评价体系说明》强调“情境是实现价值引领、素养导向、能力为重、知识为基的综合考查的载体。通过选取适宜的素材,再现学科理论产生的场景或是呈现现实中的问题情境,让学生在真实的背景下发挥核心价值的引领作用,运用必备知识和关键能力去解决实际问题,全面综合发展学科素养水平。”由此可见,无论是教学还是考试评价,都特别强调真实情境的重要性。真实情境应用于课堂教学,可以有以下几种功能:第一,价值引领。正面、积极的真实情境可以很好地体现学科价值。第二,能力、素养导向。真实、陌生情境能更好地考查学生分析问题、解决问题的综合能力,更全面的展现学科素养的水平。第三,整合知识。知识的提炼源于情境,选取包含着知识的真实情境,还原知识本来的面目,能更好地帮助学生理解、掌握必备知识。那么,如何在教学中精心选择、整合真实情境,促进学科核心素养的形成与发展,成为很多一线教师迫切要解决的问题。下面以乙醇新课教学为例,重点阐述。
二、案例设计与教学实施
(一)設定教学目标
1.知道乙醇的物理性质和用途,理解乙醇的分子结构和化学性质,深化“结构-性质-用途”模型的认识;
2.通过推测乙醇分子结构的探究活动,初步发展证据推理能力与定量实验研究能力,感受利用核磁共振、红外光谱技术探究有机物分子结构的方法及过程;
3.归纳乙醇发生化学反应时的断键方式,进一步发展从微观视角对化学反应进行分析的能力,强化官能团决定有机物性质的学科观念;
4.通过酒驾检测、杀菌消毒的原理演示及讨论,养成良好的生活方式,增强社会责任意识。
(二)斟酌教学真实情境
乙醇复习课的情境素材按照真实情境的来源分类可分为日常生活情境、生产环保情境、学术探索情境、实验探究情境和化学史料情境。
围绕教学目标,结合学生学情,精选情境素材,提出价值问题,最终形成教学情境。“选择情境素材,以教学目标为指向,再设置引发认知冲突和求知欲的有价值的问题后,才真正成为一个教学情境。”价值问题的设置还要考虑到学生的学情,这样学生解决问题的过程中就更易产生“跳一跳够得到”的学习任务和活动,提升学生的自主性,更易帮助学生在解决任务中不断建构知识,提升能力,形成素养。
(三)创设真实情境,实施教学
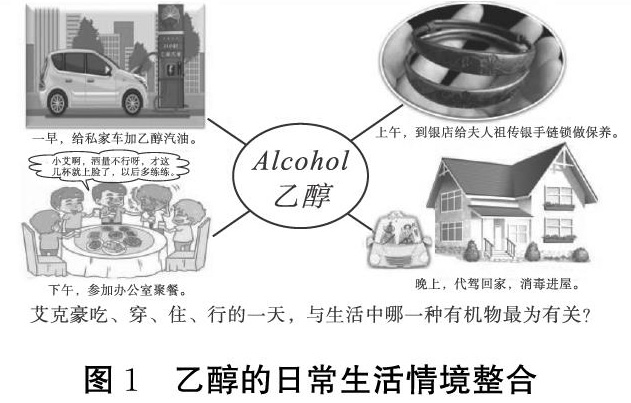
乙醇新课的引入阶段,以艾克豪(alcohol)小伙子吃、穿、住、行的一天(如图1)举例,以故事情节的方式呈现给学生,让学生思考这一天活动与哪种有机物最为相关,如何运用所学知识来解释这些活动。日常生活情境的引入,既增加了课堂的趣味性,也体现了学科价值,而且还为接下来学科学习活动搭建了框架,更有利于课堂教学的顺利开展。
教学环节一:乙醇结构的探究
[提出问题]已知乙醇的分子式为C2H6O,请同学们画出结构,看看有几种同分异构体?
[学生]两种,CH3OCH3和CH3CH2OH。
[追问]将上述两种结构与煤油和水分子结构对比,如何设计实验来验证乙醇的结构是哪一种?
[学生1]与钠反应,钠保存在煤油中,煤油的结构与第一种结构类似,可能不反应。而第二种结构与水分子结构相似,应该可以反应。
[追问]如果两者都与钠反应,结合两种分子中的等效氢种类,如何改进你的实验?
[学生2]定量测定。第一种结构只有一种氢,第二种结构有三种氢且活性不同,与钠反应产生的应该是氢气,通过乙醇与氢气的定量关系可以确定结构。
[追问]如何保证乙醇完全反应,如何测定氢气的量?
[学生2]钠过量,可以用排水法测氢气的体积。
学生组装仪器,动手实验,测定数据,处理数据如表1。
[提出问题]依据实验结果,你能判断乙醇的结构了吗?
[学生]乙醇与氢气的量之比约为2∶1,相当于1 mol乙醇中含有1 mol能与钠反应的活泼氢,因此,乙醇的结构应为CH3CH2OH。
[提出问题]实验的过程中,同学们发现乙醇与钠反应不如水与钠反应剧烈,能结合已学知识解释一下吗?
[学生]乙醇是非电解质,水是弱电解质,所以羟基氢比水中的氢活性差些。
[补充]目前就我们的认识可以这样理解,但由于乙醇(有机物)、水(无机物)与钠反应的机理不同,这样简单对比是不全面的,有待于今后继续学习才能有更准确的理解。
[提出问题]化学家分析有机物结构还有没有其他的方法呢?
[学生]核磁共振氢谱、红外光谱等。
[补充]化学家依据乙醇的核磁共振氢谱图,可以很清楚地发现氢的种类及个数比,通过红外光谱图中,特定波数处的吸收峰确定乙醇分子的官能团,从而确定乙醇分子的结构,既快速、又准确。
设计意图:先通过有机物结构特点书写同分异构体,体现模型认知,这结合微观结构的差异,设计实验验证推理结构,动手实验,收集数据,处理转换数据,通过证据推理得出乙醇结构。之后,对比乙醇、水与钠反应的不同,体会微观结构的异同所带来的宏观性质的差异,适切发展化学学科核心素养。 最后,通过展现现代化学家分析有机物结构的方法,体会科技进步与科学研究之间的协调发展,使得化学能更好地为人类服务,培养学生热爱化学的情怀。
教学环节二:乙醇汽油的优劣
[提出问题]乙醇汽油是10%的燃料乙醇和90%的普通汽油混合而成。为何我们现在提倡使用乙醇汽油呢?有何优缺点?
[学生]环保、节能;更容易燃烧;动力好……(学生几乎说不出缺点)
[补充]我国生产乙醇的主要原料有含糖作物、含淀粉作物以及纤维类燃料,这些都是可再生资源且来源丰富,因而使用乙醇燃料可减少车辆对石油资源的依赖,有利于我国能源安全。不过,乙醇汽油也有缺点,如热值低、易产生气堵、易被氧化为乙酸而腐蚀金属等。
[提出问题]请查出乙醇的燃烧热,书写热化学方程式。
[学生]C2H5OH(l)+3O2(g)2CO2(g)+3H2O(l) ΔH =-1367 kJ·mol-1
设计意图:通过对汽车乙醇汽油的优缺点分析,了解化学对能源、环保所做出的贡献,展现化学学科价值。利用乙醇燃烧反应的能量既可以以热能形式释放,理解能量的常见转换形式,加深对燃料的认识。
教学环节三:乙醇的催化氧化
[提出问题]银饰店是如何做到让银手镯光亮如新?这与乙醇有何关系呢?
[学生]乙醇的催化氧化。
[补充]下面就让我们通过分组实验的方式来理解这个原理。请仔细观察实验现象,并思考如何解释这一现象。
学生分组实验,螺旋铜丝加热后深入装有乙醇的试管中,反复多次。
[提出问题]观察到哪些现象,请写出相应的化学方程式。
[学生]铜丝加热变黑:2Cu+O2△2CuO
接触乙醇又变红:CH3CH2OH+CuO△CH3CHO+Cu+H2O
總反应:2CH3CH2OH + O2Cu或Ag△2CH3CHO + 2H2O
[提出问题]如何证明上述反应的产物?
[学生]气味与原来不同。
[追问]仅仅通过气味不同,能否证明一定是醛类物质?
[学生]用新制的氢氧化铜悬浊液或者银氨溶液,证明有醛的生成。
请学生将反应后的溶液一分为二,取其中一份做鉴定,结果有的小组成功,有的失败。
请学生向另一份中加入希夫试剂(用来检测微量醛,反应很灵敏),溶液均变为紫红色。
[追问]你们的两组实验说明了什么问题?
[学生]这个实验中,由于每组重复的次数不同,产生的醛的含量也不同,如果醛含量低,用新制的氢氧化铜悬浊液或者银氨溶液检测,有可能不成功,而用希夫试剂则效果很好。
[提出问题]上述氧化过程中CuO和Cu的作用相同吗?
[学生]CuO在与乙醇的反应中是氧化剂,而Cu在总反应中是催化剂。
[补充]请同学们认真思考下面这道题:
图2的实验装置中,实验开始前,通氢气排尽空气,加热铜,不断滴加乙醇,反应开始。反应过程中,A中活性铜始终未变黑,B中收集到大量无色无味可燃性气体,C中溶液与新制Cu(OH)2悬浊液反应有砖红色沉淀生成。
请写出该反应的化学方程式 ? ? ? ? ? 。
[学生]CH3CH2OHCu△CH3CHO+H2
[追问]你们对铜催化氧化乙醇有何新的认识?
[学生1]这个实验中Cu更像催化剂,因为它在反应过程中始终没有变黑。而前面实验中是CuO将乙醇氧化,自身被还原了。
[学生2]前面有氧气参与的催化氧化实际上是两个独立的反应,一前一后发生,严格意义上Cu不能算催化剂。
[追问]如何才能证明在有氧的情况下,Cu依然起催化作用?
[学生2]最好在同一个反应条件下,同一个反应器中。
[补充]有人设计了如图3的实验装置,反应一段时间后,发现CuSO4粉末变蓝,希夫试剂变为紫红色。
设计意图:通过手镯的保养,了解乙醇在生活中的应用,进而吸引学生关注学科原理,认识乙醇催化氧化反应。然后设计分组实验,探究氧化过程,加强宏观现象的表述、微观断键的规律以及符号方程式的书写。再引导学生设计实验验证反应产物,借助不同方法检验醛来拓展物质检验的思路,感受化学探究实验的魅力。最后,进一步设置新情境——无氧条件下的催化,对比有氧条件下催化,产生认知冲突,进而引导学生深入思考催化反应的本质特点,提升学生思辨的能力。
教学环节四:酒精测试仪
[提出问题]喝过酒是不能开车回家,交警是如何知道司机喝酒的?
[学生]酒精检测。
[追述]酒精测试仪是利用化学原理制作的,早期是利用重铬酸钾溶液与乙醇在酸性条件下反应,下面请同学们分组动手实验做一下这个实验,描述实验现象,写出离子方程式。
[学生1]酸性条件如何配制呀?
[学生2]重铬酸钾溶液本身好像就是酸性的,就像高锰酸钾溶液一样。
[追问]为什么高锰酸钾溶液、重铬酸钾溶液都是酸性的呢?他们属于哪类盐?
[学生2]强碱,强酸盐。
[提问]所以酸性高锰酸钾溶液、酸性重铬酸钾溶液一般是通过加酸来实现的,这里有盐酸和硫酸,选哪种比较合适?
[学生3]稀硫酸,盐酸中的氯离子溶液被重铬酸钾氧化。
学生实验,描述实验现象,书写离子方程式(配平出现困难)。
2Cr2O2-7+3CH3CH2OH+16H+4Cr3++3CH3COOH+11H2O
[补充]有机氧化还原反应配平常用两种方法。一种是平均化合价法,将有机物写成分子式C2H6O,氢为+1、氧为-2,得碳的平均化合价为-2。同理可得乙酸中的碳为0价,则一个乙醇分子变为乙酸就失去4个电子。另一种方法,按照有机中的氧化反应为得氧失氢,每得一个氧升高两价,每失一个氢升高一价,则一个乙醇分子变为乙酸是得一个氧,失两个氢,共升高四价。

