基于DIY教学模式探究厨房中的化学
张燕 魏梦雪 韩嘉千 李学强

摘 ?要 把DIY教学模式与化学教学相结合,依据Na2CO3和NaHCO3与不同条件下的酸反应原理,让学生运用厨房中的纯碱和小苏打并选取实验装置进行实验探索,进而达到培养学生化学核心素养的目的。
关键词 DIY教学模式;高中化学;核心素养;家庭小实验
中图分类号:G633.8 ? ?文献标识码:B
文章编号:1671-489X(2020)11-0116-03
1 前言
DIY是“Do It Yourself”的英文缩写,意为自己动手操作。将DIY教学模式应用到化学知识讲授中,有利于帮助教师在教学中落实“教师为主导,学生为主体”的教育思想。《普通高中化学课程标准(2017年版)》在化学学科核心素养“科学态度与社会责任”的水平3中提到:“能依据实际条件并运用所学的化学知识和方法解决生产、生活中简单的化学问题。”[1]DIY教学模式能够帮助学生进一步提高化学科学素养,增强自主学习能力,敢于亲自动手操作,运用自己选取的物品进行实验探究,多方面理解化学与技术、社会、环境之间的联系。基于此,笔者将DIY教学模式引入化学科学探究中,利用厨房里可以使用的原材料进行实验探究,完成因为时间等因素无法在课堂上进行的实验操作。
2 问题的提出
教师在化学教学中应全面提升学生的科学素养,不要停留在理论层面或是为了提高考试分数,只给学生简单描述一些教材提及的实验现象。教师应积极利用日常生活中的物品完成教学目标,达到课程标准提出的要求;学生需要在丰富多彩的现实生活世界里通过视觉和触觉的接触,理解教材中的难点和重点知识。
人教版高中化学必修2第三章“金属及其化合物”第二节“几种重要的金属化合物”中的“科学探究—碳酸钠与碳酸氢钠的性质”[2]引起笔者的兴趣。碳酸钠(Na2CO3,俗称纯碱或苏打)和碳酸氢钠(NaHCO3,俗称小苏打或焙碱)是厨房中常见的物品,教师可采用DIY教学模式,帮助学生创设问题,让学生在厨房中亲自探究它们的性质,完成相关探究实验。
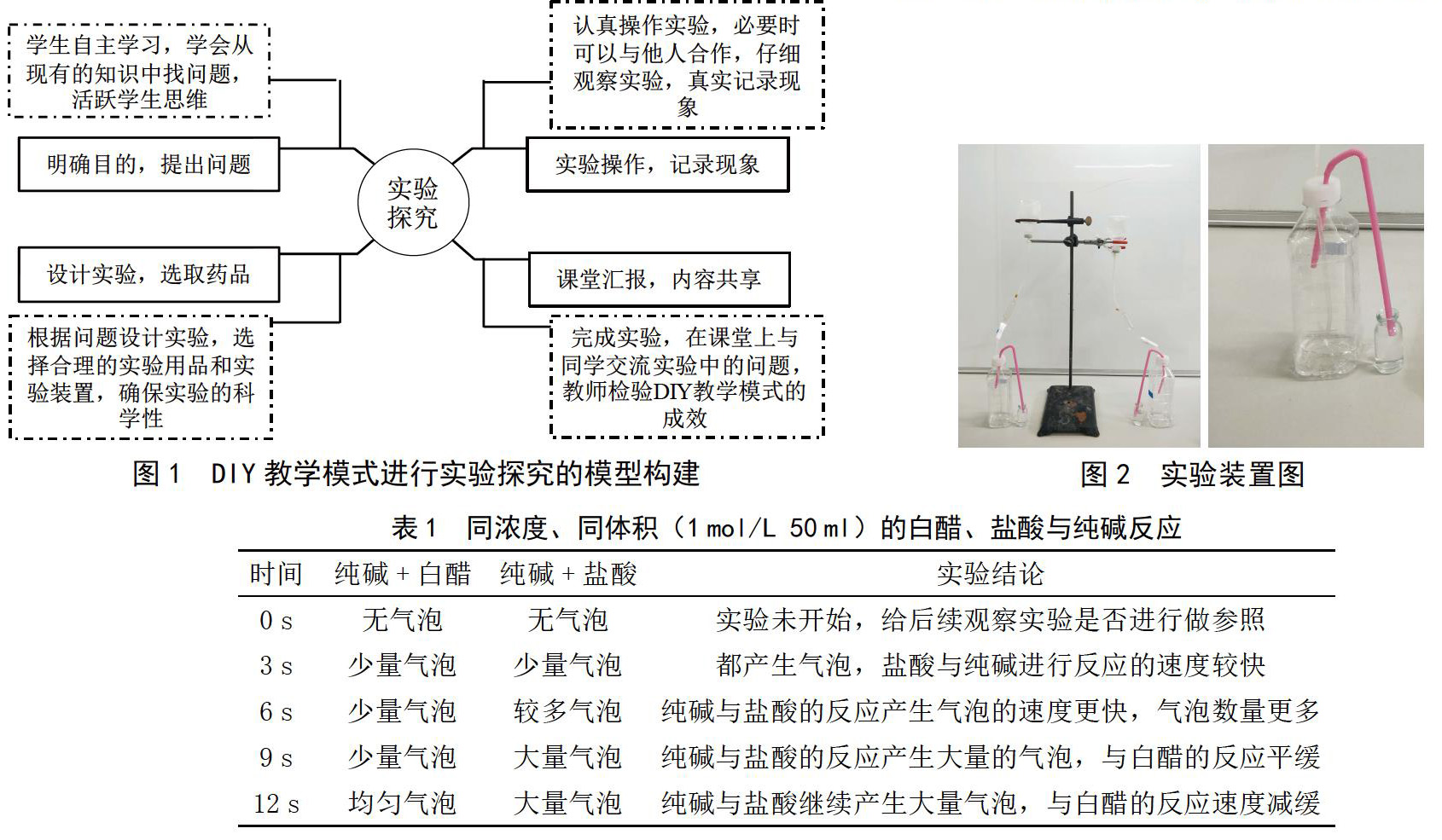
运用DIY教学模式,学生自主查阅在不同条件下酸与碱的反应,利用图1所示模型提出以下问题进行实验探究。
1)若量取同浓度、同体积(1 mol/L 50 ml)的盐酸和醋酸滴入等物质的量的Na2CO3和NaHCO3固体中,观察谁的反应速度快?谁放出的气体多?
2)若量取同pH值、同体积(pH=3,50 ml)的盐酸和醋酸滴入等物质的量的Na2CO3和NaHCO3固体中,观察谁的反应速度快?谁放出的气体多?
根据问题对化学实验用品进行生活化的DIY设计,即可用生活中常见的物品在科学可行的情况下制成实验所需的简便仪器及装置。
3 实验原理
关于探究Na2CO3和NaHCO3与酸反应的实验中,大多数学生只会选择稀盐酸进行操作,在有机相里,常用带NaHCO3固体的NaHCO3饱和溶液洗去其酸性,因NaHCO3本身溶解度不大,碱性又不强,它能随着被中和消耗,不断地溶解、解离来补充碱性[3]。根据此原理,笔者选用同浓度、同体积和同pH值、同体积的盐酸、醋酸分别与等物质的量的Na2CO3和NaHCO3进行反应,观察在反应体系中生成二氧化碳速度的变化及量的多少,说明Na2CO3与NaHCO3与不同条件下的酸反应的区别。
4 实验内容
基于学生对DIY的理解,选用简单装置进行实验操作,在学业要求的基础上,促使学生手脑并用完成药品用量少、实验现象较明显的家庭小实验。
实验用品 ?食用纯碱、食用小苏打、白醋、盐酸、澄清石灰水、矿泉水瓶、可弯曲吸管、输液袋、药匙、天平、注射器、计时器、螺丝刀、pH试纸。
实验步骤
1)根据厨房中已有白醋的浓度和pH值,配制相同浓度和pH值的盐酸溶液。准备图2所示实验装置,在矿泉水瓶盖上用螺丝刀打两个大小合适的孔,一个孔插入输液袋,另外一个孔插入吸管,吸管尾端连接一剪好的矿泉水瓶或小药瓶并倒入澄清的石灰水,将吸管伸入澄清石灰水中,同时检查装置的气密性。
2)称取两份等物质的量(0.025 mol)的纯碱(或者小苏打)固体,将固体分别装入两个大小相同的矿泉水瓶中。
3)关闭输液袋的阀门,分别量取同浓度、同体积(1 mol/L 50 ml)的白醋和盐酸移至输液袋中,连接好输液袋。
4)组装好实验装置,准备好计时器,用夹子夹住吸管的出口,同時打开白醋和盐酸的阀门,并按下计时器,待反应开始打开夹子,观察实验现象。
5)在实验过程中每3 s记录一次纯碱(或者小苏打)与白醋、盐酸反应时出现气泡的状况,判断生成气体的速度。
重新组装实验装置,配制pH=3的白醋和盐酸溶液并分别量取50 ml,观察(0.025 mol)纯碱(或者小苏打)与此状态下的白醋、盐酸反应,重复实验步骤2)~5)并记录实验现象。
5 现象表述
同浓度、同体积的白醋、盐酸与纯碱(或者小苏打)反应 ?在实验过程中,量取浓度为1 mol/L的白醋和盐酸各
50 ml,先打开输液袋的阀门,矿泉水瓶中等物质的量的纯碱(或者小苏打)与盐酸迅速反应,瓶内气泡数量逐渐增多;3 s后去掉吸管处的夹子,澄清的石灰水变浑浊,直至反应装置中的液体不再产生气泡,停止实验。实验记录见表1、表2。
分析表1可以得出,在同浓度、同体积的条件下纯碱与盐酸反应从实验开始时速度较白醋更快一些,产生的二氧化碳气泡更多。通过对强电解质的学习可知,盐酸为强电解质,完全电离为H+和Cl-,纯碱中是CO32-与H+反应先生成HCO3-,进一步反应生成CO2和H2O;醋酸为弱电解质,在电离中部分电离,产生H+、CH3COO-和未电离的CH3COOH。纯碱与同浓度的溶液反应,盐酸中H+浓度含量比白醋中的高,因此,纯碱与盐酸反应生成二氧化碳的速度更快。
与表1中的实验现象比较,表2中在同浓度、同体积的条件下,盐酸与小苏打反应现象更明显。这是因为盐酸中的H+可直接与小苏打中的HCO3-反应,省去与CO32-的反应,所以开始反应的时间更短,产生的气体更多。
同pH值、同体积的白醋、盐酸与纯碱(或者小苏打)反应 ?实验进行时,打开输液袋的阀门,矿泉水瓶内等物质的量的纯碱(或者小苏打)与同pH值的白醋、盐酸反应,继续匀速滴加,观察在不同时间段出现气泡的情况,实验记录见表3、表4。
从表3和表4的实验结论可以看出,白醋较盐酸有更多的气体产生;对比观察实验现象,等物质的量的小苏打较纯碱先产生气体且放出的气体量较多。分析可知,在同pH值、同体积状态下,H+浓度相同,醋酸部分电离,不断地将体系中H+补充到反应中,致使有更多H+可以与HCO-反应;盐酸中H+是一步电离得到,此反应体系要不断地消耗H+,盐酸中的H+不能从自身补充促进反应,因此产生的气体较少。
观察实验现象,根据产生CO2的时间及酸的剩余量可知,相同物质的量的Na2CO3和NaHCO3与不同条件下的酸反应,现象近似相同,所需时长存在差异。由此可得出,在同浓度、同体积条件下,反应速率盐酸大于醋酸,生成气体体积两者近似相等;在同pH值条件下,反应速率基本相同,产生的气体体积醋酸大于鹽酸。
6 注意事项
实验中选用的装置、药品均取自生活,学生对于生活中常见的物品和经常接触的物品用法较为熟悉,这些物品都可能成为开展化学实验的素材,如若选用它们来验证化学实验,探究相关化学规律,可拉近化学实验和实际生活的距离[4]。在用DIY模式进行Na2CO3和NaHCO3与酸反应实验的过程中需要注意以下几点问题。
1)此实验装置需学生自己动手制作,装置的气密性存在瑕疵,小孔处应用包装海绵纸进行处理,确保气密性良好。
2)本实验是用不同条件的酸滴加到等物质的量的纯碱和小苏打中观察实验现象,也可用等物质的量的纯碱、小苏打的水溶液去与酸反应,学生分组进行,观察不同条件的反应现象。
3)实验完成后,教师应该引导学生将反应剩余的药品统一处理,不要随便丢弃,帮助学生养成良好的环保意识,减少对土壤、水资源的污染。
7 结语
在DIY教学模式下进行实验探究,符合课程标准要求,为化学教学注入新的活力。DIY教学模式帮助学生用生活中的物品去验证化学学习过程中遇到的实际问题,学生通过对科学探究内容的学习,自己动手做实验验证Na2CO3和NaHCO3的物理性质和化学性质,学到了变废为宝,掌握了实验的基本操作和注意事项。DIY教学模式培养了学生动手实践的能力,激发了学生学习化学的内在动机,让学生学会用化学的眼睛看待生活,用化学知识指导生活,提升了化学核心素养,增强了创新意识。
参考文献
[1]中华人民共和国教育部.普通高中化学课程标准(2017年版)[S].北京:人民教育出版社,2018:92.
[2]宋心琦.普通高中课程标准实验教科书 化学1 必修[M].北京:人民教育出版社,2007:56.
[3]周祖新.无机化学[M].北京:化学工业出版社,2013:283.
[4]杨光.学会用身边的材料做化学实验[J].化学教与学,2011(8):85-86.

