力求规范 细话分离
侯楚东


刘禹锡在《杂曲歌辞·浪淘沙》中写道:“美人首饰侯王印,尽是沙中浪底来.”从这句诗中我们了解到,早在唐代,人们就掌握了将沙子和金子分离的方法.在日常生活中,我们也经常分离物质,如用漏勺捞出肉汤中的丸子,用滤网除去中药里的药渣等.那么在实验室中,我们是如何对物质进行分离的呢?
考点1:实验操作步骤
“粗盐中难溶性杂质的去除”实验主要包括四个步骤,分别是溶解、过滤、蒸发、计算产率.
l.溶解.
(1)粗盐是混合物,含有氯化钠、可溶性杂质和难溶性杂质等.10 mL水中能溶解多少克粗盐?我们无从知晓,因为不知道杂质是什么,它们的溶解度又是多少.怎么解决这个问题呢?我们可以先称取5g粗盐,将其逐渐加入盛有10 mL水的烧杯里,搅拌,直至粗盐不再溶解,然后称量剩余粗盐的质量,再通过计算得出溶解的粗盐的质量.所以此处有两次称量操作.
(2)注意事项:使用托盘天平时,两边托盘上各放一张相同的纸,游码先归零,遵循“左物右码”原则;量筒读数时,视线要与液体凹液面的最低处保持水平;粗盐溶解时要用玻璃棒充分搅拌.
2.过滤.
(1)注意事项:①“一贴”.滤纸紧贴漏斗内壁.②“二低”,滤纸边缘应略低于漏斗边缘,加入漏斗中液体的液面应略低于滤纸的边缘.③“三靠”.向漏斗中倾倒液体时,烧杯嘴应与玻璃棒接触:玻璃棒的底端应和三层滤纸处轻轻接触;漏斗颈的末端应与烧杯内壁相接触.
(2)过滤后,若滤液仍旧浑浊,可能的原因是:滤纸有破损,过滤时液体的液面高于滤纸边缘,盛接滤液的烧杯不干净等.
3.蒸发.
注意事项:蒸发皿里的溶液不能超过其容积的2/3,加热过程中要用玻璃棒不断搅拌,当蒸发皿中出现较多固体时停止加热.
4.计算产率.
(1)注意事项:要尽量用玻璃棒把所得精盐全部转移到纸上,以减小实验误差. (2)计算公式:精盐产率=精盐的质量/溶解粗盐的质量×100%.
以上操作力求规范,任何一个环节出现差错,都会影响到精盐的产率,当然,除去了粗盐中的难溶性杂质,并不表明就得到了纯净的氯化钠,得到的样品中往往还含有易溶于水的Ca2+、Mg2+、SO2-4等杂质,还需要用化学方法进一步提纯,
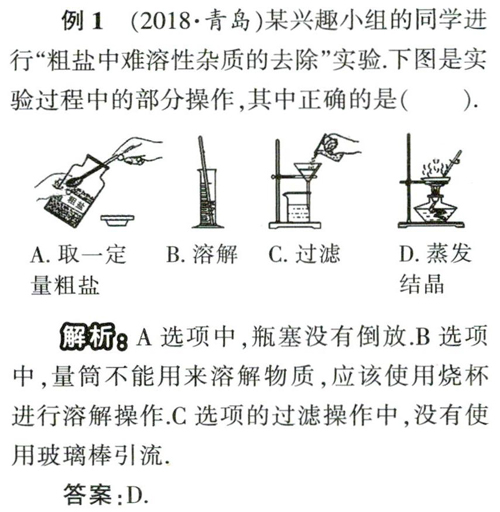
例1 (2018.青岛)某兴趣小组的同学进行“粗盐中难溶性杂质的去除”实验,下图是实验过程中的部分操作,其中正确的是( ).
解析 A选项中,瓶塞没有倒放.B选项中,量筒不能用来溶解物质,应该使用烧杯进行溶解操作.C选项的过滤操作中,没有使用玻璃棒引流,
答案:D.
考点2:玻璃棒的作用
在“粗盐中难溶性杂质的去除”实验中,玻璃棒的用途是:在溶解过程中,玻璃棒起搅拌作用,能够加速物质溶解;在过滤操作中,玻璃棒用来引流;在蒸发操作中,用玻璃棒搅拌,能够使滤液受热均匀,防止液滴飞溅.
例2(2018.南京)下列有关玻璃棒的用途,说法不正确的是( ).
A.称取粗盐后把粗盐研磨细
B.溶解时搅拌,加速粗盐溶解
C.称量精盐前,把精盐固体转移到纸上
D.蒸发时搅拌,防止因局部温度过高造成液滴飞溅
解析: A选项中,研磨物质应使用研钵,而不是玻璃棒,
答案:A.
考点3:分离物质的物理方法
1.过滤:用于固体不溶物与液体的分离,如除去粗盐中的泥沙,除去KN03溶液中的Mn02等.
2.蒸发:用于溶液体系的分离.如从NaCI溶液中提取NaCI,从蔗糖溶液中提取蔗糖.
3.结晶:溶解度受温度变化影响不大的物质用蒸发结晶的方法提纯,如除去NaCI中的KN03;溶解度受温度变化影响大的物质用降温结晶的方法提纯,如除去KN03中的NaCI.
4.蒸馏:用于沸点不同的液体混合物的分离,如制取蒸馏水,
例3 (2019.海南)在“粗盐中难溶性杂质的去除”实验中,下列不需要进行的操作是( ).
A.溶解
B.过滤
C.蒸发
D.蒸馏
解析:在“粗盐中难溶性杂质的去除”实验中,需要进行的操作有溶解、过滤、蒸发和计算产率,没有蒸馏.
答案:D.
考点4:误差分析
分析实验误差,需利用精盐产率的计算公式,并结合具体实验操作来进行判断,
例4实验结束后计算精盐的产率时,发现产率偏低,其原因可能是
(填序号).
A.滤纸破损
B.粗盐没有完全溶解
C.过滤时漏斗中的液面高于滤纸边缘
D.蒸发时没有用玻璃棒搅拌
E.蒸发后所得的精盐很潮湿
F.蒸发皿中的精盐没有全部转移到纸上称量
G.蒸发时待水分完全蒸干时才停止加热,导致食盐颗粒飞溅
解析: A、c選项会使精盐中含有难溶性杂质,使精盐产率偏高.E选项蒸发后所得的精盐很潮湿,会把水的质量当成精盐的质量,使产率偏高.B选项粗盐没有完全溶解,最终导致精盐质量减少,会使精盐产率偏低.D、G选项都会因液滴或固体飞溅导致精盐质量减少,使精盐产率偏低.F选项蒸发皿中的精盐没有全部转移到纸上称量,使精盐质量减少,产率偏低.
答案:BDFG
考点6:实验综合考查
例5(2019.河南)为除去氯化钠中的泥沙和CaC12、MgCl2、Na2S04杂质,某化学兴趣小组的同学将粗盐样品溶解、过滤,除去泥沙后,取粗盐水按如图1所示流程进行实验探究.
(1)溶解、过滤、蒸发操作中都要用到的一种玻璃仪器是____.
(2)写出一个加入Na2C03溶液时所发生反应的化学方程式_____.
(3)上述流程中,若将过滤和加盐酸的操作顺序颠倒,所得精盐产品中会含哪些杂质?(BaS04不溶于水,也不溶于酸)
解析:物质的分离与提纯的基本原则:(1)“不增”.除去杂质的过程中不能引入新的杂质.(2)“不减”,所选试剂只与杂质反应,而不与被提纯的物质反应.(3)“易分”.选用的试剂与杂质反应的產物容易与被提纯物质分离,操作简单易行.(4)“复原”,若除杂的过程中被提纯的物质发生了反应,应将生成物再复原成被提纯的物质.
物质的分离与提纯的基本方法是:先找到被提纯物质与杂质之间的物理或化学性质的差异与联系,再决定选用何种试剂或操作方法.提纯物质的化学方法是指通过发生化反应将混合物分离或除去其中杂质,以达到提纯的目的.在这道题目中,加入过量的氯化钡溶液可将硫酸根离子沉淀下来,加入过量的氢氧化钠溶液可将镁离子沉淀下来,加入过量的碳酸钠溶液可将钙离子和过量的钡离子沉淀下来.
去除粗盐中的多种可溶性杂质时要注意:(1)加入试剂的先后顺序,前面加入的试剂过量,是为了将杂质除净,但也会引入新的杂质,因此后续加入的试剂要能除去前面所加入的过量的试剂.过量的氯化钡可用碳酸钠溶液除去,因而加入试剂时,氯化钡溶液要加在碳酸钠溶液的前面.(2)先加入过量的除杂试剂,当完全沉淀后再过滤,过量的氢氧化钠和碳酸钠可用稀盐酸除去,向滤液中加入适量的稀盐酸,最后蒸发可得到较为纯净的氯化钠.
答案:(1)玻璃棒 (2)Na2C03+CaCl2=CaC03↓+2NaCl或BaCl2+Na2C03=BaC03↓+2NaCI (3)氯化钙、氯化镁、氯化钡(或CaC12、MgCl2.BaC12).
你学会了吗
某化学兴趣小组做“粗盐中难溶性杂质的去除实验”,实验过程如图2所示.
(l)步骤①的名称是____.
(2)步骤②中,玻璃棒的作用是.
(3)步骤③中,当观察到蒸发皿内出现____时,停止加热.
(4)将氯化钠与泥沙分离所采用的方法,是利用了氯化钠
的性质.
参考答案 (1)溶解 (2)引流(3)较多固体 (4)易溶于水

