丙烯酸对仿刺参(Apostichopus japonicus)幼参免疫酶活性的影响
李多慧+田甲申+罗耀明+王丽梅+鹿志创+王秀艳
摘 要:为研究丙烯酸对仿刺参(Apostichopus japonicus)的免疫酶活性的影响,采用半静水式毒性测试方法,分别用3种不同浓度(0.84、4.20、21.00 mg/L)丙烯酸处理24、48、72、96 h后,检测仿刺参体腔液中酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)和过氧化氢酶(CAT)活性。结果发现:与对照组相比,各浓度丙烯酸处理24 h后,ACP、CAT酶活性无显著差异,SOD酶活性显著上升;中、低浓度处理组AKP酶活性显著上升。48 h后,随着丙烯酸处理浓度升高,ACP、AKP、SOD酶活性上升,具有剂量-效应正相关性;与对照组相比,中、低濃度处理组CAT活性显著降低,高浓度处理组CAT活性显著上升。72 h后,随着丙烯酸处理浓度升高,SOD酶活性下降,具有剂量-效应负相关性。96 h后,ACP、AKP酶活性与对照组无显著差异,高浓度组SOD酶活性极显著降低。上述结果表明:0.84~21.00 mg/L的丙烯酸处理0~96 h对仿刺参体腔液ACP、AKP、SOD和CAT等免疫指标有一定程度的影响。
关键词:丙烯酸;仿刺参(Apostichopus japonicus);酸性磷酸酶;碱性磷酸酶;超氧化物歧化酶;过氧化氢酶
中图分类号:S968.9 文献标识码:A
丙烯酸为具辛辣气味的无色酸性液体,可溶于水、乙醚、乙醇,是强酸并且具腐蚀性。丙烯酸属于危险化学品,被收录于《危险化学品目录(2015版)》,腐蚀性极强,几乎对所有的生物都有毒害性[1]。丙烯酸在光、氧和高温同时存在的条件下,发生聚合反应,引起动物中毒,毒性机理为影响胸腺嘧啶进入DNA,进而阻止了尿嘧啶进入RNA,最后抑制蛋白质的合成[2]。丙烯酸及其酯类在化纤、造纸、纺织、胶粘剂等[3-6]领域应用广泛,是现代化工的重要基础原料。在生产丙烯酸及丙烯酸酯的过程中会产生大量废水,该废水含有丙烯酸等高浓度有毒有机物[7],化学需氧量高,毒性大,传统方法较难处理[8]。
仿刺参(Apostichopus japonicus)是黄、渤海重要底栖生物类群,主要摄食底泥中细菌、底栖硅藻和有机质碎屑,作为我国重要海水增养殖品种之一,其生物学数据基本完备、并且取材方便,是海洋底栖环境污染物生物毒性评价的理想受试生物[9-10]。
目前,国内外关于化学品对仿刺参免疫酶活性影响的研究大多集中在重金属、有机污染物及常用药物等方面[11-14],有关丙烯酸对仿刺参免疫酶活性影响的研究尚未见报道。为此,本文通过测定3种不同浓度丙烯酸处理组的仿刺参体腔液中4种免疫酶的活性,研究丙烯酸对仿刺参免疫酶活性的影响。
1 材料与方法
1.1 材料
仿刺参购于大连金州区某育苗场,体质量527±0.86 g,驯养7 d后,挑选健康的仿刺参用于试验,驯养期间每天换水1次,隔日投饵1次。
1.2 仪器与试剂
仪器:多功能酶标仪(瑞士Tecan),CT15RE型台式微量高速离心机(日本 Hitachi)。
试剂:丙烯酸为化学纯(中国国药有限公司),酸性磷酸酶(ACP)、碱性磷酸酶(AKP)、超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和总蛋白定量测试盒均购自南京建成生物工程研究所。
1.3 毒性试验
参考罗耀明等[15]研究结果,将丙烯酸设置3个不同处理浓度(0.84 mg/L、4.20 mg/L、21.00 mg/L),在10 L的玻璃缸中配置10 L不同浓度丙烯酸处理液,同时设置空白对照组,每组设置3个平行样,每个平行样中随机放入仿刺参20头,试验期间不投饵,水温14.5 ℃,溶氧为5.0 mg/L以上,盐度30.0‰,pH 7.9。每天换水1次,换水量10 L。试验开始后0、24、48、72、96 h分别取样,每次每缸随机取3只仿刺参放于冰盒上,用生理盐水清洗仿刺参体表,并用滤纸吸干体表水分,迅速解剖并收集仿刺参的体腔液,4℃、3 000转/min离心20 min后,收集上清液,迅速分装1.5 mL冻存管,放入-80 ℃冰箱中冷冻保存,用于后续的酶活性检测。
1.4 酶活性测定
仿刺参体腔液的ACP、AKP、SOD、CAT酶活性和总蛋白含量按照试剂盒提供的测定方法,利用酶标仪进行测定。
ACP活性定义为:每克组织蛋白在37 ℃与基质作用30 min产生1 mg酚为1个活力单位。
AKP活性定义为:每克组织蛋白在37 ℃与基质作用15 min产生1 mg酚为1个金氏单位。
SOD活性定义为:每毫克组织蛋白在1 mL反应液中SOD抑制率达50%时所对应的SOD量为一个SOD活力单位(U)。
CAT活性定义为:每毫克血红蛋白每秒钟分解1 μmol的H2O2的量为一个活力单位。
1.5 统计分析
采用SPSS 20.0软件,在P<0.05,P<0.01的置信水平,利用单因素方差分析法(One-way ANOVA)分析处理组与对照组酶活性之间的差异。用Excel 2010软件作图,用英文小写字母标注,凡有一个相同标记小写字母的表示差异不显著,凡没有相同标记小写字母的表示差异显著;用英文大写字母标注,凡有一个相同标记大写字母的表示差异不显著,凡没有相同标记大写字母的表示差异极显著。
2 结果
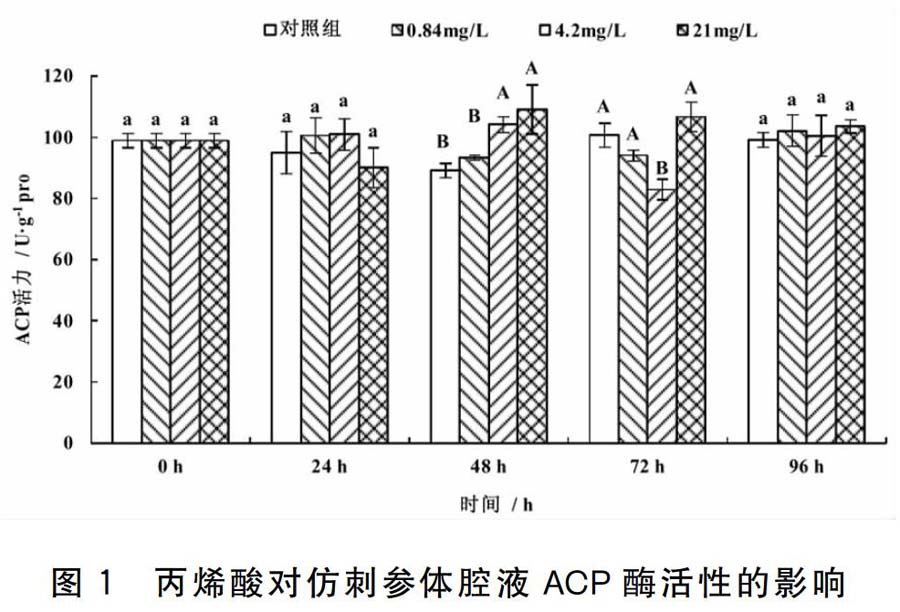
2.1 丙烯酸对仿刺参体腔液ACP酶活性的影响
丙烯酸对仿刺参体腔液ACP酶活性的影响结果见图1。在24 h和96 h,各处理组的仿刺参体腔液ACP酶活性均与对照组无显著差异。在48 h,0.84 mg/L处理组的ACP酶活性与对照组无显著差异,4.20 mg/L、21.00 mg/L处理组的ACP酶活性高于对照组,差异极显著。在72 h,0.84 mg/L、21.00 mg/L处理组的ACP酶活性与对照组无显著差异,而4.20 mg/L处理组的ACP酶活性低于对照组,差异极显著。
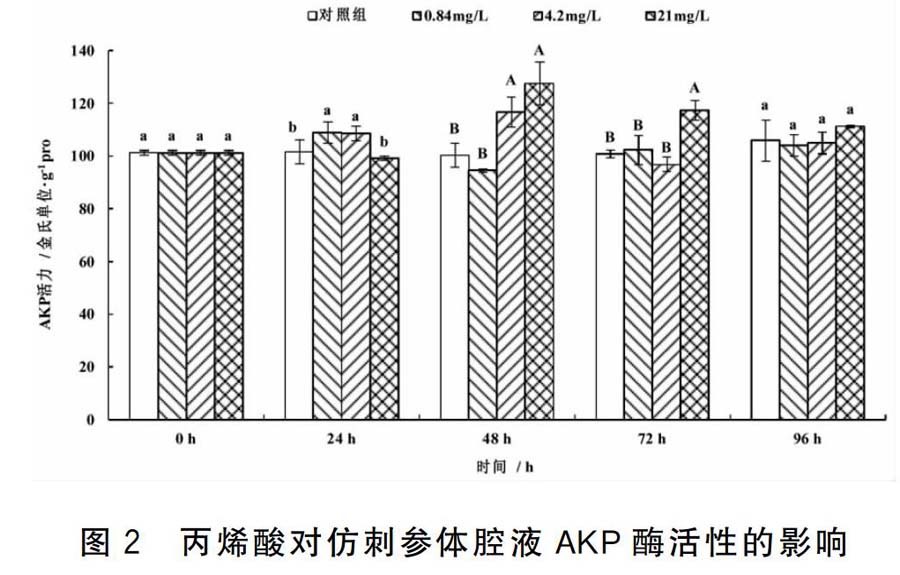
2.2 丙烯酸对仿刺参体腔液AKP酶活性的影响
丙烯酸对仿刺参体腔液AKP酶活性的影响结果见图2。在24 h,0.84 mg/L、4.20 mg/L处理组的AKP酶活性高于对照组,差异显著,2100 mg/L处理组的AKP酶活性与对照组无显著差异。在48 h,4.20 mg/L、21.00 mg/L处理组的AKP酶活性高于对照组,差异极显著,084 mg/L处理组的AKP酶活性与对照组无显著差异。在72 h,21.00 mg/L处理组的AKP酶活性高于对照组,差异极显著,而0.84 mg/L和4.20 mg/L处理组的AKP酶活性与对照组无显著差异。在96 h,各处理组的AKP酶活性均与对照组无显著差异。
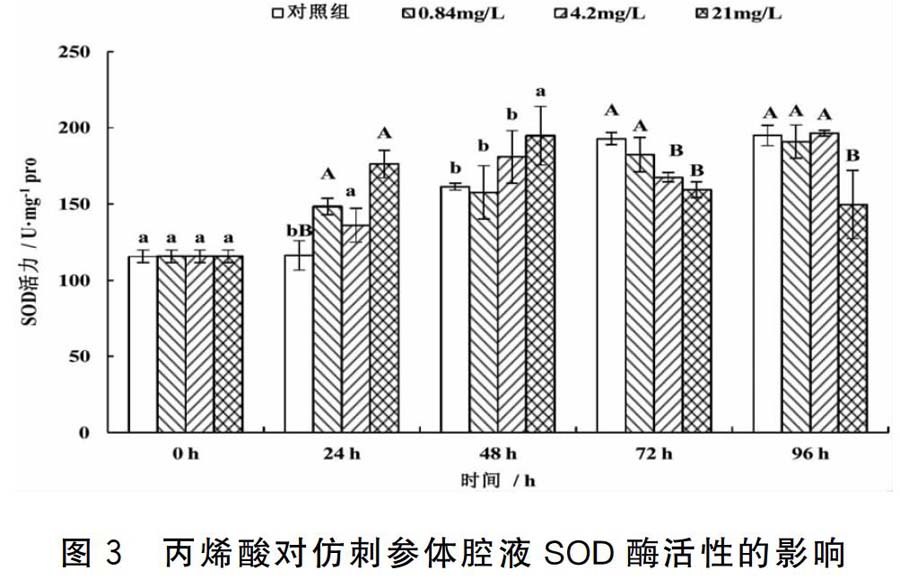
2.3 丙烯酸对仿刺参体腔液SOD酶活性的影响
丙烯酸对仿刺参体腔液SOD酶活性的影响结果见图3。在24 h,各处理组的SOD酶活性均高于对照组,具有非线性的剂量-效应正相关性。在48 h,21.00 mg/L处理组的SOD酶活性高于对照组,差异显著,0.84 mg/L、4.20 mg/L处理组的SOD酶活性与对照组无显著差异。在72 h,各处理组的SOD酶活性均低于对照组,具有剂量-效应负相关性。在96 h,21.00 mg/L处理组的SOD酶活性低于对照组,差异极显著。
2.4 丙烯酸对仿刺参体腔液CAT酶活性的影响
丙烯酸对仿刺参体腔液CAT酶活性的影响结果见图4。在24 h,各处理组的仿刺参体腔液CAT酶活性均与对照组无显著差异。在48 h,084 mg/L处理组的CAT酶活性低于对照组,差异显著。在72 h,21.00 mg/L处理组的CAT酶活性高于对照组,差异极显著。在96 h,0.84 mg/L、21.00 mg/L处理组的CAT酶活性低于对照组,差异显著。
3 讨论
3.1 丙烯酸对仿刺参体腔液ACP、AKP酶活性的影响
在缺乏特异性免疫球蛋白的低等动物体内,ACP、AKP作为溶酶体的重要水解酶,保证了溶酶体有效完成防御和消化的双重功能,参与细胞的消化代谢和免疫调节[16]。ACP、AKP普遍存在于仿刺参体内,它对底物专一性要求低,可以在酸性或碱性条件下将磷酸单脂水解,并能促进营养物质的消化吸收[17-18]。仿刺参体腔液的ACP、AKP还可用作指示外源物质对其免疫活性的影响。Jiang等[11]发现8种二价金属离子中Zn2+、Mg2+、Fe2+、Cd2+、Cu2+可增强仿刺参体腔液的ACP、AKP酶活性,Ca2+、Mn2+、Pb2+则抑制ACP、AKP酶活性。丙烯酸作为一种强酸对仿刺参的幼参具有低毒性[15]。本研究发现0.84 mg/L和4.20 mg/L丙烯酸处理组的仿刺参体腔液ACP酶活性呈诱导—抑制—诱导的趋势,2100 mg/L处理组的ACP酶活性是先抑制后诱导的趋势;0.84 mg/L、4.20 mg/L丙烯酸处理组的仿刺参体腔液AKP酶活性是先诱导后抑制,21.00 mg/L处理组的AKP酶活性是先抑制后诱导。而处理96 h后各浓度的ACP和AKP酶活性与对照组无显著差异,这可能与免疫疲劳有关[19]。
3.2 丙烯酸对仿刺参SOD、CAT酶活性的影响
正常生理状态下,生物机体细胞代谢会产生超氧阴离子自由基,而SOD作为生物体内仅有的以超氧阴离子为作用底物的酶[23],可以清除体内过多的超氧阴离子自由基,使自由基始终保持在较低的水平,避免机体内因氧自由基浓度过高引起的不良反应[20]。SOD的增加或减少受基因的调控,在外界环境因子(如化学毒物)的刺激下,机体受到轻度胁迫时,体内自由基生产量会增加,从而诱导抗氧化酶的合成[21-22],机体内的SOD活性往往会升高,与自由基作用,从而消除自由基对机体的损害。如果受到重度逆境胁迫超过了机体自身的防御能力时,就会抑制该类酶的活性,导致生物体内积累了过多的活性氧,造成应激损伤,机体随之发生生理和病理改变。可以用SOD酶活力的高低来表征生物体是否有病变发生。本试验中三个处理组丙烯酸的仿刺参体腔液中SOD酶活性都是先诱导后抑制。0.84 mg/L处理组的SOD酶活性变化不大,只在24 h时应激反应较大;4.20 mg/L处理组的SOD酶活性在24 h和72 h应激反应较大;21.00 mg/L处理组的SOD酶活性变化极大,在96 h达到最低,与对照组差异极显著,可能该处理组已造成仿刺参氧化损伤。
CAT是酶清除系统的重要组分,能将细胞内H2O2催化分解为H2O和O2,避免细胞、组织遭受氧化损伤[23]。0.84 mg/L处理组的仿刺参体腔液CAT酶活性受到抑制作用,在48 h和96 h抑制效果显著;4.20 mg/L处理组的CAT酶活性受到的影响不显著;21.00 mg/L处理组的CAT酶活性先诱导后抑制,表明在刺激早期可引起仿刺参CAT的应激反应,但随着时间的延长,可能会消弱仿刺参CAT的应答能力,最终导致仿刺参一定程度的氧化损伤。
以上研究表明,受外部环境条件改变的影响,仿刺参能够通过提高超氧化物歧化酶和过氧化氢酶活力来清除多余的活性氧,与其他无脊椎动物中超氧化物歧化酶和过氧化氢酶活力随水温升高变化趋势具有一致性[24]。
参考文献:
[1] 杨海堃.丙烯酸及其酯类产品国内外现状及发展趋势[J].化工技术经济,2001,3(2): 17-19.
[2] Wexler P,Anderson B,Peyster A,et al.Encyclopedia of toxicology[M].Second Edition,University of Michigan: Academic Press,2005.
[3] 錢伯章.丙烯酸及酯的技术进展和应用[J].精细化工原料及中间体,2011,(11): 33-36.
[4] 章文.國内外丙烯酸(酯)的市场分析(上)[J].上海化工,2005,30(2): 44-46.
[5] 李株.丙烯酸酯的性能及其应用进展[J].辽宁化工,2001,30(6): 245-247.
[6] 陶子斌.丙烯酸生产与应用技术[M].北京: 化学工业出版社,2007.
[7] 李海燕,肖华飞,马林,等.丙烯酸及丙烯酸酯生产废水处理工程[J].给水排水,2010,36(3): 58-61.
[8] 李国屏.丙烯酸及其酯的废水处理[J].上海化工,1994,19(1): 29-31.
[9] 张宝琳,孙道元,吴耀泉.灵山岛浅海岩礁区刺参(Apostichopus japonicus)食性初步分析[J].海洋科学,1995,3: 11-13.
[10] 刘晓威,姜森颢,周一兵,等.大连地区仿刺参养殖池塘底栖硅藻生产状况的周年变化研究[J].水产科学,2012,31(11): 679-682.
[11] Jiang J,Zhou Z,Dong Y,et al.The in vitro effects of divalent metal ions on the activities of immune‐related enzymes in coelomic fluid from the sea cucumber Apostichopus japonicas [J].Aquaculture Research,2014,47(4):1269-1276.
[12] 高士博,王摆,董颖,等.苯系物对仿刺参catalase基因表达及酶活性的影响[J].生态毒理学报,2015,10(2): 297-305.
[13] 董颖,王摆,崔程,等.苯系物对仿刺参肠、呼吸树谷胱甘肽过氧化物酶基因表达的影响[J].水产科学,2015,34(5): 311-315.
[14] 姜北,刘薇,周遵春,等.苯系物对仿刺参体内脂质过氧化程度的影响[J].水产科学,2014,33(1):15-21.
[15] 罗耀明,许伟定,李多慧,等.环氧丙烷、丙烯酸和异戊二烯对仿刺参幼参的急性毒性[J].水产科学,2015,34(7): 444-447.
[16] 刘志鸿,牟海津,王清印.软体动物免疫相关酶研究进展[J].海洋水产研究,2003,24(3): 86-90.
[17] 于建伟,李冬梅,李吉龙,等.仿刺参酸性磷酸酶的提取及粗酶性质研究[J].水产科学,2009,28(1): 5-7.
[18] 刘美思,程立坤,罗希,等.两种海洋寡糖对仿刺参免疫活性的影响[J].海洋渔业,2016,38(1): 51-56.
[19] 白楠.凡纳滨对虾Litopenaeus vannamei、仿刺参Apostichopus japonicus免疫增强剂使用频率和免疫疲劳的研究[D].青岛: 中国海洋大学,2010.
[20] 田春美,钟秋平.超氧化物歧化酶的现状研究进展[J].中国热带医学,2005,5(8): 1730-1732.
[21] Vaziri N D,Lin C Y,Farmand F,et al.Superoxide dismutase,catalase.glutathione peroxidase and NADPH oxidase in lead-induced hypertension[J].Kidney Int,2003,63(1): 186-194.
[22] Lopes P A,Pinheiro T,Santos M C,et al.Response of antioxidant enzymes in freshwater fish populations (leuciscus alburnoides complex) to inorganic pollutants exposure[J].Science of the Total Environment,2001,280(1/3): 153-163.
[23] Winston G W,Giulio R T D.Prooxidant and antioxidant mechanisms in aquatic organisms[J].Aquatic Toxicology,1991,19(2):137-161.
[24] 王吉桥,田相利.刺参养殖生物学新进展[M].北京:海洋出版社,2012.
The effects of acroleic acid on the immune enzyme
activity in juvenile sea cucumber Apostichopus japonicus
LI Duo-hui1,TIAN Jia-shen2,LUO Yao-ming1,
WANG Li-mei2,LU Zhi-chuang2,WANG Xiu-yan1
(1.Dalian Fisheries Research Institute,Dalian 116019,China; 2.Liaoning Ocean and Fisheries Science
Research Institute,Key Laboratory of Marine Biological Resources and Ecology, Liaoning Province,Dalian 116023,China)
Abstract:In order to study the effects of acroleic acid on the immune enzyme activities (phosphatase (ACP),alkaline phosphatase (AKP),superoxide enzyme (SOD) and catalase (CAT)) of juvenile sea cucumber (Apostichopus japonicus),coelomic fluid samples of sea cucumbers in 3 acroleic acid concentration(AAC) groups (0.84、4.20、21.00 mg/L), were collected and determined after 24,48,72 and 96 h treatments in terms of semi-hydrostatic toxicity test method.The results showed that, no significant difference was found in ACP and CAT activities after 24 h treatment in all treated groups compared with the control group,however,the SOD activities were significantly increased in 0.84 and 4.20 mg/L AAC groups and similar trend was found on AKP.After 48 h treatment,the ACP,AKP and SOD activities were increased with the increase in AAC,indicating there was a positive correlation between dose and effects.In comparison with the control group,the CAT activities were significantly decreased in 0.84 and 4.20 mg/L AAC groups,whereas the CAT activity was markedly increased in 21.00 mg/L AAC group.After 72 h treatment,the SOD activity was decreased with the increase in acroleic acid concentrations,indicating the negative correlation between dose and effects.After 96 h treatment,no significant difference was found in ACP and AKP activities between experimental groups and the control group.In contrast,the SOD activity was significantly decreased in 21.00 mg/L AAC group.The above results demonstrated that acroleic acid treatment at concentrations of 0.84~21.00 mg/L had,to some extent,effects on the ACP,AKP,SOD and CAT activities in the coelomic fluid of sea cucumber.
Key words:Apostichopus japonicus; acid phosphatase; alkaline phosphatase; superoxide enzyme; catalase

