锦鲤疱疹病毒3型ORF126基因克隆及生物信息学分析
梁思源+吕春爽+安红艳+李全振+赵宝华
摘 要:为研究锦鲤疱疹病毒3型(KHV-3)ORF126基因编码蛋白的功能,我们对该蛋白的结构特征进行研究分析。本实验采用PCR扩增技术获得KHV ORF126基因的完整序列,构建pMD19-T-ORF 126重组质粒,应用生物信息学方法分析ORF126基因编码蛋白的理化特征。结果显示:KHV ORF126基因翻译合成273个氨基酸;ExPasy预测该蛋白的理论分子量为29.9 kDa,等电点为5.11;信号肽的切割部位最可能位于第19~20位氨基酸之间;跨膜区位于第145~168位氨基酸;抗原表位预测显示抗原性良好;编码蛋白不含N-糖基化位点,含有4个O-糖基化位点和17个磷酸化位点。
关键词:锦鲤疱疹病毒;ORF126基因;生物信息学
锦鲤疱疹病毒病(Koi herpesvirus disease,KHVD)感染锦鲤、普通鲤鱼及其变种,该病具有高传染性和高致病性等特点,春夏秋季节为高发期,该病一旦暴发,难以控制,致死率高达80%~90%,给工业化水产养殖造成严重的经济损失[1-2]。锦鲤疱疹病毒病是由锦鲤疱疹病毒3(Cyprinid herpesvirus 3,CyHV-3)引起的传染病,属于异疱疹病毒科鲤鱼病毒属,是一种线性、双链DNA病毒,基因组大小约为295 kb,含有156个开放性阅读框(ORF),成熟的病毒粒子呈球形,由40种蛋白质组成,包括13个囊膜蛋白、3个核衣壳蛋白、2个间质蛋白及22个未分类蛋白,病毒核内的电子密集区疑似由病毒基因组组成的核蛋白[3]。
1998年从美国和以色列首次分离得到KHV;2002年4月在我国广东省某养殖场首次发现KHV感染,死亡率高达80%以上,后经刘荭等用nested-PCR检测证实导致锦鲤死亡的病原体为KHV[4];2008年,Rosenkranz等人成功构建KHV ORF81原核表达载体,并通过实验验证表达的ORF81重组蛋白可用于KHV DNA疫苗的研制;2010年,柯浩等人克隆出囊膜蛋白基因ORF59并高效表达[5];2011年,周井祥等人成功克隆得到KHV-CJ株ORF81基因并对其编码的蛋白进行生物信息学分析,为基因工程疫苗的研究奠定基础[6]。目前,对KHV基因组编码蛋白功能的研究相对滞后,仅部分较保守的主要囊膜蛋白基因的克隆及免疫原性分析取得进展。随着生物信息学技术的迅速发展,蛋白质分子的特异性研究越来越便捷[7-8]。
本实验以河北省水产养殖病害防治监测总站所提供患病锦鲤组织为原料,提取基因组,nested-PCR鉴定KHV的存在,以所提基因组为模板,成功构建pMD19-T-ORF126重组质粒,应用生物信息学软件对ORF126基因编码蛋白的理化性质进行分析,为进一步研究KHV的特异性检测和基因工程疫苗奠定基础。
1 材料与方法
1.1 病毒、菌株与载体
患病锦鲤组织由河北省水产养殖病害防治监测总站提供,pMD19-T载体和E.coli DH5α感受态细胞均购自石家庄天时生物技术有限公司。
1.2 主要试剂
Easy Taq DNA聚合酶、dNTPs、EcoRⅠ和XbaⅠ限制性内切酶、5K DNA Marker、15K DNA Marker等均购自石家庄天时生物技术有限公司;基因组提取试剂盒、凝胶回收试剂盒和质粒小提试剂盒购自上海索宝生物科技有限公司。
1.3 引物的设计与合成
根据NCBI公布的KHV ORF126基因序列,利用Primer Premiers 5.0软件设计ORF126基因的特异性扩增引物(见表1),并引入EcoRⅠ和XbaⅠ限制性内切酶位点(划线部位),送上海生工生物工程技术服务有限公司合成。
1.4 锦鲤疱疹病毒3型ORF126基因的PCR扩增
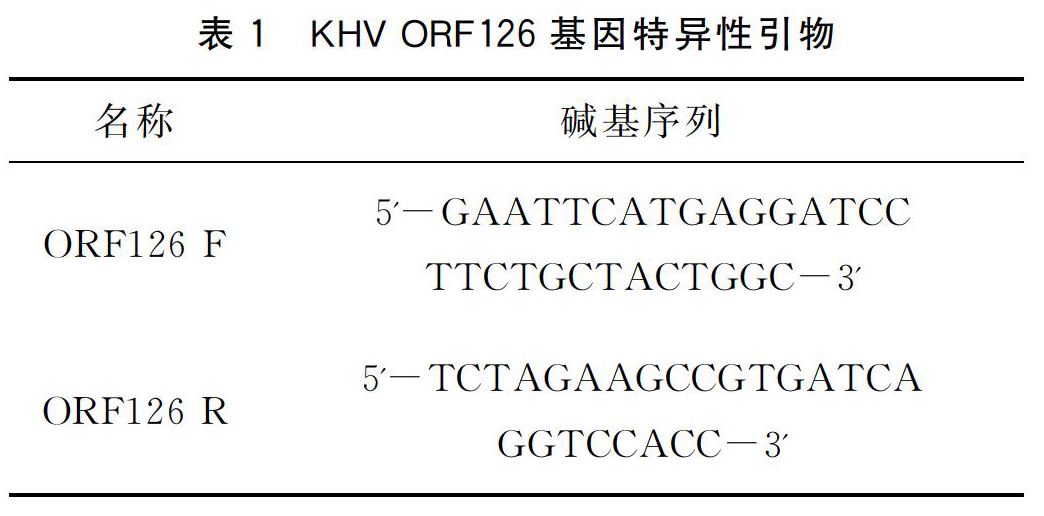
以KHV基因组为模板,进行PCR扩增,反应体系如下:10×buffer(含Mg2+),2.5 μL;2.5 mM dNTP,1 μL;10 μM ORF126 F,1 μL;10 μM ORF126 R,1 μL;模板,1 μL;Taq DNA聚合酶,0.5 μL;ddH2O,18 μL。反應条件如下:94 ℃预变性5 min,94 ℃ 30 s,59.8 ℃ 30 s,72 ℃ 45 s,30个循环后,72 ℃延伸5 min,4 ℃保存;采用浓度为1%的琼脂糖凝胶电泳检测PCR产物。
1.5 锦鲤疱疹病毒3型ORF126基因的克隆及鉴定
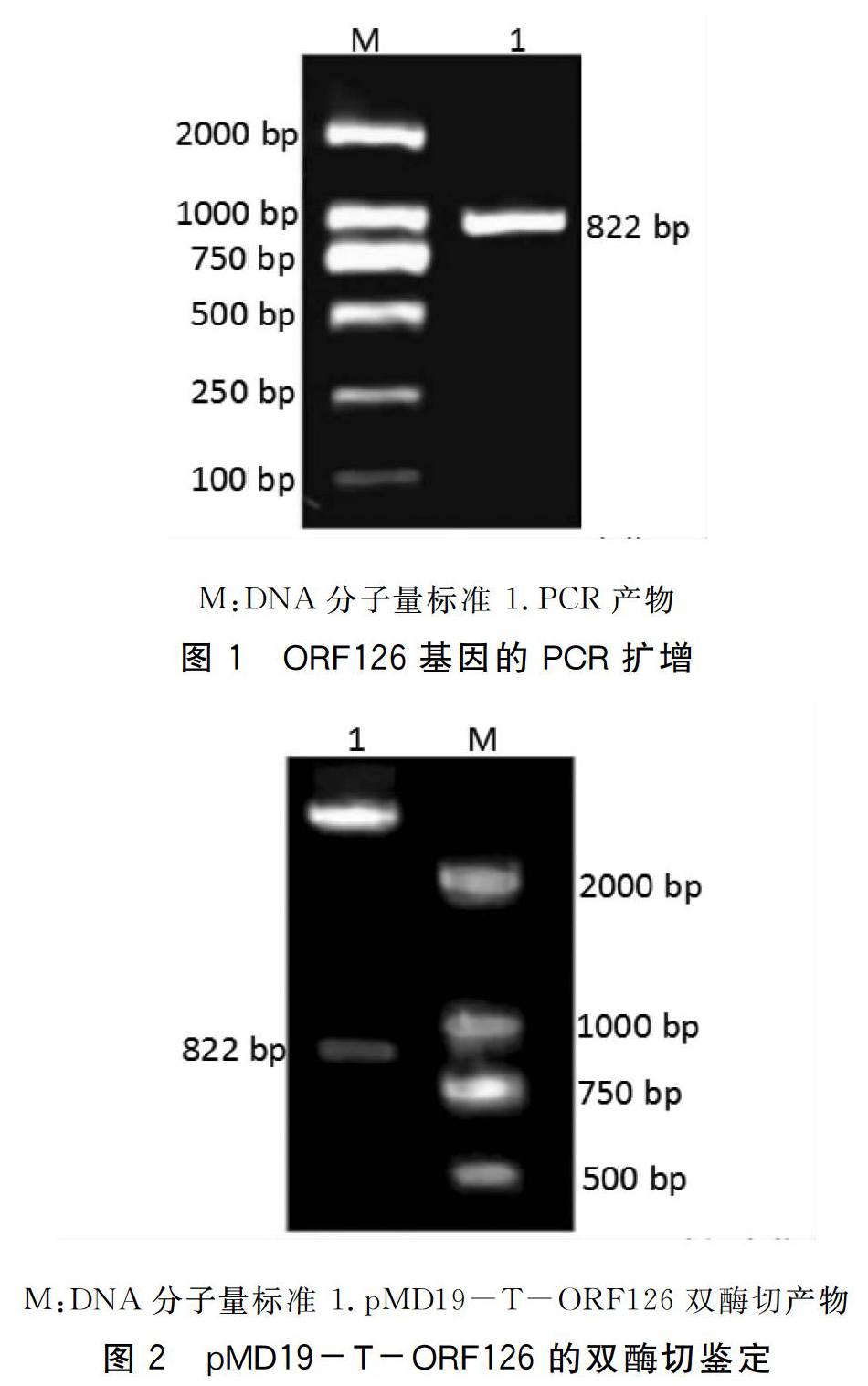
按照凝胶回收试剂盒说明书对PCR产物进行切胶纯化,连接pMD 19-T克隆载体,转化E.coli DH5α感受态细胞,筛选阳性克隆子,并命名为DH5α(pMD19-T-ORF126),送上海生工生物工程技术有限公司进行测序,测序结果在NCBI中比对。
1.6 锦鲤疱疹病毒3型ORF126基因编码蛋白的生物信息学分析
利用ExPasy在线分析获取KHV ORF126基因的氨基酸序列,计算该蛋白的等电点和分子质量;SingalPv3.0在线分析其信号肽分布,Neural net-work(NN)模型预测信号肽引导蛋白的分泌途径,Hidden Markov(HM M)模型预测分析该序列信号肽的存在情况,并确定切割位点分布;TMHMM Server v.2.0在线分析蛋白质的跨膜区域;DNAStar 6.0软件预测蛋白质理化性质;NetNGlyc1.0和YinOYang1.2在线预测N-糖基化位点和O-糖基化位点;NetPhos 3.1 Server在线预测磷酸化位点。
2 结果与分析
2.1 ORF126基因克隆载体的构建
经PCR扩增及1%琼脂糖凝胶电泳显示,获得的DNA片段与目的基因大小相符(图1),连接pMD19-T克隆载体。经EcoRⅠ和XbaⅠ双酶切验证成功后(图2),将质粒送测序,测序结果在NCBI中比对发现,该序列与锦鲤疱疹病毒3型ORF126基因序列(ID:11266456)的一致性为100%,说明ORF126基因片段已成功连接到载体。
2.2 ORF126基因编码蛋白的分子特性及理化特征
ORF126基因大小为822 bp,经ExPasy在线分析得到的氨基酸序列显示:该基因编码273个氨基酸,序列为:MMRILLLLAAAAMISVS VAERLIHAIDGDLKPYGKGPRIKQIDVDEST LVNMKGRKTIEEPEIRKVCCDAFEFNSVKC DRLRFFMSIGNGITEFDPADALEPDELIVYM SAVPPADTLRYRGKEDDGDHGNSAADEAA YQTKRQLLIDVAFIACVGIAGFAIMSMFCIT KVKSDSFPTVPSIGGGPQSSNNNNKGYELL AGTGDTVVHMDSRGRHRNIVNLCGRMTV LINSRVEEDVEDEPVSHDTHDHGTHHPDL EAPPLPDKKPLVDLITA。預测ORF126编码蛋白的理论分子量为29 889.05Da,pI值为5.11,含有42个强酸性氨基酸、38个强碱性氨基酸、138个疏水氨基酸、55个极性氨基酸。
2.3 信号肽分析
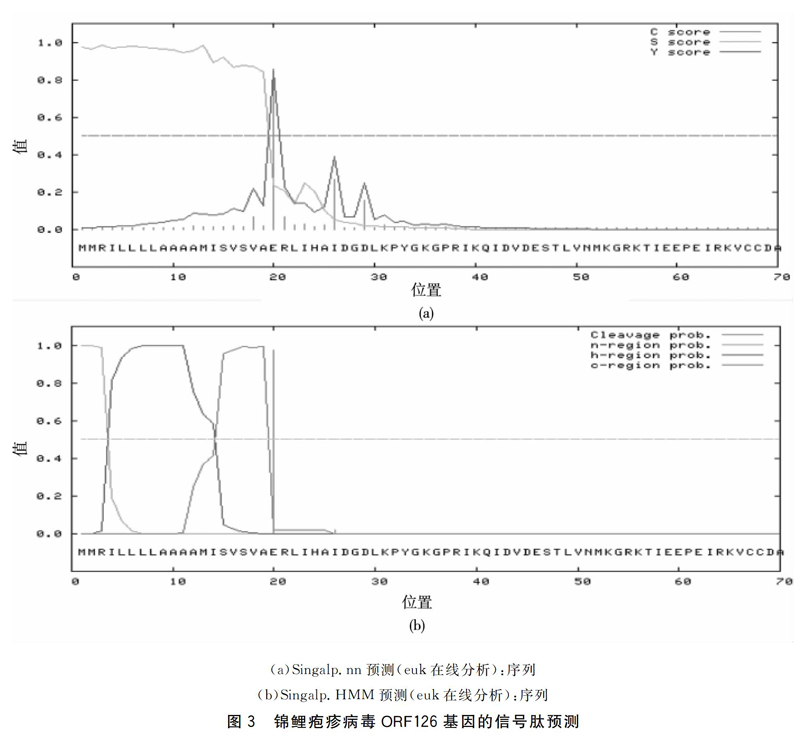
将ORF126基因编码的氨基酸序列通过Singal Pv3.0进行信号切割位点的预测。结果显示(图3),NN和HMM预测显示该蛋白存在信号肽的可能性为1.000,信号肽的切割部位最可能位于第19和20位氨基酸之间。
2.4 跨膜区分析
TMHMM预测ORF126具有一个跨膜区在145~168位氨基酸(图4),N末端可能为跨膜区,C末端位于病毒膜内区。
2.5 KHV ORF126蛋白亲水性、柔韧性、抗原指数以及表面可及性的预测
利用DNAStar子程序Protean对KHV ORF 126蛋白的理化性质进行分析,结果显示(图5),该蛋白中有5个主要区域亲水性较好,有9个区域的抗原指数较高,7个主要区域表面可及性好,而柔韧性好的区域分布相对平均。
2.6 潜在糖基化及磷酸化位点预测
Net NGlyc1.0分析显示ORF126氨基酸序列无潜在N-糖基化位点;YinOYang1.2分析显示该序列存在4个潜在的O-糖基化位点,分别位于第181、188、189、243位氨基酸;Net Phos 3.1 Server分析预测得出,当阈值为0.5时,存在17个潜在磷酸化位点,包括11个丝氨酸和6个苏氨酸。
3 讨论
1998年,锦鲤疱疹病毒病在以色列首次暴发,同年,研究人员通过人工感染试验证实病原体为KHV,并分离出KHV。KHV的传染性极强,健康鲤鱼一旦接触到已感染的鲤鱼或者水,就会被感染,给鲤鱼养殖业带来极大的经济损失。目前,已有研究表明以主要囊膜蛋白基因为模板检测KHV灵敏度更高[9-10],对KHVD进行防治的有效方法是免疫,而基因工程疫苗是最为安全有效的选择[11],本实验选用KHV-3 ORF126基因进行克隆及生物信息学分析,为进一步研究该病毒的致病机理及基因工程疫苗奠定基础。
本研究通过PCR扩增技术获得KHV ORF126基因的完整序列,构建pMD19-T-ORF126重组质粒,测序后进行生物信息学分析,结果显示ORF126基因编码273个氨基酸,预测ORF126基因编码蛋白的理论分子量为29.9 kDa,等电点为5.11;使用Neural net-work(NN)和Hidden Markov(HM M)两种模型预测ORF126基因编码的蛋白质信号肽的切割部位最可能位于第19和20位氨基酸之间[12-14],信号肽是一段引导新合成的蛋白质向分泌通路转移的短肽链,对蛋白质的定位起到非常重要的作用,信号肽不仅可以提高外源基因的表达量,还可以解决外源蛋白易形成包涵体的问题;TMHMM预测ORF126编码的蛋白质具有一个跨膜区,位于第145~168位氨基酸[15],由于膜蛋白可以与膜结合,较难分离提纯,所以需要用软件分析方法对氨基酸序列的跨膜区进行预测;利用DNA Star 6.0分析ORF126基因编码蛋白质的生理生化特征,可预测其亲水性、柔韧性、抗原指数以及表面可及性,结果显示该蛋白抗原性良好,对病毒的致病性起重要作用;使用在线软件分析得出该蛋白无N-糖基化位点,含有4个潜在的O-糖基化位点,以及17个潜在的磷酸化位点[16];本实验研究结果对该疾病的检测及基因工程疫苗的开发具有重要意义[17-18];
参考文献:
[1] Iida T, Sano M.Koi herpesvirus disease[J].Uirusu,2005,55(1):145-51.
[2] 朱霞,王好,李新伟,等.锦鲤疱疹病毒病的研究进展[J].中国兽医科学,2011(1):106-110.
[3] 袁海延,于慧,王好,等.锦鲤疱疹病毒病的研究进展[J].中国兽药杂志,2015,49(5):62-65.
[4] 刘荭,史秀杰,高隆英,等.进口锦鲤暴发病病原的nested—PCR鉴定[J].华中农业大学学报,2002,21(5):414-418.
[5] 柯浩,刘振兴,林敏,等.锦鲤疱疹病毒囊膜蛋白ORF59的克隆、分析及其主要B细胞表位区的原核表达[J].南方水产,2010,06(4):56-62.
[6] 周井祥,李新伟,王好,等.锦鲤疱疹病毒-CJ株ORF81基因的克隆及生物信息学分析[J].水产学报,2011,35(12):1780-1786.
[7] 杨毅,李莉娟,陈孝煊,等.锦鲤疱疹病毒ORF134基因的克隆与表达[J].华中农业大学学报,2013(4):100-105.
[8] 袁海延,于慧,周景祥,等.锦鲤疱疹病毒ORF146基因的克隆、表达及免疫原性的研究[J].中国兽药杂志,2015,49(6):13-16.
[9] 乌日琴,陈芳,张艺宜,等.多重PCR方法检测锦鲤疱疹病毒基因[J].中国动物检疫,2011,28(11):39-43.
[10] 孟慶峰,钱爱东,王伟利.检测锦鲤疱疹病毒方法的研究进展[J].黑龙江畜牧兽医,2012(17):27-29.
[11] 田园园,叶星.鱼用基因工程疫苗研究进展[J].中国农业科技导报,2012,14(5):145-152.
[12] 韦雪芳,王冬梅,刘思,等.信号肽及其在蛋白质表达中的应用[J].生物技术通报,2006(6):38-42.
[13] Schultz U,Kck J,Schlicht H J,et al.Recombinant duck interferon:a new reagent for studying the mode of interferon action against hepatitis B virus[J].Virology,1995,212(2):641-9.
[14] 郑斌,詹希美.信号肽序列及其在蛋白质表达中的应用[J].生物技术通讯,2005,16(3):296-298.
[15] 陈钟强,刘琪,朱贻盛,等.膜蛋白跨膜区预测方法的评价[J].生物化学与生物物理学报(英文版),2002(3):285-290.
[16] Weerapana E,Imperiali B.Asparagine linked protein glycosyla-tion:from eu-karyotic to prokaryotic systems[J].Glycobiology,2006,16(6):91-101.
[17] Gunn P R,Sato F,Powell K F,et al.Rotavirus neutralizing protein VP7:antigenic determinants investigated by sequence analysis and peptide synthesis[J].Journal of Virology,1985,54(3):791-7.
[18] 闫慧丽,席俊,贺梦雪,等.大豆主要过敏原Gly m Bd 28K的同源建模和B细胞表位的预测[J].河南工业大学学报(自然科学版),2016,37(4):41-45.

