基于高压制备液相的多维色谱技术在中药分离纯化中的应用
谢秀满+孙万阳+黄竞怡+Navaneethakrishnan+Polachi佟玲+孙国祥
摘 要 中药物质基础复杂,对其活性成分的分离一直是中药研究的难题。基于高压制备液相的多维色谱系统在高压制备液相色谱的基础上,结合了多种分离技术,极大地提高了色谱系统的分离性能和分离效率,更有利于对物质基础复杂的中药样品进行分离纯化。本文介绍了基于高压制备液相系统的多维色谱系统的基本原理、分离模式以及关键技术,并综述了其在中药分离纯化中的应用。
关键词 高压制备液相; 中药; 多维色谱; 溶剂兼容性; 接口技术; 综述
20160104收稿;20160223接受
本文系“十二五” 科技重大专项“ 重大新药创新”项目(No.2013zx09402202)和国家自然科学基金(Nos. 90612002, 81573586)资助
Email: gxswmwys@163.com
1 引 言
中药广泛应用于疾病的预防和治疗[1]。快速分离纯化技术对于理解中药复杂的物质基础、控制中药质量和发现潜在活性物质具有重要意义,也是目前中药研究的热点问题之一。作为分析型高效液相色谱系统的延伸,高压制备液相系统能够在保证样品分离度的前提下,大幅度提高载样量,从而快速获得高纯度的目标化合物。目前,高压制备液相在中药、生物药、生物制品、食品等样品的分离研究中得到广泛应用[2~6]。然而,由于中药体系复杂,各个组分间含量差异大,且很多物质极性相似、性质相近,单纯使用高压制备液相色谱进行一维分离纯化难以满足多组分复杂样品的分离要求[7,8]。对此,研究者在高压制备液相色谱的基础上,组合不同的分离技术,构建了多维制备色谱系统,有效解决了复杂体系样品分离纯化的难题。目前,基于高压制备液相 色谱的多维色谱系统已应用于中药、食品等研究工作中[9~11]。本文介绍了基于高压制备液相的多维色谱系统的基本原理和关键技术,并综述了其在中药分离纯化中的应用。
2 高压制备液相系统的多维色谱技术
由于天然产物、中药及代谢产物等样品的复杂性,传统的一维色谱在一次运行中,常常受峰容量(Peak capacity)和分辨率的限制,不能满足分析和分离的需要[12]。根据Giddings等[13]的研究,多维分离模式的峰容量应为其构成的各个一维分离模式的峰容量的乘积,这使得在一定时间内从色谱柱中洗脱出来并达到一定分离度的色谱峰的数量大大增加,多维色谱(Multidimensional chromatography, MDC)技术也因此而得到了迅速发展[14]。高压制备液相的多维色谱是在高压制备液相色谱的基础上,通过阀门控制或离线再进样操作,结合其它分离机制或分离模式的色谱技术而形成的一项能对复杂样品实现高容量分离纯化的新技术,可实现样品不同组分在一次操作中的多次分离。它不仅能提高色谱体系的峰容量和正交性[7,15],还能降低色谱峰之间峰重叠[16],使得多组分样品、含量差异大样品,性质相似样品的分离制备成为可能。
2.1 分离模式
根据两维间洗脱馏分是否直接进行连续性分离,可将多维色谱技术分为离线模式和在线模式。离线模式[17]指洗脱馏分不直接进行连续性分离,这种操作模式溶剂选择性广,对仪器要求不高,峰容量大[18],但步骤繁多,自动程度不高,耗时耗力,样品损失较多。对应于离线模式,在线模式是通过仪器系统自身对样品进行捕获、富集,最终实现多次分离的模式[19],这种模式自动化程度高,连续性强,但对溶剂的兼容性要求较高。
二维以上的多维制备色谱通常结合了离线模式与在线模式,这种多维制备色谱更适用于性质相近、结构相似的组分的分离纯化。然而,多维的分离操作会导致样品的损失量增大,因此在分离分析过程中需要确保足够的样品量。
2.2 制备色谱柱
与分析型色谱柱相比,制备型色谱柱的上样量和流速都可以提高3至4个数量级,甚至更高。制备色谱虽然不是分析色谱的简单放大,但是两者可以通过线性放大系数关联起来。线性放大的基本假设是分析色谱系统和制备色谱系统的化学性质、传质过程都保持不变,而进样量、流量、收集体积等乘以线性放大系数,线性放大系数即为制备色谱柱截面积和分析色谱柱截面积之比[20]。
色谱柱的选择要根据样品的性质,对疏水性样品可以选择反相色谱柱,亲水性样品可选正相色谱柱和亲水色谱柱,生物大分子可选择离子交换色谱柱,碳水化合物可用疏水作用色谱柱,无机离子可使用离子色谱柱,合成聚合物可采用凝胶色谱柱,立体异构可采用环糊精固定相,而外消旋体样品则可以考虑手性色谱柱[21]。在实际操作过程中,可以根据样品、色谱柱以及流动相的特点,合理设计实验对样品进行纯化。Zhang等[22]通过以NaHCO3缓冲液和0.035%三氟乙酸作为pH调节剂,根据在不同pH值条件下,色谱柱和样品在流动相选择性不同,从复杂样品中纯化出33种化合物单体。Wei等[23]采用苯基己基色谱柱,这种色谱柱在乙腈作用下对三酰基甘油具有疏水作用,而在甲醇作用下对三酰基甘油具有ππ键相互作用,实验成功从不同食用油中分离纯化出多种化合物单体。
2.3 在线多维色谱关键技术
多维的分离虽然为药物研究带来很大便利,然而如何解决不同维度溶剂体系兼容性问题,如何构建转换接口以实现两维溶剂体系的转换,以及如何利用制备色谱柱等因素设计实验对复杂样品进行有效的分离纯化仍是影响多维色谱发展的核心问题。
2.3.1 分离体系兼容性 影响分离体系兼容性的最主要因素是不同维度之间溶剂与溶剂、溶剂与样品兼容性问题。只有对两者进行合理的匹配,才可能实现最佳的分离效果。可以通过以下方法解决溶剂体系兼容性问题:
(1)使用兼容性溶剂 使用兼容性溶剂是解决该问题最简单、最直接的办法。陈芳芳[24]根据分子排阻色谱和反相色谱不同的分离机理,采用Sephadex LH20中压柱作为第一维,以C18制备色谱柱作为第二维,构建了具有正交性的全二维在线中压液相×制备型高效液相色谱的制备液相色谱系统(MPLC×prepHPLC),两维都以甲醇/水为流动相,样品在经第一维洗脱分离后储存在富集柱上,然后被交替送入第二维制备液相色谱柱进行进一步分离,在经历了两种分离机制的色谱柱分离后,获得18种纯化的化合物单体。
(2)在线稀释 在进行色谱分离时,可以采用初始流动相作为样品溶剂来避免样品、溶剂以及流动相不兼容的问题。因而可以将第一维馏分切割成小体积,与第二维流动相混合后进入第二维色谱柱中。Liu等[25]通过将一维反相色谱柱洗脱的馏分进行高有机相在线稀释,然后经定量环到达第二维进行亲水色谱柱分离,成功构建了在线RP/HILIC二维液相系统。这种系统在第一维反相色谱中可以有效对极性小的物质进行分离,在第二维亲水色谱中能有效对极性大的物质进行分离,适合各成分间极性范围广的物质的分离。
(3)在线脱溶剂 可以通过萃取或过滤的方式实现在线脱溶剂,但这种方法由于萃取不彻底或者洗脱不彻底,造成一定的溶剂残留,影响下一维分离。也可以通过控制样品捕集器的温度或真空度实现。田宏哲等[26]通过设计特定的样品环,使第一维的馏分在样品环中(90℃环境下)真空浓缩,第二维流动相经过该特定样品环后将浓缩的样品带入到第二维色谱柱中进行分离,成功实现了6种多环芳香烃化合物的分离。在线脱溶剂是需要考虑的样品的稳定性、耐热性等因素,如果样品耐热性强、稳定性好,采用高温真空浓缩会提高脱溶剂效率。
2.3.2 接口转换技术 如果各维溶剂体系兼容,理论上可以将上一维样品直接进入到下一维中,但是制备液相流速较大,如果直接进样可能会导致下一维进样体积过大,影响分离效率。所以需要通过设计样品转换接口对上一维样品进行在线处理来解决这个问题。对于不兼容性溶剂体系,就更需要依赖这种转换接口实现在线分离。捕集柱阀切换接口、样品环阀切换接口、平行柱阀切换接口是常见的3种接口转换技术。
捕集柱阀切换接口技术是在不同维度间形成样品捕集过程,对上一维馏分进行在线的捕集,已达到降低第一维切割组分的溶剂体积或者改变溶剂组成比例,然后通过阀切换技术,使用强洗脱剂将样品进样到下一维。在这种模式下,捕集柱对切割馏分的保留能力大于第一维色谱柱,且馏分在第二维流动相洗脱条件下易于解吸,以确保馏分的回收率。因此,根据样品以及流动相特点选择适合的捕集柱至关重要。Qiu等[27]在对河套大黄化学成分分离纯化的研究中,通过对3款不同型号色谱柱进行色谱柱大小、稀释比例、柱直径与柱长比值等因素的比较,选择ODS Prepcolumn为捕集柱(15 mm×30 mm i.d.), 硅胶填充中压制备柱为第一维,将一维馏分浓缩在特定的固相捕集柱上后,再通过阀切换技术使流动相将样品进入到第二维色谱柱中,分离纯化出了25种化合物单体。
样品环阀切换接口技术的环接口通常由两个相同体积的样品环和多通切换阀组成[28],第一维色谱柱的洗脱产物分别交替的储存在样品环中,第二维的泵再将储存环里的样品带入第二维进行分离[28]。使用这种接口模式时,第一维的流速较小,且要求各维流动相具有很好的兼容性,对样品有很好的溶解性。Qiao等[29]通过两个样品环切换,将第一维馏分交替储存到样品环中,并且通过第一维储存在样品环中的流动相比例,实时调节第二维初始流动相比例,以降低溶剂兼容性问题的影响,大大提高了色谱体系的峰容量。平行柱阀切换接口技术的原理其实与样品环阀切换接口模式很类似,不同的是它没有样品环作为中间储备环节,第一维样品直接交替转移到第二维两根或者多根色谱柱柱头,在第二维柱头实现谱带压缩或者样品富集,当其中的一根色谱柱正在进样时,第二根色谱柱正在进行洗脱。Machtejevas等[30]对血滤液中多肽类化合物的分析中,通过一维离子交换色谱柱平行串联4根反相色谱柱,在96 min内分离出超过1000个色谱峰。
由于分析型液相色谱在样品载样量、流速等方面都小于制备色谱,因而它更容易对样品进行稀释、浓缩、转移,更容易实现在线操作,因而接口转换技术在分析领域发展相对较快[25,26,29,30]。但是,只要合理选择流动相和色谱柱,构建合适的在线接口解决溶剂兼容性问题,就可以实现对样品的在线多维分离制备。
3 高压制备液相色谱的多维色谱在中药研究中的应用
高压制备液相色谱可以与不同色谱分离技术联用,常见的联用技术有传统的柱层析法,凝胶渗透法[31]、逆流色谱法以及超临界萃取法[32]等。高压制备液相也可以通过与不同分离机制的色谱柱联用对样品进行多维分离。
3.1 高压制备液相色谱联用柱层析法在中药研究中的应用
高压制备液相色谱可以与传统层析柱[33~35]技术联用。通过柱层析法对样品进行粗分离,然后将各馏分进行浓缩、富集,通过这种操作,样品各成分相对含量大大提高,杂质峰减少,且可通过多次柱层析达到样品纯化的目的,有利于高压制备液相进行下一维分析。Zhang等[36]通过低极性SP850大孔吸附树脂对蛇竹石杉进行粗分离,除去样品中极性组分, 获得粗萃取物,然后采用低压C18柱继续对样品富集,最后采用高压制备液相色谱分离,对粗馏分进行分离纯化,制备出了石杉碱A(纯度99.1%)和石杉碱B(纯度98.6%)。由于柱层析法自动化操作不高,耗时耗力,且容易造成样品污染,因而它与高压制备液相难以实现在线联用。
3.2 高压制备液相色谱法联用逆流色谱的多维色谱在中药研究中的应用
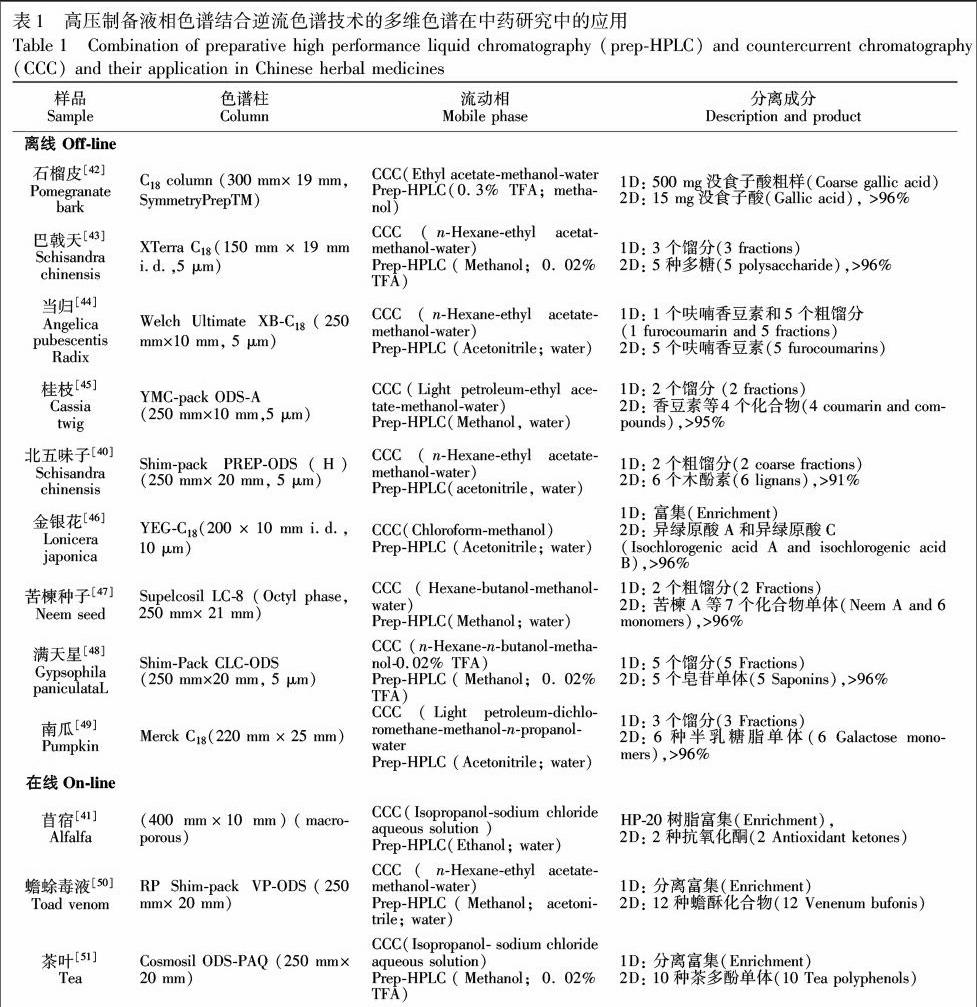
逆流色谱(Countercurrent chromatography,CCC)是利用不同物质在所选择的两相溶剂中的分配系数不同,通过多次逆流分溶对物质进行分离[37]。由于它不使用固相载体作固定相,因而克服了固相载体带来的样品吸附、损失、污染和峰形拖尾等缺点[38,39]。高压制备液相色谱通过与之联用在中药研究中得到了相对广泛的应用,见表1。
目前,大部分高压制备液相与逆流色谱联用大多采用离线模式。由于CCC样品处理要求不高,上样量大,在与制备液相联用时通常作为第一维。Zhu等[40]采用三维分离体系从北五味子中纯化出6种木酚素单体,该方法首先通过AB8大孔吸附树脂对北五味子醇提物进行粗分离,然后采用高速逆流色谱对目标馏分进行第二维分离,最后通过高压制备液相对目标馏分进行第三维分离。虽然这种方法操作复杂,但是通过组合不同分离机制色谱条件,整个色谱体系的峰容量得到了很大的提高,实现了对6种性质相近的木酚素的分离。对应于离线模式,在线模式在时间成本、劳动成本等方面具有突出的优势。Liang等[41]构建一个在线二维色谱体系,以逆流色谱为第一维,当检测到目标成分以后,六通阀将通路切换到第二维,当第一个目标峰全部进入第二维之后,第一维保持原有流动相比例不变,且流动相不洗脱,泵在第二维高压制备液相工作,对第一个目标峰进行洗脱,洗脱完成后,第一维又开始工作,如此实现了对两种抗氧化剂的纯化,大大简化了实验操作步骤。
3.3 高压制备液相色谱自身结合的多维色谱在中药研究中的应用
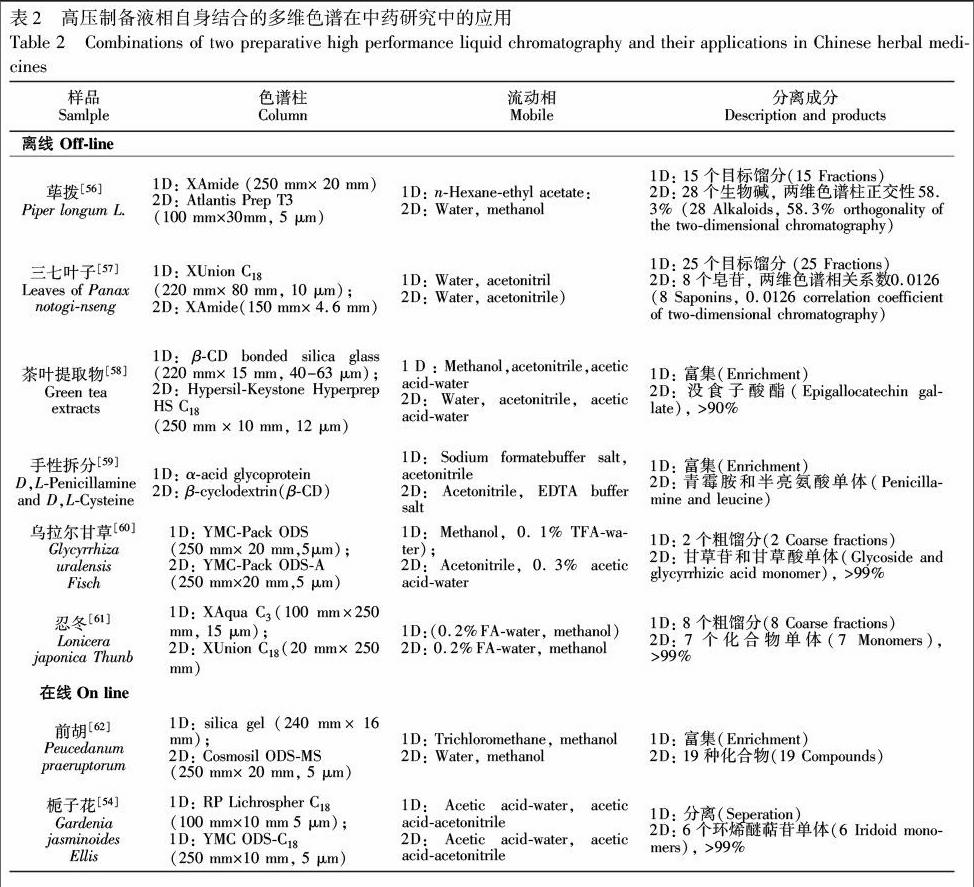
通过相同或不同分离机制的色谱柱结合也可以实现多维色谱,见表2。正相(NP)、反相(RP)、体积排阻(SEC)、离子交换(IEX)等不同的液相色谱分离模式,由于分离机理的不同,分离选择性也有很大差异[52]。van Beek等[53]首先通过硅胶柱层析(正相)对样品进行富集,除去样品中杂质,然后采用C18柱(反相)将银杏叶中性质差别较大的物质进行分离,对于多个目标化合物的组分,进一步采用银色谱法(离子交换)对性质相近组分进行第二维分离,成功从银杏叶中获得了6种极性相似的银杏酚酸单体。高压制备液相色谱自身联用也可以采用相同分离机制色谱柱,连续多次分离[54],Li等[55]通过将相同的色谱柱进行串联建立循环制备液相,在检测器未检测到样品信号前,柱通过阀切换技术使流动相进废液,除去样品中极性大的杂质,检测到样品信号以后,再通过阀切换使目标组分进入下一个色谱柱,然后使在两根色谱柱上多次循环分离,直至目标组分完全分离,通过色谱峰信号一次收集所有馏分。串联色谱柱,实际也就等同于增加了色谱柱长,增加理论塔板数,提高对物质分离的能力。
4 总结与展望
与一维制备技术相比, 基于高压制备液相的多维色谱技术能显著提高色谱峰容量和选择性, 分离纯化能力强, 可以解决单一色谱分离模式难以解决的分离分析问题。多维在线分离模式的发展, 使得仪器自动化程度大幅度提高, 降低了样品的生产周期短以及生产成本。基于高压制备液相的多维色谱制备技术已经逐渐成为中药研究中重要的分析工具。
多维制备因其大量、高速的特点, 使得它在实现高自动化操作上面临更大挑战。接口技术、分离体系的兼容性问题仍然是其发展的关键性因素。在制备过程中, 如何自动化、大批量的将分离馏分进行浓缩富集, 快速获得高纯度目标化合物, 也是目前亟需解决的问题之一。可以相信, 随着人们的不断深入探索和研究, 以高压制备液相为基础的多维色谱制备技术会成为现代药物研究中更具贡献力的技术。
References
1 Cao J L, Wei J C, Chen M W, Su H X, Wan J B, Wang Y T, Li P. J. Chromatogr. A, 2014, 1371: 1-14
2 Latif Z, Sarker S D. Methods Mol. Bio., 2012, 864: 255-274
3 Asakawa D, Iimura Y, Kiyota T, Yanagi Y, Fujitake N. J. Chromatogr. A, 2011, 1218(37): 6448-6453
4 Li W, Han J, Li Z, Li X, Zhou S, Liu C. J. Chromatogr. B, 2008, 862(12): 51-57
5 Rao R N, Alvi S N, Rao B N. J. Chromatogr. A, 2005, 1076(12): 189-192
6 Hagelin G, Oulie I, Raknes A, Undheim K, Clausen O G. J. Chromatogr. B, 2004, 811(2): 243-251
7 Camenzuli M, Schoenmakers P J. Anal. Chim. Acta, 2014, 838: 93-101
8 Yao C L, Yang W Z, Wu W Y, Da J, Hou J J, Zhang J X, Zhang Y H, Jin Y, Yang M, Jiang B Liu H X, Guo D A. J. Chromatogr. A, 2015, 1402: 71-81
9 Wei Y, Xie Q, Dong W, Ito Y. J. Chromatogr. A, 2009, 1216(19): 4313-4318
10 Rochfort S, Caridi D, Stinton M, Trenerry V C, Jones R. J. Chromatogr. A, 2006, 1120(12): 205-210
11 Turner T D, Meadus W J, Mapiye C, Vahmani P, LopezCampos O, Duff P, Rolland D C, Church J S, Dugan M E. J. Chromatogr. B, 2015, 980: 34-40
12 ZHANG LiHua, ZHANG WeiYong, ZHANG YuKui, MA ChangJiaXin. Chinese Journal of Chromatography, 2003, 21(1): 32-37
张丽华, 张维冰, 张玉奎, 马场嘉信. 色谱, 2003, 21(1): 32-37
13 Giddings J C, Chang J P, Myers M N, Davis J M, Caldwell K D. J. Chromatogr. A, 1983, 255: 359-379
14 CONG JingXiang, LIN BingChang. Prog. Chem., 2007, 19(11): 1813-1819
丛景香, 林炳昌. 化学进展, 2007, 19(11): 1813-1819
15 Palma S D, Hennrich M L, Heck A J, Mohammed S. J. Proteomics, 2012, 75(13): 3791-3813
16 DI Xin, CHEN XueGuo, KONG Liang, ZOU HanFa. Chinese Bulletin of Life Seiences, 2003, 15(2): 95-100
厉 欣, 陈学国, 孔 亮, 邹汉法. 生命科学, 2003, 15(2): 95-100
17 HUANG JingYi, TONG Ling, DING Li. Progress in Pharmaceutical Sciences, 2015, 39(5): 357-363
黄竞怡, 佟 玲, 丁 黎. 药学进展, 2015, 39(5): 357-363
18 AN Rong, XIAO Rao. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2014, 16(3): 549-553
安 蓉, 肖 尧. 世界科学技术-中医药现代化, 2014, 16(3): 549-553
19 GAO Hui, WEN XueSen, MA XiaoJun, CHEN DiHua, SI JianYong. Chin. J. Pharm. Anal., 2007, 27(4): 616-620
高 辉, 温学森, 马小军, 陈迪华, 斯建勇. 药物分析杂志, 2007, 27(4): 616-620
20 CHEN XiaoWei, HE MeiLian. West China J .Pharm Sci., 2005, 20(4): 332-333
程小卫, 何美莲. 华西药学杂志, 2005, 20(4): 332-333
21 YUAN LiMing. The Preparative Chromatography Technology and Its Aapplication. Beijing: Chemical Industry Press, 2004: 2-4
袁黎明. 制备色谱技术及应用, 北京: 化学工业出版社, 2004: 2-4
22 Zhang Y, Zeng L, Pham C, Xu R. J. Chromatog. A, 2014, 1324: 86-95
23 Wei F, Hu N, Lv X, Dong X Y, Chen H. J. Chromatogr. A, 2015, 1404: 60-71
24 CHEN FangFang. Coupling Chromatographic Techniques for Preparative Isolation of Tea Ingredients and Its Detection on Antioxidant Activity, Xiamen University, 2014: 17-26
陈芳芳. 基于色谱联用技术对茶叶成分的分离制备及其抗氧化活性的检测, 厦门大学, 2014: 17-26
25 Liu A, Tweed J, Wujcik C E. J. Chromatogr. B, 2009, 877(2021): 1873-1881
26 TIAN HongZhe, XU Jing, GUAN YaFeng. Chinese J. Anal .Chem., 2008, 36(6): 860-864
田宏哲, 徐 静, 关亚风. 分析化学, 2008, 36(6): 860-864
27 Qiu Y K, Chen F F, Zhang L L, Yan X, Chen L, Fang M J, Wu Z. Anal. Chim. Acta, 2014, 820: 176-186
28 DING Kun, WU DaPeng, GUAN YaFeng. Chinese Journal of Chromatography, 2010, 28(12): 1117-1122
丁 坤, 吴大朋, 关亚风. 色谱, 2010, 28(12): 1117-1122
29 Qiao X, Song W, Ji S, Li Y J, Wang Y, Li R, An R, Guo D A, Ye M. J. Chromatogr. A, 2014, 1362: 157-167
30 Machtejevas E, John H, Wagner K, Standker L, MarkoVarga G, Forssmann W G, Bischoff R, Unger K K. J. Chromatogr. B, 2004, 803(1): 121-130
31 Mangas I, Vilanova E, Benabent M, Estevez J. Toxicol Lett, 2014, 225(1): 167-176
32 Lo T C, Nian H C, Chiu K H, Wang A Y, Wu B Z. J. Chromatogr. B, 2012, 893894: 101-106
33 Zhang Y, Jiao J, Liu C, Wu X, Zhang Y. Food Chem., 2007, 107: 1326-1336
34 Zhou H, Yuan Q, L J u. Food Chem., 2011, 126(3): 1361-1365
35 Kuang P, Song D, Yuan Q, Yi R, Lv X, Liang H. Food Chem., 2013, 136(2): 342-347
36 Zhang H, Liang H, Kuang P, Yuan Q, Wang Y. J. Chromatogr. B., 2012, 904: 65-72
37 ZHENG Wei. Chinese Journal of Antibiotics, 2005, 3: 180-186
郑 卫. 中国抗生素杂志, 2005, 3: 180-186
38 DAI DeShun, WANG YiMing, LUO GuoAn. Chinese J. Anal. Chem., 2001, 29(5): 589-591
戴德舜, 王义明, 罗国安. 分析化学, 2001, 29(5): 589-591
39 Li S, Wang W, Tang H, Chen K, Yang J, He L, Ye H, Peng A, Chen L. J. Chromatogr. A, 2014, 1344: 1-8
40 Zhu L, Li B, Liu X, Huang G, Meng X. Food Chem., 2015, 186: 46-52
41 Liang J, Yang Z, Cao X, Wu B, Wu S. J. Chromatogr. A, 2011, 1218(36): 6191-6199
42 Lu J J, Wei Y, Yuan Q P. Sepa. Purif. Technol., 2007, 55(1): 40-43
43 Zhu L, Li H, Liang Y, Wang X, Xie H, Zhang T, Ito Y. Separation and Purification Technology, 2009, 70(2): 147-152
44 Cheng G J S, Li G K, Xiao X H. Sep. Purif. Technol., 2015, 141: 43-49
45 HANG Wei, ZHANG QinDe, WANGXiao, DUAN WenJuan. Nat. Prod. Res. Dev., 2014, 26: 1807-1810
杭 伟, 张钦德, 王 晓, 林昌虎, 文 娟. 天然产物研究与开发, 2014, 26: 1807-1810
46 Guo W, Wang L, Gao Y, Zhao B, Wang D, Duan W, Yu Z. J. Chromatogr. B, 2015, 981-982: 27-32
47 Silva J C, Jham G N, Oliveira R D, Brown L. J. Chromatogr. A, 2007, 1151(1-2): 203-210
48 Yao S, Luo J, Huang X, Kong L. J. Chromatogr. B, 2008, 864(12): 69-77
49 Du Q, Jiang Z, Wang D. J. Chromatogr. A, 2009, 1216(19): 4176-4180
50 Qiu Y K, Yan X, Fang M J, Chen L, Wu Z, Zhao Y F. J. Chromatogr. A, 2014, 1331: 80-89
51 Chen W B, Li S Q, Chen L J, Fang M J, Chen Q C, Wu Z, Wu Y L, Qiu Y K. J. Chromatogr. B, 2015, 997: 179-186
52 Sommella E, Pepe G, Ventre G, Pagano F, Manfra M, Pierri G, Ismail O, Ciogli A, Campiglia P. J. Chromatogr. A, 2015, 1375: 54-61
53 van Beek T A, Wintermans M S. J. Chromatogr. A, 2001, 930(12): 109-117
54 Zhou T, Zhao W, Fan G, Chai Y, Wu Y. J. Chromatogr. B, 2007, 858(12): 296-301
55 Li G Z, Meng Q Y, Luo B, Ge Z H, Liu W J. Chromatogaph, 2015, 31(1): 84-89
56 Li K, Zhu W, F Q u, Ke Y, Jin Y, Liang X. Analyst, 2013, 138(11): 3313-3320
57 Guo X, Zhang X, Feng J, Guo Z, Xiao Y, Liang X. Anal. Bioanal.Chem., 2013, 405(10): 3413-3421
58 Lai S M, Gu J Y. Food Bioprod. Process., 2014, 92(3): 314-320
59 Bhushan R, Kumar R. J. Chromatogr. A, 2009, 1216(15): 3413-3417
60 Chang L, Wei Y, Bi P Y, Shao Q. Sep. Purif. Technol., 2014, 134: 204-209
61 Jin H, Liu Y, Feng J, Guo Z, Wang C, Zhong Z, Peng X, Dang J, Tao Y, Liang X. J. Sep. Sci., 2013, 36(15): 2414-2420
62 Wang X Y, Li J F, Jian Y M, Wu Z, Fang M J, Qiu Y K. J. Chromatogr. A, 2015, 1387: 60-68
Abstract Separation of the active ingredients of Chinese medicine is always difficult due to its complexity matrix. Recent years, the preparativehigh performance liquid chromatography (PreHPLC)based multidimensional chromatography combined with the characteristics of different separation technology improved the separation capability and efficiency, and was applied to the separation and purification of complex traditional Chinese medicine (TCM). In this review, the based principle, separation mode and key technology of preparativeHPLCbased multidimensional chromatography, as well as its application in TCM research were introduced.
Keywords Preparativehigh performance liquid chromatography; Traditional Chinese medicine; Multidimensional chromatography; Solvent compatibility; Interface technology; Review


摘 要 中药物质基础复杂,对其活性成分的分离一直是中药研究的难题。基于高压制备液相的多维色谱系统在高压制备液相色谱的基础上,结合了多种分离技术,极大地提高了色谱系统的分离性能和分离效率,更有利于对物质基础复杂的中药样品进行分离纯化。本文介绍了基于高压制备液相系统的多维色谱系统的基本原理、分离模式以及关键技术,并综述了其在中药分离纯化中的应用。
关键词 高压制备液相; 中药; 多维色谱; 溶剂兼容性; 接口技术; 综述
20160104收稿;20160223接受
本文系“十二五” 科技重大专项“ 重大新药创新”项目(No.2013zx09402202)和国家自然科学基金(Nos. 90612002, 81573586)资助
Email: gxswmwys@163.com
1 引 言
中药广泛应用于疾病的预防和治疗[1]。快速分离纯化技术对于理解中药复杂的物质基础、控制中药质量和发现潜在活性物质具有重要意义,也是目前中药研究的热点问题之一。作为分析型高效液相色谱系统的延伸,高压制备液相系统能够在保证样品分离度的前提下,大幅度提高载样量,从而快速获得高纯度的目标化合物。目前,高压制备液相在中药、生物药、生物制品、食品等样品的分离研究中得到广泛应用[2~6]。然而,由于中药体系复杂,各个组分间含量差异大,且很多物质极性相似、性质相近,单纯使用高压制备液相色谱进行一维分离纯化难以满足多组分复杂样品的分离要求[7,8]。对此,研究者在高压制备液相色谱的基础上,组合不同的分离技术,构建了多维制备色谱系统,有效解决了复杂体系样品分离纯化的难题。目前,基于高压制备液相 色谱的多维色谱系统已应用于中药、食品等研究工作中[9~11]。本文介绍了基于高压制备液相的多维色谱系统的基本原理和关键技术,并综述了其在中药分离纯化中的应用。
2 高压制备液相系统的多维色谱技术
由于天然产物、中药及代谢产物等样品的复杂性,传统的一维色谱在一次运行中,常常受峰容量(Peak capacity)和分辨率的限制,不能满足分析和分离的需要[12]。根据Giddings等[13]的研究,多维分离模式的峰容量应为其构成的各个一维分离模式的峰容量的乘积,这使得在一定时间内从色谱柱中洗脱出来并达到一定分离度的色谱峰的数量大大增加,多维色谱(Multidimensional chromatography, MDC)技术也因此而得到了迅速发展[14]。高压制备液相的多维色谱是在高压制备液相色谱的基础上,通过阀门控制或离线再进样操作,结合其它分离机制或分离模式的色谱技术而形成的一项能对复杂样品实现高容量分离纯化的新技术,可实现样品不同组分在一次操作中的多次分离。它不仅能提高色谱体系的峰容量和正交性[7,15],还能降低色谱峰之间峰重叠[16],使得多组分样品、含量差异大样品,性质相似样品的分离制备成为可能。
2.1 分离模式
根据两维间洗脱馏分是否直接进行连续性分离,可将多维色谱技术分为离线模式和在线模式。离线模式[17]指洗脱馏分不直接进行连续性分离,这种操作模式溶剂选择性广,对仪器要求不高,峰容量大[18],但步骤繁多,自动程度不高,耗时耗力,样品损失较多。对应于离线模式,在线模式是通过仪器系统自身对样品进行捕获、富集,最终实现多次分离的模式[19],这种模式自动化程度高,连续性强,但对溶剂的兼容性要求较高。
二维以上的多维制备色谱通常结合了离线模式与在线模式,这种多维制备色谱更适用于性质相近、结构相似的组分的分离纯化。然而,多维的分离操作会导致样品的损失量增大,因此在分离分析过程中需要确保足够的样品量。
2.2 制备色谱柱
与分析型色谱柱相比,制备型色谱柱的上样量和流速都可以提高3至4个数量级,甚至更高。制备色谱虽然不是分析色谱的简单放大,但是两者可以通过线性放大系数关联起来。线性放大的基本假设是分析色谱系统和制备色谱系统的化学性质、传质过程都保持不变,而进样量、流量、收集体积等乘以线性放大系数,线性放大系数即为制备色谱柱截面积和分析色谱柱截面积之比[20]。
色谱柱的选择要根据样品的性质,对疏水性样品可以选择反相色谱柱,亲水性样品可选正相色谱柱和亲水色谱柱,生物大分子可选择离子交换色谱柱,碳水化合物可用疏水作用色谱柱,无机离子可使用离子色谱柱,合成聚合物可采用凝胶色谱柱,立体异构可采用环糊精固定相,而外消旋体样品则可以考虑手性色谱柱[21]。在实际操作过程中,可以根据样品、色谱柱以及流动相的特点,合理设计实验对样品进行纯化。Zhang等[22]通过以NaHCO3缓冲液和0.035%三氟乙酸作为pH调节剂,根据在不同pH值条件下,色谱柱和样品在流动相选择性不同,从复杂样品中纯化出33种化合物单体。Wei等[23]采用苯基己基色谱柱,这种色谱柱在乙腈作用下对三酰基甘油具有疏水作用,而在甲醇作用下对三酰基甘油具有ππ键相互作用,实验成功从不同食用油中分离纯化出多种化合物单体。
2.3 在线多维色谱关键技术
多维的分离虽然为药物研究带来很大便利,然而如何解决不同维度溶剂体系兼容性问题,如何构建转换接口以实现两维溶剂体系的转换,以及如何利用制备色谱柱等因素设计实验对复杂样品进行有效的分离纯化仍是影响多维色谱发展的核心问题。
2.3.1 分离体系兼容性 影响分离体系兼容性的最主要因素是不同维度之间溶剂与溶剂、溶剂与样品兼容性问题。只有对两者进行合理的匹配,才可能实现最佳的分离效果。可以通过以下方法解决溶剂体系兼容性问题:
(1)使用兼容性溶剂 使用兼容性溶剂是解决该问题最简单、最直接的办法。陈芳芳[24]根据分子排阻色谱和反相色谱不同的分离机理,采用Sephadex LH20中压柱作为第一维,以C18制备色谱柱作为第二维,构建了具有正交性的全二维在线中压液相×制备型高效液相色谱的制备液相色谱系统(MPLC×prepHPLC),两维都以甲醇/水为流动相,样品在经第一维洗脱分离后储存在富集柱上,然后被交替送入第二维制备液相色谱柱进行进一步分离,在经历了两种分离机制的色谱柱分离后,获得18种纯化的化合物单体。
(2)在线稀释 在进行色谱分离时,可以采用初始流动相作为样品溶剂来避免样品、溶剂以及流动相不兼容的问题。因而可以将第一维馏分切割成小体积,与第二维流动相混合后进入第二维色谱柱中。Liu等[25]通过将一维反相色谱柱洗脱的馏分进行高有机相在线稀释,然后经定量环到达第二维进行亲水色谱柱分离,成功构建了在线RP/HILIC二维液相系统。这种系统在第一维反相色谱中可以有效对极性小的物质进行分离,在第二维亲水色谱中能有效对极性大的物质进行分离,适合各成分间极性范围广的物质的分离。
(3)在线脱溶剂 可以通过萃取或过滤的方式实现在线脱溶剂,但这种方法由于萃取不彻底或者洗脱不彻底,造成一定的溶剂残留,影响下一维分离。也可以通过控制样品捕集器的温度或真空度实现。田宏哲等[26]通过设计特定的样品环,使第一维的馏分在样品环中(90℃环境下)真空浓缩,第二维流动相经过该特定样品环后将浓缩的样品带入到第二维色谱柱中进行分离,成功实现了6种多环芳香烃化合物的分离。在线脱溶剂是需要考虑的样品的稳定性、耐热性等因素,如果样品耐热性强、稳定性好,采用高温真空浓缩会提高脱溶剂效率。
2.3.2 接口转换技术 如果各维溶剂体系兼容,理论上可以将上一维样品直接进入到下一维中,但是制备液相流速较大,如果直接进样可能会导致下一维进样体积过大,影响分离效率。所以需要通过设计样品转换接口对上一维样品进行在线处理来解决这个问题。对于不兼容性溶剂体系,就更需要依赖这种转换接口实现在线分离。捕集柱阀切换接口、样品环阀切换接口、平行柱阀切换接口是常见的3种接口转换技术。
捕集柱阀切换接口技术是在不同维度间形成样品捕集过程,对上一维馏分进行在线的捕集,已达到降低第一维切割组分的溶剂体积或者改变溶剂组成比例,然后通过阀切换技术,使用强洗脱剂将样品进样到下一维。在这种模式下,捕集柱对切割馏分的保留能力大于第一维色谱柱,且馏分在第二维流动相洗脱条件下易于解吸,以确保馏分的回收率。因此,根据样品以及流动相特点选择适合的捕集柱至关重要。Qiu等[27]在对河套大黄化学成分分离纯化的研究中,通过对3款不同型号色谱柱进行色谱柱大小、稀释比例、柱直径与柱长比值等因素的比较,选择ODS Prepcolumn为捕集柱(15 mm×30 mm i.d.), 硅胶填充中压制备柱为第一维,将一维馏分浓缩在特定的固相捕集柱上后,再通过阀切换技术使流动相将样品进入到第二维色谱柱中,分离纯化出了25种化合物单体。
样品环阀切换接口技术的环接口通常由两个相同体积的样品环和多通切换阀组成[28],第一维色谱柱的洗脱产物分别交替的储存在样品环中,第二维的泵再将储存环里的样品带入第二维进行分离[28]。使用这种接口模式时,第一维的流速较小,且要求各维流动相具有很好的兼容性,对样品有很好的溶解性。Qiao等[29]通过两个样品环切换,将第一维馏分交替储存到样品环中,并且通过第一维储存在样品环中的流动相比例,实时调节第二维初始流动相比例,以降低溶剂兼容性问题的影响,大大提高了色谱体系的峰容量。平行柱阀切换接口技术的原理其实与样品环阀切换接口模式很类似,不同的是它没有样品环作为中间储备环节,第一维样品直接交替转移到第二维两根或者多根色谱柱柱头,在第二维柱头实现谱带压缩或者样品富集,当其中的一根色谱柱正在进样时,第二根色谱柱正在进行洗脱。Machtejevas等[30]对血滤液中多肽类化合物的分析中,通过一维离子交换色谱柱平行串联4根反相色谱柱,在96 min内分离出超过1000个色谱峰。
由于分析型液相色谱在样品载样量、流速等方面都小于制备色谱,因而它更容易对样品进行稀释、浓缩、转移,更容易实现在线操作,因而接口转换技术在分析领域发展相对较快[25,26,29,30]。但是,只要合理选择流动相和色谱柱,构建合适的在线接口解决溶剂兼容性问题,就可以实现对样品的在线多维分离制备。
3 高压制备液相色谱的多维色谱在中药研究中的应用
高压制备液相色谱可以与不同色谱分离技术联用,常见的联用技术有传统的柱层析法,凝胶渗透法[31]、逆流色谱法以及超临界萃取法[32]等。高压制备液相也可以通过与不同分离机制的色谱柱联用对样品进行多维分离。
3.1 高压制备液相色谱联用柱层析法在中药研究中的应用
高压制备液相色谱可以与传统层析柱[33~35]技术联用。通过柱层析法对样品进行粗分离,然后将各馏分进行浓缩、富集,通过这种操作,样品各成分相对含量大大提高,杂质峰减少,且可通过多次柱层析达到样品纯化的目的,有利于高压制备液相进行下一维分析。Zhang等[36]通过低极性SP850大孔吸附树脂对蛇竹石杉进行粗分离,除去样品中极性组分, 获得粗萃取物,然后采用低压C18柱继续对样品富集,最后采用高压制备液相色谱分离,对粗馏分进行分离纯化,制备出了石杉碱A(纯度99.1%)和石杉碱B(纯度98.6%)。由于柱层析法自动化操作不高,耗时耗力,且容易造成样品污染,因而它与高压制备液相难以实现在线联用。
3.2 高压制备液相色谱法联用逆流色谱的多维色谱在中药研究中的应用
逆流色谱(Countercurrent chromatography,CCC)是利用不同物质在所选择的两相溶剂中的分配系数不同,通过多次逆流分溶对物质进行分离[37]。由于它不使用固相载体作固定相,因而克服了固相载体带来的样品吸附、损失、污染和峰形拖尾等缺点[38,39]。高压制备液相色谱通过与之联用在中药研究中得到了相对广泛的应用,见表1。
目前,大部分高压制备液相与逆流色谱联用大多采用离线模式。由于CCC样品处理要求不高,上样量大,在与制备液相联用时通常作为第一维。Zhu等[40]采用三维分离体系从北五味子中纯化出6种木酚素单体,该方法首先通过AB8大孔吸附树脂对北五味子醇提物进行粗分离,然后采用高速逆流色谱对目标馏分进行第二维分离,最后通过高压制备液相对目标馏分进行第三维分离。虽然这种方法操作复杂,但是通过组合不同分离机制色谱条件,整个色谱体系的峰容量得到了很大的提高,实现了对6种性质相近的木酚素的分离。对应于离线模式,在线模式在时间成本、劳动成本等方面具有突出的优势。Liang等[41]构建一个在线二维色谱体系,以逆流色谱为第一维,当检测到目标成分以后,六通阀将通路切换到第二维,当第一个目标峰全部进入第二维之后,第一维保持原有流动相比例不变,且流动相不洗脱,泵在第二维高压制备液相工作,对第一个目标峰进行洗脱,洗脱完成后,第一维又开始工作,如此实现了对两种抗氧化剂的纯化,大大简化了实验操作步骤。
3.3 高压制备液相色谱自身结合的多维色谱在中药研究中的应用
通过相同或不同分离机制的色谱柱结合也可以实现多维色谱,见表2。正相(NP)、反相(RP)、体积排阻(SEC)、离子交换(IEX)等不同的液相色谱分离模式,由于分离机理的不同,分离选择性也有很大差异[52]。van Beek等[53]首先通过硅胶柱层析(正相)对样品进行富集,除去样品中杂质,然后采用C18柱(反相)将银杏叶中性质差别较大的物质进行分离,对于多个目标化合物的组分,进一步采用银色谱法(离子交换)对性质相近组分进行第二维分离,成功从银杏叶中获得了6种极性相似的银杏酚酸单体。高压制备液相色谱自身联用也可以采用相同分离机制色谱柱,连续多次分离[54],Li等[55]通过将相同的色谱柱进行串联建立循环制备液相,在检测器未检测到样品信号前,柱通过阀切换技术使流动相进废液,除去样品中极性大的杂质,检测到样品信号以后,再通过阀切换使目标组分进入下一个色谱柱,然后使在两根色谱柱上多次循环分离,直至目标组分完全分离,通过色谱峰信号一次收集所有馏分。串联色谱柱,实际也就等同于增加了色谱柱长,增加理论塔板数,提高对物质分离的能力。
4 总结与展望
与一维制备技术相比, 基于高压制备液相的多维色谱技术能显著提高色谱峰容量和选择性, 分离纯化能力强, 可以解决单一色谱分离模式难以解决的分离分析问题。多维在线分离模式的发展, 使得仪器自动化程度大幅度提高, 降低了样品的生产周期短以及生产成本。基于高压制备液相的多维色谱制备技术已经逐渐成为中药研究中重要的分析工具。
多维制备因其大量、高速的特点, 使得它在实现高自动化操作上面临更大挑战。接口技术、分离体系的兼容性问题仍然是其发展的关键性因素。在制备过程中, 如何自动化、大批量的将分离馏分进行浓缩富集, 快速获得高纯度目标化合物, 也是目前亟需解决的问题之一。可以相信, 随着人们的不断深入探索和研究, 以高压制备液相为基础的多维色谱制备技术会成为现代药物研究中更具贡献力的技术。
References
1 Cao J L, Wei J C, Chen M W, Su H X, Wan J B, Wang Y T, Li P. J. Chromatogr. A, 2014, 1371: 1-14
2 Latif Z, Sarker S D. Methods Mol. Bio., 2012, 864: 255-274
3 Asakawa D, Iimura Y, Kiyota T, Yanagi Y, Fujitake N. J. Chromatogr. A, 2011, 1218(37): 6448-6453
4 Li W, Han J, Li Z, Li X, Zhou S, Liu C. J. Chromatogr. B, 2008, 862(12): 51-57
5 Rao R N, Alvi S N, Rao B N. J. Chromatogr. A, 2005, 1076(12): 189-192
6 Hagelin G, Oulie I, Raknes A, Undheim K, Clausen O G. J. Chromatogr. B, 2004, 811(2): 243-251
7 Camenzuli M, Schoenmakers P J. Anal. Chim. Acta, 2014, 838: 93-101
8 Yao C L, Yang W Z, Wu W Y, Da J, Hou J J, Zhang J X, Zhang Y H, Jin Y, Yang M, Jiang B Liu H X, Guo D A. J. Chromatogr. A, 2015, 1402: 71-81
9 Wei Y, Xie Q, Dong W, Ito Y. J. Chromatogr. A, 2009, 1216(19): 4313-4318
10 Rochfort S, Caridi D, Stinton M, Trenerry V C, Jones R. J. Chromatogr. A, 2006, 1120(12): 205-210
11 Turner T D, Meadus W J, Mapiye C, Vahmani P, LopezCampos O, Duff P, Rolland D C, Church J S, Dugan M E. J. Chromatogr. B, 2015, 980: 34-40
12 ZHANG LiHua, ZHANG WeiYong, ZHANG YuKui, MA ChangJiaXin. Chinese Journal of Chromatography, 2003, 21(1): 32-37
张丽华, 张维冰, 张玉奎, 马场嘉信. 色谱, 2003, 21(1): 32-37
13 Giddings J C, Chang J P, Myers M N, Davis J M, Caldwell K D. J. Chromatogr. A, 1983, 255: 359-379
14 CONG JingXiang, LIN BingChang. Prog. Chem., 2007, 19(11): 1813-1819
丛景香, 林炳昌. 化学进展, 2007, 19(11): 1813-1819
15 Palma S D, Hennrich M L, Heck A J, Mohammed S. J. Proteomics, 2012, 75(13): 3791-3813
16 DI Xin, CHEN XueGuo, KONG Liang, ZOU HanFa. Chinese Bulletin of Life Seiences, 2003, 15(2): 95-100
厉 欣, 陈学国, 孔 亮, 邹汉法. 生命科学, 2003, 15(2): 95-100
17 HUANG JingYi, TONG Ling, DING Li. Progress in Pharmaceutical Sciences, 2015, 39(5): 357-363
黄竞怡, 佟 玲, 丁 黎. 药学进展, 2015, 39(5): 357-363
18 AN Rong, XIAO Rao. World Science and Technology/Modernization of Traditional Chinese Medicine and Materia Medica, 2014, 16(3): 549-553
安 蓉, 肖 尧. 世界科学技术-中医药现代化, 2014, 16(3): 549-553
19 GAO Hui, WEN XueSen, MA XiaoJun, CHEN DiHua, SI JianYong. Chin. J. Pharm. Anal., 2007, 27(4): 616-620
高 辉, 温学森, 马小军, 陈迪华, 斯建勇. 药物分析杂志, 2007, 27(4): 616-620
20 CHEN XiaoWei, HE MeiLian. West China J .Pharm Sci., 2005, 20(4): 332-333
程小卫, 何美莲. 华西药学杂志, 2005, 20(4): 332-333
21 YUAN LiMing. The Preparative Chromatography Technology and Its Aapplication. Beijing: Chemical Industry Press, 2004: 2-4
袁黎明. 制备色谱技术及应用, 北京: 化学工业出版社, 2004: 2-4
22 Zhang Y, Zeng L, Pham C, Xu R. J. Chromatog. A, 2014, 1324: 86-95
23 Wei F, Hu N, Lv X, Dong X Y, Chen H. J. Chromatogr. A, 2015, 1404: 60-71
24 CHEN FangFang. Coupling Chromatographic Techniques for Preparative Isolation of Tea Ingredients and Its Detection on Antioxidant Activity, Xiamen University, 2014: 17-26
陈芳芳. 基于色谱联用技术对茶叶成分的分离制备及其抗氧化活性的检测, 厦门大学, 2014: 17-26
25 Liu A, Tweed J, Wujcik C E. J. Chromatogr. B, 2009, 877(2021): 1873-1881
26 TIAN HongZhe, XU Jing, GUAN YaFeng. Chinese J. Anal .Chem., 2008, 36(6): 860-864
田宏哲, 徐 静, 关亚风. 分析化学, 2008, 36(6): 860-864
27 Qiu Y K, Chen F F, Zhang L L, Yan X, Chen L, Fang M J, Wu Z. Anal. Chim. Acta, 2014, 820: 176-186
28 DING Kun, WU DaPeng, GUAN YaFeng. Chinese Journal of Chromatography, 2010, 28(12): 1117-1122
丁 坤, 吴大朋, 关亚风. 色谱, 2010, 28(12): 1117-1122
29 Qiao X, Song W, Ji S, Li Y J, Wang Y, Li R, An R, Guo D A, Ye M. J. Chromatogr. A, 2014, 1362: 157-167
30 Machtejevas E, John H, Wagner K, Standker L, MarkoVarga G, Forssmann W G, Bischoff R, Unger K K. J. Chromatogr. B, 2004, 803(1): 121-130
31 Mangas I, Vilanova E, Benabent M, Estevez J. Toxicol Lett, 2014, 225(1): 167-176
32 Lo T C, Nian H C, Chiu K H, Wang A Y, Wu B Z. J. Chromatogr. B, 2012, 893894: 101-106
33 Zhang Y, Jiao J, Liu C, Wu X, Zhang Y. Food Chem., 2007, 107: 1326-1336
34 Zhou H, Yuan Q, L J u. Food Chem., 2011, 126(3): 1361-1365
35 Kuang P, Song D, Yuan Q, Yi R, Lv X, Liang H. Food Chem., 2013, 136(2): 342-347
36 Zhang H, Liang H, Kuang P, Yuan Q, Wang Y. J. Chromatogr. B., 2012, 904: 65-72
37 ZHENG Wei. Chinese Journal of Antibiotics, 2005, 3: 180-186
郑 卫. 中国抗生素杂志, 2005, 3: 180-186
38 DAI DeShun, WANG YiMing, LUO GuoAn. Chinese J. Anal. Chem., 2001, 29(5): 589-591
戴德舜, 王义明, 罗国安. 分析化学, 2001, 29(5): 589-591
39 Li S, Wang W, Tang H, Chen K, Yang J, He L, Ye H, Peng A, Chen L. J. Chromatogr. A, 2014, 1344: 1-8
40 Zhu L, Li B, Liu X, Huang G, Meng X. Food Chem., 2015, 186: 46-52
41 Liang J, Yang Z, Cao X, Wu B, Wu S. J. Chromatogr. A, 2011, 1218(36): 6191-6199
42 Lu J J, Wei Y, Yuan Q P. Sepa. Purif. Technol., 2007, 55(1): 40-43
43 Zhu L, Li H, Liang Y, Wang X, Xie H, Zhang T, Ito Y. Separation and Purification Technology, 2009, 70(2): 147-152
44 Cheng G J S, Li G K, Xiao X H. Sep. Purif. Technol., 2015, 141: 43-49
45 HANG Wei, ZHANG QinDe, WANGXiao, DUAN WenJuan. Nat. Prod. Res. Dev., 2014, 26: 1807-1810
杭 伟, 张钦德, 王 晓, 林昌虎, 文 娟. 天然产物研究与开发, 2014, 26: 1807-1810
46 Guo W, Wang L, Gao Y, Zhao B, Wang D, Duan W, Yu Z. J. Chromatogr. B, 2015, 981-982: 27-32
47 Silva J C, Jham G N, Oliveira R D, Brown L. J. Chromatogr. A, 2007, 1151(1-2): 203-210
48 Yao S, Luo J, Huang X, Kong L. J. Chromatogr. B, 2008, 864(12): 69-77
49 Du Q, Jiang Z, Wang D. J. Chromatogr. A, 2009, 1216(19): 4176-4180
50 Qiu Y K, Yan X, Fang M J, Chen L, Wu Z, Zhao Y F. J. Chromatogr. A, 2014, 1331: 80-89
51 Chen W B, Li S Q, Chen L J, Fang M J, Chen Q C, Wu Z, Wu Y L, Qiu Y K. J. Chromatogr. B, 2015, 997: 179-186
52 Sommella E, Pepe G, Ventre G, Pagano F, Manfra M, Pierri G, Ismail O, Ciogli A, Campiglia P. J. Chromatogr. A, 2015, 1375: 54-61
53 van Beek T A, Wintermans M S. J. Chromatogr. A, 2001, 930(12): 109-117
54 Zhou T, Zhao W, Fan G, Chai Y, Wu Y. J. Chromatogr. B, 2007, 858(12): 296-301
55 Li G Z, Meng Q Y, Luo B, Ge Z H, Liu W J. Chromatogaph, 2015, 31(1): 84-89
56 Li K, Zhu W, F Q u, Ke Y, Jin Y, Liang X. Analyst, 2013, 138(11): 3313-3320
57 Guo X, Zhang X, Feng J, Guo Z, Xiao Y, Liang X. Anal. Bioanal.Chem., 2013, 405(10): 3413-3421
58 Lai S M, Gu J Y. Food Bioprod. Process., 2014, 92(3): 314-320
59 Bhushan R, Kumar R. J. Chromatogr. A, 2009, 1216(15): 3413-3417
60 Chang L, Wei Y, Bi P Y, Shao Q. Sep. Purif. Technol., 2014, 134: 204-209
61 Jin H, Liu Y, Feng J, Guo Z, Wang C, Zhong Z, Peng X, Dang J, Tao Y, Liang X. J. Sep. Sci., 2013, 36(15): 2414-2420
62 Wang X Y, Li J F, Jian Y M, Wu Z, Fang M J, Qiu Y K. J. Chromatogr. A, 2015, 1387: 60-68
Abstract Separation of the active ingredients of Chinese medicine is always difficult due to its complexity matrix. Recent years, the preparativehigh performance liquid chromatography (PreHPLC)based multidimensional chromatography combined with the characteristics of different separation technology improved the separation capability and efficiency, and was applied to the separation and purification of complex traditional Chinese medicine (TCM). In this review, the based principle, separation mode and key technology of preparativeHPLCbased multidimensional chromatography, as well as its application in TCM research were introduced.
Keywords Preparativehigh performance liquid chromatography; Traditional Chinese medicine; Multidimensional chromatography; Solvent compatibility; Interface technology; Review

