基于纳米抗体—碱性磷酸酶融合蛋白的一步酶联免疫吸附分析法检测黄曲霉毒素B1
曹冬梅+许杨+涂追+李燕萍+熊亮+付金衡
摘 要 从噬菌体展示的抗黄曲霉毒素B1(AFB1)纳米抗体文库中,通过四轮亲和淘选,得到抗AFB1纳米抗体G8。将编码纳米抗体G8的基因与碱性磷酸酶(AP)基因融合,构建了重组融合表达载体pET25b(+)G8AP,将其转化大肠杆菌BL21(Rosetta,DE3)感受态细胞,异丙基βD硫代吡喃半乳糖苷(IPTG)诱导融合基因表达。SDSPAGE结果表明,融合蛋白G8AP为可溶性表达,Ni2+NTA亲和层析柱纯化融合蛋白,对硝基苯磷酸二钠(pNPP)法测得纯化后的G8AP的碱性磷酸酶比活力为(364.5 ± 8.3) U/mg。ELISA检测结果表明,G8AP具有特异识别AFB1的活性,与其它真菌毒素(AFB2、AFG1、AFG2、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、伏马菌素B1)无交叉反应。基于G8AP建立了检测AFB1的一步ELISA法。在优化的条件下,即甲醇浓度20%、盐离子浓度20 mmol/L、pH 7.4条件下,方法的半数抑制浓度(IC50)为19.8 ng/mL,线性范围为4.3~92 ng/mL,检出限为2.6 ng/mL。对玉米和小麦样品加标回收实验结果表明,基质对本方法的干扰不明显,可用于实际样品检测。
关键词 抗黄曲霉毒素B1纳米抗体;碱性磷酸酶;融合表达;酶联免疫吸附分析
20151113收稿;20160408接受
本文系国家自然科学基金(No. 31301479)、南昌大学食品科学与技术国家重点实验室青年研究基金(No. SKLFQN201513)及江西省自然科学基金重大项目(No. 20152ACB20005)资助
Email: tuzhui@ncu.edu.cn
1 引 言
黄曲霉毒素B1(AFB1)主要是由黄曲霉和寄生曲霉产生的次级代谢产物,是谷物污染中常见的真菌毒素,具有强致癌性、致毒性、致畸性[1]。世界各国及国际组织都制定了黄曲霉毒素的限量标准。我国发布的国家标准对不同种类食品中AFB1的限量范围为0.5~20 μg/kg[2];饲料卫生标准规定了各类饲料中AFB1限量范围为10~50 μg/kg[3]。因此,建立快速、准确、低成本的AFB1检测方法,对于保障食品安全具有重要意义。
目前,检测谷物食品中AFB1的方法主要有薄层色谱法(Thinlayer chromatography,TLC)[4]、高效液相色谱法(High performance liquid chromatography,HPLC)[5]、酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)[6]、胶体金试纸条法[7]以及电化学传感器[8]等。其中,基于免疫学原理建立的ELISA方法具有特异性强、灵敏度高、方便快速等优点[9, 10]。酶标抗体是ELISA中的重要组成部分,传统的化学偶联法制备酶标抗体,存在步骤繁琐、蛋白聚集、标记率低等缺点[11]。利用基因工程技术,将识别元件与显色元件融合表达制备出具有双重功能活性的融合蛋白,不仅可省略酶标抗体的制备过程,而且检测过程更加简单快速[12]。
现有的基因工程抗体与酶重组的研究多采用单链抗体与酶融合。虽然已有部分通过单链抗体融合蛋白建立一步法ELISA的报道[13,14],然而,由于单链抗体需要两个结构域共同发挥作用,单链抗体的活性受到连接肽长度、种类等诸多因素的影响[15],在原核表达中常以没有生物活性的包涵体的形式表达,限制了单链抗体的应用[16,17]。纳米抗体来源于骆驼科动物的重链抗体可变区,仅由一个结构域构成,易于进行基因工程操作[18,19]。近年来,纳米抗体用于食品安全检测已成为研究热点[20,21],展现出较好的应用前景。
前期工作通过免疫羊驼,构建了噬菌体展示的抗AFB1纳米抗体文库。本研究采用固相淘选技术,筛选特异性结合AFB1的纳米抗体G8,然后将其与大肠杆菌碱性磷酸酶融合表达,获得同时具有碱性磷酸酶活性和AFB1结合活性的融合蛋白G8AP,建立检测AFB1的一步ELISA法,替代传统ELISA中的一抗和酶标二抗,为建立快速、低成本的一步法ELISA试剂盒奠定基础。
2 实验部分
2.1 仪器与试剂
Multiskan FC酶联免疫检测仪、Multfuge XIR低温高速离心机、NanoDrop 1000紫外可见分光光度计(美国Thermo公司);Universal hood II凝胶成像系统(美国BIORAD公司);DYYI III稳压电泳仪(北京六一仪器厂);JY92IIDN超声波细胞破碎仪(宁波新艺超声设备有限公司);96孔酶标板(美国Costar公司)。
噬菌体展示抗AFB1纳米抗体文库参照文献[21]方法构建,通过将纳米抗体编码基因与丝状噬菌体pIII蛋白编码基因融合,纳米抗体展示于噬菌体表面。大肠杆菌TG1、DH5α和 BL21(Rosetta,DE3),噬菌粒pHEN1,原核表达载体pET25b(+),辅助噬菌体M13K07,碱性磷酸酶表达载体pET25b(+)AP均由本实验室保存;内切酶XhoI、NotI和T4 DNA连接酶、质粒小提试剂盒、DNA凝胶回收试剂盒和PCR纯化试剂盒购自Takara公司;HRP/AntiM13 Monoclonal Conjugate、Ni2+NTA亲和层析柱(HisTrap FF,5 × 1 mL columns)购自美国GE Healthcare公司;AFB1标准品(美国Sigma公司);牛血清白蛋白(Bovine serum albumin, BSA)、卵清蛋白(Ovalbumin, OVA)、异丙基βD硫代吡喃半乳糖苷(IsopropyβDthiogalactoside,IPTG)和对硝基苯磷酸二钠(Disodium 4Nitrophenyl Phosphate,pNPP)购自上海生工生物工程技术服务有限公司;人工抗原AFB1OVA由本实验室制备;其它试剂均为国产分析纯。DNA测序由南京金斯瑞生物科技公司进行。
2.2 实验方法
2.2.1 抗AFB1纳米抗体文库的淘选 参考文献[22]对噬菌体展示文库进行四轮淘选。包被的人工抗原浓度分别为100, 75, 50和25 μg/mL,以3% BSAPBS和3% OVAPBS交替作为封闭液。第一轮淘选采用酸洗脱方法,第二至四轮淘选采用竞争洗脱法,竞争洗脱AFB1浓度依次为100, 50和25 ng/mL。其中,富集度=后一轮噬菌体回收率/上一轮噬菌体回收率;回收率 = 洗脱的噬菌体数/当轮投入的噬菌体数。
2.2.2 间接竞争phageELISA筛选抗AFB1纳米抗体 展示噬菌体的制备及间接竞争phageELISA鉴定参照文献[22,23]进行。随机挑选第四轮淘选的95个克隆,经辅助噬菌体M13K07救援后得到展示纳米抗体的噬菌体。采用间接竞争phageELISA进行阳性克隆的鉴定,根据OD450值,挑选竞争阻断效果显著的噬菌体测序。
2.2.3 融合表达载体pET25b(+)G8AP的构建 分别用限制性内切酶XhoI和NotI双酶切pET25b(+)G8和pET25b(+)AP,琼脂糖凝胶回收后,T4 DNA连接酶按摩尔比1∶3连接酶切载体与碱性磷酸酶基因片段,CaCl2法转化连接产物至大肠杆菌DH5α感受态细胞,采用菌落聚合酶链式反应(PCR)和双酶切验证转化子,阳性克隆进行测序。
2.2.4 融合蛋白的表达与纯化 将重组质粒pET25b(+)G8AP转入表达宿主BL21 Rosetta(DE3)感受态细胞。取单菌落接种于5 mL含有100 μg/mL氨苄青霉素(Amp)和34 μg/mL氯霉素(CAP)的LB液体培养基,37℃摇床振荡培养过夜。过夜培养物按1%比例接种于50 mL含Amp和CAP的LB液体培养基,37℃摇床振荡培养至OD600≈0.6,加入终浓度为0.1 mmol/L IPTG,30℃ 摇床振荡培养6 h,收集诱导培养物于4℃以8000 r/min离心15 min,弃上清液。菌体沉淀加入1/5体积的PBS缓冲液,超声破碎,在4℃以8000 r/min离心20 min,收集上清液和沉淀,Ni2+NTA柱纯化蛋白,SDSPAGE分析表达产物及纯化的融合蛋白。
2.2.5 融合蛋白的碱性磷酸酶活力测定
采用对硝基苯磷酸二钠法测定碱性磷酸酶酶活力和比活力[24]。在酶标板中,分别加入20 μL稀释不同倍数的重组蛋白(50, 100, 200, 400, 800, 1000倍)和100 μL pNPP底物液(10 mmol/L pNPP溶于含2.0 mmol/L MgCl2的0.1 mol/L二乙醇胺缓冲液,pH 9.8),37℃孵育15 min,每孔加入80 μL终止液(0.5 mol/L Na2CO3)终止反应,酶标仪测定OD405值,计算重组蛋白催化生成对硝基苯酚的浓度(mmol/L )。1个酶活力单位(1U)定义为37℃下,每分钟催化产生1 mmol对硝基苯酚所需的酶量。酶的比活力(U/mg)=酶活力(U/mL)/蛋白浓度(mg/mL)。
2.2.6 一步法ELISA体系的建立与优化 包被人工抗原AFB1OVA(0.5 μg/mL),100 μL/孔,4℃过夜。PBST洗涤3次,4%脱脂牛奶(300 μL/孔)37℃封闭2 h。PBST洗涤3次,每孔加入50 μL不同浓度的AFB1标准品(0, 2, 5, 10, 20, 40, 100, 220 ng/mL)及50 μL 2.06 μg/mL的融合蛋白,37℃孵育1 h。PBST洗板5次,加入100 μL 1 mg/mL pNPP,37℃显色10 min。加入50 μL 4 mol/L NaOH,终止反应,酶标仪测定OD405值。考察甲醇浓度、盐离子浓度及pH值对反应体系的影响。以竞争抗原AFB1终浓度对数为横坐标,以结合率(B/B0) 为纵坐标,绘制标准曲线[25]。定义结合率90%(即IC10)时AFB1浓度为最低检出限[26]。
B/B0(%) =OD1-ODHankOD2×100%(1)
式中,OD1为竞争抗原孔OD405值, ODBlank为空白对照OD405值, OD2为非竞争对照孔OD405值。
2.2.7 样品加标回收实验 对玉米和小麦样品进行加标回收实验,样品提取方法参考文献[27]进行。称取1g不含AFB1的样品(即用商品化ELISA试剂盒未检出AFB1,南昌博恒生物制品有限公司,检测限1 μg/kg),分别加入适量AFB1标准品至浓度分别为50和100 μg/kg(每个浓度做6个平行),再加入3 mL 60%甲醇20 mmol/L PBS溶液,剧烈振荡30 min,5000 r/min离心15 min,回收上清液,用20 mmol/L PBS稀释1.5倍后进行一步法ELISA检测。
3 结果与讨论
3.1 抗AFB1纳米抗体文库的淘选和阳性克隆的鉴定
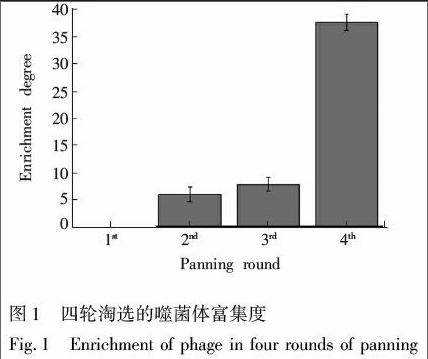
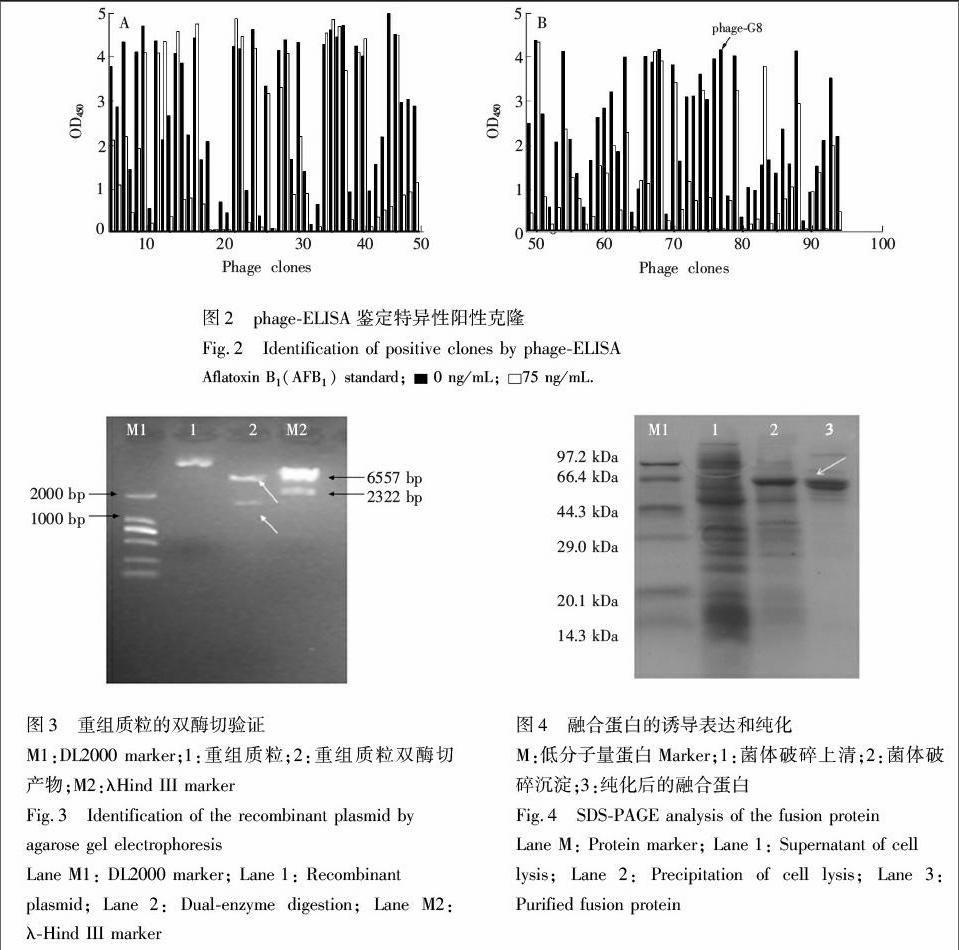
噬菌体富集度随淘选的进行呈递增趋势,表明特异性结合AFB1的噬菌体被不断富集(图1)。间接竞争ELISA鉴定结果表明,共有80个克隆的显色值降低,表明可与AFB1特异性结合,阳性率为84.2%(图2)。其中,噬菌体克隆phageG8能够被完全阻断(图2B),
3.2 融合表达载体pET25b(+)G8AP的构建与验证
双酶切重组质粒琼脂糖凝胶电泳结果可见两个条带(图3),分别与理论上酶切后pET25b(+)G8片段(5908 bp)和碱性磷酸酶基因片段(1356 bp)大小相符[28]。测序结果表明,重组表达质粒pET25b(+)G8AP构建正确。
3.3 融合蛋白的表达与纯化
诱导后的蛋白上清和破碎沉淀在SDSPAGE电泳中在65 kDa左右出现条带,表明IPTG诱导后在大肠杆菌中存在可溶性融合蛋白。表达上清经Ni2+NTA亲和柱纯化后,SDSPAGE结果显示,获得了可溶性重组融合蛋白G8AP(图4,泳道3)。
3.4 融合蛋白的碱性磷酸酶活性测定
酶活力测定结果表明,重组融合蛋白具有催化活性。经亲和纯化的重组融合蛋白浓度为0.33 mg/mL,碱性磷酸酶活力为(120.3 ± 2.8) U/mL,酶比活力为(364.5 ± 8.3) U/mg。
3.5 交叉反应
采用ELISA法测定融合蛋白与AFB1结构类似物黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)及其它常见谷物污染毒素如脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)、伏马菌素B1(FB1)的交叉反应率CR[29]:
CR(%)=IC50(AFB1)/IC50(其它毒素)×100% (2)
结果显示融合蛋白与AFB2的交叉反应率为1.5%,而与其它毒素几乎无交叉反应,表明融合蛋白具有较高的特异性。
3.6 一步法ELISA体系的建立与优化
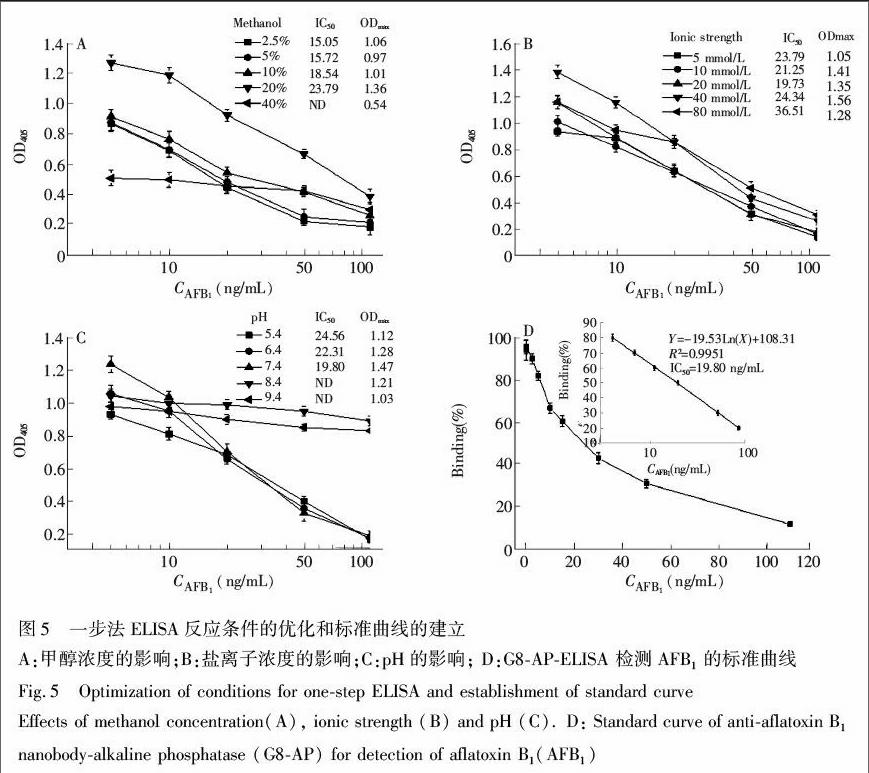
3.6.1 ELISA条件优化 样品常用甲醇溶液萃取,甲醇浓度对G8APELISA检测的影响如图5 A所示,当甲醇浓度从2.5%升高到20%时,吸光度值有所增大,IC50值变化不大;当继续升高至40%时,AFB1不能有效的抑制融合蛋白与人工抗原结合,因此选择≤20%的甲醇进行后续实验。
盐离子浓度的影响如图5B所示,当盐离子浓度从5 mmol/L升高至40 mmol/L,吸光度值上升,IC50值变化不大;当盐离子浓度升高至80 mmol/L,吸光度值下降,IC50值增大。因此检测中控制反应体系的盐离子浓度小于40 mmol/L。
反应体系pH值的影响如图5C所示,当由酸性变为中性,抗原抗体的结合能力增强,反应体系的灵敏度增强;pH=7.4时,抗原抗体结合能力最强,灵敏度最高;当pH=8.4和9.4时,吸光度值没有明显变化,但是AFB1不能有效抑制融合蛋白与人工抗原结合。因此选择pH 7.4为最适pH值。
3.6.2 一步法ELISA方法的建立 由于选择较高浓度甲醇可以减小样品提取过程中的稀释倍数,提高样品检测灵敏度,综合考虑,选择甲醇20%、盐离子20 mmol/L、pH 7.4作为最适反应条件,绘制标准曲线(图5D)。一步法ELISA的IC50值为19.8 ng/mL,线性范围(IC20~ IC80)为4.3~92 ng/mL,检测限(IC10)为2.6 ng/mL。与单克隆抗体间接竞争ELISA检测方法[27,29]相比,本实验条件下,融合蛋白一步法ELISA的 IC50值偏高,但是检测时间大幅缩短,检测线性范围更宽。
3.7 样品加标回收实验
玉米和小麦样品的黄曲霉素B1加标回收实验结果如表1所示,加标回收率在90.4%~101.5%之间,且相对标准偏差均小于10%,表明样品的基质效应对方法的影响不明显,本方法可用于玉米和小麦样品中的黄曲霉素B1检测。
4 结 论
纳米抗体分子量小,易于与其它功能蛋白融合,得到具有多功能的重组蛋白。本研究构建了抗AFB1纳米抗体与碱性磷酸酶融合表达载体,在大肠杆菌中表达,获得了同时具有纳米抗体活性和碱性磷酸酶活性的双功能可溶性融合蛋白G8AP,建立了基于重组融合蛋白的检测AFB1的一步法ELISA,可望替代传统ELISA中的一抗和酶标抗体,缩短检测时间。采用重组融合蛋白,避免了化学交联方法中存在的均一性、稳定性差等问题,研究结果可为免疫学检测中关键元件的制备提供新途径。
References
1 Abrar M, Anjum F M, Butt M S, Pasha I, Randhawa M A, Saeed F, Waqas K. Crit. Rev. Food Sci. Nutr., 2013, 53: 862-874
2 GB27612011, Maximum Levels of Mycotoxins in Foods. National Standards of the Peoples Republic of China
食品中真菌毒素的限量. 中华人民共和国国家标准. GB27612011
3 GB130782001, Hygienical Standards for Feeds. National Standards of the Peoples Republic of China.
饲料卫生标准. 中华人民共和国国家标准. GB130782001
4 Iqbal J, Asghar M A, Ahmed A, Khan M A, Jamil K. Toxicol. Mech. Methods, 2014, 24: 544-551
5 Gazioglu I, Kolak U. J. AOAC Int., 2015, 98: 939-945
6 Lupo A, Roebuck C, Dutcher M, Kennedy J, Abouzied M. J. AOAC Int., 2010, 93: 587-599
7 Ji Y, Ren M, Li Y, Huang Z, Shu M, Yang H, Xiong Y, Xu Y. Talanta, 2015, 142: 206-212
8 Wang D, Hu W, Xiong Y, Xu Y, Li C M. Biosens. Bioelectron., 2015, 63: 185-189
9 Yu F Y, Gribas A V, Vdovenko M M, Sakharov I Y. Talanta, 2013, 107: 25-29
10 Zhang B, Du D L, Yin Y M. Food Anal. Method, 2014, 7(9): 1798-1803
11 Simons B, Kaplan H, Hefford M A. J. Immunol. Methods, 2006, 315: 88-98
12 Hu Z Q, Li H P, Zhang J B, Huang T, Liu J L, Xue S, Wu A B, Liao Y C. Anal. Chim. Acta, 2013, 764: 84-92
13 Xue S, Li H P, Zhang J B, Liu J L, Hu Z Q, Gong A D, Huang T, LiaoY C. Anal. Chem., 2013, 85(22): 10992-10999
14 Yang S L, Shang Y J, Yin S H, Wang D, Cai J P, Gong Z L, Serge M, Liu X T. J. Virol. Methods, 2015, 213: 84-92
15 Farajnia S, Ahmadzadeh V, Tanomand A, Veisi K, Khosroshahi S A, Rahbarnia L. Immunopharm. Immunot., 2014, 36(5): 297-308
16 Ahmad Z A, Yeap S K, Ali A M, Ho W Y, Alitheen N B, Hamid M. Clin. Dev. Immunol., 2012, 2012: 980250
17 XU Fang, YU GuangHui, WANG Pu. J. Zhengjiang University Tech., 2014, 42(1): 45-49
徐 放, 遇广辉, 王 普. 浙江工业大学学报, 2014, 42(1): 45-49
18 Muyldermans S, Baral T N, Retarnozzo V C, De B P, De G E, Kinne J, Leonhardt H, Magez S, Nguyen V K, Revets H. Vet. Immunol. Immunop., 2009, 128 (13): 178-183
19 Kaczmarek J Z, Skottrup P D. Mol. Immunol., 2015, 65(2): 384-390
20 Liu X, Xu Y, Wan D B, Xiong Y H, He Z Y, Wang X X, Gee S J, Ryu D J, Hammock B D. Anal. Chem., 2015, 87: 1387-1394
21 Liu X, Xu Y, Xiong Y H, Tu Z, Li Y P, He Z Y, Qiu Y L, Fu J H, Gee S J, Hammock B D. Anal. Chem., 2014, 86(15): 7471-7477
22 LIU Xia, XU Yang, TU Zhui, HE QingHua. J.Food Sci.Biotech., 2011, 30(6): 950-955
刘 夏, 许 杨, 涂 追, 何庆华. 食品与生物技术学报, 2011, 30(6): 950-955
23 Xu Y, Xiong L, Li Y P, Xiong Y H, Tu Z, Fu J H, Tang X. Food Chem., 2015, 177: 97-101
24 XU HuiFang, ZHANG XianEn, ZHANG ZhiPing, ZHANG YongMei. Prog. Biochem. Biophys., 2003, 30(1): 89-94
徐卉芳, 张先恩, 张治平, 张用梅. 生物化学与生物物理进展, 2003, 30(1): 89-94
25 Liu X, Xu Y, He Q H, He Z Y, Xiong Z P. J. Agr. Food Chem., 2013, 61(20): 4765-4770
26 WANG Lü, ZOU XuQiang, CHEN ChaoChao, SHAO HuiFeng, CHEN XueLan. Chinese J. Anal. Chem., 2015, 43(6): 856-861
王 吕, 熊斯诚, 邹旭强, 陈超超, 邵辉锋, 陈雪岚. 分析化学, 2015, 43(6): 856-861
27 XIE Hui, ZHANG Xian, WANG Xin, FAN PengCheng, SHI YuFei, FANG WeiHuan. Microbiology China, 2015, 42(10): 2033-2040
谢 珲, 章 先, 王 歆, 凡鹏程, 时玉菲, 方维焕. 微生物学通报, 2015, 42(10): 2033-2040
28 YANG DanYan, LIN ChenShui. J. Zhengjiang University Tech., 2009, 37(4): 372-375
杨丹燕, 林陈水. 浙江工业大学学报, 2009, 37(4): 372-375
29 Kim S H, Cha S H, Karyn B, Park S W, Son S W, Kang H G. Toxicol. Res., 2011, 27(2): 125-131
Abstract A phage clone (designated as the antiaflatoxin B1 nanobody, G8) specific binding to aflatoxin B1 (AFB1) was screened from an immunized nanobody phage library. The DNA fragment encoding G8 was subcloned into the vector pET25b(+)alkaline phosphatase (AP), and fused to the N terminal of AP. The fusion protein G8AP was expressed in E. coli BL21 (Rosetta, DE3) as soluble protein, and purified by immobilized metal affinity chromatography. The purified G8AP exhibited AP activity of 364.5±8.3 U/mg. Enzymelinked immunosorbent assay (ELISA) showed that G8AP was also capable of recognizing AFB1, with negligible crossreactivity toward other six common mycotoxins. A onestep ELISA was established to detect AFB1 using G8AP. The effects of methanol concentration, ionic strength, and pH on the detection sensitivity of the G8APELISA were evaluated and optimized. Under the optimized conditions (methanol 20%, NaCl 20 mmol/L, pH 7.4), the half inhibitory concentration (IC50) of the G8AP based ELISA was 19.8 ng/mL, with the linear range of 4.3-92 ng/mL and the detection limit of 2.6 ng/mL. The recoveries of AFB1 for corn and wheat samples were 90.4%–101.5%.
Keywords Antiaflatoxin B1 Nanobody; Alkaline phosphatase; Fusion expression; Enzymelinked immunosorbent assay



摘 要 从噬菌体展示的抗黄曲霉毒素B1(AFB1)纳米抗体文库中,通过四轮亲和淘选,得到抗AFB1纳米抗体G8。将编码纳米抗体G8的基因与碱性磷酸酶(AP)基因融合,构建了重组融合表达载体pET25b(+)G8AP,将其转化大肠杆菌BL21(Rosetta,DE3)感受态细胞,异丙基βD硫代吡喃半乳糖苷(IPTG)诱导融合基因表达。SDSPAGE结果表明,融合蛋白G8AP为可溶性表达,Ni2+NTA亲和层析柱纯化融合蛋白,对硝基苯磷酸二钠(pNPP)法测得纯化后的G8AP的碱性磷酸酶比活力为(364.5 ± 8.3) U/mg。ELISA检测结果表明,G8AP具有特异识别AFB1的活性,与其它真菌毒素(AFB2、AFG1、AFG2、脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮、伏马菌素B1)无交叉反应。基于G8AP建立了检测AFB1的一步ELISA法。在优化的条件下,即甲醇浓度20%、盐离子浓度20 mmol/L、pH 7.4条件下,方法的半数抑制浓度(IC50)为19.8 ng/mL,线性范围为4.3~92 ng/mL,检出限为2.6 ng/mL。对玉米和小麦样品加标回收实验结果表明,基质对本方法的干扰不明显,可用于实际样品检测。
关键词 抗黄曲霉毒素B1纳米抗体;碱性磷酸酶;融合表达;酶联免疫吸附分析
20151113收稿;20160408接受
本文系国家自然科学基金(No. 31301479)、南昌大学食品科学与技术国家重点实验室青年研究基金(No. SKLFQN201513)及江西省自然科学基金重大项目(No. 20152ACB20005)资助
Email: tuzhui@ncu.edu.cn
1 引 言
黄曲霉毒素B1(AFB1)主要是由黄曲霉和寄生曲霉产生的次级代谢产物,是谷物污染中常见的真菌毒素,具有强致癌性、致毒性、致畸性[1]。世界各国及国际组织都制定了黄曲霉毒素的限量标准。我国发布的国家标准对不同种类食品中AFB1的限量范围为0.5~20 μg/kg[2];饲料卫生标准规定了各类饲料中AFB1限量范围为10~50 μg/kg[3]。因此,建立快速、准确、低成本的AFB1检测方法,对于保障食品安全具有重要意义。
目前,检测谷物食品中AFB1的方法主要有薄层色谱法(Thinlayer chromatography,TLC)[4]、高效液相色谱法(High performance liquid chromatography,HPLC)[5]、酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA)[6]、胶体金试纸条法[7]以及电化学传感器[8]等。其中,基于免疫学原理建立的ELISA方法具有特异性强、灵敏度高、方便快速等优点[9, 10]。酶标抗体是ELISA中的重要组成部分,传统的化学偶联法制备酶标抗体,存在步骤繁琐、蛋白聚集、标记率低等缺点[11]。利用基因工程技术,将识别元件与显色元件融合表达制备出具有双重功能活性的融合蛋白,不仅可省略酶标抗体的制备过程,而且检测过程更加简单快速[12]。
现有的基因工程抗体与酶重组的研究多采用单链抗体与酶融合。虽然已有部分通过单链抗体融合蛋白建立一步法ELISA的报道[13,14],然而,由于单链抗体需要两个结构域共同发挥作用,单链抗体的活性受到连接肽长度、种类等诸多因素的影响[15],在原核表达中常以没有生物活性的包涵体的形式表达,限制了单链抗体的应用[16,17]。纳米抗体来源于骆驼科动物的重链抗体可变区,仅由一个结构域构成,易于进行基因工程操作[18,19]。近年来,纳米抗体用于食品安全检测已成为研究热点[20,21],展现出较好的应用前景。
前期工作通过免疫羊驼,构建了噬菌体展示的抗AFB1纳米抗体文库。本研究采用固相淘选技术,筛选特异性结合AFB1的纳米抗体G8,然后将其与大肠杆菌碱性磷酸酶融合表达,获得同时具有碱性磷酸酶活性和AFB1结合活性的融合蛋白G8AP,建立检测AFB1的一步ELISA法,替代传统ELISA中的一抗和酶标二抗,为建立快速、低成本的一步法ELISA试剂盒奠定基础。
2 实验部分
2.1 仪器与试剂
Multiskan FC酶联免疫检测仪、Multfuge XIR低温高速离心机、NanoDrop 1000紫外可见分光光度计(美国Thermo公司);Universal hood II凝胶成像系统(美国BIORAD公司);DYYI III稳压电泳仪(北京六一仪器厂);JY92IIDN超声波细胞破碎仪(宁波新艺超声设备有限公司);96孔酶标板(美国Costar公司)。
噬菌体展示抗AFB1纳米抗体文库参照文献[21]方法构建,通过将纳米抗体编码基因与丝状噬菌体pIII蛋白编码基因融合,纳米抗体展示于噬菌体表面。大肠杆菌TG1、DH5α和 BL21(Rosetta,DE3),噬菌粒pHEN1,原核表达载体pET25b(+),辅助噬菌体M13K07,碱性磷酸酶表达载体pET25b(+)AP均由本实验室保存;内切酶XhoI、NotI和T4 DNA连接酶、质粒小提试剂盒、DNA凝胶回收试剂盒和PCR纯化试剂盒购自Takara公司;HRP/AntiM13 Monoclonal Conjugate、Ni2+NTA亲和层析柱(HisTrap FF,5 × 1 mL columns)购自美国GE Healthcare公司;AFB1标准品(美国Sigma公司);牛血清白蛋白(Bovine serum albumin, BSA)、卵清蛋白(Ovalbumin, OVA)、异丙基βD硫代吡喃半乳糖苷(IsopropyβDthiogalactoside,IPTG)和对硝基苯磷酸二钠(Disodium 4Nitrophenyl Phosphate,pNPP)购自上海生工生物工程技术服务有限公司;人工抗原AFB1OVA由本实验室制备;其它试剂均为国产分析纯。DNA测序由南京金斯瑞生物科技公司进行。
2.2 实验方法
2.2.1 抗AFB1纳米抗体文库的淘选 参考文献[22]对噬菌体展示文库进行四轮淘选。包被的人工抗原浓度分别为100, 75, 50和25 μg/mL,以3% BSAPBS和3% OVAPBS交替作为封闭液。第一轮淘选采用酸洗脱方法,第二至四轮淘选采用竞争洗脱法,竞争洗脱AFB1浓度依次为100, 50和25 ng/mL。其中,富集度=后一轮噬菌体回收率/上一轮噬菌体回收率;回收率 = 洗脱的噬菌体数/当轮投入的噬菌体数。
2.2.2 间接竞争phageELISA筛选抗AFB1纳米抗体 展示噬菌体的制备及间接竞争phageELISA鉴定参照文献[22,23]进行。随机挑选第四轮淘选的95个克隆,经辅助噬菌体M13K07救援后得到展示纳米抗体的噬菌体。采用间接竞争phageELISA进行阳性克隆的鉴定,根据OD450值,挑选竞争阻断效果显著的噬菌体测序。
2.2.3 融合表达载体pET25b(+)G8AP的构建 分别用限制性内切酶XhoI和NotI双酶切pET25b(+)G8和pET25b(+)AP,琼脂糖凝胶回收后,T4 DNA连接酶按摩尔比1∶3连接酶切载体与碱性磷酸酶基因片段,CaCl2法转化连接产物至大肠杆菌DH5α感受态细胞,采用菌落聚合酶链式反应(PCR)和双酶切验证转化子,阳性克隆进行测序。
2.2.4 融合蛋白的表达与纯化 将重组质粒pET25b(+)G8AP转入表达宿主BL21 Rosetta(DE3)感受态细胞。取单菌落接种于5 mL含有100 μg/mL氨苄青霉素(Amp)和34 μg/mL氯霉素(CAP)的LB液体培养基,37℃摇床振荡培养过夜。过夜培养物按1%比例接种于50 mL含Amp和CAP的LB液体培养基,37℃摇床振荡培养至OD600≈0.6,加入终浓度为0.1 mmol/L IPTG,30℃ 摇床振荡培养6 h,收集诱导培养物于4℃以8000 r/min离心15 min,弃上清液。菌体沉淀加入1/5体积的PBS缓冲液,超声破碎,在4℃以8000 r/min离心20 min,收集上清液和沉淀,Ni2+NTA柱纯化蛋白,SDSPAGE分析表达产物及纯化的融合蛋白。
2.2.5 融合蛋白的碱性磷酸酶活力测定
采用对硝基苯磷酸二钠法测定碱性磷酸酶酶活力和比活力[24]。在酶标板中,分别加入20 μL稀释不同倍数的重组蛋白(50, 100, 200, 400, 800, 1000倍)和100 μL pNPP底物液(10 mmol/L pNPP溶于含2.0 mmol/L MgCl2的0.1 mol/L二乙醇胺缓冲液,pH 9.8),37℃孵育15 min,每孔加入80 μL终止液(0.5 mol/L Na2CO3)终止反应,酶标仪测定OD405值,计算重组蛋白催化生成对硝基苯酚的浓度(mmol/L )。1个酶活力单位(1U)定义为37℃下,每分钟催化产生1 mmol对硝基苯酚所需的酶量。酶的比活力(U/mg)=酶活力(U/mL)/蛋白浓度(mg/mL)。
2.2.6 一步法ELISA体系的建立与优化 包被人工抗原AFB1OVA(0.5 μg/mL),100 μL/孔,4℃过夜。PBST洗涤3次,4%脱脂牛奶(300 μL/孔)37℃封闭2 h。PBST洗涤3次,每孔加入50 μL不同浓度的AFB1标准品(0, 2, 5, 10, 20, 40, 100, 220 ng/mL)及50 μL 2.06 μg/mL的融合蛋白,37℃孵育1 h。PBST洗板5次,加入100 μL 1 mg/mL pNPP,37℃显色10 min。加入50 μL 4 mol/L NaOH,终止反应,酶标仪测定OD405值。考察甲醇浓度、盐离子浓度及pH值对反应体系的影响。以竞争抗原AFB1终浓度对数为横坐标,以结合率(B/B0) 为纵坐标,绘制标准曲线[25]。定义结合率90%(即IC10)时AFB1浓度为最低检出限[26]。
B/B0(%) =OD1-ODHankOD2×100%(1)
式中,OD1为竞争抗原孔OD405值, ODBlank为空白对照OD405值, OD2为非竞争对照孔OD405值。
2.2.7 样品加标回收实验 对玉米和小麦样品进行加标回收实验,样品提取方法参考文献[27]进行。称取1g不含AFB1的样品(即用商品化ELISA试剂盒未检出AFB1,南昌博恒生物制品有限公司,检测限1 μg/kg),分别加入适量AFB1标准品至浓度分别为50和100 μg/kg(每个浓度做6个平行),再加入3 mL 60%甲醇20 mmol/L PBS溶液,剧烈振荡30 min,5000 r/min离心15 min,回收上清液,用20 mmol/L PBS稀释1.5倍后进行一步法ELISA检测。
3 结果与讨论
3.1 抗AFB1纳米抗体文库的淘选和阳性克隆的鉴定
噬菌体富集度随淘选的进行呈递增趋势,表明特异性结合AFB1的噬菌体被不断富集(图1)。间接竞争ELISA鉴定结果表明,共有80个克隆的显色值降低,表明可与AFB1特异性结合,阳性率为84.2%(图2)。其中,噬菌体克隆phageG8能够被完全阻断(图2B),
3.2 融合表达载体pET25b(+)G8AP的构建与验证
双酶切重组质粒琼脂糖凝胶电泳结果可见两个条带(图3),分别与理论上酶切后pET25b(+)G8片段(5908 bp)和碱性磷酸酶基因片段(1356 bp)大小相符[28]。测序结果表明,重组表达质粒pET25b(+)G8AP构建正确。
3.3 融合蛋白的表达与纯化
诱导后的蛋白上清和破碎沉淀在SDSPAGE电泳中在65 kDa左右出现条带,表明IPTG诱导后在大肠杆菌中存在可溶性融合蛋白。表达上清经Ni2+NTA亲和柱纯化后,SDSPAGE结果显示,获得了可溶性重组融合蛋白G8AP(图4,泳道3)。
3.4 融合蛋白的碱性磷酸酶活性测定
酶活力测定结果表明,重组融合蛋白具有催化活性。经亲和纯化的重组融合蛋白浓度为0.33 mg/mL,碱性磷酸酶活力为(120.3 ± 2.8) U/mL,酶比活力为(364.5 ± 8.3) U/mg。
3.5 交叉反应
采用ELISA法测定融合蛋白与AFB1结构类似物黄曲霉毒素B2(AFB2)、黄曲霉毒素G1(AFG1)、黄曲霉毒素G2(AFG2)及其它常见谷物污染毒素如脱氧雪腐镰刀菌烯醇(DON)、玉米赤霉烯酮(ZEN)、伏马菌素B1(FB1)的交叉反应率CR[29]:
CR(%)=IC50(AFB1)/IC50(其它毒素)×100% (2)
结果显示融合蛋白与AFB2的交叉反应率为1.5%,而与其它毒素几乎无交叉反应,表明融合蛋白具有较高的特异性。
3.6 一步法ELISA体系的建立与优化
3.6.1 ELISA条件优化 样品常用甲醇溶液萃取,甲醇浓度对G8APELISA检测的影响如图5 A所示,当甲醇浓度从2.5%升高到20%时,吸光度值有所增大,IC50值变化不大;当继续升高至40%时,AFB1不能有效的抑制融合蛋白与人工抗原结合,因此选择≤20%的甲醇进行后续实验。
盐离子浓度的影响如图5B所示,当盐离子浓度从5 mmol/L升高至40 mmol/L,吸光度值上升,IC50值变化不大;当盐离子浓度升高至80 mmol/L,吸光度值下降,IC50值增大。因此检测中控制反应体系的盐离子浓度小于40 mmol/L。
反应体系pH值的影响如图5C所示,当由酸性变为中性,抗原抗体的结合能力增强,反应体系的灵敏度增强;pH=7.4时,抗原抗体结合能力最强,灵敏度最高;当pH=8.4和9.4时,吸光度值没有明显变化,但是AFB1不能有效抑制融合蛋白与人工抗原结合。因此选择pH 7.4为最适pH值。
3.6.2 一步法ELISA方法的建立 由于选择较高浓度甲醇可以减小样品提取过程中的稀释倍数,提高样品检测灵敏度,综合考虑,选择甲醇20%、盐离子20 mmol/L、pH 7.4作为最适反应条件,绘制标准曲线(图5D)。一步法ELISA的IC50值为19.8 ng/mL,线性范围(IC20~ IC80)为4.3~92 ng/mL,检测限(IC10)为2.6 ng/mL。与单克隆抗体间接竞争ELISA检测方法[27,29]相比,本实验条件下,融合蛋白一步法ELISA的 IC50值偏高,但是检测时间大幅缩短,检测线性范围更宽。
3.7 样品加标回收实验
玉米和小麦样品的黄曲霉素B1加标回收实验结果如表1所示,加标回收率在90.4%~101.5%之间,且相对标准偏差均小于10%,表明样品的基质效应对方法的影响不明显,本方法可用于玉米和小麦样品中的黄曲霉素B1检测。
4 结 论
纳米抗体分子量小,易于与其它功能蛋白融合,得到具有多功能的重组蛋白。本研究构建了抗AFB1纳米抗体与碱性磷酸酶融合表达载体,在大肠杆菌中表达,获得了同时具有纳米抗体活性和碱性磷酸酶活性的双功能可溶性融合蛋白G8AP,建立了基于重组融合蛋白的检测AFB1的一步法ELISA,可望替代传统ELISA中的一抗和酶标抗体,缩短检测时间。采用重组融合蛋白,避免了化学交联方法中存在的均一性、稳定性差等问题,研究结果可为免疫学检测中关键元件的制备提供新途径。
References
1 Abrar M, Anjum F M, Butt M S, Pasha I, Randhawa M A, Saeed F, Waqas K. Crit. Rev. Food Sci. Nutr., 2013, 53: 862-874
2 GB27612011, Maximum Levels of Mycotoxins in Foods. National Standards of the Peoples Republic of China
食品中真菌毒素的限量. 中华人民共和国国家标准. GB27612011
3 GB130782001, Hygienical Standards for Feeds. National Standards of the Peoples Republic of China.
饲料卫生标准. 中华人民共和国国家标准. GB130782001
4 Iqbal J, Asghar M A, Ahmed A, Khan M A, Jamil K. Toxicol. Mech. Methods, 2014, 24: 544-551
5 Gazioglu I, Kolak U. J. AOAC Int., 2015, 98: 939-945
6 Lupo A, Roebuck C, Dutcher M, Kennedy J, Abouzied M. J. AOAC Int., 2010, 93: 587-599
7 Ji Y, Ren M, Li Y, Huang Z, Shu M, Yang H, Xiong Y, Xu Y. Talanta, 2015, 142: 206-212
8 Wang D, Hu W, Xiong Y, Xu Y, Li C M. Biosens. Bioelectron., 2015, 63: 185-189
9 Yu F Y, Gribas A V, Vdovenko M M, Sakharov I Y. Talanta, 2013, 107: 25-29
10 Zhang B, Du D L, Yin Y M. Food Anal. Method, 2014, 7(9): 1798-1803
11 Simons B, Kaplan H, Hefford M A. J. Immunol. Methods, 2006, 315: 88-98
12 Hu Z Q, Li H P, Zhang J B, Huang T, Liu J L, Xue S, Wu A B, Liao Y C. Anal. Chim. Acta, 2013, 764: 84-92
13 Xue S, Li H P, Zhang J B, Liu J L, Hu Z Q, Gong A D, Huang T, LiaoY C. Anal. Chem., 2013, 85(22): 10992-10999
14 Yang S L, Shang Y J, Yin S H, Wang D, Cai J P, Gong Z L, Serge M, Liu X T. J. Virol. Methods, 2015, 213: 84-92
15 Farajnia S, Ahmadzadeh V, Tanomand A, Veisi K, Khosroshahi S A, Rahbarnia L. Immunopharm. Immunot., 2014, 36(5): 297-308
16 Ahmad Z A, Yeap S K, Ali A M, Ho W Y, Alitheen N B, Hamid M. Clin. Dev. Immunol., 2012, 2012: 980250
17 XU Fang, YU GuangHui, WANG Pu. J. Zhengjiang University Tech., 2014, 42(1): 45-49
徐 放, 遇广辉, 王 普. 浙江工业大学学报, 2014, 42(1): 45-49
18 Muyldermans S, Baral T N, Retarnozzo V C, De B P, De G E, Kinne J, Leonhardt H, Magez S, Nguyen V K, Revets H. Vet. Immunol. Immunop., 2009, 128 (13): 178-183
19 Kaczmarek J Z, Skottrup P D. Mol. Immunol., 2015, 65(2): 384-390
20 Liu X, Xu Y, Wan D B, Xiong Y H, He Z Y, Wang X X, Gee S J, Ryu D J, Hammock B D. Anal. Chem., 2015, 87: 1387-1394
21 Liu X, Xu Y, Xiong Y H, Tu Z, Li Y P, He Z Y, Qiu Y L, Fu J H, Gee S J, Hammock B D. Anal. Chem., 2014, 86(15): 7471-7477
22 LIU Xia, XU Yang, TU Zhui, HE QingHua. J.Food Sci.Biotech., 2011, 30(6): 950-955
刘 夏, 许 杨, 涂 追, 何庆华. 食品与生物技术学报, 2011, 30(6): 950-955
23 Xu Y, Xiong L, Li Y P, Xiong Y H, Tu Z, Fu J H, Tang X. Food Chem., 2015, 177: 97-101
24 XU HuiFang, ZHANG XianEn, ZHANG ZhiPing, ZHANG YongMei. Prog. Biochem. Biophys., 2003, 30(1): 89-94
徐卉芳, 张先恩, 张治平, 张用梅. 生物化学与生物物理进展, 2003, 30(1): 89-94
25 Liu X, Xu Y, He Q H, He Z Y, Xiong Z P. J. Agr. Food Chem., 2013, 61(20): 4765-4770
26 WANG Lü, ZOU XuQiang, CHEN ChaoChao, SHAO HuiFeng, CHEN XueLan. Chinese J. Anal. Chem., 2015, 43(6): 856-861
王 吕, 熊斯诚, 邹旭强, 陈超超, 邵辉锋, 陈雪岚. 分析化学, 2015, 43(6): 856-861
27 XIE Hui, ZHANG Xian, WANG Xin, FAN PengCheng, SHI YuFei, FANG WeiHuan. Microbiology China, 2015, 42(10): 2033-2040
谢 珲, 章 先, 王 歆, 凡鹏程, 时玉菲, 方维焕. 微生物学通报, 2015, 42(10): 2033-2040
28 YANG DanYan, LIN ChenShui. J. Zhengjiang University Tech., 2009, 37(4): 372-375
杨丹燕, 林陈水. 浙江工业大学学报, 2009, 37(4): 372-375
29 Kim S H, Cha S H, Karyn B, Park S W, Son S W, Kang H G. Toxicol. Res., 2011, 27(2): 125-131
Abstract A phage clone (designated as the antiaflatoxin B1 nanobody, G8) specific binding to aflatoxin B1 (AFB1) was screened from an immunized nanobody phage library. The DNA fragment encoding G8 was subcloned into the vector pET25b(+)alkaline phosphatase (AP), and fused to the N terminal of AP. The fusion protein G8AP was expressed in E. coli BL21 (Rosetta, DE3) as soluble protein, and purified by immobilized metal affinity chromatography. The purified G8AP exhibited AP activity of 364.5±8.3 U/mg. Enzymelinked immunosorbent assay (ELISA) showed that G8AP was also capable of recognizing AFB1, with negligible crossreactivity toward other six common mycotoxins. A onestep ELISA was established to detect AFB1 using G8AP. The effects of methanol concentration, ionic strength, and pH on the detection sensitivity of the G8APELISA were evaluated and optimized. Under the optimized conditions (methanol 20%, NaCl 20 mmol/L, pH 7.4), the half inhibitory concentration (IC50) of the G8AP based ELISA was 19.8 ng/mL, with the linear range of 4.3-92 ng/mL and the detection limit of 2.6 ng/mL. The recoveries of AFB1 for corn and wheat samples were 90.4%–101.5%.
Keywords Antiaflatoxin B1 Nanobody; Alkaline phosphatase; Fusion expression; Enzymelinked immunosorbent assay

