高原低氧环境气虚小鼠肾、骨和脑组织反应性变化的分子机制研究
安方玉 骆亚莉 刘永琦 李应东 刘雪松 史旭锋 高卓越
摘要:目的 观察高原低压低氧环境中小鼠肾、骨、脑组织的适应性反应分子机制,探讨肾与脑髓的阴阳上下升降互济的统一性。方法 将SPF级小鼠采用随机数字表法分为正常对照组、模型组。模型组小鼠于低氧舱中模拟高海拔环境进行低氧暴露,连续21 d。第22日出舱称重后眼球采血处死小鼠。比色分析法检测各组小鼠脑组织乳酸脱氢酶(LDH)及Na+-K+-ATP酶活性。ELISA检测各组小鼠脑、骨骼肌组织磷酸果糖激酶(PFK)活性及肾组织促红细胞生成素(EPO)及其受体(EPOR)的含量。RT-PCR检测各组小鼠脑组织缺氧诱导因子-1α(HIF-1α)和水通道蛋白(AQP)-4 mRNA表达,Western blot检测脑组织HIF-1α、AQP-1及骨骼肌组织肌红蛋白(Mb)蛋白表达。结果 与正常对照组比较,模型组小鼠肾组织EPO含量升高,脑组织LDH、PFK活性增强(P<0.05)、HIF-1α和AQP-4的mRNA和蛋白表达水平升高(P<0.05,P<0.01);模型组小鼠骨骼肌组织PFK活性增强和Mb蛋白表达水平升高(P<0.05),脑组织Na+-K+-ATP酶活性和肾组织EPOR含量降低(P<0.05,P<0.01)。结论 高原低压低氧环境小鼠肾、骨和脑组织均发生了阴阳上下升降互济的适应性反应。
关键词:高原低氧;分子机制;肾;骨;脑;小鼠
DOI:10.3969/j.issn.1005-5304.2016.01.014
中图分类号:R228 文献标识码:A 文章编号:1005-5304(2016)01-0060-05
Study on Molecular Mechanism of Reactive Changes in Kidney, Skeleton and Brain of Mice Models in High Altitude Hypoxia Environment AN Fang-yu1, LUO Ya-li1, LIU Yong-qi1,2, LI Ying-dong1,2, LIU Xue-song1, SHI Xu-feng3, GAO Zhuo-yue1,2 (1. Provincial-Level Key Laboratory for Molecular Medicine of Major Diseases and Study on Prevention and Treatment of Traditional Chinese Medicine, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Dunhuang Medicine and Transformation of Ministry of Education and Gansu Province, Lanzhou 730000, China; 3. Clinical College of Gansu University of Chinese Medicine, Lanzhou 730000, China)
Abstract: Objective To observe the molecular mechanism of adaptive response of the kidney and skeleton and brain issues in the high altitude hypoxia; To discuss the unity of yin and yang oscillation relationship of kidney and brain marrow. Methods SPF KM mice were randomly divided into control group and model group according to random number table method. Mice in the model group were exposed to high altitude hypoxia cabin for successive 21 d. On the 22nd day, mice got out of the cabin and their body weight was measured, and then they were put to death through eyeball blood sampling. The activities of lactic LDH and Na+-K+-ATPase in brain tissue were detected by spectrophotometric colorimetry. The PFK activities of brain and skeletal muscle were detected by ELISA. Meanwhile the contents of EPO and EPOR in the kidney were measured by ELISA. The mRNA expressions of HIF-1α and AQP-4 in brain were assessed by RT-PCR. At the same time, the protein expressions of HIF-1α and AQP-1 in brain and the protein expression of Mb in skeletal muscle were detected by Western blot. Results Compared with the normal group, the LDH and PFK in brain tissue and the content of EPO in kidney tissue were all raised in the model
group(P<0.05). Meanwhile the mRNA expressions of HIF-1α and AQP-4 and the protein expressions of HIF-1α and AQP-1 in brain were all increased in the mice from the model group; the activities of PFK and the protein expression of Mb in skeletal muscle were also raised in the model group. But the activity of Na+-K+-ATPase in brain tissue and the content of EPOR in kidney tissue both decreased in the model group (P<0.05, P<0.01). Conclusion Adaptive response and the unity of yin and yang oscillation relationship between kidney, skeleton and brain tissue happen in high altitude hypoxia.
Key words: high altitude hypoxia; molecular mechanism; kidney; skeleton; brain; mice
高原地区低压、低氧、低温、强辐射等因素对人体生理和免疫系统均有明显的影响,其中,低氧是主要影响因素[1]。中医认为高原清气不足(缺氧)、燥寒二气为主(干燥多风、寒冷低温)。高原低氧多可诱发机体出现气虚、寒凝、血瘀等证,成为高原反应及高原病发生发展的重要机制。中医认为肾主骨生髓,通于脑。肾属五脏,位于下焦,藏精、主骨生髓;脑属奇恒之腑,位置最高,为诸阳之会,主认识。一属阴,一属阳,上下升降互济,肾精肾水上滋脑髓,脑固摄升提肾气,相互作用,互生互长,肾、骨、脑的升降互济对维持机体平衡健康发挥关键作用[2]。基于此,本研究观察了高原低氧环境中小鼠肾组织、骨骼肌组织、脑组织的反应分子机制,以期为肾与脑髓的上下升降互济统一性及中西医结合防治高原反应提供细胞与分子生物学基础。
1 材料与方法
1.1 动物
KM种小鼠30只,SPF级,6~8周龄,体质量(20±2)g,甘肃中医药大学科研实验中心,合格证号SCXK(甘)2011-0001,并在甘肃中医药大学科研实验中心SPF级动物实验室饲养。
1.2 主要试剂与仪器
乳酸脱氢酶(LDH)和Na+-K+-ATP酶检测试剂盒,南京建成生物工程研究所,批号分别为20131026、20131108;小鼠磷酸果糖激酶(PFK)、促红细胞生成素(EPO)及其受体(EPOR)precocated ELISA kit检测试剂盒,源叶公司,批号均为20131101A;Trizol Reagent试剂(美国),批号47115;GoScriptTM Reverse Transcription System试剂盒和GoTaq qPCR Master Mix试剂盒,Promega,批号分别为0000079524和0000114742;山羊抗小鼠抗体和山羊抗兔多克隆抗体,ABCAM公司;山羊抗小鼠缺氧诱导因子-1α(HIF-1α)抗体、水通道蛋白(AQP)-1抗体、肌红蛋白(Mb)抗体,IMMNUWAY公司。723N型分光光度计,北京瑞利分析仪器公司;FLYDWC50-IIA低压氧舱,贵州风雷航空军械有限责任公司;Bcnchnark Plus连续波长酶标仪,上海闪谱生物科技有限公司;美国Quawell Q5000超微量紫外可见分光光度计,北京鼎国昌盛生物技术有限责任公司;S1000TM Thermal Cycler、Molecular Imager ChemiDocTM XRS+With Image LabTM Software,BIO-RAD;7500 Real Time PCR System,英潍捷基(上海)贸易有限公司。
1.3 分组与造模
小鼠适应性饲养1周,常规饮食,自由饮水。采用随机数字表法将小鼠分为正常对照组、模型组各30只。参考文献[3-4]方法建立高原低氧小鼠模型,模型组小鼠置低压氧舱内进行减压低氧暴露:以10 m/s 速度上升至3000 m 停留5 min,再以同样速度上升至4500 m停留3 min,再以10 m/s 速度上升至6000 m,低氧暴露22 h 后,以15 m/s速度降至海平面高度。正常对照组小鼠常氧环境中饲养。连续21 d。
1.4 标本制备
末次低氧暴露后,眼球采血处死小鼠,分别摘取脑、肾及骨骼肌组织,用生理盐水冲洗数遍后备用。其中,实验过程中模型组死亡2只。
1.5 指标检测
1.5.1 肾促红细胞生成素及其受体水平测定 肾组织匀浆按质量(g)∶体积(mL)=1∶9加入9倍生理盐水,冰浴条件下2500 r/min离心10 min,取上清液用生理盐水按1∶4稀释成2%组织匀浆备用。ELISA检测肾组织EPO和EPOR含量。操作方法按试剂盒说明进行,于酶标仪450 nm处测定各孔A值。以标准品浓度为横坐标,绘制标准曲线,求出EPO和EPOR线性方程。分别为Y=0.042 3X+0.102 7,r2=0.990 8;Y=0.024 3X+0.158 9,r2=0.991 1。将各样品A值代入方程求出对应的浓度。
1.5.2 脑组织乳酸脱氢酶、Na+-K+-ATP酶及磷酸果糖激酶活性测定 脑组织匀浆制备方法同“1.5.1”项。2,4-二硝基苯肼比色法检测脑组织LDH活性,无机磷比色法检测脑组织Na+-K+-ATP酶活性,ELISA检测脑组织PFK活性,操作方法按试剂盒说明进行。其线性方程为:Y=0.001 3X+0.160 6,r2=0.996 3。将各样品A值代入方程求出对应的浓度。
1.5.3 脑组织缺氧诱导因子-1α和水通道蛋白-4基因表达检测 冰浴条件下用Trizol Reagent试剂抽提脑组织总RNA,用超微量核酸测定仪检测RNA浓度和纯度。用GoScriptTM Reverse Transcription System试剂盒合成cDNA第一链,按荧光定量 PCR操作说明书进行PCR反应,反应条件:预变性95 ℃、2 min,变性95 ℃、15 s,退火58 ℃、45 s,延伸60 ℃、1 min。共45个循环。每个样品各平行3次,数据经2-ΔΔCt处理后进行相对表达量分析。其中,β-actin、HIF-1α和AQP-4引物由TaKaRa宝生物工程(大连)有限公司设计并合成。基因序列为:HIF-1α上游引物5'-GGACGATGAACATCAAGCA-3',下游引物5'- AGGAAT GGGTTCACAAATCAGCA-3',扩增产物长度146 bp;AQP-4上游引物5'-TGGAGCCAG CATGAATCCAG-3',下游引物5'-ACGTTTGAGCTC CACATCAGGAC-3',扩增产物长度157 bp;β-actin上游引物5'-CATCCGTAAAGACCTCTATGCCAC-3',下游引物5'-ATGGAGCCACCGATCCACA-3',扩增产物长度172 bp。
1.5.4 脑组织缺氧诱导因子-1α和水通道蛋白-1蛋白表达检测 用预冷的组织蛋白裂解液(RPMI∶PMSF=1∶100)脑组织,提取脑组织总蛋白。用4×上样缓冲液调整蛋白浓度为40 μg/20 μL。每孔点样20 μL,进行SDS-PAGE(分离胶12%,浓缩胶5%)电泳后、电转至PVDF膜,用5%脱脂奶粉封闭液封闭2 h。加一抗(山羊抗小鼠HIF-1α抗体、AQP-1抗体和GAPDH抗体),4 ℃孵育过夜。TBST洗膜4次,将膜置于山羊抗兔辣根酶标记的二抗中,室温孵育2 h后,TBST洗膜4次。用ECL化学发光显影后,Bio-Rad凝胶成像仪采集信号并摄取凝胶图像。
1.5.5 骨骼肌组织磷酸果糖激酶活性检测 骨骼肌组织匀浆制备方法同“1.5.1”项。ELISA检测骨骼肌组织PFK活性,按试剂盒说明进行。其线性方程为:Y=0.001 2X+0.188 2,r2=0.996 4。将各样品A值代入方程求出对应的浓度。
1.5.6 骨骼肌组织肌红蛋白表达检测 蛋白裂解、定量、SDS-PAGE电泳、转膜、封闭、一抗及二抗孵育、ECL显影及图像采集等方法均同“1.5.4”项。
1.6 统计学方法
采用SPSS13.0统计软件进行分析。实验数据以—x±s表示,组间差异采用单因素方差分析,两两比较采用LSD分析,若方差不齐时用Dunnett's法分析。P<0.05表示差异有统计学意义。
2 结果
2.1 高原低压低氧环境对小鼠促红细胞生成素及其受体含量的影响
与正常对照组比较,模型组小鼠肾脏中EPO含量升高(P<0.05),EPOR含量降低(P<0.01)。结果见表1。
2.2 高原低压低氧环境对小鼠脑组织乳酸脱氢酶、Na+-K+-ATP酶及磷酸果糖激酶活性的影响
与正常对照组比较,模型组小鼠脑组织LDH活性增强(P<0.05),Na+-K+-ATP酶活性降低(P<0.01),PFK活性增强(P<0.05)。结果见表2。
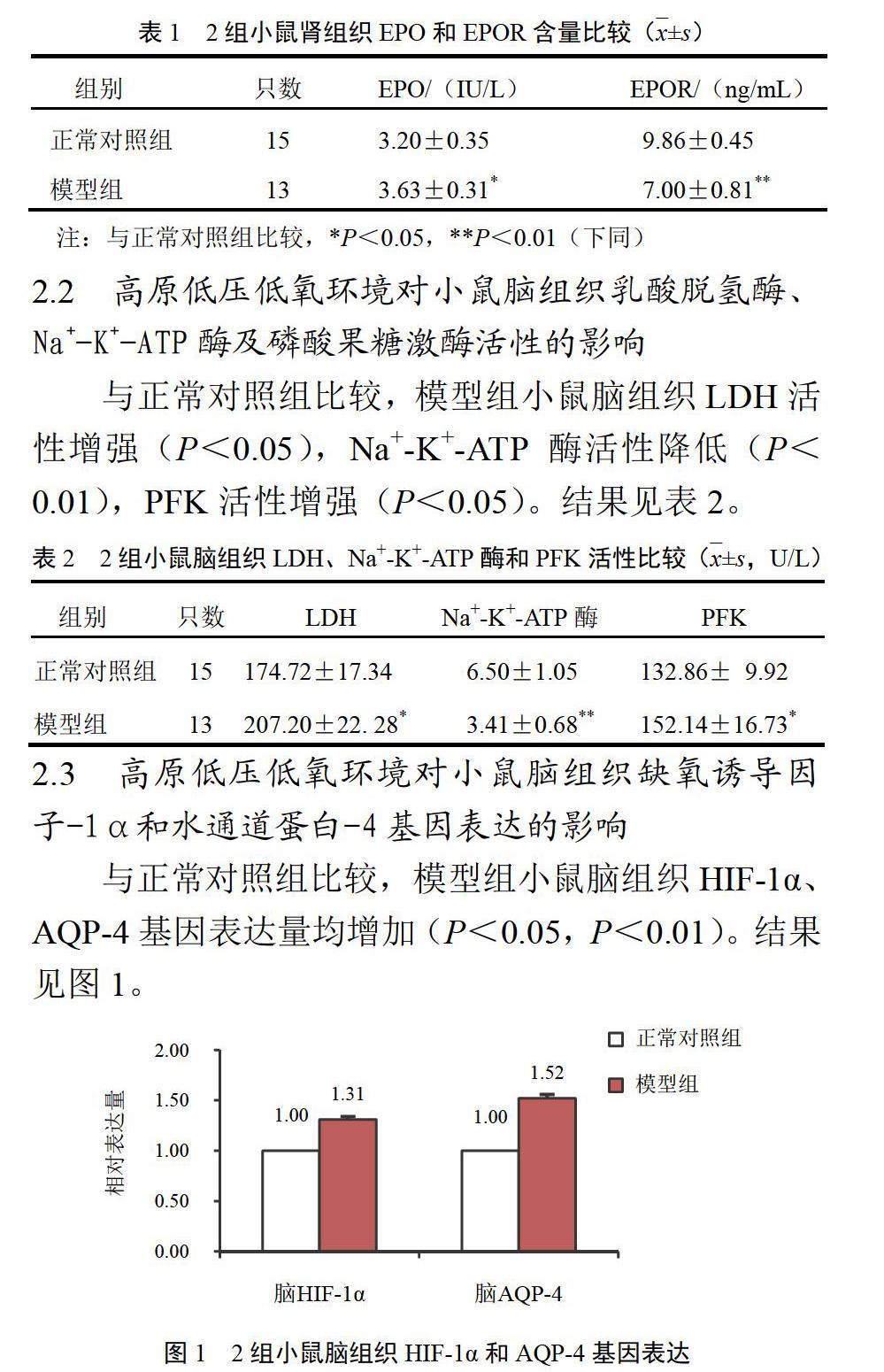
2.3 高原低压低氧环境对小鼠脑组织缺氧诱导因子-1α和水通道蛋白-4基因表达的影响
与正常对照组比较,模型组小鼠脑组织HIF-1α、AQP-4基因表达量均增加(P<0.05,P<0.01)。结果见图1。
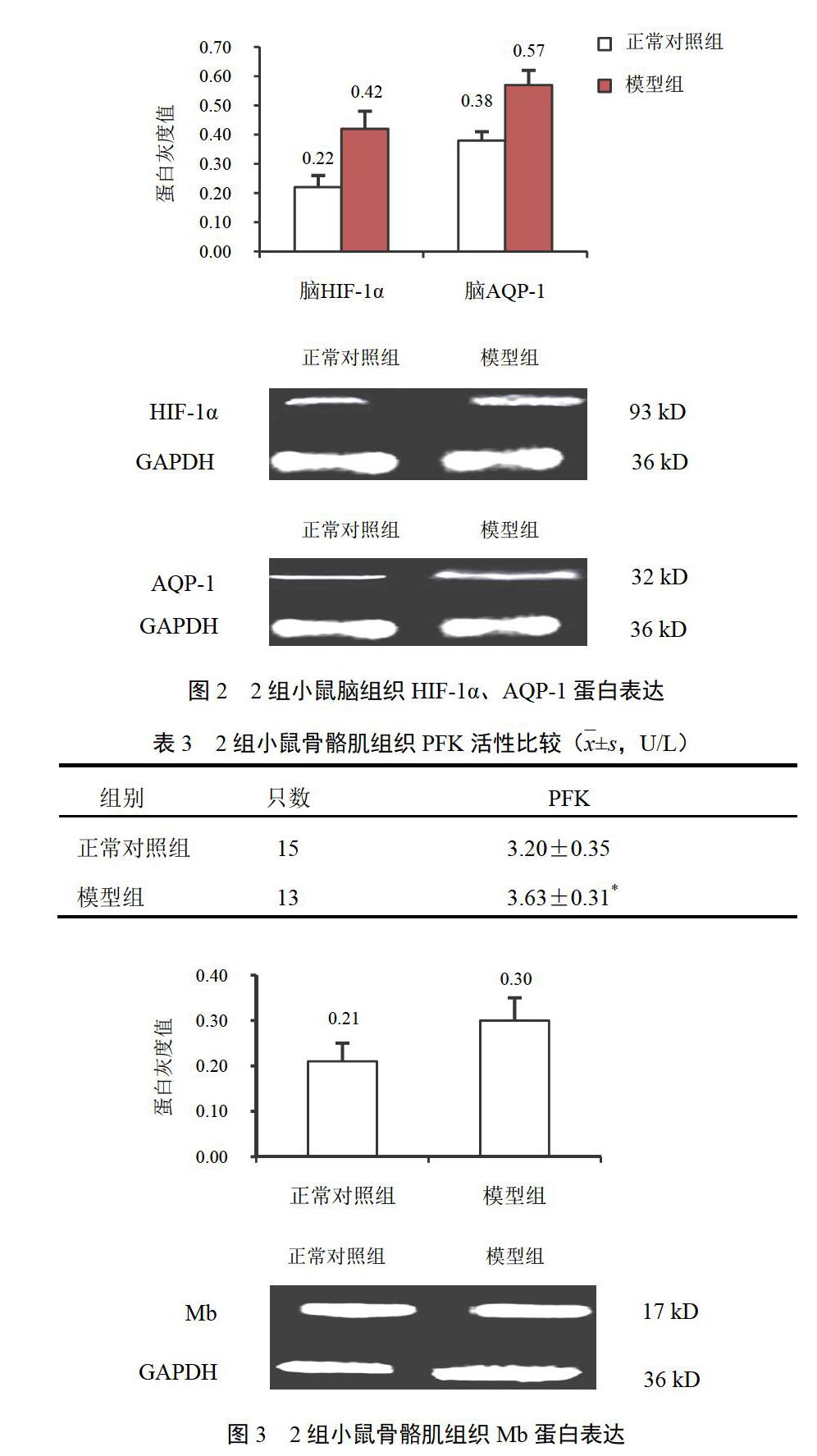
2.4 高原低压低氧环境对小鼠脑组织缺氧诱导因子-1α和水通道蛋白-1蛋白表达的影响
与正常对照组比较,模型组小鼠脑组织HIF-1α和AQP-1蛋白表达量均增加(P<0.01)。结果见图2。
2.5 高原低压低氧环境对小鼠骨骼肌组织磷酸果糖激酶活性的影响
与正常对照组比较,模型组小鼠骨骼肌组织PFK活性增强(P<0.05)。结果见表3。
2.6 高原低压低氧环境对小鼠骨骼肌组织肌红蛋白表达的影响
与正常对照组比较,模型组小鼠骨骼肌组织Mb蛋白表达增强(P<0.05)。结果见图3。
3 讨论
中医学认为,主骨生髓,通于脑,肾主藏精,而能生髓,髓居于骨中,骨赖髓以充养。所以,《素问·宣明五气篇》有“肾主骨”,《素问·阴阳应象大论篇》有“肾生骨髓”。肾精充足,则骨髓的生化有源,骨骼得到髓的充足滋养而坚固有力。如果肾精虚少,骨髓的化源不足,不能营养骨骼,便会出现骨骼脆弱无力,甚至发育不良。EPO在胚胎早期由肝脏产生,并逐渐转移至肾脏,出生后主要由肾皮质近曲小管管周细胞分泌,是一种激素样的糖蛋白。EPO可与肾组织及骨髓中红系干细胞表面的红细胞生成素受体结合,刺激红系干细胞,促进红系干细胞增殖、分化和成熟,使红细胞数增多,血红蛋白含量增加。并能稳定红细胞膜,增强红细胞抗氧能力。红细胞是脊椎动物体内通过血液运送氧气的最主要的媒介,红细胞把氧气运输给人身体组织的各部位,再从各部位运送出代谢产物二氧化碳,所以红细胞是我们人体内不可缺少的“运输队”,保证组织能量代谢的正常运行。EPO系统的研究发现,不仅为临床防治血液系统临床疾病提供了新途径,也进一步为中医的肾藏精,精血互生,肾主骨,精生髓理论提供了细胞生物学科学依据。本研究中发现,与正常对照组比较,模型组小鼠肾组织EPO含量升高,提示高原低氧环境可能通过刺激肾脏分泌EPO促进红细胞适应性增多,从而增强携氧能力;但模型组小鼠EPOR含量明显降低,影响了EPO与靶细胞的有效结合及其活性的发挥。
Mb是一种主要分布于心肌和骨骼肌组织的氧结合血红素蛋白,是机体内的细胞储氧器。在氧分压相同的情况下,Mb结合氧的能力比Hb高6倍,其中低氧诱导因子可活化控制Mb合成的基因。因此,Mb在心肌和骨骼肌组织的含量多少,直接影响肌细胞的摄氧能力,从而影响机体在缺氧条件下的适应能力。研究发现,世居高原的动物和人骨骼肌组织中Mb的含量比平原水平高,原居民与平原动物(如大鼠、囊鼠和豚鼠)等在经过3100~5000 m海拔高度驯化后,其骨骼肌组织中Mb则会显著增加[5]。本研究结果也表明,高原低氧环境小鼠骨骼肌组织Mb的蛋白表达水平明显增强(P<0.05)。因此可以推测,机体对高原低氧环境的适应机制可能是通过提高Mb在体内的含量,减慢其转变为高铁肌红蛋白的速度,从而进一步促进Mb与氧的结合来保证满足机体在低氧条件下对氧气的需求而实现的。
高原低氧环境使机体面临的最大挑战是缺氧。在缺氧条件下,机体要维持正常的生命活动,必须需要ATP来为其提供能量。在这种特殊的环境下,机体只能通过糖酵解来产生ATP。在糖酵解反应中,LDH是进入第二反应阶段的很重要的酶,PFK则是糖酵解反应中最为关键的一个酶。而LDH活性大小与细胞内氧分压的高低密切相关。PFK是糖酵解第一反应阶段最主要的限速酶。在高原低氧环境下,机体相对的ATP不足,ADP过剩,ADP是PFK的变构激活剂,能够增强PFK的活性,从而加速糖酵解。王氏[6]研究发现,在高原低氧环境下,与平原组对照,世居高原者LDH活性增强;王氏等[7]研究也发现,无氧组PFK活性随运动时间的延长均逐步增强。本研究结果显示,与正常对照组比较,高原低压低氧小鼠PFK和LDH活性增强。因此,可以推测出,在高原低氧环境下,机体主要通过增强糖酵解途径来维持机体的正常生命活动。
脑髓是脑功能活动的物质基础,而能量维持脑功能的实现是首要条件。ATP是机体内主要能量的直接供给者,其主要功能是维持细胞膜电位、维持细胞膜的完整性、参与细胞的各种代谢,而Na+-K+-ATP酶是一种大分子蛋白,具有ATP酶的活性,当胞内高Na+或胞外高K+增加时被激活,它在维持细胞内外离子交换的过程中具有不可替代的作用,并且它可作为判定代谢紊乱及组织损伤恢复能力的可靠指标之一。马氏等[8]研究发现,与正常对照组比较,模拟海拔5000 m减压缺氧6 h后,随着心肌细胞和脑细胞内ATP含量的大幅度下降,存在于心肌和脑细胞膜上的Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性也显著下降。本研究结果表明,与正常对照组比较,高原低压低氧小鼠脑组织Na+-K+-ATP酶显著下降(P<0.01)。因此,在高原低氧环境下,机体处于相对ATP不足的状态,导致机体组织发生损伤,从而严重影响Na+-K+-ATP酶的活性。
HIF-1是在缺血低氧的刺激下,广泛分布于机体组织的一种核转录因子。HIF-1主要由α亚基和β亚基构成的二聚体蛋白质,其中,HIF-1α的激活是缺氧反应的重要标志,也是脑组织缺氧反应的重要信号,无论是在全身缺氧或脑局灶性缺血时,脑组织中都发现有HIF-1α的激活。AQP是一组与水通透有关的细胞膜转运蛋白,在脑水肿的病理生理中发挥着重要作用。AQP-4主要分布在脑组织,具有选择性转运水的功能。AQP-1是Aquaporin家族的另一成员,主要分布在血管、肾脏远曲小管、眼、耳及脑,其作用是选择性通透水分子。本实验结果表明,与正常对照组比较,高原低压低氧模型小鼠脑组织HIF-1α mRNA和蛋白表达均增强,AQP-4 mRNA表达和AQP-1蛋白表达均增强。由此推测,机体对高原低氧环境的适应是通过增强HIF-1α来实现的,同时高原低氧环境可能使机体启动了内源性保护机制。
综上所述,模拟高原低压低氧环境复制气虚小鼠模型,肾组织、骨骼肌组织、脑组织均发生了阴阳上下升降互济的适应性反应,其适应高原低氧环境的可能机制是:在低氧状态下,机体可以促进HIF-1α表达增加,后者又进一步调控糖酵解酶、其他酶类、EPO及Mb等诸多参与氧代谢的下游靶基因转录,进一步增强机体对缺氧的耐受力,以保持机体内的氧平衡状态。
参考文献:
[1] 邓炳楠,李培兵,毛忠,等.单兵供氧器对高原移居青年心率和SaO2影响的评价[J].中国应用生理学杂志,2015,31(1):17-18,22.
[2] 窦娟娟,骆文郁,刘永琦.补肾益髓中药血清孵育骨髓间充质干细胞移植防治缺血性脑血管病的理论探讨[J].时珍国医国药,2011,22(3):562-563.
[3] 安方玉,刘永琦,骆亚莉,等.当归不同有效部位对高原低氧模型小鼠免疫功能的影响[J].中国中医药信息杂志,2015,22(2):51-54.
[4] 徐瑜,柳君泽,夏琛.棕榈酸对模拟高原低氧大鼠离体脑线粒体解耦联蛋白活性及质子漏的影响[J].生理学报,2008,60(1):59-64.
[5] 李庆芬.人与动物呼吸系统对高海拔低氧的适应[J].生物学通报, 1991,26(10):19.
[6] 王勇.不同海拔地区人血清乳酸脱氢酶同工酶的研究[J].高原医学杂志,2005,15(4):59-60.
[7] 王丽艳,张敏,赵晓丽,等.不同运动方式对大鼠异柠檬酸脱氢酶和磷酸果糖激酶-1的影响[J].天津医科大学学报,2011,17(2):170-172.
[8] 马慧萍,焦阳,高荣敏,等.天山雪莲乙醇提取物对模拟高原缺氧小鼠生化指标的影响[J].中药材,2014,37(1):99-103.
(收稿日期:2015-05-27)
(修回日期:2015-10-19;编辑:华强)


摘要:目的 观察高原低压低氧环境中小鼠肾、骨、脑组织的适应性反应分子机制,探讨肾与脑髓的阴阳上下升降互济的统一性。方法 将SPF级小鼠采用随机数字表法分为正常对照组、模型组。模型组小鼠于低氧舱中模拟高海拔环境进行低氧暴露,连续21 d。第22日出舱称重后眼球采血处死小鼠。比色分析法检测各组小鼠脑组织乳酸脱氢酶(LDH)及Na+-K+-ATP酶活性。ELISA检测各组小鼠脑、骨骼肌组织磷酸果糖激酶(PFK)活性及肾组织促红细胞生成素(EPO)及其受体(EPOR)的含量。RT-PCR检测各组小鼠脑组织缺氧诱导因子-1α(HIF-1α)和水通道蛋白(AQP)-4 mRNA表达,Western blot检测脑组织HIF-1α、AQP-1及骨骼肌组织肌红蛋白(Mb)蛋白表达。结果 与正常对照组比较,模型组小鼠肾组织EPO含量升高,脑组织LDH、PFK活性增强(P<0.05)、HIF-1α和AQP-4的mRNA和蛋白表达水平升高(P<0.05,P<0.01);模型组小鼠骨骼肌组织PFK活性增强和Mb蛋白表达水平升高(P<0.05),脑组织Na+-K+-ATP酶活性和肾组织EPOR含量降低(P<0.05,P<0.01)。结论 高原低压低氧环境小鼠肾、骨和脑组织均发生了阴阳上下升降互济的适应性反应。
关键词:高原低氧;分子机制;肾;骨;脑;小鼠
DOI:10.3969/j.issn.1005-5304.2016.01.014
中图分类号:R228 文献标识码:A 文章编号:1005-5304(2016)01-0060-05
Study on Molecular Mechanism of Reactive Changes in Kidney, Skeleton and Brain of Mice Models in High Altitude Hypoxia Environment AN Fang-yu1, LUO Ya-li1, LIU Yong-qi1,2, LI Ying-dong1,2, LIU Xue-song1, SHI Xu-feng3, GAO Zhuo-yue1,2 (1. Provincial-Level Key Laboratory for Molecular Medicine of Major Diseases and Study on Prevention and Treatment of Traditional Chinese Medicine, Gansu University of Chinese Medicine, Lanzhou 730000, China; 2. Key Laboratory of Dunhuang Medicine and Transformation of Ministry of Education and Gansu Province, Lanzhou 730000, China; 3. Clinical College of Gansu University of Chinese Medicine, Lanzhou 730000, China)
Abstract: Objective To observe the molecular mechanism of adaptive response of the kidney and skeleton and brain issues in the high altitude hypoxia; To discuss the unity of yin and yang oscillation relationship of kidney and brain marrow. Methods SPF KM mice were randomly divided into control group and model group according to random number table method. Mice in the model group were exposed to high altitude hypoxia cabin for successive 21 d. On the 22nd day, mice got out of the cabin and their body weight was measured, and then they were put to death through eyeball blood sampling. The activities of lactic LDH and Na+-K+-ATPase in brain tissue were detected by spectrophotometric colorimetry. The PFK activities of brain and skeletal muscle were detected by ELISA. Meanwhile the contents of EPO and EPOR in the kidney were measured by ELISA. The mRNA expressions of HIF-1α and AQP-4 in brain were assessed by RT-PCR. At the same time, the protein expressions of HIF-1α and AQP-1 in brain and the protein expression of Mb in skeletal muscle were detected by Western blot. Results Compared with the normal group, the LDH and PFK in brain tissue and the content of EPO in kidney tissue were all raised in the model
group(P<0.05). Meanwhile the mRNA expressions of HIF-1α and AQP-4 and the protein expressions of HIF-1α and AQP-1 in brain were all increased in the mice from the model group; the activities of PFK and the protein expression of Mb in skeletal muscle were also raised in the model group. But the activity of Na+-K+-ATPase in brain tissue and the content of EPOR in kidney tissue both decreased in the model group (P<0.05, P<0.01). Conclusion Adaptive response and the unity of yin and yang oscillation relationship between kidney, skeleton and brain tissue happen in high altitude hypoxia.
Key words: high altitude hypoxia; molecular mechanism; kidney; skeleton; brain; mice
高原地区低压、低氧、低温、强辐射等因素对人体生理和免疫系统均有明显的影响,其中,低氧是主要影响因素[1]。中医认为高原清气不足(缺氧)、燥寒二气为主(干燥多风、寒冷低温)。高原低氧多可诱发机体出现气虚、寒凝、血瘀等证,成为高原反应及高原病发生发展的重要机制。中医认为肾主骨生髓,通于脑。肾属五脏,位于下焦,藏精、主骨生髓;脑属奇恒之腑,位置最高,为诸阳之会,主认识。一属阴,一属阳,上下升降互济,肾精肾水上滋脑髓,脑固摄升提肾气,相互作用,互生互长,肾、骨、脑的升降互济对维持机体平衡健康发挥关键作用[2]。基于此,本研究观察了高原低氧环境中小鼠肾组织、骨骼肌组织、脑组织的反应分子机制,以期为肾与脑髓的上下升降互济统一性及中西医结合防治高原反应提供细胞与分子生物学基础。
1 材料与方法
1.1 动物
KM种小鼠30只,SPF级,6~8周龄,体质量(20±2)g,甘肃中医药大学科研实验中心,合格证号SCXK(甘)2011-0001,并在甘肃中医药大学科研实验中心SPF级动物实验室饲养。
1.2 主要试剂与仪器
乳酸脱氢酶(LDH)和Na+-K+-ATP酶检测试剂盒,南京建成生物工程研究所,批号分别为20131026、20131108;小鼠磷酸果糖激酶(PFK)、促红细胞生成素(EPO)及其受体(EPOR)precocated ELISA kit检测试剂盒,源叶公司,批号均为20131101A;Trizol Reagent试剂(美国),批号47115;GoScriptTM Reverse Transcription System试剂盒和GoTaq qPCR Master Mix试剂盒,Promega,批号分别为0000079524和0000114742;山羊抗小鼠抗体和山羊抗兔多克隆抗体,ABCAM公司;山羊抗小鼠缺氧诱导因子-1α(HIF-1α)抗体、水通道蛋白(AQP)-1抗体、肌红蛋白(Mb)抗体,IMMNUWAY公司。723N型分光光度计,北京瑞利分析仪器公司;FLYDWC50-IIA低压氧舱,贵州风雷航空军械有限责任公司;Bcnchnark Plus连续波长酶标仪,上海闪谱生物科技有限公司;美国Quawell Q5000超微量紫外可见分光光度计,北京鼎国昌盛生物技术有限责任公司;S1000TM Thermal Cycler、Molecular Imager ChemiDocTM XRS+With Image LabTM Software,BIO-RAD;7500 Real Time PCR System,英潍捷基(上海)贸易有限公司。
1.3 分组与造模
小鼠适应性饲养1周,常规饮食,自由饮水。采用随机数字表法将小鼠分为正常对照组、模型组各30只。参考文献[3-4]方法建立高原低氧小鼠模型,模型组小鼠置低压氧舱内进行减压低氧暴露:以10 m/s 速度上升至3000 m 停留5 min,再以同样速度上升至4500 m停留3 min,再以10 m/s 速度上升至6000 m,低氧暴露22 h 后,以15 m/s速度降至海平面高度。正常对照组小鼠常氧环境中饲养。连续21 d。
1.4 标本制备
末次低氧暴露后,眼球采血处死小鼠,分别摘取脑、肾及骨骼肌组织,用生理盐水冲洗数遍后备用。其中,实验过程中模型组死亡2只。
1.5 指标检测
1.5.1 肾促红细胞生成素及其受体水平测定 肾组织匀浆按质量(g)∶体积(mL)=1∶9加入9倍生理盐水,冰浴条件下2500 r/min离心10 min,取上清液用生理盐水按1∶4稀释成2%组织匀浆备用。ELISA检测肾组织EPO和EPOR含量。操作方法按试剂盒说明进行,于酶标仪450 nm处测定各孔A值。以标准品浓度为横坐标,绘制标准曲线,求出EPO和EPOR线性方程。分别为Y=0.042 3X+0.102 7,r2=0.990 8;Y=0.024 3X+0.158 9,r2=0.991 1。将各样品A值代入方程求出对应的浓度。
1.5.2 脑组织乳酸脱氢酶、Na+-K+-ATP酶及磷酸果糖激酶活性测定 脑组织匀浆制备方法同“1.5.1”项。2,4-二硝基苯肼比色法检测脑组织LDH活性,无机磷比色法检测脑组织Na+-K+-ATP酶活性,ELISA检测脑组织PFK活性,操作方法按试剂盒说明进行。其线性方程为:Y=0.001 3X+0.160 6,r2=0.996 3。将各样品A值代入方程求出对应的浓度。
1.5.3 脑组织缺氧诱导因子-1α和水通道蛋白-4基因表达检测 冰浴条件下用Trizol Reagent试剂抽提脑组织总RNA,用超微量核酸测定仪检测RNA浓度和纯度。用GoScriptTM Reverse Transcription System试剂盒合成cDNA第一链,按荧光定量 PCR操作说明书进行PCR反应,反应条件:预变性95 ℃、2 min,变性95 ℃、15 s,退火58 ℃、45 s,延伸60 ℃、1 min。共45个循环。每个样品各平行3次,数据经2-ΔΔCt处理后进行相对表达量分析。其中,β-actin、HIF-1α和AQP-4引物由TaKaRa宝生物工程(大连)有限公司设计并合成。基因序列为:HIF-1α上游引物5'-GGACGATGAACATCAAGCA-3',下游引物5'- AGGAAT GGGTTCACAAATCAGCA-3',扩增产物长度146 bp;AQP-4上游引物5'-TGGAGCCAG CATGAATCCAG-3',下游引物5'-ACGTTTGAGCTC CACATCAGGAC-3',扩增产物长度157 bp;β-actin上游引物5'-CATCCGTAAAGACCTCTATGCCAC-3',下游引物5'-ATGGAGCCACCGATCCACA-3',扩增产物长度172 bp。
1.5.4 脑组织缺氧诱导因子-1α和水通道蛋白-1蛋白表达检测 用预冷的组织蛋白裂解液(RPMI∶PMSF=1∶100)脑组织,提取脑组织总蛋白。用4×上样缓冲液调整蛋白浓度为40 μg/20 μL。每孔点样20 μL,进行SDS-PAGE(分离胶12%,浓缩胶5%)电泳后、电转至PVDF膜,用5%脱脂奶粉封闭液封闭2 h。加一抗(山羊抗小鼠HIF-1α抗体、AQP-1抗体和GAPDH抗体),4 ℃孵育过夜。TBST洗膜4次,将膜置于山羊抗兔辣根酶标记的二抗中,室温孵育2 h后,TBST洗膜4次。用ECL化学发光显影后,Bio-Rad凝胶成像仪采集信号并摄取凝胶图像。
1.5.5 骨骼肌组织磷酸果糖激酶活性检测 骨骼肌组织匀浆制备方法同“1.5.1”项。ELISA检测骨骼肌组织PFK活性,按试剂盒说明进行。其线性方程为:Y=0.001 2X+0.188 2,r2=0.996 4。将各样品A值代入方程求出对应的浓度。
1.5.6 骨骼肌组织肌红蛋白表达检测 蛋白裂解、定量、SDS-PAGE电泳、转膜、封闭、一抗及二抗孵育、ECL显影及图像采集等方法均同“1.5.4”项。
1.6 统计学方法
采用SPSS13.0统计软件进行分析。实验数据以—x±s表示,组间差异采用单因素方差分析,两两比较采用LSD分析,若方差不齐时用Dunnett's法分析。P<0.05表示差异有统计学意义。
2 结果
2.1 高原低压低氧环境对小鼠促红细胞生成素及其受体含量的影响
与正常对照组比较,模型组小鼠肾脏中EPO含量升高(P<0.05),EPOR含量降低(P<0.01)。结果见表1。
2.2 高原低压低氧环境对小鼠脑组织乳酸脱氢酶、Na+-K+-ATP酶及磷酸果糖激酶活性的影响
与正常对照组比较,模型组小鼠脑组织LDH活性增强(P<0.05),Na+-K+-ATP酶活性降低(P<0.01),PFK活性增强(P<0.05)。结果见表2。
2.3 高原低压低氧环境对小鼠脑组织缺氧诱导因子-1α和水通道蛋白-4基因表达的影响
与正常对照组比较,模型组小鼠脑组织HIF-1α、AQP-4基因表达量均增加(P<0.05,P<0.01)。结果见图1。
2.4 高原低压低氧环境对小鼠脑组织缺氧诱导因子-1α和水通道蛋白-1蛋白表达的影响
与正常对照组比较,模型组小鼠脑组织HIF-1α和AQP-1蛋白表达量均增加(P<0.01)。结果见图2。
2.5 高原低压低氧环境对小鼠骨骼肌组织磷酸果糖激酶活性的影响
与正常对照组比较,模型组小鼠骨骼肌组织PFK活性增强(P<0.05)。结果见表3。
2.6 高原低压低氧环境对小鼠骨骼肌组织肌红蛋白表达的影响
与正常对照组比较,模型组小鼠骨骼肌组织Mb蛋白表达增强(P<0.05)。结果见图3。
3 讨论
中医学认为,主骨生髓,通于脑,肾主藏精,而能生髓,髓居于骨中,骨赖髓以充养。所以,《素问·宣明五气篇》有“肾主骨”,《素问·阴阳应象大论篇》有“肾生骨髓”。肾精充足,则骨髓的生化有源,骨骼得到髓的充足滋养而坚固有力。如果肾精虚少,骨髓的化源不足,不能营养骨骼,便会出现骨骼脆弱无力,甚至发育不良。EPO在胚胎早期由肝脏产生,并逐渐转移至肾脏,出生后主要由肾皮质近曲小管管周细胞分泌,是一种激素样的糖蛋白。EPO可与肾组织及骨髓中红系干细胞表面的红细胞生成素受体结合,刺激红系干细胞,促进红系干细胞增殖、分化和成熟,使红细胞数增多,血红蛋白含量增加。并能稳定红细胞膜,增强红细胞抗氧能力。红细胞是脊椎动物体内通过血液运送氧气的最主要的媒介,红细胞把氧气运输给人身体组织的各部位,再从各部位运送出代谢产物二氧化碳,所以红细胞是我们人体内不可缺少的“运输队”,保证组织能量代谢的正常运行。EPO系统的研究发现,不仅为临床防治血液系统临床疾病提供了新途径,也进一步为中医的肾藏精,精血互生,肾主骨,精生髓理论提供了细胞生物学科学依据。本研究中发现,与正常对照组比较,模型组小鼠肾组织EPO含量升高,提示高原低氧环境可能通过刺激肾脏分泌EPO促进红细胞适应性增多,从而增强携氧能力;但模型组小鼠EPOR含量明显降低,影响了EPO与靶细胞的有效结合及其活性的发挥。
Mb是一种主要分布于心肌和骨骼肌组织的氧结合血红素蛋白,是机体内的细胞储氧器。在氧分压相同的情况下,Mb结合氧的能力比Hb高6倍,其中低氧诱导因子可活化控制Mb合成的基因。因此,Mb在心肌和骨骼肌组织的含量多少,直接影响肌细胞的摄氧能力,从而影响机体在缺氧条件下的适应能力。研究发现,世居高原的动物和人骨骼肌组织中Mb的含量比平原水平高,原居民与平原动物(如大鼠、囊鼠和豚鼠)等在经过3100~5000 m海拔高度驯化后,其骨骼肌组织中Mb则会显著增加[5]。本研究结果也表明,高原低氧环境小鼠骨骼肌组织Mb的蛋白表达水平明显增强(P<0.05)。因此可以推测,机体对高原低氧环境的适应机制可能是通过提高Mb在体内的含量,减慢其转变为高铁肌红蛋白的速度,从而进一步促进Mb与氧的结合来保证满足机体在低氧条件下对氧气的需求而实现的。
高原低氧环境使机体面临的最大挑战是缺氧。在缺氧条件下,机体要维持正常的生命活动,必须需要ATP来为其提供能量。在这种特殊的环境下,机体只能通过糖酵解来产生ATP。在糖酵解反应中,LDH是进入第二反应阶段的很重要的酶,PFK则是糖酵解反应中最为关键的一个酶。而LDH活性大小与细胞内氧分压的高低密切相关。PFK是糖酵解第一反应阶段最主要的限速酶。在高原低氧环境下,机体相对的ATP不足,ADP过剩,ADP是PFK的变构激活剂,能够增强PFK的活性,从而加速糖酵解。王氏[6]研究发现,在高原低氧环境下,与平原组对照,世居高原者LDH活性增强;王氏等[7]研究也发现,无氧组PFK活性随运动时间的延长均逐步增强。本研究结果显示,与正常对照组比较,高原低压低氧小鼠PFK和LDH活性增强。因此,可以推测出,在高原低氧环境下,机体主要通过增强糖酵解途径来维持机体的正常生命活动。
脑髓是脑功能活动的物质基础,而能量维持脑功能的实现是首要条件。ATP是机体内主要能量的直接供给者,其主要功能是维持细胞膜电位、维持细胞膜的完整性、参与细胞的各种代谢,而Na+-K+-ATP酶是一种大分子蛋白,具有ATP酶的活性,当胞内高Na+或胞外高K+增加时被激活,它在维持细胞内外离子交换的过程中具有不可替代的作用,并且它可作为判定代谢紊乱及组织损伤恢复能力的可靠指标之一。马氏等[8]研究发现,与正常对照组比较,模拟海拔5000 m减压缺氧6 h后,随着心肌细胞和脑细胞内ATP含量的大幅度下降,存在于心肌和脑细胞膜上的Na+-K+-ATP酶和Ca2+-Mg2+-ATP酶活性也显著下降。本研究结果表明,与正常对照组比较,高原低压低氧小鼠脑组织Na+-K+-ATP酶显著下降(P<0.01)。因此,在高原低氧环境下,机体处于相对ATP不足的状态,导致机体组织发生损伤,从而严重影响Na+-K+-ATP酶的活性。
HIF-1是在缺血低氧的刺激下,广泛分布于机体组织的一种核转录因子。HIF-1主要由α亚基和β亚基构成的二聚体蛋白质,其中,HIF-1α的激活是缺氧反应的重要标志,也是脑组织缺氧反应的重要信号,无论是在全身缺氧或脑局灶性缺血时,脑组织中都发现有HIF-1α的激活。AQP是一组与水通透有关的细胞膜转运蛋白,在脑水肿的病理生理中发挥着重要作用。AQP-4主要分布在脑组织,具有选择性转运水的功能。AQP-1是Aquaporin家族的另一成员,主要分布在血管、肾脏远曲小管、眼、耳及脑,其作用是选择性通透水分子。本实验结果表明,与正常对照组比较,高原低压低氧模型小鼠脑组织HIF-1α mRNA和蛋白表达均增强,AQP-4 mRNA表达和AQP-1蛋白表达均增强。由此推测,机体对高原低氧环境的适应是通过增强HIF-1α来实现的,同时高原低氧环境可能使机体启动了内源性保护机制。
综上所述,模拟高原低压低氧环境复制气虚小鼠模型,肾组织、骨骼肌组织、脑组织均发生了阴阳上下升降互济的适应性反应,其适应高原低氧环境的可能机制是:在低氧状态下,机体可以促进HIF-1α表达增加,后者又进一步调控糖酵解酶、其他酶类、EPO及Mb等诸多参与氧代谢的下游靶基因转录,进一步增强机体对缺氧的耐受力,以保持机体内的氧平衡状态。
参考文献:
[1] 邓炳楠,李培兵,毛忠,等.单兵供氧器对高原移居青年心率和SaO2影响的评价[J].中国应用生理学杂志,2015,31(1):17-18,22.
[2] 窦娟娟,骆文郁,刘永琦.补肾益髓中药血清孵育骨髓间充质干细胞移植防治缺血性脑血管病的理论探讨[J].时珍国医国药,2011,22(3):562-563.
[3] 安方玉,刘永琦,骆亚莉,等.当归不同有效部位对高原低氧模型小鼠免疫功能的影响[J].中国中医药信息杂志,2015,22(2):51-54.
[4] 徐瑜,柳君泽,夏琛.棕榈酸对模拟高原低氧大鼠离体脑线粒体解耦联蛋白活性及质子漏的影响[J].生理学报,2008,60(1):59-64.
[5] 李庆芬.人与动物呼吸系统对高海拔低氧的适应[J].生物学通报, 1991,26(10):19.
[6] 王勇.不同海拔地区人血清乳酸脱氢酶同工酶的研究[J].高原医学杂志,2005,15(4):59-60.
[7] 王丽艳,张敏,赵晓丽,等.不同运动方式对大鼠异柠檬酸脱氢酶和磷酸果糖激酶-1的影响[J].天津医科大学学报,2011,17(2):170-172.
[8] 马慧萍,焦阳,高荣敏,等.天山雪莲乙醇提取物对模拟高原缺氧小鼠生化指标的影响[J].中药材,2014,37(1):99-103.
(收稿日期:2015-05-27)
(修回日期:2015-10-19;编辑:华强)

