基于超高效液相色谱—质谱的药物性肝损伤患者血清代谢组学研究
安卓玲 史忱 赵瑞 李鹏飞 刘丽宏
摘 要 利用超高效液相色谱与四级杆-轨道阱高分辨质谱仪联用技术(UPLC-MS/MS)结合多变量统计分析方法,开展健康者与肿瘤药物、中药、他汀类降脂药、抗菌药引发肝损伤患者的血清代谢组学研究。血清样本采用冰乙腈沉淀蛋白,HSS T3-C18色谱柱,水(含0.01%甲酸)与乙腈为流动相梯度洗脱,液相色谱串联质谱分析测定。基于健康者与药物性肝损伤初诊病例代谢轮廓的正交偏最小二乘判别分析(OPLS-DA)以及偏最小二乘法判别分析(PLS-DA),寻找114个与药物性肝损伤早期诊断密切相关的氨基酸类生物标志物,其中有38个代谢物在两组间具有显著差异(p<0.001)。对各组分离贡献大的化合物进行串联质谱分析,经Human Metabolome Database(HMDB)等数据库检索, 进行质谱信息匹配, 鉴定出与药物性肝损伤相关的可能生物标志物苯丙氨酸和二甲基鸟苷。
关键词 超高效液相色谱-串联质谱; 药物性肝损伤; 血清; 代谢组学; 生物标志物
1 引 言
随着新药的广泛应用以及联合用药的增多,药物性肝损伤(Drug-induced liver injury,DILI)临床常见且发病率有逐年上升趋势[1~4]。药物性肝损伤是指治疗过程中使用治疗剂量的药物,机体受药物及其代谢产物产生的毒性作用引起受药机体肝脏损害,表现为肝细胞坏死、胆汁瘀积、脂肪肝、慢性肝炎、肝硬化等各种肝病。临床应用中各类药物都有肝损伤的相关报道,以抗菌药物、非甾体类抗炎药、抗结核药、抗肿瘤等药物为主,中草药与保健品的肝毒性发生率也有上升趋势[5~8]。药物性肝损伤是药物本身对肝脏的损害,也可能是机体对药物的特异质反应,原来没有肝病的人群或以往就有肝病的患者都可能发生不同程度的肝脏损害[9,10]。据统计,约40%肝炎和25%急性肝衰竭都是由药物引起的[11],药物性肝损伤在住院患者中的发病率为1%~5%,占急性肝损伤住院病例的10%[12]。因此,药物性肝损伤指标的早期发现对于有效降低治疗期间的用药风险、保障患者的用药安全至关重要。
目前,药物治疗过程中发生的肝损伤具有一定的隐匿性,易与基础疾病症状混淆,临床上缺乏用于药物性肝损伤早期发现的敏感性和特异性小分子标志物,仅根据丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)等传统指标, 联合病理组织学检查, 很难在肝损伤发生之前进行准确而及时的预警[13,14]。另外,现阶段药物性肝损伤的研究往往针对单一药物的机制探讨或回顾性分析,缺乏临床常用药物引发肝损伤的共性研究及共性判定指标,很难在相对独立的研究结果中真正建立各类药物肝损伤之间的联系,严重阻碍了药物性肝损伤的早期预警及防治[15,16]。代谢组学(Metabonomics)比单一靶标具有更好的预见性和可靠性,更有利于准确、有效地判定毒副作用程度,能够寻找用于早期发现药物性肝损伤的相关生物标志物,在疾病的早期发现、机制研究及药物安全性评价等方面发挥重要作用[17~19]。基于药物性肝损伤研究中的难点问题,本研究率先采用LC-MS/MS技术开展健康者及临床药物肝损伤初诊病例血清的代谢组学研究,探索内源性代谢物浓度变化与药物性肝损伤之间的相关性,以临床数据为基础探索药物性肝损伤相关的可能生物标志物。
2 实验部分
2.1 仪器与试剂
UltiMate 3000 UPLC 系统(美国Thermo Scientific公司),配有双三元液相色谱梯度泵系统(包含在线脱气单元)、柱温箱、DAD紫外检测器及Chromeleon色谱系统控制软件;Q EXACTIVE 四级杆-轨道阱高分辨质谱仪(美国Thermo Scientific公司),配有ESI源及Xcalibur数据系统;Waters ACQUITY UPLC HSS T3-C18色谱柱 (10 cm × 2.1 mm, 1.8 μm)。SAVANT SPD121 P SpeedVac离心浓缩仪(美国Thermo Scientific公司);Captiva 96 孔过滤板-0.2 μm(Agilent Technologies公司)。乙腈、甲醇和甲酸(色谱纯,德国Merck公司),实验用纯净水(杭州娃哈哈集团有限公司)。
2.2 样品收集和制备
以临床病历诊断及肝脏状态相关的酶学指标为依据,严格执行入组标准与排除标准,收集了21例健康者与24例药物性肝损伤(6例抗肿瘤药物、4例中药、13例降脂药及1例抗菌药物)初诊患者的血清样本(见表1),具体信息详见附录1。取100 μL血清,加入300 μL冰乙腈沉淀蛋白,涡旋4 min,于4℃下10000 r/min离心10 min ,取上清液200 μL,置于离心浓缩仪,在36℃条件下,干燥60~90 min。以200 μL 2%乙腈复溶,经0.2 μm Captiva 96 孔过滤板过滤,待UPLC-MS分析。
2.3 色谱-质谱条件及样品分析
色谱条件:A超纯水(含0.01%甲酸),B乙腈;梯度洗脱:0~9 min,2%~60% B; 9~18 min,60% B;18~20 min,60%~100% B。柱温:50℃;流速:0.25 mL/min,进样量5 μL。
质谱条件: 全扫描; 离子化方式: 加热ESI源HESI; 喷雾电压: 3500V(+)/3300(-); 鞘气: 4.46 MPa(+)/0.68 MPa(-); 辅助气: 1.02 MPa(+)/无(-); 离子传输管温度: 320℃。
质量扫描范围为m/z 100~1000,分辨率70000 FWHM,使用气体均为氮气,数据采集软件使用Xcalibur数据系统。被测样品通过正、负离子模式的UPLC-MS谱分析后,利用信息依赖的数据采集(Information dependent acquisition, IDA)功能,获得相关代谢物的MS/MS谱。碰撞能量(CE)设定为30 eV或 10 eV。正离子模式选用背景离子邻苯二甲酸酯类物质的相关离子(m/z 149.0233, 279.1591, 391.2843)进行自动校正。
本研究将健康者血清样本进行混合制得质控样本(Quality control,QC),通过连续6针进样平衡系统,保证系统的适应性。另外,QC作为实际样本插入检测序列中,以QC数据的PCA得分图监测方法的稳定性。
2.4 数据处理
对上述健康者与药物性肝损伤血清样本进行UPLC-(±)ESIMS分析,通过R命令的数据转换方法,删除若干同位素离子与加合离子,完成峰识别、峰对齐、峰匹配和峰强度校正,最终获得包括保留时间、质荷比与峰面积的二维数据阵。再将转化获得数据阵导入SIMCA-P软件 (version 13.0, Umetrics AB, Ume, Sweden)进行数据处理,建立模式识别模型并提取差异变量,获得对分组有贡献的变量。通过高分辨MS谱、MS/MS谱、网上数据库检索以及代谢物的质谱裂解规律对差异代谢物即可能生物标志物的结构进行鉴定。数据库主要包括:human metabolite database (http://hmdb.ca/);PubChem compound database (http://www.ncbi.nlm.nih.gov);METLIN (http://metlin.scripps.edu/);KEGG(http://www.genome.jp/kegg/ligand.html)。
3 结果与讨论
3.1 健康者与药物性肝损伤临床患者的病例信息与酶学指标
采用SPSS16.0统计软件的单因素方差分析方法对组间生化结果进行比较。药物性肝损伤患者血清的丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)均有异常升高,其中中药、他汀类降脂药相关肝损伤的血清ALT与AST显著增加(p<0.01),抗肿瘤药的血清ALT有明显增加(p<0.05), 一例抗菌药相关肝损伤AST与ALT显著增加,超过3倍正常值上限。
3.2 药物性肝损伤的血清代谢组学研究
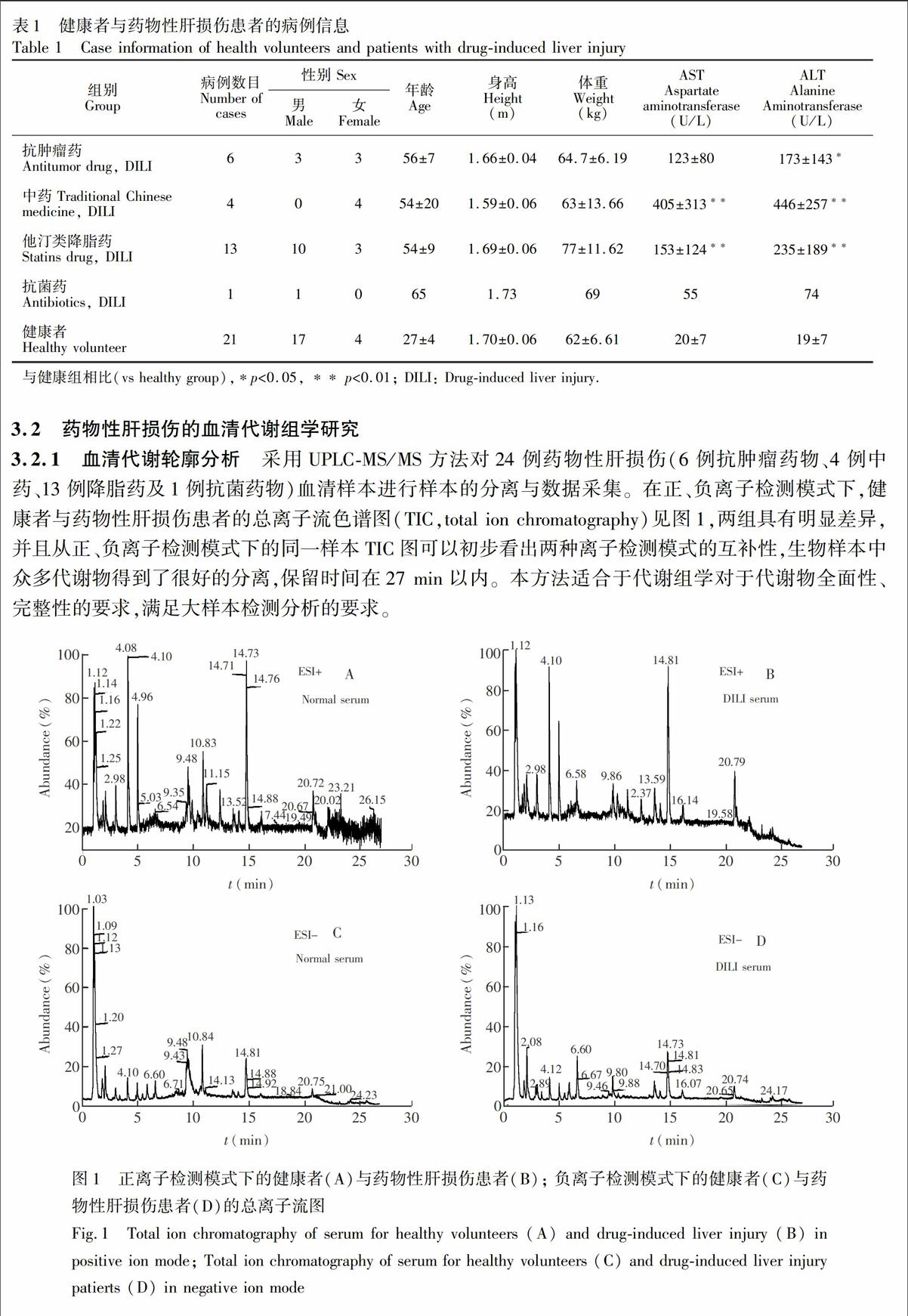
3.2.1 血清代谢轮廓分析 采用UPLC-MS/MS方法对24例药物性肝损伤(6例抗肿瘤药物、4例中药、13例降脂药及1例抗菌药物)血清样本进行样本的分离与数据采集。在正、负离子检测模式下,健康者与药物性肝损伤患者的总离子流色谱图(TIC,total ion chromatography)见图1,两组具有明显差异,并且从正、负离子检测模式下的同一样本TIC图可以初步看出两种离子检测模式的互补性,生物样本中众多代谢物得到了很好的分离,保留时间在27 min以内。本方法适合于代谢组学对于代谢物全面性、完整性的要求,满足大样本检测分析的要求。
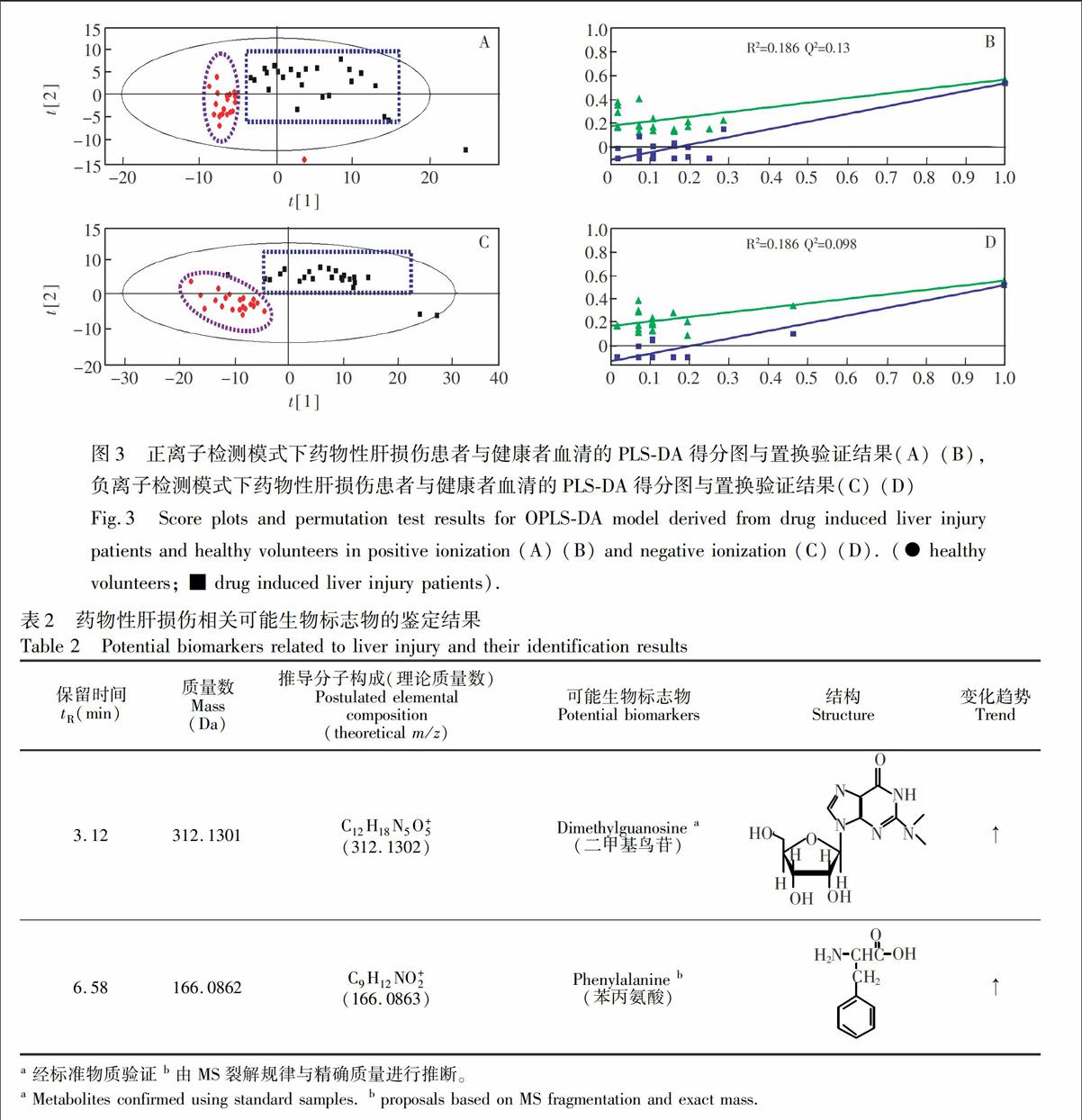
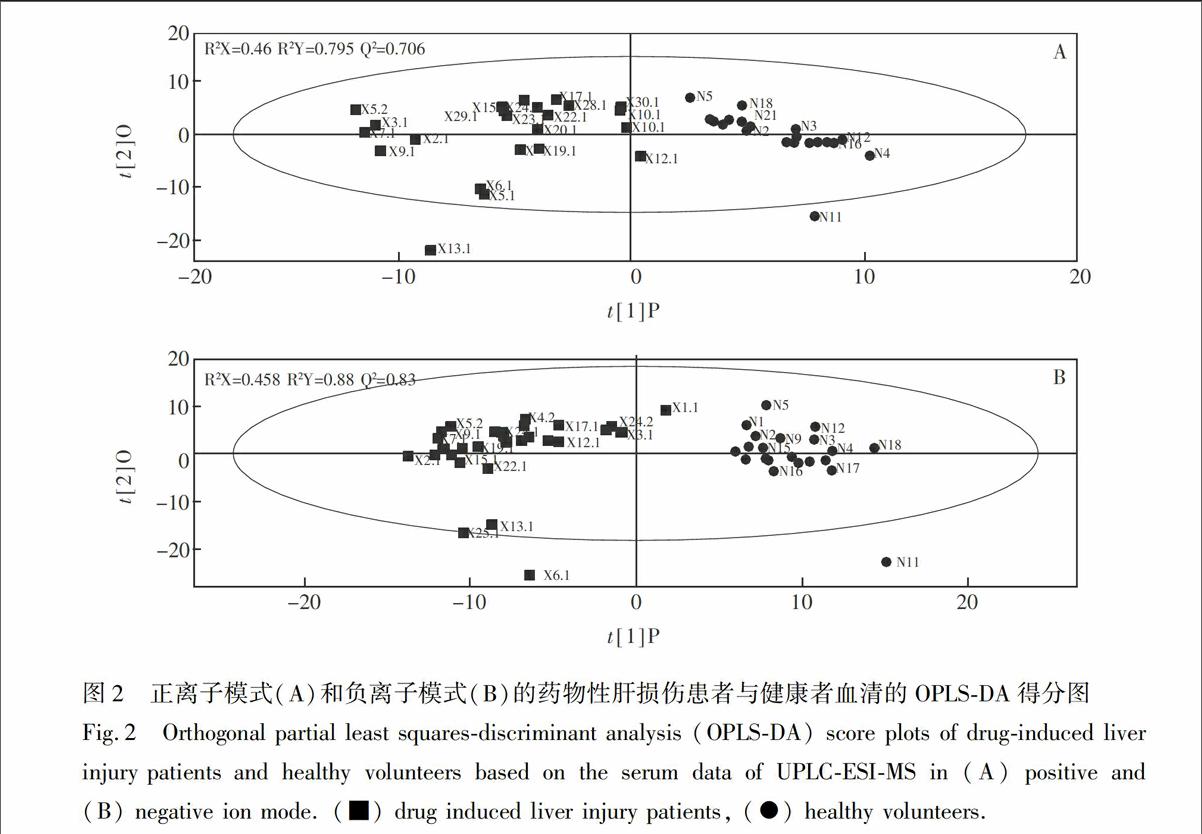
3.2.2 潜在生物标志物的鉴定 对数据进行正交偏最小二乘判别分析(Orthogonal partial least squares-discriminant analysis, OPLS-DA)分析,并使用偏最小二乘法判别分析(Partial least squares-discriminant analysis, PLS-DA)模型进行置换验证(Permutation test),从而避免相应模式的过度拟合,确保数据模型模型的可靠性。正离子检测模式下血清样本的OPLS-DA结果见图2A,交叉验证显示预测能力Q2Y=0.706,46%的变量 [R2(X)] 可用于解释79.5%的组间差异[R2(Y)]。负离子检测模式下血清样本的OPLS-DA结果见图2B,Q2Y=0.83,45.8%的变量 [R2(X)] 可用于解释88%的组间差异[R2(Y)]。置换验证结果中R2Y(绿色三角)与真实模型的R2Y值共同构成的回归线截距分别为0.186,经100次建模获得的Q2Y(蓝色方块)与真实模型的Q2Y值共同构成的回归线截距≤ 0.05,如图3所示。以上结果表明, 在正、负离子检测模式下,血清样本的多变量数据模型符合参数标准,可有效、可靠地应用于可能生物标志物的筛选。
结合OPLS-DA模型中变量的VIP值,S-plot 载荷图,带Jack-knifed 置信区间的载荷图和原始变量轮廓图,对差异变量进行筛选和可靠性验证,并通过均值t-检验删除两组间没有显著性差异(p>0.05)的变量。本研究共寻找114个与药物性肝损伤早期诊断密切相关的生物标志物,其中有38种代谢物在两组间具有显著差异(p<0.001)。通过高分辨MS、MS/MS谱分析、网上数据库检索结合代谢物结构的质谱裂解特征,推断可能生物标志物的结构,详见附录2,已鉴定出两个可能生物标志物的结构,包括苯丙氨酸和二甲基鸟苷,如表2所示。
3.3 可能生物标志物的生物学意义
二甲基鸟苷是RNA的降解产物,有研究发现, 实验动物猴的肝癌模型尿液中二甲基鸟苷浓度增加是tRNA甲基转移酶活性与能力高度表达的结果[20],但尚未有研究发现二甲基鸟苷与药物性肝损伤之间的关联。另外,肝脏是芳香族氨基酸的主要代谢场所,肝脏的氨基酸代谢减弱、肝细胞坏死及蛋白质分解加强会导致氨基酸在肝细胞中的浓度增高[21~24]。本研究中二甲基鸟苷与苯丙氨酸在药物性肝损伤患者血清中的浓度异常增高,提示其可能为药物性肝损伤相关的可能生物标志物,并且氨基酸与核苷代谢通路可能是药物性肝损伤的重要代谢途径。
4 结 论
本研究运用正、负离子检测模式的UPLC-MS/MS 技术结合多变量统计分析方法进行了临床药物性肝损伤患者血清的代谢组学研究,已鉴定出两个在肝损伤初诊患者与健康人血清中存在显著性差异的可能生物标志物结构,分别为苯丙氨酸和二甲基鸟苷。今后的研究将继续对可能生物标志物的结构进行鉴定,并深入阐述其生物学意义,为药物性肝损伤的早期发现提供依据。
References
1 Rangnekar A S, Fontana R J. Minerva Gastroenterol. Dietol., 2011, 57(2): 213-229
2 Matsumoto K. Rinsho Byori., 2011, 59(12): 1117-1122
3 Suk K T, Kim D J. Clin. Mol. Hepatol., 2012, 18(3): 249-257
4 Corsini A, Ganey P, Ju C, Kaplowitz N, Pessayre D, Roth R, Watkins P B, Albassam M, Liu B, Stancic S, Suter L, Bortolini M. Drug Saf., 2012, 35(12): 1099-1117
5 Robles M, Toscano E, Cotta J, Lucena M I, Andrade R J. Curr. Drug. Saf., 2010, 5(3): 212-222
6 Senousy B E, Belal S I, Draganov P V. Nat. Rev. Gastroenterol Hepatol., 2010, 7(10): 543-556
7 Agúndez J A, Lucena M I, Martínez C, Andrade R J, Blanca M, Ayuso P, García-Martín E. Expert. Opin. Drug. Metab. Toxicol., 2011, 7(7): 817-828
8 GAO Xu-Dong, FAN Yan-Hua. Zhonghua Gan Zang Bing Za Zhi., 2009, 17(6): 478-480
高旭东, 樊艳华. 中华肝脏病杂志, 2009, 17(6): 478-480
9 XU Xin, QU Cai-Qin. Medical Recapitulate. 2008, 14(5): 747-749
徐 鑫, 屈彩芹. 医学综述, 2008, 14(5): 747-749
10 SUO Qi-Rong. China clinical practical medicine, 2010, 4(5): 171-172
所齐嵘. 中国临床实用医学, 2010, 4(5): 171-172
11 Denk H. Verb. Diseh. Ges. Pathol., 2002, 86: 120-125
12 Meier Y, Cavallaro M, Roos M, Pauli-Magnus C, Folkers G, Meier P J, Fattinger K. Eur J Clin Pharmacol., 2005, 61: 135-143
13 GAO Xu-Cong, CHAI Zhen-Hai, ZHANG Zong-Peng. Chinese Journal of Pharmacology and Toxicology, 2012, 26 (5): 692-696
高绪聪, 柴振海, 张宗鹏. 中国药理学与毒理学杂志, 2012, 26 (5): 692-696
14 YANG Jiao, L Wen-Liang. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2012, 21(12): 1359-1363
杨 佼, 吕文良. 现代中西医结合杂志, 2012, 21(12): 1359-1363
15 Woodhead J L, Howell B A, Yang Y, Harrill A H, Clewell H J 3rd, Andersen M E, Siler S Q, Watkins P B. J. Pharmacol. Exp. Ther., 2012, 342(2): 529-540
16 Hawkins M T, Lewis J H. Expert. Opin. Drug. Metab. Toxicol., 2012, 8(12): 1521-1530
17 Nicholson J K, Everett J R, Lindon J C. Expert. Opin. Drug. Metab. Toxicol., 2012, 8(2): 135-139
18 Sreekumar A, Poisson L M, Rajendiran T M, Khan A P, Cao Q, Yu J, Laxman B, Mehra R, Lonigro R J, Li Y, Nyati M K, Ahsan A, Kalyana-Sundaram S, Han B, Cao X, Byun J, Omenn G S, Ghosh D, Pennathur S, Alexander D C, Berger A, Shuster J R, Wei J T, Varambally S, Beecher C, Chinnaiyan A M. Nature, 2009, 457(7231): 910-914
19 Nicholson J K, Connelly J, Lindon J C, Holmes E. Nat. Rev. Drug. Discov., 2002, 1(2): 153-161
20 Lakings D B, Waalkes T P, Borek E, Gehrke C W, Mrochek J E, Longmore J,Adamson R H. Cancer Res., 1977, 37(1): 285-292
21 QIN Huan-Long. Parenteral & EnteralNutrition, 2004, 11(4): 249-252
秦环龙. 肠外与肠内营养, 2004, 11(4): 249-252
22 WU Ying, ZHENG Jin-Hui, LI Jing, GAO Ru. Chinese Medical Research & Chinical., 2005, 3(1): 38-40
武 英, 郑锦辉, 李 晶, 高 茹. 中国医学研究与临床, 2005, 3(1): 38-40
23 JIANG Chao-Hui, LIU Xue-Lian. International Journal of Digestive Diseases., 1992, 12(2): 68-71
姜朝晖, 刘学廉. 国外医学消化系疾病分册, 1992, 12(2): 68-71
24 FENG Xiao-Ping, JIANG Ying, HUANG Mei-Ying. Amino acid & Biotic Resources., 1994, (1): 17-19
冯小平, 蒋 滢, 黄美英. 氨基酸杂志, 1994, (1): 17-19



摘 要 利用超高效液相色谱与四级杆-轨道阱高分辨质谱仪联用技术(UPLC-MS/MS)结合多变量统计分析方法,开展健康者与肿瘤药物、中药、他汀类降脂药、抗菌药引发肝损伤患者的血清代谢组学研究。血清样本采用冰乙腈沉淀蛋白,HSS T3-C18色谱柱,水(含0.01%甲酸)与乙腈为流动相梯度洗脱,液相色谱串联质谱分析测定。基于健康者与药物性肝损伤初诊病例代谢轮廓的正交偏最小二乘判别分析(OPLS-DA)以及偏最小二乘法判别分析(PLS-DA),寻找114个与药物性肝损伤早期诊断密切相关的氨基酸类生物标志物,其中有38个代谢物在两组间具有显著差异(p<0.001)。对各组分离贡献大的化合物进行串联质谱分析,经Human Metabolome Database(HMDB)等数据库检索, 进行质谱信息匹配, 鉴定出与药物性肝损伤相关的可能生物标志物苯丙氨酸和二甲基鸟苷。
关键词 超高效液相色谱-串联质谱; 药物性肝损伤; 血清; 代谢组学; 生物标志物
1 引 言
随着新药的广泛应用以及联合用药的增多,药物性肝损伤(Drug-induced liver injury,DILI)临床常见且发病率有逐年上升趋势[1~4]。药物性肝损伤是指治疗过程中使用治疗剂量的药物,机体受药物及其代谢产物产生的毒性作用引起受药机体肝脏损害,表现为肝细胞坏死、胆汁瘀积、脂肪肝、慢性肝炎、肝硬化等各种肝病。临床应用中各类药物都有肝损伤的相关报道,以抗菌药物、非甾体类抗炎药、抗结核药、抗肿瘤等药物为主,中草药与保健品的肝毒性发生率也有上升趋势[5~8]。药物性肝损伤是药物本身对肝脏的损害,也可能是机体对药物的特异质反应,原来没有肝病的人群或以往就有肝病的患者都可能发生不同程度的肝脏损害[9,10]。据统计,约40%肝炎和25%急性肝衰竭都是由药物引起的[11],药物性肝损伤在住院患者中的发病率为1%~5%,占急性肝损伤住院病例的10%[12]。因此,药物性肝损伤指标的早期发现对于有效降低治疗期间的用药风险、保障患者的用药安全至关重要。
目前,药物治疗过程中发生的肝损伤具有一定的隐匿性,易与基础疾病症状混淆,临床上缺乏用于药物性肝损伤早期发现的敏感性和特异性小分子标志物,仅根据丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、碱性磷酸酶(ALP)等传统指标, 联合病理组织学检查, 很难在肝损伤发生之前进行准确而及时的预警[13,14]。另外,现阶段药物性肝损伤的研究往往针对单一药物的机制探讨或回顾性分析,缺乏临床常用药物引发肝损伤的共性研究及共性判定指标,很难在相对独立的研究结果中真正建立各类药物肝损伤之间的联系,严重阻碍了药物性肝损伤的早期预警及防治[15,16]。代谢组学(Metabonomics)比单一靶标具有更好的预见性和可靠性,更有利于准确、有效地判定毒副作用程度,能够寻找用于早期发现药物性肝损伤的相关生物标志物,在疾病的早期发现、机制研究及药物安全性评价等方面发挥重要作用[17~19]。基于药物性肝损伤研究中的难点问题,本研究率先采用LC-MS/MS技术开展健康者及临床药物肝损伤初诊病例血清的代谢组学研究,探索内源性代谢物浓度变化与药物性肝损伤之间的相关性,以临床数据为基础探索药物性肝损伤相关的可能生物标志物。
2 实验部分
2.1 仪器与试剂
UltiMate 3000 UPLC 系统(美国Thermo Scientific公司),配有双三元液相色谱梯度泵系统(包含在线脱气单元)、柱温箱、DAD紫外检测器及Chromeleon色谱系统控制软件;Q EXACTIVE 四级杆-轨道阱高分辨质谱仪(美国Thermo Scientific公司),配有ESI源及Xcalibur数据系统;Waters ACQUITY UPLC HSS T3-C18色谱柱 (10 cm × 2.1 mm, 1.8 μm)。SAVANT SPD121 P SpeedVac离心浓缩仪(美国Thermo Scientific公司);Captiva 96 孔过滤板-0.2 μm(Agilent Technologies公司)。乙腈、甲醇和甲酸(色谱纯,德国Merck公司),实验用纯净水(杭州娃哈哈集团有限公司)。
2.2 样品收集和制备
以临床病历诊断及肝脏状态相关的酶学指标为依据,严格执行入组标准与排除标准,收集了21例健康者与24例药物性肝损伤(6例抗肿瘤药物、4例中药、13例降脂药及1例抗菌药物)初诊患者的血清样本(见表1),具体信息详见附录1。取100 μL血清,加入300 μL冰乙腈沉淀蛋白,涡旋4 min,于4℃下10000 r/min离心10 min ,取上清液200 μL,置于离心浓缩仪,在36℃条件下,干燥60~90 min。以200 μL 2%乙腈复溶,经0.2 μm Captiva 96 孔过滤板过滤,待UPLC-MS分析。
2.3 色谱-质谱条件及样品分析
色谱条件:A超纯水(含0.01%甲酸),B乙腈;梯度洗脱:0~9 min,2%~60% B; 9~18 min,60% B;18~20 min,60%~100% B。柱温:50℃;流速:0.25 mL/min,进样量5 μL。
质谱条件: 全扫描; 离子化方式: 加热ESI源HESI; 喷雾电压: 3500V(+)/3300(-); 鞘气: 4.46 MPa(+)/0.68 MPa(-); 辅助气: 1.02 MPa(+)/无(-); 离子传输管温度: 320℃。
质量扫描范围为m/z 100~1000,分辨率70000 FWHM,使用气体均为氮气,数据采集软件使用Xcalibur数据系统。被测样品通过正、负离子模式的UPLC-MS谱分析后,利用信息依赖的数据采集(Information dependent acquisition, IDA)功能,获得相关代谢物的MS/MS谱。碰撞能量(CE)设定为30 eV或 10 eV。正离子模式选用背景离子邻苯二甲酸酯类物质的相关离子(m/z 149.0233, 279.1591, 391.2843)进行自动校正。
本研究将健康者血清样本进行混合制得质控样本(Quality control,QC),通过连续6针进样平衡系统,保证系统的适应性。另外,QC作为实际样本插入检测序列中,以QC数据的PCA得分图监测方法的稳定性。
2.4 数据处理
对上述健康者与药物性肝损伤血清样本进行UPLC-(±)ESIMS分析,通过R命令的数据转换方法,删除若干同位素离子与加合离子,完成峰识别、峰对齐、峰匹配和峰强度校正,最终获得包括保留时间、质荷比与峰面积的二维数据阵。再将转化获得数据阵导入SIMCA-P软件 (version 13.0, Umetrics AB, Ume, Sweden)进行数据处理,建立模式识别模型并提取差异变量,获得对分组有贡献的变量。通过高分辨MS谱、MS/MS谱、网上数据库检索以及代谢物的质谱裂解规律对差异代谢物即可能生物标志物的结构进行鉴定。数据库主要包括:human metabolite database (http://hmdb.ca/);PubChem compound database (http://www.ncbi.nlm.nih.gov);METLIN (http://metlin.scripps.edu/);KEGG(http://www.genome.jp/kegg/ligand.html)。
3 结果与讨论
3.1 健康者与药物性肝损伤临床患者的病例信息与酶学指标
采用SPSS16.0统计软件的单因素方差分析方法对组间生化结果进行比较。药物性肝损伤患者血清的丙氨酸氨基转移酶(ALT)和天门冬氨酸氨基转移酶(AST)均有异常升高,其中中药、他汀类降脂药相关肝损伤的血清ALT与AST显著增加(p<0.01),抗肿瘤药的血清ALT有明显增加(p<0.05), 一例抗菌药相关肝损伤AST与ALT显著增加,超过3倍正常值上限。
3.2 药物性肝损伤的血清代谢组学研究
3.2.1 血清代谢轮廓分析 采用UPLC-MS/MS方法对24例药物性肝损伤(6例抗肿瘤药物、4例中药、13例降脂药及1例抗菌药物)血清样本进行样本的分离与数据采集。在正、负离子检测模式下,健康者与药物性肝损伤患者的总离子流色谱图(TIC,total ion chromatography)见图1,两组具有明显差异,并且从正、负离子检测模式下的同一样本TIC图可以初步看出两种离子检测模式的互补性,生物样本中众多代谢物得到了很好的分离,保留时间在27 min以内。本方法适合于代谢组学对于代谢物全面性、完整性的要求,满足大样本检测分析的要求。
3.2.2 潜在生物标志物的鉴定 对数据进行正交偏最小二乘判别分析(Orthogonal partial least squares-discriminant analysis, OPLS-DA)分析,并使用偏最小二乘法判别分析(Partial least squares-discriminant analysis, PLS-DA)模型进行置换验证(Permutation test),从而避免相应模式的过度拟合,确保数据模型模型的可靠性。正离子检测模式下血清样本的OPLS-DA结果见图2A,交叉验证显示预测能力Q2Y=0.706,46%的变量 [R2(X)] 可用于解释79.5%的组间差异[R2(Y)]。负离子检测模式下血清样本的OPLS-DA结果见图2B,Q2Y=0.83,45.8%的变量 [R2(X)] 可用于解释88%的组间差异[R2(Y)]。置换验证结果中R2Y(绿色三角)与真实模型的R2Y值共同构成的回归线截距分别为0.186,经100次建模获得的Q2Y(蓝色方块)与真实模型的Q2Y值共同构成的回归线截距≤ 0.05,如图3所示。以上结果表明, 在正、负离子检测模式下,血清样本的多变量数据模型符合参数标准,可有效、可靠地应用于可能生物标志物的筛选。
结合OPLS-DA模型中变量的VIP值,S-plot 载荷图,带Jack-knifed 置信区间的载荷图和原始变量轮廓图,对差异变量进行筛选和可靠性验证,并通过均值t-检验删除两组间没有显著性差异(p>0.05)的变量。本研究共寻找114个与药物性肝损伤早期诊断密切相关的生物标志物,其中有38种代谢物在两组间具有显著差异(p<0.001)。通过高分辨MS、MS/MS谱分析、网上数据库检索结合代谢物结构的质谱裂解特征,推断可能生物标志物的结构,详见附录2,已鉴定出两个可能生物标志物的结构,包括苯丙氨酸和二甲基鸟苷,如表2所示。
3.3 可能生物标志物的生物学意义
二甲基鸟苷是RNA的降解产物,有研究发现, 实验动物猴的肝癌模型尿液中二甲基鸟苷浓度增加是tRNA甲基转移酶活性与能力高度表达的结果[20],但尚未有研究发现二甲基鸟苷与药物性肝损伤之间的关联。另外,肝脏是芳香族氨基酸的主要代谢场所,肝脏的氨基酸代谢减弱、肝细胞坏死及蛋白质分解加强会导致氨基酸在肝细胞中的浓度增高[21~24]。本研究中二甲基鸟苷与苯丙氨酸在药物性肝损伤患者血清中的浓度异常增高,提示其可能为药物性肝损伤相关的可能生物标志物,并且氨基酸与核苷代谢通路可能是药物性肝损伤的重要代谢途径。
4 结 论
本研究运用正、负离子检测模式的UPLC-MS/MS 技术结合多变量统计分析方法进行了临床药物性肝损伤患者血清的代谢组学研究,已鉴定出两个在肝损伤初诊患者与健康人血清中存在显著性差异的可能生物标志物结构,分别为苯丙氨酸和二甲基鸟苷。今后的研究将继续对可能生物标志物的结构进行鉴定,并深入阐述其生物学意义,为药物性肝损伤的早期发现提供依据。
References
1 Rangnekar A S, Fontana R J. Minerva Gastroenterol. Dietol., 2011, 57(2): 213-229
2 Matsumoto K. Rinsho Byori., 2011, 59(12): 1117-1122
3 Suk K T, Kim D J. Clin. Mol. Hepatol., 2012, 18(3): 249-257
4 Corsini A, Ganey P, Ju C, Kaplowitz N, Pessayre D, Roth R, Watkins P B, Albassam M, Liu B, Stancic S, Suter L, Bortolini M. Drug Saf., 2012, 35(12): 1099-1117
5 Robles M, Toscano E, Cotta J, Lucena M I, Andrade R J. Curr. Drug. Saf., 2010, 5(3): 212-222
6 Senousy B E, Belal S I, Draganov P V. Nat. Rev. Gastroenterol Hepatol., 2010, 7(10): 543-556
7 Agúndez J A, Lucena M I, Martínez C, Andrade R J, Blanca M, Ayuso P, García-Martín E. Expert. Opin. Drug. Metab. Toxicol., 2011, 7(7): 817-828
8 GAO Xu-Dong, FAN Yan-Hua. Zhonghua Gan Zang Bing Za Zhi., 2009, 17(6): 478-480
高旭东, 樊艳华. 中华肝脏病杂志, 2009, 17(6): 478-480
9 XU Xin, QU Cai-Qin. Medical Recapitulate. 2008, 14(5): 747-749
徐 鑫, 屈彩芹. 医学综述, 2008, 14(5): 747-749
10 SUO Qi-Rong. China clinical practical medicine, 2010, 4(5): 171-172
所齐嵘. 中国临床实用医学, 2010, 4(5): 171-172
11 Denk H. Verb. Diseh. Ges. Pathol., 2002, 86: 120-125
12 Meier Y, Cavallaro M, Roos M, Pauli-Magnus C, Folkers G, Meier P J, Fattinger K. Eur J Clin Pharmacol., 2005, 61: 135-143
13 GAO Xu-Cong, CHAI Zhen-Hai, ZHANG Zong-Peng. Chinese Journal of Pharmacology and Toxicology, 2012, 26 (5): 692-696
高绪聪, 柴振海, 张宗鹏. 中国药理学与毒理学杂志, 2012, 26 (5): 692-696
14 YANG Jiao, L Wen-Liang. Modern Journal of Integrated Traditional Chinese and Western Medicine, 2012, 21(12): 1359-1363
杨 佼, 吕文良. 现代中西医结合杂志, 2012, 21(12): 1359-1363
15 Woodhead J L, Howell B A, Yang Y, Harrill A H, Clewell H J 3rd, Andersen M E, Siler S Q, Watkins P B. J. Pharmacol. Exp. Ther., 2012, 342(2): 529-540
16 Hawkins M T, Lewis J H. Expert. Opin. Drug. Metab. Toxicol., 2012, 8(12): 1521-1530
17 Nicholson J K, Everett J R, Lindon J C. Expert. Opin. Drug. Metab. Toxicol., 2012, 8(2): 135-139
18 Sreekumar A, Poisson L M, Rajendiran T M, Khan A P, Cao Q, Yu J, Laxman B, Mehra R, Lonigro R J, Li Y, Nyati M K, Ahsan A, Kalyana-Sundaram S, Han B, Cao X, Byun J, Omenn G S, Ghosh D, Pennathur S, Alexander D C, Berger A, Shuster J R, Wei J T, Varambally S, Beecher C, Chinnaiyan A M. Nature, 2009, 457(7231): 910-914
19 Nicholson J K, Connelly J, Lindon J C, Holmes E. Nat. Rev. Drug. Discov., 2002, 1(2): 153-161
20 Lakings D B, Waalkes T P, Borek E, Gehrke C W, Mrochek J E, Longmore J,Adamson R H. Cancer Res., 1977, 37(1): 285-292
21 QIN Huan-Long. Parenteral & EnteralNutrition, 2004, 11(4): 249-252
秦环龙. 肠外与肠内营养, 2004, 11(4): 249-252
22 WU Ying, ZHENG Jin-Hui, LI Jing, GAO Ru. Chinese Medical Research & Chinical., 2005, 3(1): 38-40
武 英, 郑锦辉, 李 晶, 高 茹. 中国医学研究与临床, 2005, 3(1): 38-40
23 JIANG Chao-Hui, LIU Xue-Lian. International Journal of Digestive Diseases., 1992, 12(2): 68-71
姜朝晖, 刘学廉. 国外医学消化系疾病分册, 1992, 12(2): 68-71
24 FENG Xiao-Ping, JIANG Ying, HUANG Mei-Ying. Amino acid & Biotic Resources., 1994, (1): 17-19
冯小平, 蒋 滢, 黄美英. 氨基酸杂志, 1994, (1): 17-19

