涡旋辅助—液液萃取—气相色谱法测定土壤中水和甲醇可提态五氯酚
于雄胜 柳勇 楼骏 冯小莉 汪海珍 徐建明
摘 要 建立了涡旋辅助-液液萃取-气相色谱测定土壤中水和甲醇可提态五氯酚(Pentachlorophenol,PCP)的方法。对涡旋转速、液液体积比等参数进行了优化,即涡旋转速为2000 r/min时PCP回收率最高,可达97.4%,重复性较好,相对标准偏差(RSD)为0.5%;衍生化溶液与正己烷的体积比为10∶4时PCP回收率为103%,RSD为0.7%。PCP提取测定的标准曲线线性范围为1.25~4000 μg/L(R2=0.9999),方法检出限在0.02 μg/L以下,测量范围较宽,适合于痕量及微量PCP的分析。与传统液液萃取和固相萃取相比,本方法采用涡旋辅助萃取后有机溶剂消耗量最低、操作步骤最少,且测定的PCP回收率最高,可达96.8%。4种不同类型土壤经水提取一次和甲醇提取3次,在1和10 mg/kg PCP污染条件下,总回收率分别为89.5%~98.9%和88.7%~98.4%,说明本方法满足了不同类型土壤中水和甲醇可提态PCP在不同浓度范围内的提取测定要求。
关键词 五氯酚; 涡旋辅助; 液液萃取; 水提态; 甲醇可提态; 土壤
1 引 言
五氯酚(Pentachlorophenol,PCP)及其钠盐最初被用作杀菌剂、除草剂、除虫剂以及木材防腐剂,在世界范围内广泛使用。在我国,PCP还被长期用于消灭稻田内寄生血吸虫的宿主钉螺[1]。PCP化学性质相对稳定,且对生物体具有广谱毒性和致突变性,被列为环境优先监测的持久性有机污染物之一[2]。虽然包括我国在内的多个国家已禁止或限制使用PCP,但在某些血吸虫回升地区继续采用PCP除杀钉螺的现象仍然存在。如今,在水体以及土壤环境中还能检测出微量或痕量PCP,对农业和自然生态系统以及人类健康构成威胁[3]。
在对PCP分析检测时,样品的前期准备(包括净化和浓缩)至关重要[4]。溶液中PCP的传统提取方法包括液液萃取(LLE)[5]、固相萃取(SPE)[6,7]等。然而,LLE、SPE等方法需要耗费大量有机溶剂和样品,需经过浓缩后测定,整个操作程序复杂繁琐;尤其是SPE方法在分析费用上昂贵,目标物也可能被吸附到柱子上,体系复杂时还容易堵塞柱子。近年,提取净化方法趋向于向节省样本、减少试剂消耗、降低环境污染、提高灵敏度、减少人工量的方向发展,由此建立了固相微萃取[8]、液相微萃取[9]以及由此衍生出的各种方法等。然而,微萃取也有一定弊端,如需使用一些特殊的装置、试剂量太少,导致水分难以去除而对仪器有损害等。本研究借用微萃取思路对LLE方法进行优化,减少有机溶剂用量、保证脱水所需样品用量,使之具有更广谱的适用性。对于PCP的测定,常用的方法有气相色谱-电子捕获检测器法 [10,11]、高效液相色谱-紫外检测法[12]、气相色谱-串联质谱法[8]、高效液相色谱-串联质谱法[6]等。PCP经衍生化后在气相色谱的电子捕获检测器(ECD)上的灵敏度要高于液相色谱的紫外检测器,又具有普遍性,常用于痕量PCP的分析。
本研究对溶液中PCP的萃取条件进行了优化,基于涡旋辅助-液液萃取-气相色谱法测定了土壤中水和甲醇可提态PCP,其中水提态PCP是污染土壤中生物有效性和毒性最高的部分,易随淋溶作用进入地下水、河流等,造成水体污染[13,14];甲醇可提取态代表易被有机质等土壤组分吸附并固定的PCP[15],二者同时测定更能全面反映其环境学意义。本方法减少了有机溶剂的用量,且有低的检出限(LOD),为不同类型土壤中水和甲醇可提态PCP的准确测定提供了方法选择的依据。
2 实验部分
2.1 仪器与试剂
GC6890N气相色谱仪(美国Agilent Technologies公司),配有ECD检测器、7683B series自动进样器、HP-5(30.0 m×320 μm, 0.25 μm)色谱柱等;MixMate涡旋仪(美国Eppendorf公司);SK8210HP超声波清洗仪(上海科导超声仪器有限公司);Mill-Q超纯水仪(法国Millipore公司);-9210K旋转摇床(太仓市华利达实验设备有限公司);Multifuge 3S离心机(德国Heraeus公司)。
五氯酚(98%,美国Sigma公司);正己烷和甲醇(色谱纯,西班牙Scharlab公司);丙酮(色谱纯,Tida公司);乙酸酐、K2CO3、H2SO4和无水Na2SO4(分析纯,国药集团)。
2.2 供试土壤
选取4种性质差异较大的土壤为研究对象,分别为浙江水稻土、江西红壤、黑龙江黑土以及河南潮土。土壤均采自0~20 cm表土层,风干,过2 mm筛,基本理化性质见表1。将以上4种土壤分别制备成1和10 mg/kg PCP污染土壤,即称取4种土壤每种20 g各两份于60 mL玻璃离心管中;吸取20和200 mg/L PCP的丙酮溶液各1 mL,分5次小心加入到装有同种土壤的上述两份离心管中,分别混合均匀,将离心管置于通风橱中将丙酮挥发完全,即成为PCP浓度为1和10 mg/kg 的污染土壤;不同土壤的制备过程相同。
2.3 实验方法
2.3.1 标准曲线 配制100和2000 μg/L的PCP-K2CO3标准溶液,分别吸取100 μg/L的标准溶液0.05、0.1、0.2、0.5、1.0、2.0、4.0和8.0 mL,2000 μg/L的标准溶液1.0、2.0、4.0和8.0 mL, 于10.0 mL介质中,用0.5 mL乙酸酐衍生化后,加入4 mL正己烷萃取衍生化产物乙酸五氯苯酯,吸取部分有机相后,用无水Na2SO4干燥脱水并通过0.22 μm有机相滤膜,得浓度为1.25, 2.5, 5.0, 12.5, 25, 50, 100, 200, 500, 1000, 2000和4000 μg/L的系列标准溶液。
2.3.2 土壤中水提态PCP的萃取测定 取PCP污染土壤2 g于 50 mL离心管中,加入超纯水10 mL,于25℃下250 r/min振荡60 min后,4000 r/min离心20 min,取上清液过0.45 μm有机相滤膜,按以下步骤测定水提态PCP:(1)纯化 准确吸取6 mL待测液于30 mL玻璃离心管中,加入0.5 mL 9 mol/L H2SO4充分酸化,使PCP全部以分子态存在(pH<4),再用6 mL正己烷涡旋振荡2 min,使PCP进入有机相,2500 r/min离心3 min后,吸除下层水相,上层正己烷相分别用0.2 mol/L K2CO3分两次反萃,使PCP进入K2CO3溶液中,合并两次反萃溶液。(2)衍生化 在收集反萃液中,加入0.5 mL乙酸酐,摇动玻璃离心管,释放气泡,25℃下200 r/min振荡20 min,使PCP衍化生成乙酸五氯苯酯。(3)涡旋辅助萃取 衍生化后的溶液按优化后的萃取条件加入适量正己烷进行涡旋辅助萃取,以一定涡旋转速萃取2 min。(4)脱水测定 2500 r/min离心3 min后,吸取上层有机相,用1 g无水Na2SO4干燥脱水,并过0.22 μm有机相滤膜后进行测定。
2.3.3 土壤中甲醇可提态PCP的萃取测定 取2.3.2节中水提取后的土壤,倒尽上清液后,用9 mol/L H2SO4调至pH<4,加入10 mL甲醇进行超声提取(25℃,54 kHz,30 min),然后3000 r/min离心10 min,收集上清液。用相同的方法继续提取两次,收集各自提取液于30 mL离心管中,用氮气吹干至约0.5 mL,再加入0.2 mol/L K2CO3溶液10 mL, 乙酸酐0.5 mL振荡发生衍生化反应,最后按2.3.2节步骤(3)、(4)操作。
2.4 色谱条件
载气为氮气,流速2.0 mL/min。升温程序:柱初始温度80℃,保持1 min,以30℃/min升温到220℃,继续以5℃/min升温到230℃,保持3 min,最后以30℃/min升温到250℃,保持1 min; 进样口温度为250℃,ECD温度为300℃。不分流进样,进样量1 μL,外标法定量[11]。每个样品分析时间为11.8 min。
2.5 实验数据分析
采用Origin 8.0和Microsoft Office Excel 2013软件进行图表编辑。图表中,PCP回收率数据表示为算数平均值±标准差。采用IBM SPSS Statistics 20软件进行数理统计分析。单因素方差分析采用LSD法;所有统计检验均以α=0.05为显著水准,采用小写字母标注显著性。
3 结果与讨论
3.1 溶液中PCP的萃取条件优化
3.1.1 涡旋时间和转速的影响
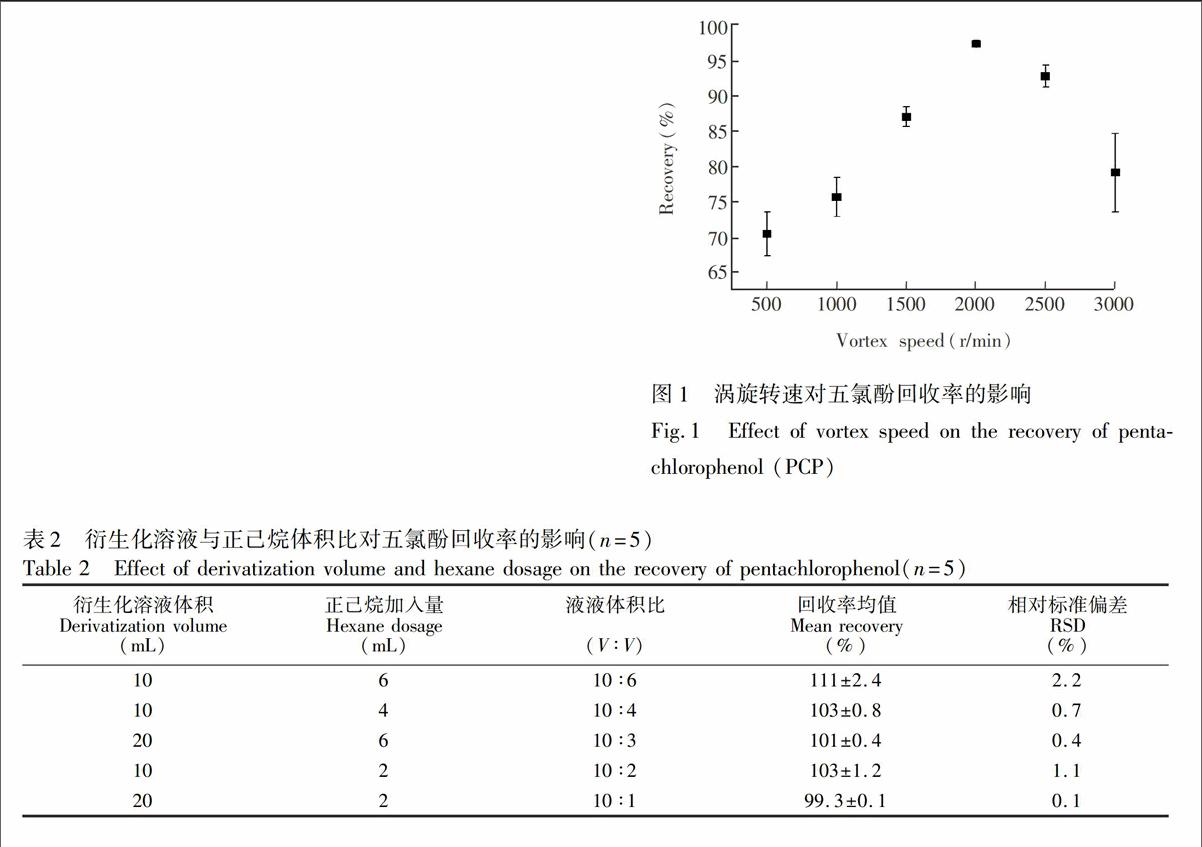
先比较了涡旋时间对回收率的影响,发现在1~5 min范围内回收率没有显著差异,与文献[4]的研究结果一致。为便于操作,所有涡旋时间都设定为2 min。之后考察了涡旋转速(500、1000、1500、2000、2500和3000 r/min)对萃取率的影响。实验表明,随着涡旋转速的增大,回收率升高,重复性变好,500和2000 r/min时回收率分别为70.5%和97.4%,相对标准偏差(RSD)分别为3.1%和0.5%;涡旋转速大于2500 r/min后,回收率降低,重复性也变差,3000 r/min时回收率为79.2%,RSD为5.6%(图1)。
究其原因,涡旋转速达到3000 r/min时,溶液急剧旋转,大量溶液溅到离心管盖上,引起回收率降低;而转速太低时,两种液相不能充分混合,也导致回收率偏低。本研究选择2000 r/min。
3.1.2 液液体积比的影响 研究了衍生化溶液与正己烷体积比(10∶6、10∶4、10∶3、10∶2、10∶1),对衍生化溶液萃取效率及稳定性的影响。由表2可知,各萃取比下回收率在99.3%~111%之间,RSD在0.1%~2.2%之间,萃取的稳定性随着体积比的增大呈现出变差的趋势。综合而言,衍生化溶液-正己烷=10∶4(V∶V)时萃取测定的PCP回收率较高(103%),重复性较好(RSD为0.7%),且便于操作。
[
3.2 标准曲线
在1.25~200 μg/L、200~4000 μg/L以及1.25~4000 μg/L范围内,待测液中PCP浓度(CPCP,μg/L)与色谱峰积分面积(A)有很好的线性关系,具有较宽的线性范围。其回归方程分别为: A=9.9665CPCP + 22.879(R2=0.9998); A=9.9627CPCP-113.92(R2=0.9999);A=9.5857CPCP-1.7667(R2=0.9999)。方法的LOD以信噪比3倍计为0.02 μg/L。说明方法灵敏度高,适合于痕量及微量PCP的分析。
3.3 土壤中PCP的提取测定
3.3.1 反萃取回收率的验证
He等[16]研究表明,红壤有机质含量一般较低,在不同类型土壤中对PCP的吸附容量较小。因此,选取江西红壤为测试土壤,制备干净红壤提取液并加标至100 μg/L,萃取
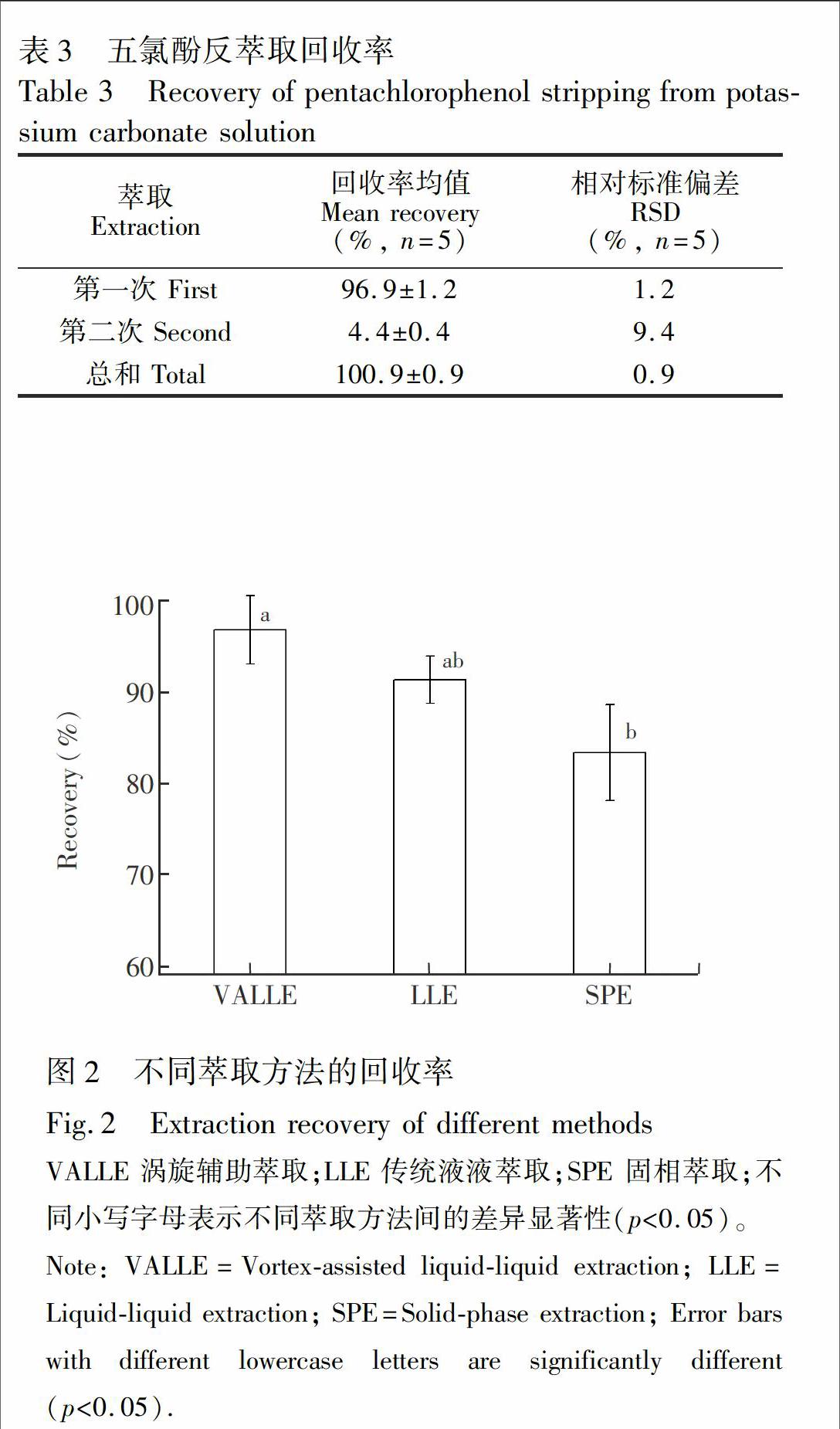
后的有机相用10和6 mL K2CO3溶液分两次反萃取,验证纯化步骤中PCP的反萃取回收率。结果表明,第一次回收率为96.9%,RSD为1.2%;第二次回收率为4.4%,RSD为9.4%;两次总回收率为100.9%,且有好的重复性(RSD为0.9%),可见两次足以将PCP反萃取完全(表3)。
3.3.2 涡旋辅助萃取回收率的验证 同3.3.1节制备干净红壤提取液并加标到100 μg/L,验证涡旋辅助萃取(VALLE)步骤中PCP的回收率,并与LLE、SPE方法比较。LLE方法参照环保部591-2010标准[5],回收率为91.4%,RSD为2.6%;SPE方法参照文献[6],回收率为83.3%,RSD为5.2%; VALLE方法回收率达96.8%,RSD为3.8%(图2)。相比于LLE、SPE方法,
VALLE方法有机溶剂消耗量最低、操作步骤最少,且回收率最高。尤其是,涡旋辅助可以缩短提取时间[17],并减小处理间人为操作的不稳定性。
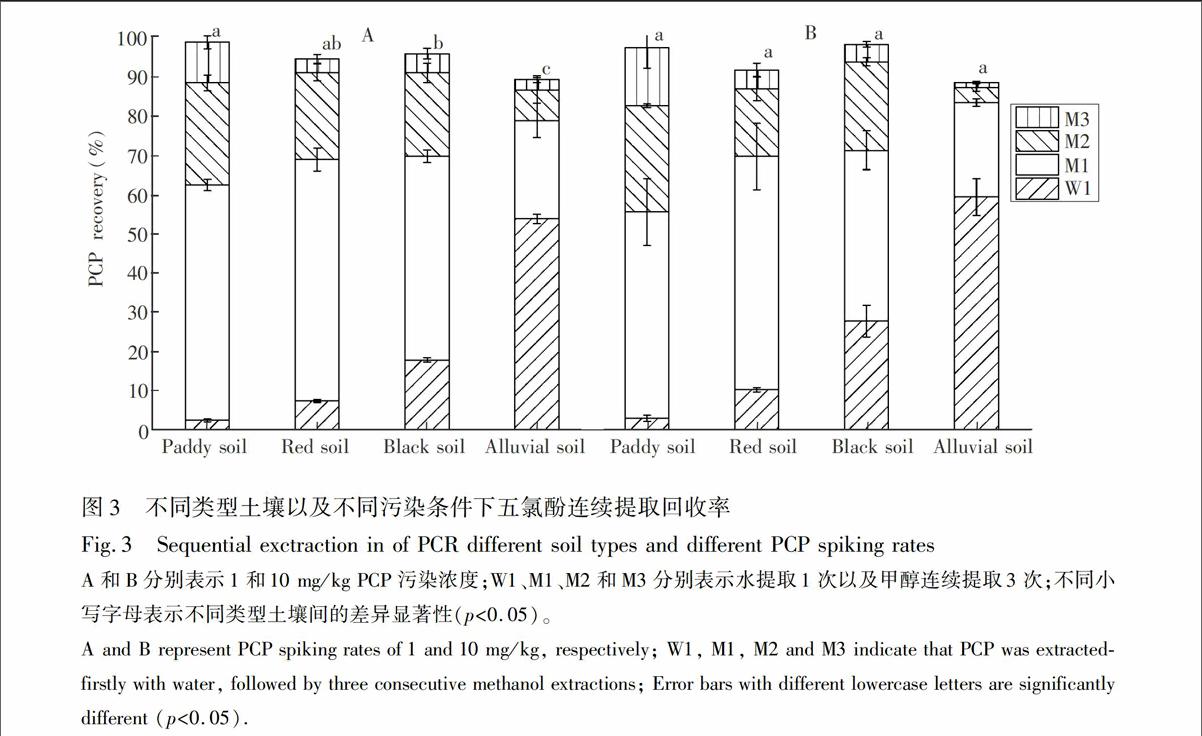
3.3.3 水和甲醇可提态PCP的提取测定 采取水和甲醇连续提取的方法,结合之前摸索出的最佳提取条件,在不同类型土壤(水稻土、红壤、黑土、潮土)以及不同污染条件(1, 10 mg/kg)下验证涡旋辅助-液液萃取-气相色谱法在PCP测定中的可靠性。由图3可见,4种土壤在1 mg/kg PCP污染条件下总回收率为89.5%~98.9%,10 mg/kg PCP污染条件下总回收率为88.7%~98.4%;1 mg/kg PCP污染土壤回收率重复性优于10 mg/kg PCP污染土壤。不同类型土壤总的回收率在1 mg/kg PCP污染条件下有显著差异(P<0.05),而10 mg/kg PCP污染条件下无显著差异;不同污染条件下水稻土和黑土的总回收率最高,潮土最低,但总回收率均符合要求,说明用水提取1次以及甲醇提取3次可将PCP提取完全。不同类型土壤中PCP的水提取比例有显著差异(P<0.05),水提取比例呈现出从水稻土到潮土逐渐升高的趋势。这主要是因为,PCP在水中的溶解度受pH值影响较大[18],随着土壤pH值的升高,水提取比例也逐渐上升;粒径含量大小也会影响土壤对PCP的吸附,其中较高的粘粒含量下土壤对PCP吸附作用增强[19],导致水提取态比例呈降低趋势(潮土除外),这与文献[10]的研究结果一致。
实验结果表明,涡旋辅助-液液萃取-气相色谱法满足了不同类型土壤中不同形态PCP在不同浓度范围内的提取测定,为水和甲醇可提态PCP的准确测定提供了方法选择的依据。
References
1 Liu Y, Li F B, Xia W, Xu J M, Yu X S. Chemosphere, 2013, 91(11): 1547-1555
2 Zheng W W, Wang X, Yu H, Tao X G, Zhou Y, Qu W D. Environ. Sci. Technol., 2011, 45(11): 4668-4675
3 Zheng W W, Yu H, Wang X, Qu W D. Environ. Int., 2012, 42(SI): 105-116
4 Farhadi K, Farajzadeh M A, Matin A A, Hashemi P. Cent. Eur. J. Chem., 2009, 7(3): 369-374
5 Water Quality-determination of Pentachlorophenol by Gas Chromatography. National Standards for Environmental Protection of the People′s Republic of China. 591-2010
水质五氯酚的测定气相色谱法. 中华人民共和国国家环境保护标准. 591-2010
6 YANG Qiu-Hong, CHENG Xiao-Yan, YANG Ping, QIAN Shu, DAN De-Zhong. Chinese J. Anal. Chem., 2011, 39(8): 1208-1212
杨秋红, 程小艳, 杨 坪, 钱 蜀, 但德忠. 分析化学, 2011, 39(8): 1208-1212
7 ZHOU Rui-Juan, DUAN Lian, SUN Xiao-Jie, WU Cai-Ying, XING Jun. Chem. J. Chinese Universities, 2010, 31(10): 1945-1948
周瑞娟, 段 炼, 孙晓杰, 吴采樱, 邢 钧. 高等学校化学学报, 2010, 31(10): 1945-1948
8 Morales R, Ortiz M C, Sarabia L A. Anal. Bioanal. Chem., 2012, 403(4): 1095-1107
9 Li X Y, Xue A F, Chen H, Li S Q. J. Chromatogr. A, 2013, 1280: 9-15
10 SUN Lei, JIANG Xin, ZHOU Jian-Min, WANG Dai-Zhang, KONG De-Yang, TAO Run-Xian. Chinese J. Anal. Chem., 2003, 31(6): 716-719
孙 磊, 蒋 新, 周健民, 王代长, 孔德洋, 陶润先. 分析化学, 2003, 31(6): 716-719
11 Hayat T, Ding N, Ma B, He Y, Shi J C, Xu J M. J. Environ. Qual., 2011, 40(6): 1722-1729
12 He Y, Xu J M, Wang H Z, Wu Y P. Environ. Pollut., 2007, 147(2): 343-349
13 Subramanian B, Namboodiri V, Khodadoust A P, Dionysiou D D. J. Hazard. Mater., 2010, 174(1-3): 263-269
14 ZHU Xiao-Ping, LI Xiao-Min, Li Yong-Tao, LIN Zhong, CAI Yan-Fei, DONG Jun. J. Agro-Environ.Sci., 2011, (11): 2218-2224
朱小平, 李晓敏, 李永涛, 蔺 中, 蔡燕飞, 董 军. 农业环境科学学报, 2011, (11): 2218-2224
15 Xu T, Lou L P, Luo L, Cao R K, Duan D C, Chen Y X. Sci. Total Environ., 2012, 414: 727-731
16 He Y, Xu J M, Wang H Z, Zhang Q C, Muhammad A. Chemosphere, 2006, 65(3): 497-505
17 LENG Geng, LU Gui-Bin, CHEN Yong, YIN Hui, DAN De-Zhong. Chinese J. Anal. Chem., 2012, 40(11): 1752-1757
冷 庚, 吕桂宾, 陈 勇, 尹 辉, 但德忠. 分析化学, 2012, 40(11): 1752-1757
18 Xing L Q, Liu H L, Giesy J P, Yu H X. Sci. Total Environ., 2012, 441: 125-131
19 He Y, Xu J M, Wang H Z, Ma Z H, Chen J Q. Environ. Res., 2006, 101(3): 362-372



摘 要 建立了涡旋辅助-液液萃取-气相色谱测定土壤中水和甲醇可提态五氯酚(Pentachlorophenol,PCP)的方法。对涡旋转速、液液体积比等参数进行了优化,即涡旋转速为2000 r/min时PCP回收率最高,可达97.4%,重复性较好,相对标准偏差(RSD)为0.5%;衍生化溶液与正己烷的体积比为10∶4时PCP回收率为103%,RSD为0.7%。PCP提取测定的标准曲线线性范围为1.25~4000 μg/L(R2=0.9999),方法检出限在0.02 μg/L以下,测量范围较宽,适合于痕量及微量PCP的分析。与传统液液萃取和固相萃取相比,本方法采用涡旋辅助萃取后有机溶剂消耗量最低、操作步骤最少,且测定的PCP回收率最高,可达96.8%。4种不同类型土壤经水提取一次和甲醇提取3次,在1和10 mg/kg PCP污染条件下,总回收率分别为89.5%~98.9%和88.7%~98.4%,说明本方法满足了不同类型土壤中水和甲醇可提态PCP在不同浓度范围内的提取测定要求。
关键词 五氯酚; 涡旋辅助; 液液萃取; 水提态; 甲醇可提态; 土壤
1 引 言
五氯酚(Pentachlorophenol,PCP)及其钠盐最初被用作杀菌剂、除草剂、除虫剂以及木材防腐剂,在世界范围内广泛使用。在我国,PCP还被长期用于消灭稻田内寄生血吸虫的宿主钉螺[1]。PCP化学性质相对稳定,且对生物体具有广谱毒性和致突变性,被列为环境优先监测的持久性有机污染物之一[2]。虽然包括我国在内的多个国家已禁止或限制使用PCP,但在某些血吸虫回升地区继续采用PCP除杀钉螺的现象仍然存在。如今,在水体以及土壤环境中还能检测出微量或痕量PCP,对农业和自然生态系统以及人类健康构成威胁[3]。
在对PCP分析检测时,样品的前期准备(包括净化和浓缩)至关重要[4]。溶液中PCP的传统提取方法包括液液萃取(LLE)[5]、固相萃取(SPE)[6,7]等。然而,LLE、SPE等方法需要耗费大量有机溶剂和样品,需经过浓缩后测定,整个操作程序复杂繁琐;尤其是SPE方法在分析费用上昂贵,目标物也可能被吸附到柱子上,体系复杂时还容易堵塞柱子。近年,提取净化方法趋向于向节省样本、减少试剂消耗、降低环境污染、提高灵敏度、减少人工量的方向发展,由此建立了固相微萃取[8]、液相微萃取[9]以及由此衍生出的各种方法等。然而,微萃取也有一定弊端,如需使用一些特殊的装置、试剂量太少,导致水分难以去除而对仪器有损害等。本研究借用微萃取思路对LLE方法进行优化,减少有机溶剂用量、保证脱水所需样品用量,使之具有更广谱的适用性。对于PCP的测定,常用的方法有气相色谱-电子捕获检测器法 [10,11]、高效液相色谱-紫外检测法[12]、气相色谱-串联质谱法[8]、高效液相色谱-串联质谱法[6]等。PCP经衍生化后在气相色谱的电子捕获检测器(ECD)上的灵敏度要高于液相色谱的紫外检测器,又具有普遍性,常用于痕量PCP的分析。
本研究对溶液中PCP的萃取条件进行了优化,基于涡旋辅助-液液萃取-气相色谱法测定了土壤中水和甲醇可提态PCP,其中水提态PCP是污染土壤中生物有效性和毒性最高的部分,易随淋溶作用进入地下水、河流等,造成水体污染[13,14];甲醇可提取态代表易被有机质等土壤组分吸附并固定的PCP[15],二者同时测定更能全面反映其环境学意义。本方法减少了有机溶剂的用量,且有低的检出限(LOD),为不同类型土壤中水和甲醇可提态PCP的准确测定提供了方法选择的依据。
2 实验部分
2.1 仪器与试剂
GC6890N气相色谱仪(美国Agilent Technologies公司),配有ECD检测器、7683B series自动进样器、HP-5(30.0 m×320 μm, 0.25 μm)色谱柱等;MixMate涡旋仪(美国Eppendorf公司);SK8210HP超声波清洗仪(上海科导超声仪器有限公司);Mill-Q超纯水仪(法国Millipore公司);-9210K旋转摇床(太仓市华利达实验设备有限公司);Multifuge 3S离心机(德国Heraeus公司)。
五氯酚(98%,美国Sigma公司);正己烷和甲醇(色谱纯,西班牙Scharlab公司);丙酮(色谱纯,Tida公司);乙酸酐、K2CO3、H2SO4和无水Na2SO4(分析纯,国药集团)。
2.2 供试土壤
选取4种性质差异较大的土壤为研究对象,分别为浙江水稻土、江西红壤、黑龙江黑土以及河南潮土。土壤均采自0~20 cm表土层,风干,过2 mm筛,基本理化性质见表1。将以上4种土壤分别制备成1和10 mg/kg PCP污染土壤,即称取4种土壤每种20 g各两份于60 mL玻璃离心管中;吸取20和200 mg/L PCP的丙酮溶液各1 mL,分5次小心加入到装有同种土壤的上述两份离心管中,分别混合均匀,将离心管置于通风橱中将丙酮挥发完全,即成为PCP浓度为1和10 mg/kg 的污染土壤;不同土壤的制备过程相同。
2.3 实验方法
2.3.1 标准曲线 配制100和2000 μg/L的PCP-K2CO3标准溶液,分别吸取100 μg/L的标准溶液0.05、0.1、0.2、0.5、1.0、2.0、4.0和8.0 mL,2000 μg/L的标准溶液1.0、2.0、4.0和8.0 mL, 于10.0 mL介质中,用0.5 mL乙酸酐衍生化后,加入4 mL正己烷萃取衍生化产物乙酸五氯苯酯,吸取部分有机相后,用无水Na2SO4干燥脱水并通过0.22 μm有机相滤膜,得浓度为1.25, 2.5, 5.0, 12.5, 25, 50, 100, 200, 500, 1000, 2000和4000 μg/L的系列标准溶液。
2.3.2 土壤中水提态PCP的萃取测定 取PCP污染土壤2 g于 50 mL离心管中,加入超纯水10 mL,于25℃下250 r/min振荡60 min后,4000 r/min离心20 min,取上清液过0.45 μm有机相滤膜,按以下步骤测定水提态PCP:(1)纯化 准确吸取6 mL待测液于30 mL玻璃离心管中,加入0.5 mL 9 mol/L H2SO4充分酸化,使PCP全部以分子态存在(pH<4),再用6 mL正己烷涡旋振荡2 min,使PCP进入有机相,2500 r/min离心3 min后,吸除下层水相,上层正己烷相分别用0.2 mol/L K2CO3分两次反萃,使PCP进入K2CO3溶液中,合并两次反萃溶液。(2)衍生化 在收集反萃液中,加入0.5 mL乙酸酐,摇动玻璃离心管,释放气泡,25℃下200 r/min振荡20 min,使PCP衍化生成乙酸五氯苯酯。(3)涡旋辅助萃取 衍生化后的溶液按优化后的萃取条件加入适量正己烷进行涡旋辅助萃取,以一定涡旋转速萃取2 min。(4)脱水测定 2500 r/min离心3 min后,吸取上层有机相,用1 g无水Na2SO4干燥脱水,并过0.22 μm有机相滤膜后进行测定。
2.3.3 土壤中甲醇可提态PCP的萃取测定 取2.3.2节中水提取后的土壤,倒尽上清液后,用9 mol/L H2SO4调至pH<4,加入10 mL甲醇进行超声提取(25℃,54 kHz,30 min),然后3000 r/min离心10 min,收集上清液。用相同的方法继续提取两次,收集各自提取液于30 mL离心管中,用氮气吹干至约0.5 mL,再加入0.2 mol/L K2CO3溶液10 mL, 乙酸酐0.5 mL振荡发生衍生化反应,最后按2.3.2节步骤(3)、(4)操作。
2.4 色谱条件
载气为氮气,流速2.0 mL/min。升温程序:柱初始温度80℃,保持1 min,以30℃/min升温到220℃,继续以5℃/min升温到230℃,保持3 min,最后以30℃/min升温到250℃,保持1 min; 进样口温度为250℃,ECD温度为300℃。不分流进样,进样量1 μL,外标法定量[11]。每个样品分析时间为11.8 min。
2.5 实验数据分析
采用Origin 8.0和Microsoft Office Excel 2013软件进行图表编辑。图表中,PCP回收率数据表示为算数平均值±标准差。采用IBM SPSS Statistics 20软件进行数理统计分析。单因素方差分析采用LSD法;所有统计检验均以α=0.05为显著水准,采用小写字母标注显著性。
3 结果与讨论
3.1 溶液中PCP的萃取条件优化
3.1.1 涡旋时间和转速的影响
先比较了涡旋时间对回收率的影响,发现在1~5 min范围内回收率没有显著差异,与文献[4]的研究结果一致。为便于操作,所有涡旋时间都设定为2 min。之后考察了涡旋转速(500、1000、1500、2000、2500和3000 r/min)对萃取率的影响。实验表明,随着涡旋转速的增大,回收率升高,重复性变好,500和2000 r/min时回收率分别为70.5%和97.4%,相对标准偏差(RSD)分别为3.1%和0.5%;涡旋转速大于2500 r/min后,回收率降低,重复性也变差,3000 r/min时回收率为79.2%,RSD为5.6%(图1)。
究其原因,涡旋转速达到3000 r/min时,溶液急剧旋转,大量溶液溅到离心管盖上,引起回收率降低;而转速太低时,两种液相不能充分混合,也导致回收率偏低。本研究选择2000 r/min。
3.1.2 液液体积比的影响 研究了衍生化溶液与正己烷体积比(10∶6、10∶4、10∶3、10∶2、10∶1),对衍生化溶液萃取效率及稳定性的影响。由表2可知,各萃取比下回收率在99.3%~111%之间,RSD在0.1%~2.2%之间,萃取的稳定性随着体积比的增大呈现出变差的趋势。综合而言,衍生化溶液-正己烷=10∶4(V∶V)时萃取测定的PCP回收率较高(103%),重复性较好(RSD为0.7%),且便于操作。
[
3.2 标准曲线
在1.25~200 μg/L、200~4000 μg/L以及1.25~4000 μg/L范围内,待测液中PCP浓度(CPCP,μg/L)与色谱峰积分面积(A)有很好的线性关系,具有较宽的线性范围。其回归方程分别为: A=9.9665CPCP + 22.879(R2=0.9998); A=9.9627CPCP-113.92(R2=0.9999);A=9.5857CPCP-1.7667(R2=0.9999)。方法的LOD以信噪比3倍计为0.02 μg/L。说明方法灵敏度高,适合于痕量及微量PCP的分析。
3.3 土壤中PCP的提取测定
3.3.1 反萃取回收率的验证
He等[16]研究表明,红壤有机质含量一般较低,在不同类型土壤中对PCP的吸附容量较小。因此,选取江西红壤为测试土壤,制备干净红壤提取液并加标至100 μg/L,萃取
后的有机相用10和6 mL K2CO3溶液分两次反萃取,验证纯化步骤中PCP的反萃取回收率。结果表明,第一次回收率为96.9%,RSD为1.2%;第二次回收率为4.4%,RSD为9.4%;两次总回收率为100.9%,且有好的重复性(RSD为0.9%),可见两次足以将PCP反萃取完全(表3)。
3.3.2 涡旋辅助萃取回收率的验证 同3.3.1节制备干净红壤提取液并加标到100 μg/L,验证涡旋辅助萃取(VALLE)步骤中PCP的回收率,并与LLE、SPE方法比较。LLE方法参照环保部591-2010标准[5],回收率为91.4%,RSD为2.6%;SPE方法参照文献[6],回收率为83.3%,RSD为5.2%; VALLE方法回收率达96.8%,RSD为3.8%(图2)。相比于LLE、SPE方法,
VALLE方法有机溶剂消耗量最低、操作步骤最少,且回收率最高。尤其是,涡旋辅助可以缩短提取时间[17],并减小处理间人为操作的不稳定性。
3.3.3 水和甲醇可提态PCP的提取测定 采取水和甲醇连续提取的方法,结合之前摸索出的最佳提取条件,在不同类型土壤(水稻土、红壤、黑土、潮土)以及不同污染条件(1, 10 mg/kg)下验证涡旋辅助-液液萃取-气相色谱法在PCP测定中的可靠性。由图3可见,4种土壤在1 mg/kg PCP污染条件下总回收率为89.5%~98.9%,10 mg/kg PCP污染条件下总回收率为88.7%~98.4%;1 mg/kg PCP污染土壤回收率重复性优于10 mg/kg PCP污染土壤。不同类型土壤总的回收率在1 mg/kg PCP污染条件下有显著差异(P<0.05),而10 mg/kg PCP污染条件下无显著差异;不同污染条件下水稻土和黑土的总回收率最高,潮土最低,但总回收率均符合要求,说明用水提取1次以及甲醇提取3次可将PCP提取完全。不同类型土壤中PCP的水提取比例有显著差异(P<0.05),水提取比例呈现出从水稻土到潮土逐渐升高的趋势。这主要是因为,PCP在水中的溶解度受pH值影响较大[18],随着土壤pH值的升高,水提取比例也逐渐上升;粒径含量大小也会影响土壤对PCP的吸附,其中较高的粘粒含量下土壤对PCP吸附作用增强[19],导致水提取态比例呈降低趋势(潮土除外),这与文献[10]的研究结果一致。
实验结果表明,涡旋辅助-液液萃取-气相色谱法满足了不同类型土壤中不同形态PCP在不同浓度范围内的提取测定,为水和甲醇可提态PCP的准确测定提供了方法选择的依据。
References
1 Liu Y, Li F B, Xia W, Xu J M, Yu X S. Chemosphere, 2013, 91(11): 1547-1555
2 Zheng W W, Wang X, Yu H, Tao X G, Zhou Y, Qu W D. Environ. Sci. Technol., 2011, 45(11): 4668-4675
3 Zheng W W, Yu H, Wang X, Qu W D. Environ. Int., 2012, 42(SI): 105-116
4 Farhadi K, Farajzadeh M A, Matin A A, Hashemi P. Cent. Eur. J. Chem., 2009, 7(3): 369-374
5 Water Quality-determination of Pentachlorophenol by Gas Chromatography. National Standards for Environmental Protection of the People′s Republic of China. 591-2010
水质五氯酚的测定气相色谱法. 中华人民共和国国家环境保护标准. 591-2010
6 YANG Qiu-Hong, CHENG Xiao-Yan, YANG Ping, QIAN Shu, DAN De-Zhong. Chinese J. Anal. Chem., 2011, 39(8): 1208-1212
杨秋红, 程小艳, 杨 坪, 钱 蜀, 但德忠. 分析化学, 2011, 39(8): 1208-1212
7 ZHOU Rui-Juan, DUAN Lian, SUN Xiao-Jie, WU Cai-Ying, XING Jun. Chem. J. Chinese Universities, 2010, 31(10): 1945-1948
周瑞娟, 段 炼, 孙晓杰, 吴采樱, 邢 钧. 高等学校化学学报, 2010, 31(10): 1945-1948
8 Morales R, Ortiz M C, Sarabia L A. Anal. Bioanal. Chem., 2012, 403(4): 1095-1107
9 Li X Y, Xue A F, Chen H, Li S Q. J. Chromatogr. A, 2013, 1280: 9-15
10 SUN Lei, JIANG Xin, ZHOU Jian-Min, WANG Dai-Zhang, KONG De-Yang, TAO Run-Xian. Chinese J. Anal. Chem., 2003, 31(6): 716-719
孙 磊, 蒋 新, 周健民, 王代长, 孔德洋, 陶润先. 分析化学, 2003, 31(6): 716-719
11 Hayat T, Ding N, Ma B, He Y, Shi J C, Xu J M. J. Environ. Qual., 2011, 40(6): 1722-1729
12 He Y, Xu J M, Wang H Z, Wu Y P. Environ. Pollut., 2007, 147(2): 343-349
13 Subramanian B, Namboodiri V, Khodadoust A P, Dionysiou D D. J. Hazard. Mater., 2010, 174(1-3): 263-269
14 ZHU Xiao-Ping, LI Xiao-Min, Li Yong-Tao, LIN Zhong, CAI Yan-Fei, DONG Jun. J. Agro-Environ.Sci., 2011, (11): 2218-2224
朱小平, 李晓敏, 李永涛, 蔺 中, 蔡燕飞, 董 军. 农业环境科学学报, 2011, (11): 2218-2224
15 Xu T, Lou L P, Luo L, Cao R K, Duan D C, Chen Y X. Sci. Total Environ., 2012, 414: 727-731
16 He Y, Xu J M, Wang H Z, Zhang Q C, Muhammad A. Chemosphere, 2006, 65(3): 497-505
17 LENG Geng, LU Gui-Bin, CHEN Yong, YIN Hui, DAN De-Zhong. Chinese J. Anal. Chem., 2012, 40(11): 1752-1757
冷 庚, 吕桂宾, 陈 勇, 尹 辉, 但德忠. 分析化学, 2012, 40(11): 1752-1757
18 Xing L Q, Liu H L, Giesy J P, Yu H X. Sci. Total Environ., 2012, 441: 125-131
19 He Y, Xu J M, Wang H Z, Ma Z H, Chen J Q. Environ. Res., 2006, 101(3): 362-372

