基于吐温—姜黄素复合物的荧光探针检测脂肪酶活性
汤燕+张卫+左焕桢+刘佳+江凌+田丹碧


摘 要 本实验以姜黄素作为信号探针,吐温作为脂肪酶的底物和包裹姜黄素的载体,建立了一种检测脂肪酶活性的荧光法。实验发现,采用0.3 mmol/L 吐温40, 25 μmol/L 姜黄素,并且脂肪酶水解吐温40的时间为35 min时,姜黄素的荧光强度变化值与脂肪酶浓度在0.002~0.05 mg/mL和0.05~0.25 mg/mL范围内呈现线性关系,检出限为0.6 mg/L (S/N=3)。此探针在高通量检测脂肪酶活性以及与脂肪酶相关疾病检测领域中有较好的应用前景。
关键词 姜黄素; 吐温40; 脂肪酶; 荧光探针
1 引 言
许多疾病都与生物体内特定酶的活性密切相关,因此在生理条件下准确检测酶活性十分关键【1】,其中,脂肪酶(Lipase E.C. 3.1.1.3)是作用于羧酸酯键的一类水解酶,与急性胰腺炎、肥胖症、动脉粥样化等疾病密切相关【2】。脂肪酶的催化机理与其它的水解酶并不相同,其催化水解反应发生在油-水界面上【3~5】,并且,它的底物为水不溶性酯类化合物,在测定酶活性过程中,通常需要乳化,乳化剂的加入会显著影响酶活性检测的真实性【6,7】,所以建立一种可靠、简单、灵敏的检测脂肪酶活性的方法尤为重要。
姜黄素是一种天然疏水性抗癌药物,其自身具有紫外和荧光性质【8,9】,可作为荧光信号探针;同时,吐温是一种两亲性的、生物相容性良好的非离子表面活性剂【10,11】,它既作为脂肪酶的底物,又作为包封姜黄素的载体。因此,本研究利用姜黄素作为信号探针,吐温作为脂肪酶的底物和姜黄素的载体,构建了吐温-姜黄素复合物这一传感平台,用于脂肪酶活性的检测。与传统的滴定法、平板法和浊度法等相比,本方法无需乳化底物、操作简单、成本低廉,灵敏度得到明显提高。
2 实验部分
2.1 仪器与试剂
SpectraMax M3微孔板检测系统(美国分子仪器公司),HH-S1恒温水浴锅(金坛市医疗仪器厂),电子天平 (德国赛多利斯公司)。吐温20、40、60、80,姜黄素 (Curcumin),无水甲醇等均为分析纯 (国药集团化学试剂有限公司)。猪胰腺脂肪酶 (PPL)和人血清购于北京索莱宝科技有限公司。除姜黄素是用无水甲醇配制以外,其余所有样品均在10 mmol/L磷酸钠缓冲液(PBS, pH 7.4)中制备得到。
2.2 脂肪酶的荧光检测
分别移取1 mL 0.3 mmol/L 吐温40和10 μL 2.5 mmol/L姜黄素溶液于2 mL离心管中,混匀,加入10 μL不同浓度的PPL在 37 ℃下反应35 min后,在微孔板检测系统上测量体系加入PPL前后的荧光强度(图1)。最终,以F0 -F (ΔF505)为纵坐标,PPL浓度为横坐标,绘制标准曲线,F0和F分别表示加入PPL前后的荧光强度。
2.3 实际样品测定
将人血清在10000 r/min下离心10 min,向所获得的上层清液中分别加入不同浓度的PPL溶液,配制成最终浓度分别为0.025, 0.5和1.0 mg/mL PPL的人血清样品,按照绘制标准曲线的方法进行检测。
3 结果与讨论
3.1 吐温-姜黄素复合物荧光检测脂肪酶活性
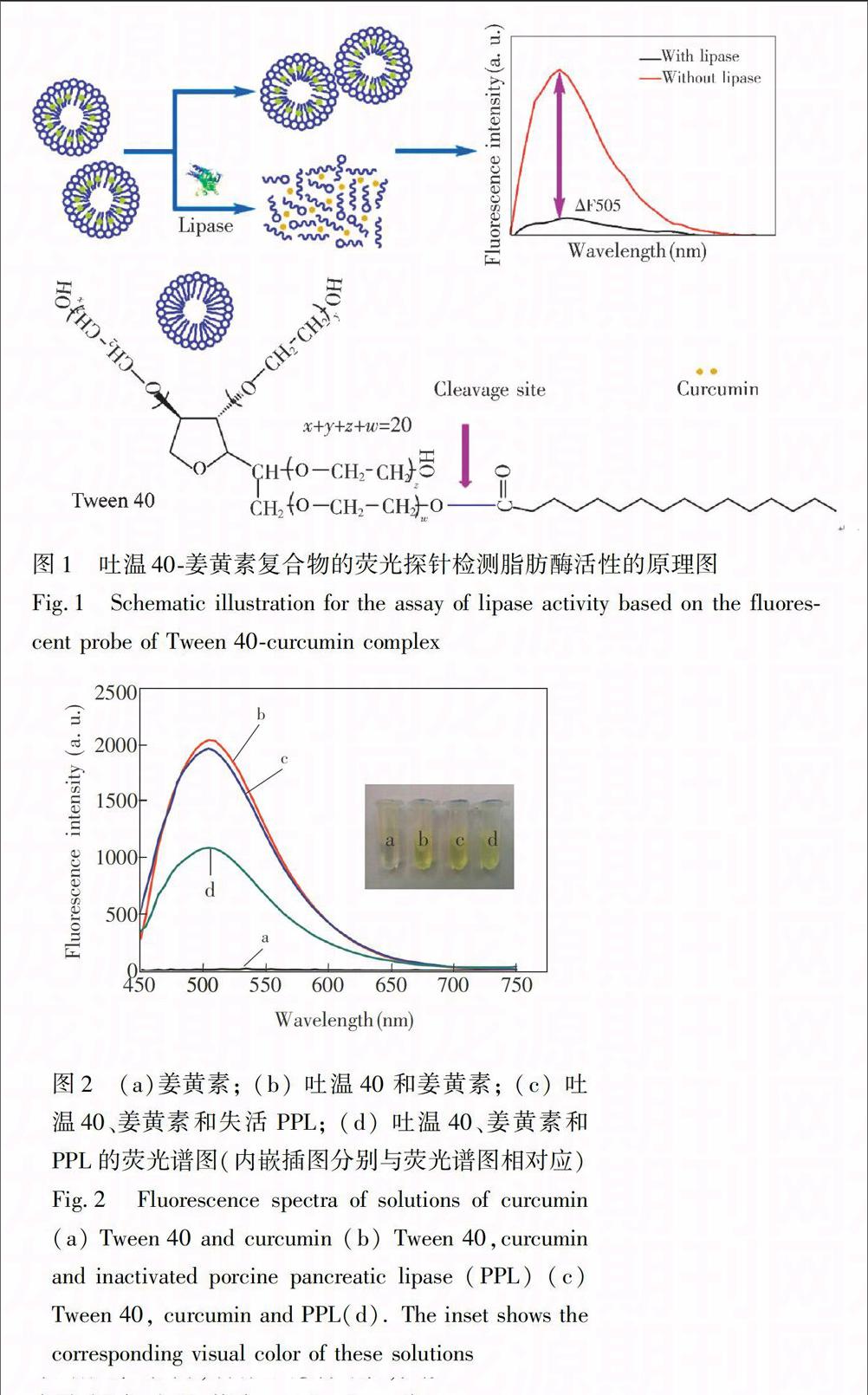
图1为吐温40-姜黄素复合物的荧光探针检测脂肪酶活性的原理图。当没有脂肪酶存在时,吐温40-姜黄素复合物仍然保持着胶束结构,姜黄素无法释放到缓冲溶液中发生降解,依然具有很高的荧光强度;当脂肪酶存在时,它水解切割吐温40中的羧酸酯键,
破坏了吐温40-姜黄素复合物的胶束结构,使得姜黄素从中释放出来,在缓冲溶液中发生降解,荧光强度大大降低。为了验证这一传感机理,如图2所示。姜黄素存在于10 mmol/L PBS (pH 7.4)时,发生降解,几乎没有荧光强度,溶液颜色为无色 (图2a,a离心管);当吐温40存在时,其姜黄素被包裹在内,无法发生降解,具有很高的荧光强度,溶液颜色为黄色 (图2b,b离心管),说明吐温40保护姜黄素避免它与缓冲溶液相互作用而发生降解,从而拥有很高的荧光强度;当加入PPL时,会使吐温40发生水解,破坏了吐温40-姜黄素复合物的胶束结构,释放出姜黄素,其荧光强度大大减弱,溶液颜色为淡黄色 (图2d,d离心管),表明PPL具有破坏吐温40的作用,进而使得姜黄素游离出来并与缓冲溶液相互作用发生降解,荧光强度减弱;同时,为了说明是PPL水解吐温40,使姜黄素释放到缓冲溶液中发生降解,对照实验采用失活的PPL(100 ℃煮沸一段时间)加入到吐温40-姜黄素复合物溶液中,其荧光强度与未加酶时几乎一致,且溶液颜色也是一致的 (图2c,c离心管)。以上实验结果表明,脂肪酶、姜黄素和吐温40三者之间的相互作用关系, 即在PPL的作用下,吐温40-姜黄素复合物的结构遭到破坏,姜黄素释放出来与缓冲液相互作用发生降解,荧光强度减弱。因此,本方法可成功检测脂肪酶活性。
为了进一步探究该传感机理,采用紫外谱图进行研究。在中性水溶液中,姜黄素在430和355 nm处有两个特征吸收峰,其中355 nm处出现的峰是由于水分子与姜黄素之间相互作用所导致的【8,12】。当姜黄素加入到pH 7.4的PBS缓冲溶液中时,反应1 min,发现在425 nm处出现一个低强度的吸收峰,并且在355 nm处有个不明显的峰(图3b);35 min后,425 nm处的峰完全消失,355 nm处有一个明显的吸收峰(图3a), 图3 (a)磷酸钠缓冲溶液与姜黄素反应35 min;(b)磷酸钠缓冲溶液和姜黄素反应1 min;(c)吐温40、姜黄素和PPL反应35 min;(c)吐温40与姜黄素反应35 min的紫外谱图
Fig.3 UV-vis spectra of curcumin after reacted with (a) PBS for 35 min, (b) PBS for 1 min, (c) mixture of Tween 40 and PPL for 35 min and (d) Tween 40 for 35 min
说明随着反应时间的不断延长,355 nm处的峰越来越明显,其姜黄素与缓冲溶液相互作用越强。当吐温40存在时,355 nm处的峰完全消失,在425 nm处出现一个高强度的吸收峰 (图3d);加入PPL后,同样355 nm处的峰完全消失,但是在425 nm处的吸收峰的强度要低于没有加酶的(图3c),表明了吐温40的存在能够显著降低姜黄素与缓冲溶液的相互作用,加入PPL后,会增强姜黄素与缓冲溶液的相互作用,导致姜黄素不断降解。这些现象再次验证此传感策略能很好地用于检测脂肪酶活性。
3.2 实验条件的优化
采用荧光光谱考察了吐温类型与浓度、姜黄素浓度以及PPL水解吐温时间对此传感策略性能的影响。吐温有多种类型,如吐温20, 40, 60和80等,都可以作为PPL的底物和包裹姜黄素的载体【10,12~15】,但是PPL对其水解程度不一样,并且它们包裹姜黄素的能力也不一样,因此选择合适的吐温十分关键,结果如图4A所示,当选用吐温40作为PPL底物和包裹姜黄素载体时,荧光信号差值最大。
吐温40浓度的选择对于该传感器的构建尤为重要,低浓度不利于形成胶束,以包裹姜黄素,高浓度不利于PPL对其水解催化(图4B)。在吐温40浓度为0.05~0.30 mmol/L时,荧光信号差值不断增大,当浓度超过0.30 mmol/L时,荧光信号差值下降,因此选择0.30 mmol/L 吐温40作为最佳实验条件。
姜黄素作为该策略的信号传感元件,信号的强弱与其浓度大小相关。如图4C所示,随着姜黄素浓度的增加,荧光信号差值也相应增大,至浓度达到25 μmol/L时,荧光信号差值趋向稳定。因此,姜黄素的浓度选为25 μmol/L。
在PPL催化水解吐温40的过程中,反应时间是评价传感策略的重要因素,结果如图4D所示。在0~35 min反应时间内,随着反应时间的延长,荧光信号差值不断增加,35 min后,荧光信号差值趋于稳定,表明PPL催化水解吐温40达到平衡状态,因此选择PPL催化水解吐温40的时间为35 min。
3.3 酶活动力学的测定
在最佳的实验条件下,测定了不同浓度的PPL的酶活动力学曲线。如图5所示,在相同反应时间内,随着PPL浓度的增加,荧光信号差值也越来越大。另外,随着水解反应时间的不断进行,相同浓度下的PPL,其荧光信号差值也越来越大。这些结果表明,当PPL的浓度越大或者随着水解时间的增加,其破坏吐温40-姜黄素复合物的能力就越强,释放出来的姜黄素在缓冲溶液中降解的程度就越大,最终荧光强度的变化值也越大。
3.4 标准曲线的建立
在最优化条件下,对不同浓度的PPL进行了定量检测。如图6A所示,随着PPL浓度的不断增加,反应体系的荧光强度逐渐降低。以荧光强度的变化值为纵坐标,PPL的浓度为横坐标绘制标准曲线,结果如图6 B所示,PPL浓度在0.002~0.05 mg/mL和0.05~0.25 mg/mL范围内呈线性关系,线性方程分别为ΔF505=7.900+5647CPPL(R2=0.9966),ΔF505=188.8+2217CPPL(R2=0.9892),检出限低至0.6 mg/L(S/N=3)。本方法与传统检测脂肪酶活性相比,灵敏度大大提高,并且在高通量检测脂肪酶活性以及与脂肪酶相关疾病检测领域中有很大的应用前景。
3.5 人血清中PPL的标准加入回收率
按照所建立的荧光检测方法,通过标准加入法对人血清中的PPL进行回收率计算。检测结果如表1所示。结果表明,此传感方法可以适用于实际样品的检测。
References
1 Hutter E, Maysinger D. Trends Pharmacol. Sci., 2013, 34(9): 497-507
2 Gupta R, Gupta N, Rathi P. Appl. Microbiol. Biotechno., 2004, 64(6): 763-781
3 Gupta R, Rathi P, Gupta N, Bradoo S. Biotechnol. Appl. Biochem., 2003, 37(1): 63-71
4 Gomes N, Goncalves C, Garcia-Roman M, Teixeira J A, Belo I. Anal. Methods, 2011, 3(4): 1008-1013
5 Hasan F, Shah A A, Hameed A. Biotechnol. Adv., 2009, 27(6): 782-798
6 Beisson F, Tiss A, Rivière C, Verger R. Eur. J. Lipid Sci. Technol., 2000, 102(2): 133-153
7 Gilham D, Lehner R. Methods, 2005, 36(2): 139-147
8 Sahu A, Bora U, Kasoju N, Goswami P. Acta Biomater., 2008, 4(6): 1752-1761
9 Ke D, Wang X, Yang Q, Niu Y, Chai S, Chen Z, An X, Shen W. Langmuir, 2011, 27(23): 14112-14117
10 Kerwin B A. J. Pharmacol. Sci., 2008, 97(8): 2924-2935
11 Plou F, Ferrer M, Nuero O, Calvo M, Alcalde M, Reyes F, Ballesteros A. Biotechnol. Tech., 1998, 12(3): 183-186
12 Mandal S, Banerjee C, Ghosh S, Kuchlyan J, Sarkar N. J. Phys.Chem. B., 2013, 117(23): 6957-6968
13 Sakai Y, Hayatsu M, Hayano K. Soil Sci. Plant Nutr., 2002, 48(5): 729-734
14 Carson L A, Favero M S, Bond W W, Petersen N J. Appl.Microbiol., 1973, 25(3): 476-483
15 Baradi A F, Bourne G H. Nature, 1951, 168(4284): 977-979



摘 要 本实验以姜黄素作为信号探针,吐温作为脂肪酶的底物和包裹姜黄素的载体,建立了一种检测脂肪酶活性的荧光法。实验发现,采用0.3 mmol/L 吐温40, 25 μmol/L 姜黄素,并且脂肪酶水解吐温40的时间为35 min时,姜黄素的荧光强度变化值与脂肪酶浓度在0.002~0.05 mg/mL和0.05~0.25 mg/mL范围内呈现线性关系,检出限为0.6 mg/L (S/N=3)。此探针在高通量检测脂肪酶活性以及与脂肪酶相关疾病检测领域中有较好的应用前景。
关键词 姜黄素; 吐温40; 脂肪酶; 荧光探针
1 引 言
许多疾病都与生物体内特定酶的活性密切相关,因此在生理条件下准确检测酶活性十分关键【1】,其中,脂肪酶(Lipase E.C. 3.1.1.3)是作用于羧酸酯键的一类水解酶,与急性胰腺炎、肥胖症、动脉粥样化等疾病密切相关【2】。脂肪酶的催化机理与其它的水解酶并不相同,其催化水解反应发生在油-水界面上【3~5】,并且,它的底物为水不溶性酯类化合物,在测定酶活性过程中,通常需要乳化,乳化剂的加入会显著影响酶活性检测的真实性【6,7】,所以建立一种可靠、简单、灵敏的检测脂肪酶活性的方法尤为重要。
姜黄素是一种天然疏水性抗癌药物,其自身具有紫外和荧光性质【8,9】,可作为荧光信号探针;同时,吐温是一种两亲性的、生物相容性良好的非离子表面活性剂【10,11】,它既作为脂肪酶的底物,又作为包封姜黄素的载体。因此,本研究利用姜黄素作为信号探针,吐温作为脂肪酶的底物和姜黄素的载体,构建了吐温-姜黄素复合物这一传感平台,用于脂肪酶活性的检测。与传统的滴定法、平板法和浊度法等相比,本方法无需乳化底物、操作简单、成本低廉,灵敏度得到明显提高。
2 实验部分
2.1 仪器与试剂
SpectraMax M3微孔板检测系统(美国分子仪器公司),HH-S1恒温水浴锅(金坛市医疗仪器厂),电子天平 (德国赛多利斯公司)。吐温20、40、60、80,姜黄素 (Curcumin),无水甲醇等均为分析纯 (国药集团化学试剂有限公司)。猪胰腺脂肪酶 (PPL)和人血清购于北京索莱宝科技有限公司。除姜黄素是用无水甲醇配制以外,其余所有样品均在10 mmol/L磷酸钠缓冲液(PBS, pH 7.4)中制备得到。
2.2 脂肪酶的荧光检测
分别移取1 mL 0.3 mmol/L 吐温40和10 μL 2.5 mmol/L姜黄素溶液于2 mL离心管中,混匀,加入10 μL不同浓度的PPL在 37 ℃下反应35 min后,在微孔板检测系统上测量体系加入PPL前后的荧光强度(图1)。最终,以F0 -F (ΔF505)为纵坐标,PPL浓度为横坐标,绘制标准曲线,F0和F分别表示加入PPL前后的荧光强度。
2.3 实际样品测定
将人血清在10000 r/min下离心10 min,向所获得的上层清液中分别加入不同浓度的PPL溶液,配制成最终浓度分别为0.025, 0.5和1.0 mg/mL PPL的人血清样品,按照绘制标准曲线的方法进行检测。
3 结果与讨论
3.1 吐温-姜黄素复合物荧光检测脂肪酶活性
图1为吐温40-姜黄素复合物的荧光探针检测脂肪酶活性的原理图。当没有脂肪酶存在时,吐温40-姜黄素复合物仍然保持着胶束结构,姜黄素无法释放到缓冲溶液中发生降解,依然具有很高的荧光强度;当脂肪酶存在时,它水解切割吐温40中的羧酸酯键,
破坏了吐温40-姜黄素复合物的胶束结构,使得姜黄素从中释放出来,在缓冲溶液中发生降解,荧光强度大大降低。为了验证这一传感机理,如图2所示。姜黄素存在于10 mmol/L PBS (pH 7.4)时,发生降解,几乎没有荧光强度,溶液颜色为无色 (图2a,a离心管);当吐温40存在时,其姜黄素被包裹在内,无法发生降解,具有很高的荧光强度,溶液颜色为黄色 (图2b,b离心管),说明吐温40保护姜黄素避免它与缓冲溶液相互作用而发生降解,从而拥有很高的荧光强度;当加入PPL时,会使吐温40发生水解,破坏了吐温40-姜黄素复合物的胶束结构,释放出姜黄素,其荧光强度大大减弱,溶液颜色为淡黄色 (图2d,d离心管),表明PPL具有破坏吐温40的作用,进而使得姜黄素游离出来并与缓冲溶液相互作用发生降解,荧光强度减弱;同时,为了说明是PPL水解吐温40,使姜黄素释放到缓冲溶液中发生降解,对照实验采用失活的PPL(100 ℃煮沸一段时间)加入到吐温40-姜黄素复合物溶液中,其荧光强度与未加酶时几乎一致,且溶液颜色也是一致的 (图2c,c离心管)。以上实验结果表明,脂肪酶、姜黄素和吐温40三者之间的相互作用关系, 即在PPL的作用下,吐温40-姜黄素复合物的结构遭到破坏,姜黄素释放出来与缓冲液相互作用发生降解,荧光强度减弱。因此,本方法可成功检测脂肪酶活性。
为了进一步探究该传感机理,采用紫外谱图进行研究。在中性水溶液中,姜黄素在430和355 nm处有两个特征吸收峰,其中355 nm处出现的峰是由于水分子与姜黄素之间相互作用所导致的【8,12】。当姜黄素加入到pH 7.4的PBS缓冲溶液中时,反应1 min,发现在425 nm处出现一个低强度的吸收峰,并且在355 nm处有个不明显的峰(图3b);35 min后,425 nm处的峰完全消失,355 nm处有一个明显的吸收峰(图3a), 图3 (a)磷酸钠缓冲溶液与姜黄素反应35 min;(b)磷酸钠缓冲溶液和姜黄素反应1 min;(c)吐温40、姜黄素和PPL反应35 min;(c)吐温40与姜黄素反应35 min的紫外谱图
Fig.3 UV-vis spectra of curcumin after reacted with (a) PBS for 35 min, (b) PBS for 1 min, (c) mixture of Tween 40 and PPL for 35 min and (d) Tween 40 for 35 min
说明随着反应时间的不断延长,355 nm处的峰越来越明显,其姜黄素与缓冲溶液相互作用越强。当吐温40存在时,355 nm处的峰完全消失,在425 nm处出现一个高强度的吸收峰 (图3d);加入PPL后,同样355 nm处的峰完全消失,但是在425 nm处的吸收峰的强度要低于没有加酶的(图3c),表明了吐温40的存在能够显著降低姜黄素与缓冲溶液的相互作用,加入PPL后,会增强姜黄素与缓冲溶液的相互作用,导致姜黄素不断降解。这些现象再次验证此传感策略能很好地用于检测脂肪酶活性。
3.2 实验条件的优化
采用荧光光谱考察了吐温类型与浓度、姜黄素浓度以及PPL水解吐温时间对此传感策略性能的影响。吐温有多种类型,如吐温20, 40, 60和80等,都可以作为PPL的底物和包裹姜黄素的载体【10,12~15】,但是PPL对其水解程度不一样,并且它们包裹姜黄素的能力也不一样,因此选择合适的吐温十分关键,结果如图4A所示,当选用吐温40作为PPL底物和包裹姜黄素载体时,荧光信号差值最大。
吐温40浓度的选择对于该传感器的构建尤为重要,低浓度不利于形成胶束,以包裹姜黄素,高浓度不利于PPL对其水解催化(图4B)。在吐温40浓度为0.05~0.30 mmol/L时,荧光信号差值不断增大,当浓度超过0.30 mmol/L时,荧光信号差值下降,因此选择0.30 mmol/L 吐温40作为最佳实验条件。
姜黄素作为该策略的信号传感元件,信号的强弱与其浓度大小相关。如图4C所示,随着姜黄素浓度的增加,荧光信号差值也相应增大,至浓度达到25 μmol/L时,荧光信号差值趋向稳定。因此,姜黄素的浓度选为25 μmol/L。
在PPL催化水解吐温40的过程中,反应时间是评价传感策略的重要因素,结果如图4D所示。在0~35 min反应时间内,随着反应时间的延长,荧光信号差值不断增加,35 min后,荧光信号差值趋于稳定,表明PPL催化水解吐温40达到平衡状态,因此选择PPL催化水解吐温40的时间为35 min。
3.3 酶活动力学的测定
在最佳的实验条件下,测定了不同浓度的PPL的酶活动力学曲线。如图5所示,在相同反应时间内,随着PPL浓度的增加,荧光信号差值也越来越大。另外,随着水解反应时间的不断进行,相同浓度下的PPL,其荧光信号差值也越来越大。这些结果表明,当PPL的浓度越大或者随着水解时间的增加,其破坏吐温40-姜黄素复合物的能力就越强,释放出来的姜黄素在缓冲溶液中降解的程度就越大,最终荧光强度的变化值也越大。
3.4 标准曲线的建立
在最优化条件下,对不同浓度的PPL进行了定量检测。如图6A所示,随着PPL浓度的不断增加,反应体系的荧光强度逐渐降低。以荧光强度的变化值为纵坐标,PPL的浓度为横坐标绘制标准曲线,结果如图6 B所示,PPL浓度在0.002~0.05 mg/mL和0.05~0.25 mg/mL范围内呈线性关系,线性方程分别为ΔF505=7.900+5647CPPL(R2=0.9966),ΔF505=188.8+2217CPPL(R2=0.9892),检出限低至0.6 mg/L(S/N=3)。本方法与传统检测脂肪酶活性相比,灵敏度大大提高,并且在高通量检测脂肪酶活性以及与脂肪酶相关疾病检测领域中有很大的应用前景。
3.5 人血清中PPL的标准加入回收率
按照所建立的荧光检测方法,通过标准加入法对人血清中的PPL进行回收率计算。检测结果如表1所示。结果表明,此传感方法可以适用于实际样品的检测。
References
1 Hutter E, Maysinger D. Trends Pharmacol. Sci., 2013, 34(9): 497-507
2 Gupta R, Gupta N, Rathi P. Appl. Microbiol. Biotechno., 2004, 64(6): 763-781
3 Gupta R, Rathi P, Gupta N, Bradoo S. Biotechnol. Appl. Biochem., 2003, 37(1): 63-71
4 Gomes N, Goncalves C, Garcia-Roman M, Teixeira J A, Belo I. Anal. Methods, 2011, 3(4): 1008-1013
5 Hasan F, Shah A A, Hameed A. Biotechnol. Adv., 2009, 27(6): 782-798
6 Beisson F, Tiss A, Rivière C, Verger R. Eur. J. Lipid Sci. Technol., 2000, 102(2): 133-153
7 Gilham D, Lehner R. Methods, 2005, 36(2): 139-147
8 Sahu A, Bora U, Kasoju N, Goswami P. Acta Biomater., 2008, 4(6): 1752-1761
9 Ke D, Wang X, Yang Q, Niu Y, Chai S, Chen Z, An X, Shen W. Langmuir, 2011, 27(23): 14112-14117
10 Kerwin B A. J. Pharmacol. Sci., 2008, 97(8): 2924-2935
11 Plou F, Ferrer M, Nuero O, Calvo M, Alcalde M, Reyes F, Ballesteros A. Biotechnol. Tech., 1998, 12(3): 183-186
12 Mandal S, Banerjee C, Ghosh S, Kuchlyan J, Sarkar N. J. Phys.Chem. B., 2013, 117(23): 6957-6968
13 Sakai Y, Hayatsu M, Hayano K. Soil Sci. Plant Nutr., 2002, 48(5): 729-734
14 Carson L A, Favero M S, Bond W W, Petersen N J. Appl.Microbiol., 1973, 25(3): 476-483
15 Baradi A F, Bourne G H. Nature, 1951, 168(4284): 977-979

