气相色谱高分辨质谱测定婴儿胎发中含氯持久性有机污染物
宋淑玲+胡小健+祁鹏+李松+佟玲+田芹+马晓东

摘 要 婴儿的胎发是评价婴儿在母体环境中污染物累积暴露水平的良好介质。含氯持久性有机污染物是人体中残留浓度最高的持久性有机污染物。本研究依次采用HCl酸化、正己烷/二氯甲烷混合溶液萃取、硅胶和氧化铝混合填充小柱净化,以及气相色谱高分辨质谱法检测了北京20个婴儿胎发中的16种典型含氯持久性有机污染物。结果表明,16种目标物的检出限可达到1.0~2.5 μg/kg,替代物五氯硝基苯回收率大于67.6%,加标样品中目标物回收率范围为62.5%~92.3%。20个胎发样品中六氯苯、β-六六六和p,p′-滴滴伊检出率均为100%,γ-六六六、2,4,4′-三氯联苯和2,2′,5,5′-四氯联苯的检出率分别为85%, 50%和40%。4种污染物总量的浓度分布范围分别为5.48~8.40 μg/kg(六氯苯)、3.86~27.1 μg/kg(六六六)、1.16~18.3 μg/kg(滴滴涕)和2.20~22.1 μg/kg(多氯联苯),平均浓度分别为6.91,6.10,5.53和3.44 μg/kg。此方法和分析结果可用于胎儿体内16种含氯持续性有机污染物蓄积水平和母体内累计暴露水平的评价。
关键词 胎发;含氯持久性有机污染物;气相色谱高分辨质谱;累积暴露
1 引 言
大量研究表明,有机氯农药(Organochlorine pesticides, OCPs)和多氯联苯(Polychlorodiphenyls, PCBs)是人体内蓄积浓度最高、代谢速度极为缓慢的持久性有机污染物(Persistent organic pollutants, POPs)[1]。在怀孕期间,母体中蓄积的高浓度OCPs和PCBs通过各种途径进入胎儿体内及各种脂肪组织或器官。目前,研究者通常采用脐带血为介质[2~5],通过分析其中的POPs浓度评价胎儿在母体内POPs的暴露风险。遗憾的是脐带血取样困难,同时脐带血中POPs的浓度会随着母体血液中POPs浓度改变[6]反映的是胎儿的短期暴露水平,不能直接反映胎儿体内以及胎儿在母体内POPs的蓄积水平。
胎儿在母体中15周后开始生长胎发,而胎发具有生长周期长、容易采集和不伤害婴儿身体的特点。本研究以胎发为介质,分析其中典型的16种含氯高浓度POPs,进而评价婴儿在母体中的累积暴露水平。
早在1992年,Schramm等就指出头发含有3%~4%的脂肪,是评价人体在环境中有机污染物长期暴露和短期暴露情况的良好生物介质[7,8]。随后,更多的研究者均验证了头发作为监测基质,评价人体在环境中有机污染物的暴露风险的可行性,并开展了相关的研究[9~13]。如Schummer等以头发为介质,通过分析当地居民头发等多种介质中农药,评价了不同农药的暴露水平[14]; Wielgomas等分析了40年内波兰人发中的含氯POPs的变化趋势,表明人发中含氯POPs浓度持续下降[15],Behrooz等利用人发研究了伊朗怀孕女性含氯POPs的暴露水平[16], Kerstin等采集德国儿童头发,研究了儿童体外含氯POPs的暴露水平[17]。以上结果均表明,头发可作为一种评价人体含氯POPs的暴露水平的良好介质。但当前的研究主要以成年人头发为介质研究暴露水平,鲜有用胎发作为监测介质,评价胎儿在母体内POPs的暴露水平或出生前体内POPs的蓄积水平。其主要原因是胎发中目标物含量低,且样品难收集、采样量有限,故对分析方法的灵敏度和检出限要求高。
本研究收集了北京地区20个胎发样品, 采用气相色谱高分辨质谱(Gas chromatography and high resolution mass spectrometry, GC-HRMS)准确测定20个胎发样品中低含量典型含氯POPs的种类和浓度,初步评价北京婴幼儿在母体中含氯POPs的暴露水平。
2 实验部分
2.1 仪器与材料
AutoSpec Premier 型高分辨质谱仪,配有Agilient 7890气相色谱仪和自动进样器(美国Waters公司); GC 2010气相色谱仪(日本Shimadzhu公司),配有电子捕获检测器(Electron capture detector, ECD); LABORATA4003型旋转蒸发仪(德国Heidolph公司); KL512/509J型氮吹仪(中国康林公司)。
硅胶(75~150 μm)和氧化铝(150 μm)均为分析纯(北京化学试剂厂);酸化硅胶: 将27 mL浓H2SO4与50 g 硅胶充分振荡、混匀后放入干燥器备用;10%水钝化氧化铝: 向100 g中性氧化铝中加入10 mL超纯水,充分振荡、混匀放入干燥器中备用。
2.2 标准溶液和主要试剂
8种OCPs混合标准溶液:α-六六六(α-Hexachlorocyclohexane,α-HCH)、β-六六六(β-HCH)、 γ-六六六(γ-HCH)、δ-六六六(δ-HCH)、p,p′-滴滴伊(1,1-Dichloro-2-(4-chlorophenyl)-2-(4-chlorophenyl)ethene,p,p′-DDE)、p,p′-滴滴滴(1,1-Dichloro-2-(4-chlorophenyl)-2-(4-chlorophenyl)ethane,p,p′-DDD)、o,p′-滴滴涕(o,p′-DDT)、p,p′-滴滴涕(p,p′-DDT),浓度50 mg/L,甲醇相。六氯苯(Hexachlorobenzene, HCB),浓度为101 mg/L,异辛烷相。7种PCBs混合标准溶液:2,4,4′-三氯联苯(2,4,4′-Trichlorobiphenyl,PCB28)、2,2′,5,5′-四氯联苯(2,2′,5,5′-Tetrachlorobiphenyl,PCB52)、2,2′,4,5,5′-五氯联苯(2,2′,4,5,5′-Pentachlorobiphenyl,PCB101)、2,3′,4,4′,5-五氯联苯(2,3′,4,4′,5-Pentachlorobiphenyl,PCB118)、2,2′,3,4,4′,5′-六氯联苯(2,2′,3,4,4′,5′-Hexachlorobiphenyl,PCB138)、2,2′,4,4′,5,5′-六氯联苯(2,2′,4,4′,5,5′-Hexachlorobiphenyl,PCB153)、2,2′,3,4,4′,5,5′-七氯联苯(2,2′,3,4,4′,5,5′-Heptachlorobiphenyl,PCB180),浓度2.0 mg/L,异辛烷相。以上标准均购自中国计量科学研究院国家标准物质研究中心。
五氯硝基苯,浓度为10 mg/L,环己烷相(Dr.Ehrenstorfer公司);正己烷,二氯甲烷(色谱纯,百灵威科技有限公司);HCl(优级纯,北京化学试剂厂)。
2.3 样品处理方法
婴儿出生30天内采集胎发,并收集到密封袋中。将胎发用去离子水清洗后,自然晾干,并剪成1~3 mm。准确称取100 mg胎发,转移到15 mL的离心管中,加入20 μL 1.0 mg/L 五氯硝基苯,6 mL 4 mol/L HCl,加盖,置60 ℃水浴中连续酸化16 h[12]。
向离心管中加入3 mL 正己烷-二氯甲烷(4∶1, V/V)进行液液萃取,充分振摇5 min,收集上层的提取液,并用等体积的正己烷-二氯甲烷重复萃取一次。合并两次萃取液,将萃取液浓缩到2~3 mL,并用硅胶、氧化铝和无水Na2SO4的混合自制SPE柱净化样品,以15 mL正己烷-二氯甲烷(4∶1, V/V)为淋洗液,浓缩洗脱液,并用正己烷定容至1.0 mL,待测。
2.4 气相色谱-高分辨质谱分析方法
GC分析条件:进样口温度290 ℃;无分流进样;载气(高纯氦气,99.999%)流速1.2 mL/min。色谱柱 DB-5MS(J&W, 60 m×0.25 mm×0.25 μm)。色谱柱升温程序:初始80 ℃保持2.0 min,以15 ℃/min升温至150 ℃,再以15 ℃/min升温至270 ℃保持3 min,最后以15 ℃/min升温至300 ℃保持1.0 min。传输线温度250 ℃;质谱条件:电子轰击(EI)离子源能量35 eV;温度280 ℃;检测方式多离子检测(MID);加速电压8000 V;分辨率用全氟煤油PFK43调协分辨率到10000。
3 结果与讨论
3.1 色谱柱的选择
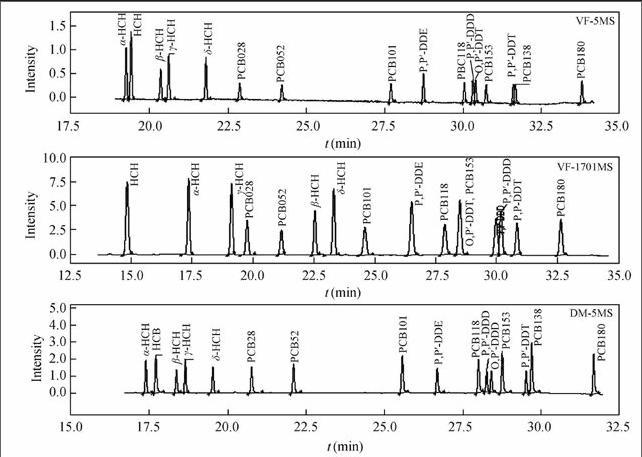
弱极性色谱柱通常是分析有机氯农药和多氯联苯类化合物的理想色谱柱。研究中比较了多个厂家、不同长度、相似极性的毛细管色谱柱对16种目标物的分离效果。这些色谱柱包括DB-5, HT-8, Rtx-CLPesticides2, VF-5和VF-1701。结果表明,30 m的色谱柱一般无法实现16种目标物的基线分离。例如,VF-1701(Varian, 30 m×0.25 mm×0.25 μm)无法分离PCB153和o,p′-DDT,以及基线分离PCB138和p,p′-DDD;DB-5(J&W, 30 m×0.25 mm×0.25 μm)和VF-5(Varian, 30 m×0.25 mm×0.25 μm)无法基线分离o,p′-DDT和p,p′-DDD,以及PCB138和p,p′-DDT;Rtx-CLPesticides2无法分离PCB138和p,p′-DDT。而HT-8(SGE, 25 m×0.22 mm×0.25 μm)、DM-5MS(Dikma, 30 m×0.25 mm×0.25 μm)、DM-5MS(Dikma, 50 m×0.25 mm×0.25 μm)和DB-5MS(J&W, 60 m×0.25 mm×0.25 μm)均能有效分离16种目标物,特别是o,p′-DDT和p,p′-DDD、o,p′-DDT和PCB153以及PCB138和p,p′-DDT这3对化合物。图1例举了3种色谱柱上16种目标物的GC-ECD色谱分离图。
3.2 质量控制
质量控制主要包括试剂空白和分析过程全流程控制。
16种目标物是环境中普遍存在的典型含氯POPs,其在胎发中浓度远低于其它生物样品中的浓度。为了确保分析结果的准确度和精密度、降低方法的检出限,需要最低限度地降低空白本底值和减少干扰。将实验中使用的正己烷和二氯甲烷分别取50 mL进行浓缩,然后定容到1.0 mL,分别以HT-8(30 m), DM-5MS(30 m), DM-5MS(50 m)和DB-5MS(60 m)色谱柱进行分析,并与16种目标物色谱图对比。结果表明,正己烷和二氯甲烷中的16种目标物的浓度均低于0.02 μg/L,但HT-8无法基线分离δ-HCH与干扰物邻苯二甲酸酯;DM-5MS(30 m)无法基线分离PCB180与某大分子干扰物;只有DM-5MS (50 m×0.25 mm×0.25μm)和DB-5MS(60 m×0.25 mm×0.25 μm)能同时满足所有目标物,以及目标物与空白样品中干扰物的基线分离。本研究选择DB-5MS(60 m)作为分析色谱柱。
采用添加替代物、全流程试剂空白和试剂空白加标监控分析全流程,并采用平行样品、实际样品和实际样品添加标准(实际加标样品)评价方法的稳定性、准确性和精密度。样品提取前,每个样品中添加五氯硝基苯作为替代物,试剂空白加标和实际加标样品中添加了目标物,并以五氯硝基苯的回收率、试剂空白加标样品和实际加标样品中目标物的回收率评价目标物在整个过程中的损失及整个分析方法准确度。结果表明,五氯硝基苯的回收率范围为67.6%~85.2%,加标样品中目标物回收率范围为62.5%~92.3%。
3.3 分析方法的灵敏度和检出限
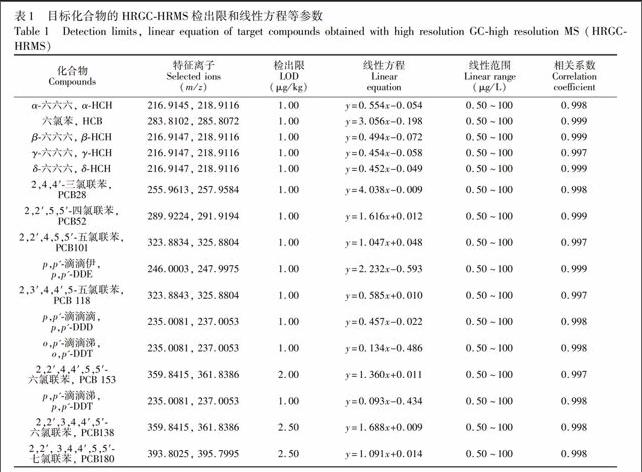
在2001年,Covaci等[12]采用GC-ECD分析技术检测人发中含氯有机污染物。由于头发中目标物浓度低,为了提高分析方法的灵敏度和降低检出限,该方法在样品前处理时需将样品提取液或净化液浓缩到50 μL后进样。这样大大延长了样品前处理时间,同时容易造成低沸点目标物HCB和HCH的损失,且单独采用保留时间定性也难以保证定性分析的准确性。本方法采用GC-HRMS技术,将仪器的检出限从1.0 μg/L(GC-ECD)降低到0.20~0.50 μg/L,在简化和缩减了样品前处理过程和时间的同时,确保了分析的灵敏度和定性与定量分析的准确性。表1中列出了16种目标物的HRGC-HRMS分析方法参数。
3.4 婴儿胎发中16种含氯POPs的残留情况
所有样品中均有HCB, HCHs和DDTs检出,浓度范围分别为5.48~8.40 μg/kg, 3.86~27.1 μg/kg和1.16~18.3 μg/kg, 表明胎儿在母体中不同污染物的累积暴露水平差异显著。
胎发中检出的HCHs以β-HCH和γ-HCH为主,两者平均浓度分别为9.27和5.81 μg/kg,检出率分别为100%和85%。与本研究组前期的母乳中HCHs研究结果相比[18],婴儿胎发中γ-HCH与β-HCH浓度差异显著减小,而检出率显著提高。这可能是由于γ-HCH的水溶解性比β-HCH强,更容易通过血液从母体运输到胎儿体内及胎发。除了β-HCH和γ-HCH外,α-HCH的检出率为30%(均值为3.32 μg/kg),δ-HCH未检出。
婴儿胎发中HCB的平均浓度为6.91 μg/kg,与HCHs和PCBs相比,个体间浓度无显著差异。这可能由于HCB是一种多源性释放和多形式传输的典型POPs。
与有机氯农药相比,胎发样品中PCBs的检出率较低,以低氯代PCB28和PCB52为主,检出率为50%和40%,质量浓度占胎发中16种POPs总量的24%(如图2)。与HCHs和DDTs相比,PCBs各种单体的检出浓度差异较大,例如PCB28的浓度范围为1.70~21.3 μg/kg。这种浓度的显著差异性,以及与母体中PCBs蓄积水平的相关性,还有待进一步研究。
4 结 论
采用HRGC-HRMS方法检测婴儿胎发中16种典型含氯POPs,对16种目标物在多种色谱柱上分离效果进行了比较和筛选,本方法灵敏度高,定性准确,很好地满足婴儿胎发中低含量POPs的检测要求。研究结果表明,20个胎发样本中普遍检测出典型含氯有机污染物HCHs, HCB, DDTs和PCBs,其中OCPs和PCBs的平均残留总量分别为36.3和24.1 μg/kg,OCPs的残留浓度和比重均大于PCBs。此结果与其它以脐带或胎盘血为介质评价胎儿在母体内含氯POPs暴露风险的研究结果一致,但胎发中HCHs和PCBs浓度显著高于现有报道的脐带或胎盘血中HCHs或PCBs的浓度[19,20]。因此,胎发中POPs的监测既可在一定程度上反映胎儿在母体中POPs累积蓄积水平,又能反映胎儿在母体中的POPs暴露风险。
References
1
LIN Zhu-Guang, JIN Zhen, LIU Yong, FAN Yu-Lan, TAN Jun, MA Yu, CHEN Mei-Yu, CHEN Zhao-Bin. Chem. J. Chinese Universities, 2005, ?26(12): 2218-2222
林竹光, 金 珍, 刘 勇, 范玉兰, 谭 君, 马 玉, 陈美瑜, 陈招斌. 高等学校化学学报, 2005, 26(12): 2218-222
2 HE Sheng-Liang, HAI Guan-Geng, LI Chao-Lin, ?LI Shuang. Chinese J.Prev. Med., 2006, 7(4): 334-336
何升良, 韩关根, 李朝林, 李 霜. 中国预防医学, 2006, 7(4): 334-336
3 LI Shuang, HAN Guan-Geng, XU Ying, CHEN Ling-Xuan, REN Jun, ZHOU An-Shou, SHI Xiao, LI Zhao-Lin. Chinese J.Ind. Med., ?2006, 19(3): 136-138
李 霜, 韩关根, 徐 盈, 陈令宣, 任 军, 周安寿, 史 晓, 李朝林. ?中国工业医学, 2006, 19(3): 136-138
4 Wang Y R, Zhang M, Wang Q, Yang D Y, Li C L, Liu J, Li J G, Li H, Yang X Y. Sci. Total Environ., ?2008, 396(1): 34-41
5 Yu Y X, Wang X L, Wang B, Tao S, Liu W X, Wang X J, Cao J, Li B G, Lu X X, Wong M H. Environ. Sci. Technol., ?2011, 45(23): 10235-10242
6 Adetona O, Horton K, Sjodin A, Jones R, Hall D B, Manuel A V, Cassidy B E, Vena J E, Needham L L, Naeher L P. Chemosphere, ?2013, 91(10): 1426-1433
7 Schramm K W, Kuettner T, Weber S, Lutzke K. Chemosphere, ?1992, 24(3): 351-358
8 Schramm K W. Bull. Environ. Contam. Toxicol., ?1997, 59(3): 396-402
9 Covaci A, Tutudaki M, Tsatsakis A, Schepens P. Chemosphere, ?2002, 46(3): 413-418
10 Salquèbre G, Schummer C, Millet M, Briand O, Appenzeller B M R. Anal. Chim. Acta, ?2012, 710: 65-74
11 Zhao G F, Wang Z J, Dong M H, Rao K F, Luo J P, Wang D H, Zha J M, Huang S B, Xua Y P, Ma M. Sci. Total Environ., ?2008, 397(1-3): 46-57
12 Covaci A, Schepens P. Chromatographia, ?2001, 53(1): S366-S371
13 Ostrea E M Jr., Bielawski D M, Posecion N C Jr, Corrion M, Esterlita V Uy, Bernardo R C, Jin Y, Janisse J J, Ager J W. Environ. Res., ?2009, 109(1): 116-122
14 Schummer C, Salquèbre G, Briand O, Millet M, Appenzeller B M. Toxicol. lett., ?2012, 210(2): 203-210
15 Wielgomas B, Czarnowski W, Jansen EH. Chemosphere, ?2012, 89(8): 975-981
16 Behrooz R D, Barghi M, Bahramifar N, Sari A E. Chemosphere, ?2012, 86(3): 235-241
17 Kerstin N, Merkel G, Randow F F E. Toxicol. Lett., ?1999, 107(1): 189-192
18 Song S L, Ma X D, Tong L, Tian Q, Huang Y, Yin S Q, Sun H B. Environ. Monit. Assess., ?2013, 185(9): ?7225-7229
19 Lopes B, Arrebola J P, Serafim A, Company R, J. Olea R N. Chemosphere, ?2014, 114: 291-302
20 Dewan P, Jain V, Gupta P, Banerjee B D. Chemosphere, ?2013, 90(5): 1704-1710
Determination of Chlorinated Persistent Organic Pollutants in Infant Hair
by Gas Chromatography-High Resolution Mass Spectrometry
SONG Shu-Ling1, HU Xiao-Jian3, QI Peng1, LI Song1, TONG Ling1, TIAN Qin1, MA Xiao-Dong*2
1(National Research Center for Geological Analysis, Beijing 100037, China)
2(Applied Chemistry, China Agricultural University, Beijing 100193, China)
3(Institute of Environmental Heath and Relative Product Safety China Centers for Disease Control, Beijing 100021, China)
Abstract ?Infant hair is a good medium to assess the cumulative exposure level of infant in the mother's body. Chlorinated persistent organic pollutants were ubiquitous and with the highest volume concentration in the human body. In this experiment, 20 infant hairs were collected from Beijing. The sample was overnight incubated in HCl, extracted with the mixture of hexane and dichloromethane, and cleaned up by a cartridge filled with alumina and acidified silica. The final eluate was concentrated, and 16 kinds of typical chlorinated persistent organic pollutants were detected with gas chromatography-high resolution mass spectrometry (HRGC-MS). The results showed that the detection limit of the target compounds in sample was 1.00-2.50 μg/kg, the recovery of surrogate in all samples was more than 67.6%, and the range of recoveries for target compounds in spiked sample was 62.5%-92.3%. The positive rate is 100% for hexachlorobenzene, β-HCH and p,p′-DDE, 85% for γ-HCH, 50% for PCB28, and 40% for PCB52. The concentrations of Hexachlorobenzene, HCHs, DDTs and PCBs were 5.48-8.40 μg/kg, 3.86-27.1 μg/kg, 1.16-18.3 μg/kg and 2.20-22.1 μg/kg, respectively. The average concentrations were 7.84 μg/kg for hexachlorobenzene, 6.93 μg/kg for HCHs, 5.53 μg/kg for DDTs, and 3.44 μg/kg for PCBs. The method and the analysis results can be used to evaluate the accumulation level and cumulative exposure level of 16 target compounds for fetal in mother′s body.
Keywords Infant fair; Chlorinated persistent organic pollutants; Gas chromatography-high resolution mass spectrometry; Cumulative exposure
(Received 21 August 2014; accepted 9 October 2012)
This work was supported by the Key Projects in the National Science & Technology Pillar Program (No.2011BAE06B09-04)



摘 要 婴儿的胎发是评价婴儿在母体环境中污染物累积暴露水平的良好介质。含氯持久性有机污染物是人体中残留浓度最高的持久性有机污染物。本研究依次采用HCl酸化、正己烷/二氯甲烷混合溶液萃取、硅胶和氧化铝混合填充小柱净化,以及气相色谱高分辨质谱法检测了北京20个婴儿胎发中的16种典型含氯持久性有机污染物。结果表明,16种目标物的检出限可达到1.0~2.5 μg/kg,替代物五氯硝基苯回收率大于67.6%,加标样品中目标物回收率范围为62.5%~92.3%。20个胎发样品中六氯苯、β-六六六和p,p′-滴滴伊检出率均为100%,γ-六六六、2,4,4′-三氯联苯和2,2′,5,5′-四氯联苯的检出率分别为85%, 50%和40%。4种污染物总量的浓度分布范围分别为5.48~8.40 μg/kg(六氯苯)、3.86~27.1 μg/kg(六六六)、1.16~18.3 μg/kg(滴滴涕)和2.20~22.1 μg/kg(多氯联苯),平均浓度分别为6.91,6.10,5.53和3.44 μg/kg。此方法和分析结果可用于胎儿体内16种含氯持续性有机污染物蓄积水平和母体内累计暴露水平的评价。
关键词 胎发;含氯持久性有机污染物;气相色谱高分辨质谱;累积暴露
1 引 言
大量研究表明,有机氯农药(Organochlorine pesticides, OCPs)和多氯联苯(Polychlorodiphenyls, PCBs)是人体内蓄积浓度最高、代谢速度极为缓慢的持久性有机污染物(Persistent organic pollutants, POPs)[1]。在怀孕期间,母体中蓄积的高浓度OCPs和PCBs通过各种途径进入胎儿体内及各种脂肪组织或器官。目前,研究者通常采用脐带血为介质[2~5],通过分析其中的POPs浓度评价胎儿在母体内POPs的暴露风险。遗憾的是脐带血取样困难,同时脐带血中POPs的浓度会随着母体血液中POPs浓度改变[6]反映的是胎儿的短期暴露水平,不能直接反映胎儿体内以及胎儿在母体内POPs的蓄积水平。
胎儿在母体中15周后开始生长胎发,而胎发具有生长周期长、容易采集和不伤害婴儿身体的特点。本研究以胎发为介质,分析其中典型的16种含氯高浓度POPs,进而评价婴儿在母体中的累积暴露水平。
早在1992年,Schramm等就指出头发含有3%~4%的脂肪,是评价人体在环境中有机污染物长期暴露和短期暴露情况的良好生物介质[7,8]。随后,更多的研究者均验证了头发作为监测基质,评价人体在环境中有机污染物的暴露风险的可行性,并开展了相关的研究[9~13]。如Schummer等以头发为介质,通过分析当地居民头发等多种介质中农药,评价了不同农药的暴露水平[14]; Wielgomas等分析了40年内波兰人发中的含氯POPs的变化趋势,表明人发中含氯POPs浓度持续下降[15],Behrooz等利用人发研究了伊朗怀孕女性含氯POPs的暴露水平[16], Kerstin等采集德国儿童头发,研究了儿童体外含氯POPs的暴露水平[17]。以上结果均表明,头发可作为一种评价人体含氯POPs的暴露水平的良好介质。但当前的研究主要以成年人头发为介质研究暴露水平,鲜有用胎发作为监测介质,评价胎儿在母体内POPs的暴露水平或出生前体内POPs的蓄积水平。其主要原因是胎发中目标物含量低,且样品难收集、采样量有限,故对分析方法的灵敏度和检出限要求高。
本研究收集了北京地区20个胎发样品, 采用气相色谱高分辨质谱(Gas chromatography and high resolution mass spectrometry, GC-HRMS)准确测定20个胎发样品中低含量典型含氯POPs的种类和浓度,初步评价北京婴幼儿在母体中含氯POPs的暴露水平。
2 实验部分
2.1 仪器与材料
AutoSpec Premier 型高分辨质谱仪,配有Agilient 7890气相色谱仪和自动进样器(美国Waters公司); GC 2010气相色谱仪(日本Shimadzhu公司),配有电子捕获检测器(Electron capture detector, ECD); LABORATA4003型旋转蒸发仪(德国Heidolph公司); KL512/509J型氮吹仪(中国康林公司)。
硅胶(75~150 μm)和氧化铝(150 μm)均为分析纯(北京化学试剂厂);酸化硅胶: 将27 mL浓H2SO4与50 g 硅胶充分振荡、混匀后放入干燥器备用;10%水钝化氧化铝: 向100 g中性氧化铝中加入10 mL超纯水,充分振荡、混匀放入干燥器中备用。
2.2 标准溶液和主要试剂
8种OCPs混合标准溶液:α-六六六(α-Hexachlorocyclohexane,α-HCH)、β-六六六(β-HCH)、 γ-六六六(γ-HCH)、δ-六六六(δ-HCH)、p,p′-滴滴伊(1,1-Dichloro-2-(4-chlorophenyl)-2-(4-chlorophenyl)ethene,p,p′-DDE)、p,p′-滴滴滴(1,1-Dichloro-2-(4-chlorophenyl)-2-(4-chlorophenyl)ethane,p,p′-DDD)、o,p′-滴滴涕(o,p′-DDT)、p,p′-滴滴涕(p,p′-DDT),浓度50 mg/L,甲醇相。六氯苯(Hexachlorobenzene, HCB),浓度为101 mg/L,异辛烷相。7种PCBs混合标准溶液:2,4,4′-三氯联苯(2,4,4′-Trichlorobiphenyl,PCB28)、2,2′,5,5′-四氯联苯(2,2′,5,5′-Tetrachlorobiphenyl,PCB52)、2,2′,4,5,5′-五氯联苯(2,2′,4,5,5′-Pentachlorobiphenyl,PCB101)、2,3′,4,4′,5-五氯联苯(2,3′,4,4′,5-Pentachlorobiphenyl,PCB118)、2,2′,3,4,4′,5′-六氯联苯(2,2′,3,4,4′,5′-Hexachlorobiphenyl,PCB138)、2,2′,4,4′,5,5′-六氯联苯(2,2′,4,4′,5,5′-Hexachlorobiphenyl,PCB153)、2,2′,3,4,4′,5,5′-七氯联苯(2,2′,3,4,4′,5,5′-Heptachlorobiphenyl,PCB180),浓度2.0 mg/L,异辛烷相。以上标准均购自中国计量科学研究院国家标准物质研究中心。
五氯硝基苯,浓度为10 mg/L,环己烷相(Dr.Ehrenstorfer公司);正己烷,二氯甲烷(色谱纯,百灵威科技有限公司);HCl(优级纯,北京化学试剂厂)。
2.3 样品处理方法
婴儿出生30天内采集胎发,并收集到密封袋中。将胎发用去离子水清洗后,自然晾干,并剪成1~3 mm。准确称取100 mg胎发,转移到15 mL的离心管中,加入20 μL 1.0 mg/L 五氯硝基苯,6 mL 4 mol/L HCl,加盖,置60 ℃水浴中连续酸化16 h[12]。
向离心管中加入3 mL 正己烷-二氯甲烷(4∶1, V/V)进行液液萃取,充分振摇5 min,收集上层的提取液,并用等体积的正己烷-二氯甲烷重复萃取一次。合并两次萃取液,将萃取液浓缩到2~3 mL,并用硅胶、氧化铝和无水Na2SO4的混合自制SPE柱净化样品,以15 mL正己烷-二氯甲烷(4∶1, V/V)为淋洗液,浓缩洗脱液,并用正己烷定容至1.0 mL,待测。
2.4 气相色谱-高分辨质谱分析方法
GC分析条件:进样口温度290 ℃;无分流进样;载气(高纯氦气,99.999%)流速1.2 mL/min。色谱柱 DB-5MS(J&W, 60 m×0.25 mm×0.25 μm)。色谱柱升温程序:初始80 ℃保持2.0 min,以15 ℃/min升温至150 ℃,再以15 ℃/min升温至270 ℃保持3 min,最后以15 ℃/min升温至300 ℃保持1.0 min。传输线温度250 ℃;质谱条件:电子轰击(EI)离子源能量35 eV;温度280 ℃;检测方式多离子检测(MID);加速电压8000 V;分辨率用全氟煤油PFK43调协分辨率到10000。
3 结果与讨论
3.1 色谱柱的选择
弱极性色谱柱通常是分析有机氯农药和多氯联苯类化合物的理想色谱柱。研究中比较了多个厂家、不同长度、相似极性的毛细管色谱柱对16种目标物的分离效果。这些色谱柱包括DB-5, HT-8, Rtx-CLPesticides2, VF-5和VF-1701。结果表明,30 m的色谱柱一般无法实现16种目标物的基线分离。例如,VF-1701(Varian, 30 m×0.25 mm×0.25 μm)无法分离PCB153和o,p′-DDT,以及基线分离PCB138和p,p′-DDD;DB-5(J&W, 30 m×0.25 mm×0.25 μm)和VF-5(Varian, 30 m×0.25 mm×0.25 μm)无法基线分离o,p′-DDT和p,p′-DDD,以及PCB138和p,p′-DDT;Rtx-CLPesticides2无法分离PCB138和p,p′-DDT。而HT-8(SGE, 25 m×0.22 mm×0.25 μm)、DM-5MS(Dikma, 30 m×0.25 mm×0.25 μm)、DM-5MS(Dikma, 50 m×0.25 mm×0.25 μm)和DB-5MS(J&W, 60 m×0.25 mm×0.25 μm)均能有效分离16种目标物,特别是o,p′-DDT和p,p′-DDD、o,p′-DDT和PCB153以及PCB138和p,p′-DDT这3对化合物。图1例举了3种色谱柱上16种目标物的GC-ECD色谱分离图。
3.2 质量控制
质量控制主要包括试剂空白和分析过程全流程控制。
16种目标物是环境中普遍存在的典型含氯POPs,其在胎发中浓度远低于其它生物样品中的浓度。为了确保分析结果的准确度和精密度、降低方法的检出限,需要最低限度地降低空白本底值和减少干扰。将实验中使用的正己烷和二氯甲烷分别取50 mL进行浓缩,然后定容到1.0 mL,分别以HT-8(30 m), DM-5MS(30 m), DM-5MS(50 m)和DB-5MS(60 m)色谱柱进行分析,并与16种目标物色谱图对比。结果表明,正己烷和二氯甲烷中的16种目标物的浓度均低于0.02 μg/L,但HT-8无法基线分离δ-HCH与干扰物邻苯二甲酸酯;DM-5MS(30 m)无法基线分离PCB180与某大分子干扰物;只有DM-5MS (50 m×0.25 mm×0.25μm)和DB-5MS(60 m×0.25 mm×0.25 μm)能同时满足所有目标物,以及目标物与空白样品中干扰物的基线分离。本研究选择DB-5MS(60 m)作为分析色谱柱。
采用添加替代物、全流程试剂空白和试剂空白加标监控分析全流程,并采用平行样品、实际样品和实际样品添加标准(实际加标样品)评价方法的稳定性、准确性和精密度。样品提取前,每个样品中添加五氯硝基苯作为替代物,试剂空白加标和实际加标样品中添加了目标物,并以五氯硝基苯的回收率、试剂空白加标样品和实际加标样品中目标物的回收率评价目标物在整个过程中的损失及整个分析方法准确度。结果表明,五氯硝基苯的回收率范围为67.6%~85.2%,加标样品中目标物回收率范围为62.5%~92.3%。
3.3 分析方法的灵敏度和检出限
在2001年,Covaci等[12]采用GC-ECD分析技术检测人发中含氯有机污染物。由于头发中目标物浓度低,为了提高分析方法的灵敏度和降低检出限,该方法在样品前处理时需将样品提取液或净化液浓缩到50 μL后进样。这样大大延长了样品前处理时间,同时容易造成低沸点目标物HCB和HCH的损失,且单独采用保留时间定性也难以保证定性分析的准确性。本方法采用GC-HRMS技术,将仪器的检出限从1.0 μg/L(GC-ECD)降低到0.20~0.50 μg/L,在简化和缩减了样品前处理过程和时间的同时,确保了分析的灵敏度和定性与定量分析的准确性。表1中列出了16种目标物的HRGC-HRMS分析方法参数。
3.4 婴儿胎发中16种含氯POPs的残留情况
所有样品中均有HCB, HCHs和DDTs检出,浓度范围分别为5.48~8.40 μg/kg, 3.86~27.1 μg/kg和1.16~18.3 μg/kg, 表明胎儿在母体中不同污染物的累积暴露水平差异显著。
胎发中检出的HCHs以β-HCH和γ-HCH为主,两者平均浓度分别为9.27和5.81 μg/kg,检出率分别为100%和85%。与本研究组前期的母乳中HCHs研究结果相比[18],婴儿胎发中γ-HCH与β-HCH浓度差异显著减小,而检出率显著提高。这可能是由于γ-HCH的水溶解性比β-HCH强,更容易通过血液从母体运输到胎儿体内及胎发。除了β-HCH和γ-HCH外,α-HCH的检出率为30%(均值为3.32 μg/kg),δ-HCH未检出。
婴儿胎发中HCB的平均浓度为6.91 μg/kg,与HCHs和PCBs相比,个体间浓度无显著差异。这可能由于HCB是一种多源性释放和多形式传输的典型POPs。
与有机氯农药相比,胎发样品中PCBs的检出率较低,以低氯代PCB28和PCB52为主,检出率为50%和40%,质量浓度占胎发中16种POPs总量的24%(如图2)。与HCHs和DDTs相比,PCBs各种单体的检出浓度差异较大,例如PCB28的浓度范围为1.70~21.3 μg/kg。这种浓度的显著差异性,以及与母体中PCBs蓄积水平的相关性,还有待进一步研究。
4 结 论
采用HRGC-HRMS方法检测婴儿胎发中16种典型含氯POPs,对16种目标物在多种色谱柱上分离效果进行了比较和筛选,本方法灵敏度高,定性准确,很好地满足婴儿胎发中低含量POPs的检测要求。研究结果表明,20个胎发样本中普遍检测出典型含氯有机污染物HCHs, HCB, DDTs和PCBs,其中OCPs和PCBs的平均残留总量分别为36.3和24.1 μg/kg,OCPs的残留浓度和比重均大于PCBs。此结果与其它以脐带或胎盘血为介质评价胎儿在母体内含氯POPs暴露风险的研究结果一致,但胎发中HCHs和PCBs浓度显著高于现有报道的脐带或胎盘血中HCHs或PCBs的浓度[19,20]。因此,胎发中POPs的监测既可在一定程度上反映胎儿在母体中POPs累积蓄积水平,又能反映胎儿在母体中的POPs暴露风险。
References
1
LIN Zhu-Guang, JIN Zhen, LIU Yong, FAN Yu-Lan, TAN Jun, MA Yu, CHEN Mei-Yu, CHEN Zhao-Bin. Chem. J. Chinese Universities, 2005, ?26(12): 2218-2222
林竹光, 金 珍, 刘 勇, 范玉兰, 谭 君, 马 玉, 陈美瑜, 陈招斌. 高等学校化学学报, 2005, 26(12): 2218-222
2 HE Sheng-Liang, HAI Guan-Geng, LI Chao-Lin, ?LI Shuang. Chinese J.Prev. Med., 2006, 7(4): 334-336
何升良, 韩关根, 李朝林, 李 霜. 中国预防医学, 2006, 7(4): 334-336
3 LI Shuang, HAN Guan-Geng, XU Ying, CHEN Ling-Xuan, REN Jun, ZHOU An-Shou, SHI Xiao, LI Zhao-Lin. Chinese J.Ind. Med., ?2006, 19(3): 136-138
李 霜, 韩关根, 徐 盈, 陈令宣, 任 军, 周安寿, 史 晓, 李朝林. ?中国工业医学, 2006, 19(3): 136-138
4 Wang Y R, Zhang M, Wang Q, Yang D Y, Li C L, Liu J, Li J G, Li H, Yang X Y. Sci. Total Environ., ?2008, 396(1): 34-41
5 Yu Y X, Wang X L, Wang B, Tao S, Liu W X, Wang X J, Cao J, Li B G, Lu X X, Wong M H. Environ. Sci. Technol., ?2011, 45(23): 10235-10242
6 Adetona O, Horton K, Sjodin A, Jones R, Hall D B, Manuel A V, Cassidy B E, Vena J E, Needham L L, Naeher L P. Chemosphere, ?2013, 91(10): 1426-1433
7 Schramm K W, Kuettner T, Weber S, Lutzke K. Chemosphere, ?1992, 24(3): 351-358
8 Schramm K W. Bull. Environ. Contam. Toxicol., ?1997, 59(3): 396-402
9 Covaci A, Tutudaki M, Tsatsakis A, Schepens P. Chemosphere, ?2002, 46(3): 413-418
10 Salquèbre G, Schummer C, Millet M, Briand O, Appenzeller B M R. Anal. Chim. Acta, ?2012, 710: 65-74
11 Zhao G F, Wang Z J, Dong M H, Rao K F, Luo J P, Wang D H, Zha J M, Huang S B, Xua Y P, Ma M. Sci. Total Environ., ?2008, 397(1-3): 46-57
12 Covaci A, Schepens P. Chromatographia, ?2001, 53(1): S366-S371
13 Ostrea E M Jr., Bielawski D M, Posecion N C Jr, Corrion M, Esterlita V Uy, Bernardo R C, Jin Y, Janisse J J, Ager J W. Environ. Res., ?2009, 109(1): 116-122
14 Schummer C, Salquèbre G, Briand O, Millet M, Appenzeller B M. Toxicol. lett., ?2012, 210(2): 203-210
15 Wielgomas B, Czarnowski W, Jansen EH. Chemosphere, ?2012, 89(8): 975-981
16 Behrooz R D, Barghi M, Bahramifar N, Sari A E. Chemosphere, ?2012, 86(3): 235-241
17 Kerstin N, Merkel G, Randow F F E. Toxicol. Lett., ?1999, 107(1): 189-192
18 Song S L, Ma X D, Tong L, Tian Q, Huang Y, Yin S Q, Sun H B. Environ. Monit. Assess., ?2013, 185(9): ?7225-7229
19 Lopes B, Arrebola J P, Serafim A, Company R, J. Olea R N. Chemosphere, ?2014, 114: 291-302
20 Dewan P, Jain V, Gupta P, Banerjee B D. Chemosphere, ?2013, 90(5): 1704-1710
Determination of Chlorinated Persistent Organic Pollutants in Infant Hair
by Gas Chromatography-High Resolution Mass Spectrometry
SONG Shu-Ling1, HU Xiao-Jian3, QI Peng1, LI Song1, TONG Ling1, TIAN Qin1, MA Xiao-Dong*2
1(National Research Center for Geological Analysis, Beijing 100037, China)
2(Applied Chemistry, China Agricultural University, Beijing 100193, China)
3(Institute of Environmental Heath and Relative Product Safety China Centers for Disease Control, Beijing 100021, China)
Abstract ?Infant hair is a good medium to assess the cumulative exposure level of infant in the mother's body. Chlorinated persistent organic pollutants were ubiquitous and with the highest volume concentration in the human body. In this experiment, 20 infant hairs were collected from Beijing. The sample was overnight incubated in HCl, extracted with the mixture of hexane and dichloromethane, and cleaned up by a cartridge filled with alumina and acidified silica. The final eluate was concentrated, and 16 kinds of typical chlorinated persistent organic pollutants were detected with gas chromatography-high resolution mass spectrometry (HRGC-MS). The results showed that the detection limit of the target compounds in sample was 1.00-2.50 μg/kg, the recovery of surrogate in all samples was more than 67.6%, and the range of recoveries for target compounds in spiked sample was 62.5%-92.3%. The positive rate is 100% for hexachlorobenzene, β-HCH and p,p′-DDE, 85% for γ-HCH, 50% for PCB28, and 40% for PCB52. The concentrations of Hexachlorobenzene, HCHs, DDTs and PCBs were 5.48-8.40 μg/kg, 3.86-27.1 μg/kg, 1.16-18.3 μg/kg and 2.20-22.1 μg/kg, respectively. The average concentrations were 7.84 μg/kg for hexachlorobenzene, 6.93 μg/kg for HCHs, 5.53 μg/kg for DDTs, and 3.44 μg/kg for PCBs. The method and the analysis results can be used to evaluate the accumulation level and cumulative exposure level of 16 target compounds for fetal in mother′s body.
Keywords Infant fair; Chlorinated persistent organic pollutants; Gas chromatography-high resolution mass spectrometry; Cumulative exposure
(Received 21 August 2014; accepted 9 October 2012)
This work was supported by the Key Projects in the National Science & Technology Pillar Program (No.2011BAE06B09-04)

