胰腺导管内乳头状黏液性肿瘤的临床表现与影像学特征
肖鹏 白洁 李明阳

[摘要]目的 探讨胰腺导管内乳头状黏性液瘤(IPMN)的临床特征及影像学的特征。方法 回顾性分析2013年1月~2017年12月解放军总医院(301医院)收治的45例IPMN患者的临床资料、影像学资料、病理分型及治疗方式。结果 45例IPMN患者中主胰管型(MD-IPMN)13例,分支胰管型28例(BD-IPMN),混合型4例(MT-IPMN)。术后病理提示低度异型增生25例,中度异型增生5例,高度异型增生4例,浸润癌11例。良性占所有患者的比例为77.8%,恶性占所有患者总数为22.2%。良恶性BD-IPMN患者主胰管直径及壁结节比较,差异有统计学意义(P<0.05),良恶性MD-IPMN及MT-IPMN患者的肿瘤大小、主胰管(MPD)直径以及壁结节的比较,差异有统计学意义(P<0.05)。影像学诊断IPMN良性的灵敏度为86.7%,特异度为73.3%,准确度为77.7%。结论 影像学对IPMN良恶性的鉴别诊断具有一定的临床价值。
[关键词]导管内乳头状黏液性肿瘤;临床特征;影像学诊断
[中图分类号] R735.9? ? ? ? ? [文献标识码] A? ? ? ? ? [文章编号] 1674-4721(2019)8(c)-0076-04
[Abstract] Objective To explore the clinical feature and imaging manifestations of introductal papillary mucinous neoplasm (IPMN). Methods The clinical features, imaging data and pathogical files of the 45 IPMN patients treated in PLA General Hospital from January 2013 to December 2017 were retrospectively analyzed. Results Of the 45 patient, 13 cases were with main duct type (MD-IPMN), 28 cases were with branch duct type (BD-IPMN), and 4 cases were with mixed pancreatic duct type (MT-IPMN). Postoperative pathology revealed 25 cases of low-grade dysplasi, 5 cases of moderate dysplasi, 4 cases of high dysplasia, 11 cases of invasive carcinoma. Benign diseases accounted for 77.8% of all patients, malignancy accounted for 22.2% of all patients. The difference of mural nudules and main pancreatic duct diameter between benign and malignant BD-IPMN patients was statistically significant (P<0.05). The difference of size of the cyst, mural nudules and main pancreatic duct diameter between benign and malignant MD-IPMN and MT-IPMN patients was statistically significant (P<0.05). The sensitivity, specificity and accurity of the imaging diagnoses of IPMN were 86.7%, 73.3% and 77.7%. Conclusion Imaging has clinical and diagnostic values in differential diagnosis of benign and malignant IPMN.
[Key words] Introductal papillary mucinous neoplasm; Clinical feature; Imaging diagnosis
近年來,随着CT、磁共振检查(MRI)等影像学技术的发展及临床医生对胰腺囊性病变认识的加深,胰腺导管内乳头状黏液性肿瘤(intraductal papillary mucinous neoplasm,IPMN)的发病率呈逐年上升趋势[1-2]。IPMN大多起病隐匿,早期无明显的临床症状,目前被认为是一种癌前病变[3]。与胰腺癌相比,IPMN预后良好,因此IPMN诊断及治疗方法的选择极为重要。但目前对IPMN的自然转归及可能进展为胰腺癌的时间节点及进展途径认识仍不够完全,导致无法预测哪种类型的IPMN具有高的进展为侵袭性疾病的风险。本研究通过对IPMN患者的临床及影像学资料分析,能够为临床识别具有潜在恶性的或正在转化为恶性IPMN提供理论基础。
1资料与方法
1.1一般资料
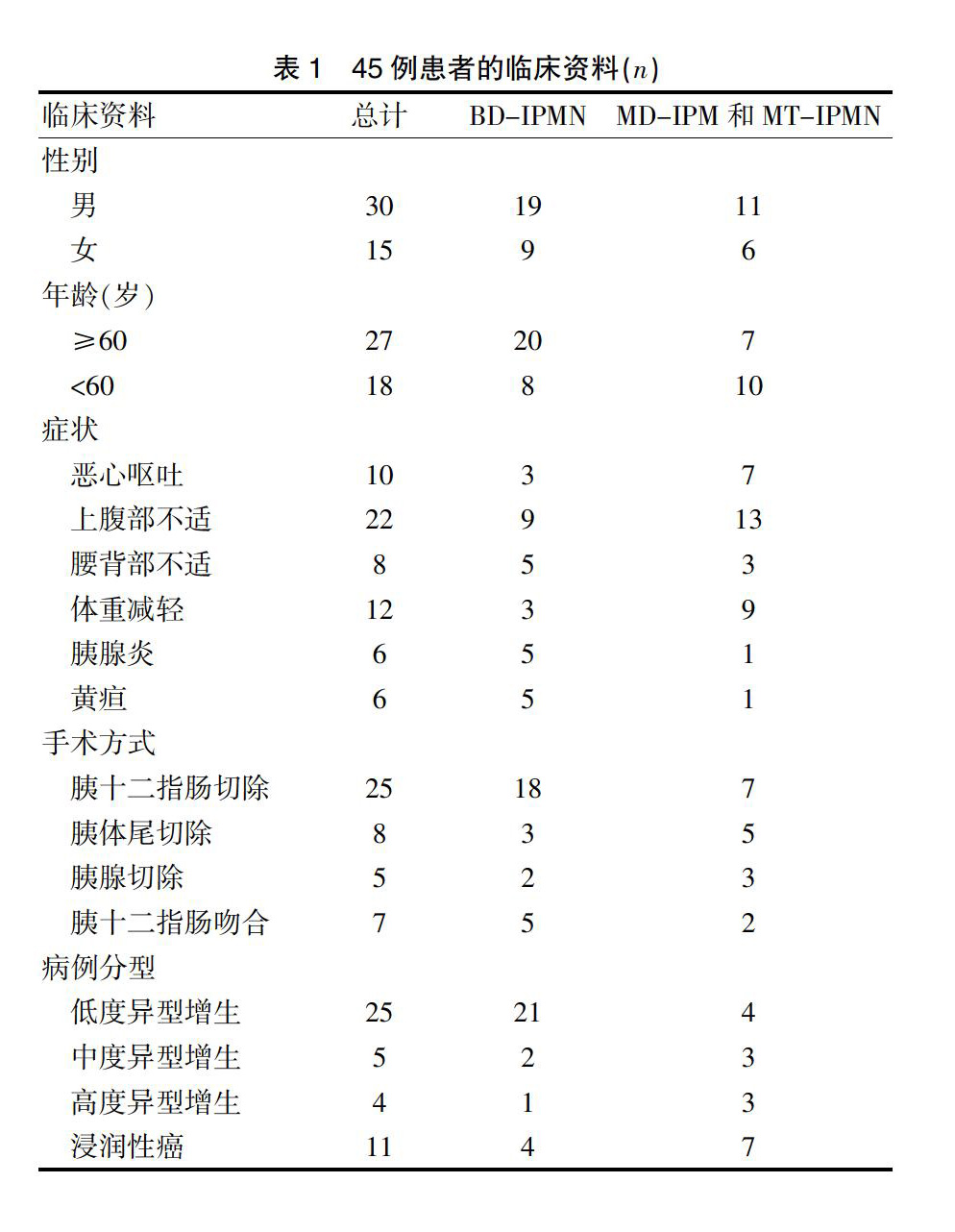
选取2013年1月~2017年12月于中国人民解放军总医院(301医院)接受治疗的45例IPMN患者的临床资料进行回顾性分析。纳入标准:①所有患者均经病理学诊断确诊为IPMN;②患者均在301医院手术,并有完整的影像学资料。排除标准:①胰腺癌患者;②合并其他系统如心血管、免疫、血液系统严重疾病患者。其中男30例,女15例;年龄46~89岁,平均(63.2±10.3)岁。45例患者中31例有临床症状,其中持续性上腹部不适8例,体重减轻7例,黄疸6例,以胰腺炎发作6例,肩后背部不适6例。
1.2检查方法
全组患者均行CT和MRI检查。检查流程按照医院影像学检查前的准备工作进行,检查设备为同一型号设备。
1.3影像学分析及病理分型
影像学检查重点观察病灶部位、大小、形态、内部结构,胰管扩张程度以及有无壁结节等。根据指南,将IPMN分为主胰管型(main ductal-IPMNs,MD-IPMN)、分支胰管型(branch ductal-IPMNs,BD-IPMN)及混合胰管型(mix-IPMN,MT-IPMN)。按指南所述[4-6],BD-IPMN的高危特征包括:①胰头部囊性病变伴梗阻性黄疸出现;②囊腔内出现强化的实性成分;③主胰管(main pancreatic duct,MPD)直径≥10 mm,报警特征包括囊腔直径≥3 cm、囊壁增厚或出现强化(>2 mm)、囊腔内不强化的壁结节;④胰管突然变细并伴胰尾部萎缩。MD-IPMN暂无统一的分级标准,根据指南,MT-IPMN可任意按照BD-IPMN及MD-IPMN标准进行处理,本研究根据患者临床表现以及疾病转归将其与MD-IPMN归为一类[4]。
患者的影像学及病理学检查结果由两名经验丰富的医师双盲阅片,对有争议的检查结果或测量值由第三名医师诊断后经协商得到最终结论。
1.4统计学方法
采用SPSS 17.0 统计学分析软件处理数据,对计数资料用百分率表示,进行χ2检验,以P<0.05为差异有统计学意义。
2结果
2.1患者的临床资料
45例患者中,男30例,女15例;平均年龄(63.2±10.3)岁。MD-IPMN和MT-IPMN患者17例,BD-IPMN患者28例。按病理类型划分,低度异型增生25例,中度异型增生5例,高度异型增生4例,浸润癌11例。良性占所有患者的比例为77.8%,恶性占所有患者比例为22.2%。BD-IPMN患者中恶性的比例为58.8%,MD-IPMN和MT-IPMN患者中恶性的比例为17.8%。患者入院时以上腹部不适为主要临床表现,同时有不同比例的患者有体重减轻,胰腺炎,黄疸等症状,具体资料见表1。
2.2患者的影像学表现
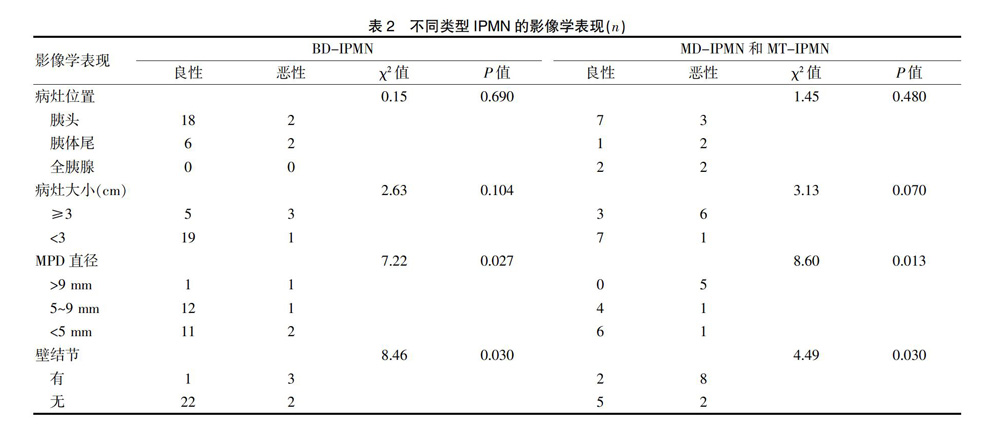
良恶性BD-IPMN的壁结节、MPD直径比较,差异有统计学意义(P<0.05),而病灶大小及病灶位置差异无统计学意义(P>0.05)。良恶性MD-IPMN和MT-IPMN病灶大小、MPD直径、壁结节比较,差异有统计学意义(P<0.05),而病灶位置差异无统计学意义(P>0.05)(表2)。
2.3影像学对良恶性IPMN诊断准确率的比较
结果显示,30例良性IPMN患者中,8例误诊为恶性,15例恶性IPMN患者中,2例误诊为良性,因此影像学诊断IPMN良性的的灵敏度为86.7%,特异度为73.3%,准确度为77.7%(表3)。
3讨论
IPMNS分为主胰管型、分支胰管型和混合胰管型,主胰管型的恶变风险高达40%~60%,明显高于分支胰管型的19%~30%[7-8]。根据胰腺上皮细胞显示不同程度的异型增生,将IPMN分为四个连续的阶段:低度异型增生、中度异型增生、高度异型增生和浸润性癌,临床分型及腺上皮的分型对IPMN的良恶性评估极为重要。在最近召开的胰腺肿瘤癌前病变共识会议上,建议将低度和中度异型增生均划分为低度异型增生[9-10]。IPMN的临床处理方法的选择取决于对IPMN恶性转化风险的准确评估,但IPMN在术前很难得到明确的诊断,只能通过联合患者的临床表现、症状及影像学资料进行初步的评估。2006年公布的胰腺囊性病变指南对手术患者的选择较为谨慎[11-12]。而2012年对指南进行了修正,内容包括:MD-IPMN患者的胰管扩张>5 mm,即使没有其他伴随症状也建议手术切除治疗;对于有报警症状的患者即胰腺头部囊性病变合并梗阻性黄疸,壁结节增强,主胰管直径≥10 mm的建议手术治疗,同时增加了对可疑恶性病变的临床观察的方法及实践[13]。
目前,IPMN的分型主要还是依赖影像学检查手段,而诊断的要点主要是判断病灶位置、大小及与MPD间的关系。MRI可较好的分辨受累的胰管及病变与胰管的关系,而CT可较好的显示病灶的大小、位置、强化方式、周围胰腺实质及血管、淋巴结受累的情况,ERCP可观察胰管受累、扩张情况,并可取病理及行内镜下治疗。不同的影像学检测方法联合可提高对IPMN的诊断的准确率[14-15]。本研究统计了CT和MRI联合诊断IPMN的准确率及灵敏度,结果显示,30例良性IPMN患者中,8例被誤诊为恶性,15例恶性IPMN患者中,2例被误诊为良性,因此影像学诊断IPMN良性的的灵敏度为86.7%,特异度为73.3%,准确度为77.7%。
IPMN患者的早期表现多不典型,易与胰腺炎、胰腺癌等混淆,但IPMN大多预后良好,治疗方法也与胰腺癌截然不同,这就要求临床医生根据患者的临床表现,准确选择检查手段,在诊断不清时,可联合多项检查同时诊断。因此本研究尚存在一定的局限性,回顾性研究中并非所有患者同时进行了CT和MRI检查,而样本量也比较小,可能无法充分说明此类疾病的特性。
综上所述,临床上诊疗IPMN患者时,可联合应用MRI及CT进行病情判断,如果病灶大小>3 cm,有壁结节,出现强化,主胰管有扩张,提示病变可能为恶性,应按照指南规定的方法进行随诊或治疗。
[参考文献]
[1]Okamura Y,Sano S,Sugiura T,et al.The 2012 international consensus guidelines of intraductal papillary mucinous neoplasms of the pancreas (fukuoka criteria) predict the malignant potential,even in actual clinical situations[J].Pancreas,2018,47(3):285-290.
[2]Ridtitid W,DeWitt JM,Schmidt CM,et al.Management of branch-duct intraductal papillary mucinous neoplasms:a large single-center study to assess predictors of malignancy and long-term outcomes[J].Gastrointest Endosc,2016,84(3):436- 445.
[3]Sugimoto M,Elliott IA,Nguyen AH,et al.Assessment of a revised management strategy for patients with intraductal papillary mucinous neoplasms involving the main pancreatic duct[J].JAMA Surg,2017,152(1):e163349.
[4]《中华胰腺病杂志》编辑委员会.我国胰腺囊性肿瘤共识意见(草案2013,上海)[J].中华胰腺病杂志,2013,13(2):79-90.
[5]Elta GH,Enestvedt BK,Sauer BG,et al.ACG clinical guideline: diagnosis and management of pancreatic cysts[J].Am J Gastroenterol,2018,113(4):464-479.
[6]European Study Group on cystic tumours of the pancreas.European evidence-based guidelines on pancreatic cystic neoplasms[J].Gut,2018,67(5):789-804.
[7]Rodriguez JR,Salvia R,Crippa S,et al.Branch-duct intraductal papillary mucinous neoplasms:observations in 145 patients who underwen resection[J].Gastroenterology,2007,133(1):72 -79.
[8]Ugbarugba EE,Grieco C,Hart PA,et al.Diagnostic accuracy of preoperative imaging for differentiation of branch duct versus mixed duct intraductal papillary mucinous neoplasms[J].Pancreas,2018,47(5):556-560.
[9]Attiyeh MA,Fernández-Del Castillo C,Al Efishat M,et al.Development and validation of a multi-institutional preoperative nomogram for predicting grade of dysplasia in intraductal papillary mucinous neoplasms (IPMNs)of the pancreas:a report from the pancreatic surgery consortium[J].Ann Surg,2018,267(1):157-163.
[10]张彤,黄子星,宋彬.胰腺导管内乳头状黏液性肿瘤的研究进展[J].中国普外基础与临床杂志,2017,24(3):376-380.
[11]Tanaka M,Fernández-Del Castillo C,Kamisawa T,et al.Revisions of international consensus fukuoka guidelines for the management of IPMN of the pancreas[J].Pancreatology,2017,17(5):738-753.
[12]Carpenter SL.Continuing Medical Education Questions:April 2018:ACG clinical guideline:diagnosis and management of pancreatic cysts[J].Am J Gastroenterol,2018,113(4):480.
[13]Tanaka M,Fernández-del Castillo C,Adsay V,et al.International consensus guidelines 2012 for the management of IPMN and MCN of the pancreas[J].Pancreatology,2012,12(3):183-197.
[14]陳宇,许秦风.影像学诊断在胰腺导管内乳头状黏液性肿瘤中的应用价值[J].江苏医药,2018,44(3):282-286.
[15]Strauss A,Birdsey M,Fritz S,et al.Intraductal papillary mucinous neoplasms of the pancreas:radiological predictors of malignant transformation and the introduction of bile duct dilation to current guidelines[J].Br J Radiol,2016,89(1061):20 150 853.
(收稿日期:2018-12-12? 本文编辑:崔建中)

