
摘要:目的 探讨淫羊藿苷调控大鼠骨髓间充质干细胞(MSC)迁移作用机制。方法 CCK-8法检测细胞增殖。建立体外细胞缺糖缺氧模型,Hoechst33342染色观察细胞凋亡。Western blot检测淫羊藿苷处理后MSC表面基质细胞衍生因子l(SDF-1)受体趋化因子受体4(CXCR4)的蛋白表达。Transwell小室跨膜实验观察淫羊藿苷对MSC迁移的作用。结果 0.01、0.1、1 μmol/L淫羊藿苷可明显促进MSC增殖,10 μmol/L淫羊藿苷抑制MSC增殖。经体外缺糖缺氧处理后,0.1、1 μmol/L淫羊藿苷可明显抑制MSC凋亡。淫羊藿苷可显著促进MSC CXCR4的蛋白表达,同时可提高MSC跨膜迁移的数量。加入CXCR4拮抗剂AMD3100后,各组间细胞迁移数量无明显差异。结论 一定浓度淫羊藿苷可促进MSC的增殖、存活和迁移,SDF-1/CXCR4信号通路参与淫羊藿苷调控MSC迁移的作用。
关键词:淫羊藿苷;骨髓间充质干细胞;存活;迁移;信号通路
DOI:10.3969/j.issn.1005-5304.2017.02.013
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2017)02-0044-05
干细胞是一类具有自我更新和多向分化潜能的原始细胞。在一定条件下,干细胞可以分化成多种功能细胞,成为治疗损伤性疾病极具潜力的疗法。在心
血管领域,近年来的临床研究表明,干细胞移植在一定程度上有利于心功能的恢复[1]。我们的研究发现,骨髓间充质干细胞(mesenchymal stem cell,MSC)移植可降低大鼠心肌梗死后梗死面积,促进血管新生和旁分泌[2-3]。然而,心肌梗死后局部微环境不利影响干细胞的存活,也限制了干细胞的迁移[4]。淫羊藿苷(icariin)是一种从淫羊藿中提取的异黄酮类化合物,可补肾壮阳、延缓衰老,增加心脑血管血流量、强心、降血压和抗心律失常[5]。淫羊藿苷不仅可诱导胚胎干细胞向心肌细胞分化[6],还可以促进细胞增殖和抑制细胞凋亡[7-8]。最近的研究发现,淫羊藿苷可促进血管内皮祖细胞(endothelial progenitor cells,EPC)的迁移,但其具体作用机制尚不明确[9]。基质细胞衍生因子l(stromal cell derived factor-l,SDF-l)/趋化因子受体4(CXCL receptor 4,CXCR4)信号通路在干细胞归巢、迁移和募集过程中发挥重要的调控作用[10]。因此,本研究探讨SDF-1/CXCR4信号通路在淫羊藿苷调控MSC迁移中的作用机制,为临床应用干细胞移植治疗心肌梗死等损伤性疾病提供实验数据。
1 实验材料
1.1 动物
SPF级雄性SD大鼠10只,体质量(200±50)g,上海中医药大学实验动物中心,动物许可证号SYXK(沪)2014-0008,购入后直接用于原代MSC培养。
1.2 主要试剂和仪器
胰酶、多聚赖氨酸、AMD3100和牛血清白蛋白(美国Sigma 公司),高糖DMEM和无糖DMEM培养基(美国Gibco公司),胎牛血清(美国Hyclone公司),CCK-8试剂盒、Hoechst33342、PMSF和RIPA裂解液(上海碧云天生物技术有限公司),Transwell小室和24孔板(美国Corning Costar公司),SDF-1α (美国PeproTech公司),CXCR4抗体、GAPDH抗体和HRP标记二抗(美国CST公司)。电泳仪和转膜仪(美国Bio-Rad公司),IX53显微镜(日本Olympus),细胞培养箱(美国Thermo Fisher公司)。
2 实验方法
2.1 骨髓间充质干细胞培养
将成年雄性SD大鼠脱颈处死,无菌条件下分离双侧股骨和胫骨。剪开骨两端的干骺端,暴露骨髓腔,用含有肝素的0.01 mol/L PBS冲洗骨髓腔至10 mL离心管内,1000 r/min离心8 min。吸去上清液,用含15%FBS DMEM培养液混悬沉淀,均匀接种至培养瓶中,37 ℃、5%CO2条件下培养。当细胞达到70%~80%汇合时,进行传代培养。
2.2 CCK-8法检测细胞增殖
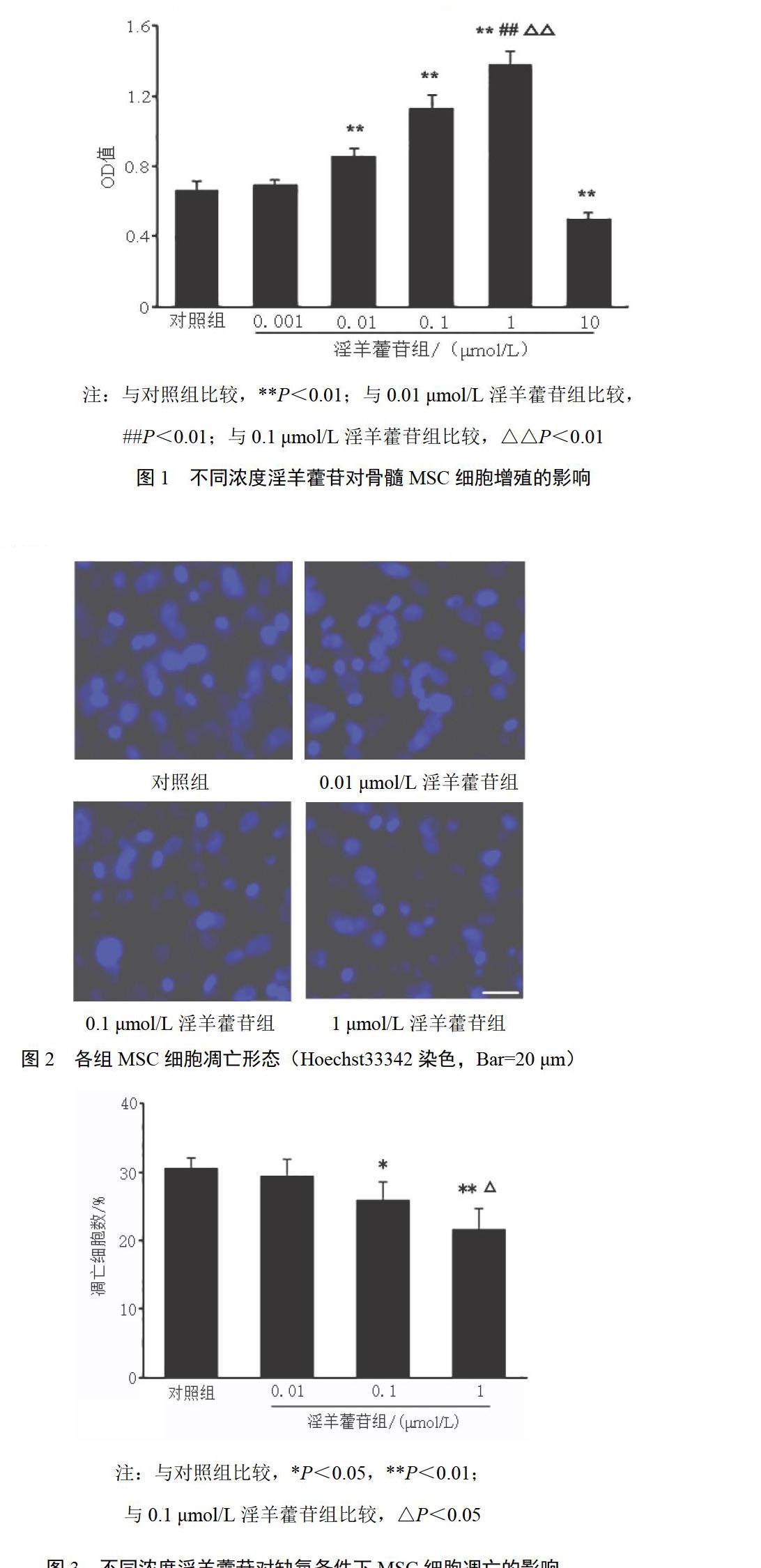
取第5代MSC,用0.01 mol/L PBS漂洗后,经0.25%胰蛋白酶和0.02%EDTA混合消化液消化,收集细胞悬液,1000 r/min离心8 min,弃去上清液,加入新鲜培养液重新混悬沉淀后将细胞以5×104个/mL接种至96孔板中。用不同浓度的淫羊藿苷对MSC进行刺激,分为0.001、0.01、0.1、1、10 μmol/L淫羊藿苷组,未加淫羊藿苷处理的作为对照组。加入不同浓度淫羊藿苷处理48 h后,CCK-8法检测各组细胞吸光度(OD)值。取各组细胞,每孔加入10 μL CCK-8溶液,于细胞培养箱内继续孵育1 h后,于酶标仪波长450 nm处测定OD值。
2.3 体外缺糖缺氧模型建立
参照Hori O等[11]方法自制缺氧盒,并加以改进。在有机塑料盒的2个侧面各建立1个通气孔,分别用于进气和排气,将95% N2和5% CO2的混合气体通过进气孔通入缺氧盒中,通过排气孔将盒内气体抽空和连接测氧仪。实验分为对照组(未加淫羊藿苷)和0.01、0.1、1 μmol/L淫羊藿苷组。将细胞接种至24孔板内的灭菌盖玻片上,培养24 h后从培养箱内取出24孔板,吸去培养液,用0.01 mol/L PBS漂洗3次,更换无糖无血清的DMEM,淫羊藿苷组分别添加相应浓度的淫羊藿苷进行处理。然后将24孔板放入自制无菌缺氧盒中,密封盒盖,关闭通气孔。通过排气孔用50 mL注射器将缺氧盒中的气体尽可能抽空。然后密封排气孔,经通气孔通入体积分数为5% CO2和95% N2的混合气体,并通過测氧仪检测盒中的氧气含量。当缺氧盒内氧浓度低于1%时迅速密封通气孔,然后将缺氧盒置于37 ℃下继续培养。
2.4 Hoechst33342染色
各组细胞经体外缺糖缺氧处理24 h后,弃去培养液,用0.01 mol/L PBS漂洗3次,加入4%多聚甲醛固定20 min,0.01 mol/L PBS漂洗3次后加入Hoechst33342染色液,室温孵育10 min,0.01 mol/L PBS漂洗3次,磷酸甘油封片,荧光显微镜下观察细胞核的形态。每孔随机选取5个视野,分别计数凋亡和全部细胞数。实验重复5次,计算细胞凋亡率。细胞凋亡率(%)=凋亡细胞数÷细胞总数×100%。
2.5 Western blot检测CXCR4蛋白表达
实验分为对照组和0.01、0.1、1 μmol/L淫羊藿苷组。将MSC接种至6孔板中,不同浓度淫羊藿苷处理48 h,吸去上清液,经0.01 mol/L PBS漂洗3次,每孔加200 μL预冷的含PMSF的RIPA裂解液,充分裂解细胞后12 000 r/min离心15 min,取上清液。BCA蛋白浓度测定试剂盒测定蛋白浓度。取各组蛋白30 μg,加入5×SDS上样缓冲液,于沸水中煮5 min使蛋白变性。上样后行电泳,至溴酚兰刚跑出时终止电泳,经半干转转膜仪转膜,20 V条件下转印60 min,使胶内蛋白充分转移至PVDF膜上。将膜用PBST浸湿后,移至含5%脱脂奶粉的平皿中,室温脱色摇床上摇动封闭1 h。加入CXCR4抗体(1∶2000)、GAPDH抗体(1∶5000),4 ℃脱色摇床上孵育过夜。PBST室温清洗3次,每次10 min。加入HRP标记的二抗(1∶10 000),室温脱色摇床上摇动孵育2 h。PBST清洗3次后,ECL发光,化学发光成像仪上直接成像并拍照。
2.6 Transwell小室跨膜实验
实验分对照组和0.01、0.1、1 μmol/L淫羊藿苷组及0.01 μmol/L淫羊藿苷+1 μg/mL AMD3100组、0.1 μmol/L淫羊藿苷+1 μg/mL AMD3100组。Transwell小室(8 μmol/L)检测细胞迁移。培养时Transwell小室置于24孔板,将600 μL含100 ng/mL SDF-1α的DMEM添加到小室的下池。将各组MSC(1×105)混悬于200 μL含0.1%BSA的DMEM中,加入培养小室内,置5% CO2培养箱培养24 h。弃去孔中DMEM,用棉签小心将小室膜上表面细胞擦去,用4%多聚甲醛固定10 min,结晶紫常温染色10 min,蒸馏水充分洗涤后,显微镜下观察并拍照,计数表面细胞的数量。
3 统计学方法
采用SPSS21.0统计软件进行分析。实验结果以—x±s表示,组间比较采用方差分析。P<0.05表示差异有统计学意义。
4 结果
4.1 淫羊藿苷对骨髓间充质干细胞增殖的影响
0.001 μmol/L淫羊藿苷对MSC的增殖无明显影响。0.01、0.1、1 μmol/L淫羊藿苷均可促进MSC增殖(P<0.01),其中1 μmol/L淫羊藿苷促进MSC增殖的作用最明显,与0.01、0.1 μmol/L组比较,差异均有统计学意义(P<0.01)。10 μmol/L淫羊藿苷则对MSC具有一定的细胞毒性作用,可显著抑制MSC的增殖。结果见图1。
4.2 淫羊藿苷对骨髓间充质干细胞凋亡的影响
经缺血缺氧处理24 h后,对照组中有大量的MSC细胞核表现出典型的凋亡形态,染色质发生固缩或断裂为大小不等的片段,有的出现凋亡小体,镜下可见细胞核呈致密浓染,或呈碎块状致密浓染。加入不同浓度淫羊藿苷可减少凋亡MSC的数量。0.01 μmol/L淫羊藿苷组与对照组比较,凋亡细胞数量无明显差异,而0.1 μmol/L或1 μmol/L淫羊藿苷可明显抑制MSC的凋亡(P<0.05,P<0.01)。1 μmol/L淫羊藿苷组发生凋亡的MSC数量最少,与0.1 μmol/L淫羊藿苷组比较差异有统计学意义(P<0.05)。
4.3 淫羊藿苷对骨髓间充质干细胞CXCR4蛋白表达的影响
与对照组比较,0.01 μmol/L或0.1 μmol/L淫羊藿苷组CXCR4的蛋白表达有升高趋势,但差异无统计学意义(P>0.05)。1 μmol/L淫羊藿苷可促进CXCR4蛋白表达,明显高于对照组和0.1 μmol/L淫羊藿苷组(P<0.05,P<0.01)。
与对照组比较,0.01 μmol/L淫羊藿苷处理不能提高MSC跨膜迁移的数量。0.1、1 μmol/L淫羊藿苷组迁移细胞数量均明显高于对照组(P<0.05,P<0.01)。与0.1 μmol/L淫羊藿苷组比较,1 μmol/L淫羊藿苷组迁移细胞数量增加明显(P<0.01)。加入AMD3100后,0.1、1 μmol/L淫羊藿苷促进MSC迁移能力被削弱。各浓度淫羊藿苷+AMD3100组之间细胞迁移数量无明显差异。与1 μmol/L淫羊藿苷组比较,1 μmol/L淫羊藿苷+AMD3100组迁移细胞数明显减少(P<0.01)。
5 讨论
干细胞领域的兴起与快速发展为心肌梗死等缺血性心肌病的治疗带来曙光。通过中药复方或有效成分处理可促进干细胞增殖、存活、迁移和分化等,为解决干细胞移植面临的问题提供思路和方向。淫羊藿具有补肾阳、坚筋骨、强心的功效。淫羊藿苷作为淫羊藿的主要活性成分,在心血管方面具有多种药理活性。研究表明,淫羊藿苷不仅对异丙肾上腺素所致大鼠急性心肌缺血具有一定的保护作用[12],还可以保护缺血再灌注引起的心肌损伤,缩小心肌梗死面积[13]。本研究发现,一定浓度的淫羊藿苷可明显促进MSC的增殖,但高浓度的淫羊藿苷却对MSC的活性有明显的抑制作用,这与文献[7]报道一致。10 μmol/L淫羊藿苷对MSC活性的抑制作用可能是该浓度淫羊藿苷具有较大的细胞毒性。我们以前的研究也发现,高浓度的丹酚酸B对MSC也有一定的细胞毒性,明顯抑制MSC的增殖[2]。因此,在选择中药或其有效成分处理干细胞时,首先要考虑不同浓度对细胞活力的影响。
干細胞移植后在移植部位停留和存活是治疗成功与否的关键所在。绝大部分的干细胞在移植到心肌局部缺血缺氧环境后出现凋亡、坏死或直接丢失,这也是目前制约干细胞治疗的瓶颈所在。淫羊藿苷可通过抑制活性氧依赖的JNK/NF-κB减少H9c2大鼠心肌细胞凋亡[14]。本实验通过体外建立缺糖缺氧模型,研究淫羊藿苷对大鼠骨髓MSC抗缺血缺氧的保护作用。经缺血缺氧处理24 h后,对照组大量MSC细胞核表现出明显的凋亡形态变化。而在0.1 μmol/L或1 μmol/L淫羊藿苷组,大部分细胞仍保持较好的形态,凋亡细胞数目明显减少。以上结果提示,缺糖缺氧处理可导致MSC产生细胞凋亡,而适当浓度的淫羊藿苷有助于细胞对抗缺血缺氧微环境,提高其存活能力。有研究表明,淫羊藿苷可显著抑制H2O2诱导的EPC凋亡,其机制可能与上调mTOR、p70S6K和4EBP1磷酸化水平和下调ATF2和ERK1/2蛋白表达水平有关[9]。然而,淫羊藿苷促进MSC存活的具体作用机制尚需进一步研究。干细胞存活后向梗死部位的迁移和募集也是影响干细胞移植效果的主要问题。干细胞移植后如在梗死部位或梗死边缘区域成簇存在,不仅不利于新生心肌细胞与宿主心肌之间的偶联,还有可能造成心律失常[15]。淫羊藿苷可以在体外增加EPC增殖和跨膜迁移的能力[9]。本研究发现,一定浓度的淫羊藿苷可以提高MSC的迁移能力。进一步研究发现,淫羊藿苷可以促进MSC表达趋化因子SDF-1的受体CXCR4,经CXCR4阻断剂AMD3100处理后跨膜迁移的MSC数显著降低,提示淫羊藿苷可通过SDF-1/CXCR4信号通路调控MSC的迁移。SDF-l与CXCR4特异性结合后,通过激活下游的二级信使,调控细胞迁移、凋亡、黏附等多种功能。SDF-l/CXCR4轴在组织缺血损伤和心肌再生修复中发挥重要作用,它参与调节组织缺血损伤后的血管新生和心肌梗死后的干细胞募集,在干细胞的动员、归巢、黏附、血管穿透和在靶器官内的增殖、存活的整个过程中发挥着重要作用。有研究表明,MSC在体外培养后,其表面受体CXCR4的表达水平逐渐降低,导致MSC向心肌组织的募集减少。研究发现,对急性大脑中动脉梗死大鼠灌胃低剂量淫羊藿苷可显著提高脑组织中SDF-1和CXCR4的表达,促进大鼠脑缺血后的神经功能恢复[16]。因此,移植淫羊藿苷预处理的MSC可能会提高干细胞治疗心肌梗死的效果。
综上所述,一定浓度的淫羊藿苷可促进MSC的增殖、存活和迁移。SDF-1/CXCR4信号通路参与淫羊藿苷调控MSC迁移的作用。本研究可为临床应用干细胞移植治疗心肌梗死等损伤性疾病提供实验数据参考。
参考文献:
[1] BEHFAR A, CRESPO-DIAZ R, TERZIC A, et al. Cell therapy for cardiac repair-lessons from clinical trials[J]. Nat Rev Cardiol, 2014,11(4):232-246.
[2] GUO H D, CUI G H, TIAN J X, et al. Transplantation of salvianolic acid B pretreated mesenchymal stem cells improves cardiac function in rats with myocardial infarction through angiogenesis and paracrine mechanisms[J]. Int J Cardiol,2014,177(2):538-542.
[3] GUO H D, WANG H J, TAN Y Z, et al. Transplantation of marrow-derived cardiac stem cells carried in fibrin improves cardiac function after myocardial infarction[J]. Tissue Eng Part A,2011,17(1/2):45-58.
[4] ANVERSA P, NADAL-GINARD B. Myocyte renewal and ventricular remodelling[J]. Nature,2002,415(6868):240-243.
[5] 王东芝,李东万,张守刚.淫羊藿在心血管疾病方面的研究进展[J].浙江中医药大学学报,2013,37(1):107-110.
[6] LIANG X, HONG D, HUANG Y, et al. Icariin promotes expression of junctophilin 2 and Ca2+ related function during cardiomyocyte differentiation of murine embryonic stem cells[J]. Pharmazie, 2015,70(12):804-809.
[7] FAN J J, CAO L G, WU T, et al. The dose-effect of icariin on the proliferation and osteogenic differentiation of human bone mesenchymal stem cells[J]. Molecules,2011,16(12):10123-10133.
[8] WANG Y K, HUANG Z Q. Protective effects of icariin on human umbilical vein endothelial cell injury induced by H2O2 in vitro[J]. Pharmacol Res,2005,52(2):174-182.
[9] TANG Y, JACOBI A, VATER C, et al. Icariin promotes angiogenic differentiation and prevents oxidative stress-induced autophagy in endothelial progenitor cells[J]. Stem Cells,2015,33(6):1863- 1877.
[10] CHENG M, QIN G. Progenitor cell mobilization and recruitment:SDF-1, CXCR4, α4-integrin, and c-kit[J]. Prog Mol Biol Transl Sci,2012,111:243-264.
[11] HORI O, MATSUMOTO M, KUWABARA K, et al. Exposure of astrocytes to hypoxia/reoxygenation enhances expression of glucose- regulated protein 78 facilitating astrocyte release of the neuroprotective cytokine interleukin 6[J]. J Neurochem,1996, 66(3):973-979.
[12] 潘志偉,王秋娟,杨涓,等.淫羊藿苷对异丙肾上腺素所致大鼠急性心肌缺血的影响[J].中国药理学通报,2007,23(5):622-625.
[13] 李虹葳,许广义,李爽,等.淫羊藿苷后处理对心肌缺血再灌注损伤的保护作用研究[J].牡丹江医学院学报,2014,35(6):17-21.
[14] ZHOU H, YUAN Y, LIU Y, et al. Icariin protects H9c2 cardiomyocytes from lipopolysaccharide-induced injury via inhibition of the reactive oxygen species?dependent c-Jun N-terminal kinases/nuclear factor-κB pathway[J]. Mol Med Rep, 2015,11(6):4327-4332.
[15] MENASCHE P, HAGEGE A A, VILQUIN J T, et al. Autologous skeletal myoblast transplantation for severe postinfarction left ventricular dysfunction[J]. J Am Coll Cardiol 2003,41(7):1078- 1083.
[16] 马立,吴明华,韩漾,等.淫羊藿苷对急性大脑中动脉梗死大鼠SDF-1及其受体CXCR-4的影响[J].中国中医急症,2014,23(5):821-822,882.
(收稿日期:2016-06-26)
(修回日期:2016-07-12;编辑:华强)
- 猪大肠杆菌病防治措施
- 探讨基层畜牧养殖管理存在问题与解决方法
- 果树种植病虫害防治策略探讨
- 探讨基层兽医在畜禽疾病防治中的重点
- 关于辣椒嫁接抗疫病效果的研究
- 浅谈中小规模猪场的疾病防控措施
- ‘野香优676’作中稻优质高产栽培技术分析
- 猪传染性胃肠炎的诊治
- 一例猪繁殖与呼吸综合征的诊断与防制
- 常见蔬菜水果农药残留检测技术概述
- “水肥一体化”技术在马铃薯栽培中的应用
- 羊常见疾病的症状及防治措施
- 论村级动物防疫员在陕西省四级动物防疫体系建设中的作用
- 油茶苗木培育技术及病虫害防治
- 畜牧兽医工作者的自身防护措施探析
- 探讨生态猪养殖技术及发展趋势
- 液相色谱串联四级杆质谱联用测定苹果中的乙霉威残留
- 现代科学技术革命与实验动物科学
- 鸡细菌性腹泻的防治
- 种植刺梨的气候适应性分析
- 安顺优质畜禽产品品牌培育实施建议
- 浅谈西红柿栽培技术
- 牛前胃疾病的诊断技术探讨
- 鸡的传染性支气管炎
- 山地地膜豆角优良品种筛选研究
- matchmaking's
- matchmakings
- match sth up (with sth)
- matchstick
- matchsticks
- match up
- match up to sb/sth
- match²
- match¹
- mate
- mated
- matehood
- material
- materialise
- materialised
- materialises
- materialising
- materialism
- materialisms
- materialist
- materialistic
- materialistically
- materialists
- materiality
- materialization
- 河上歌
- 河不出图
- 河东
- 河东三凤
- 河东三箧
- 河东三绝
- 河东三薛
- 河东性
- 河东狮
- 河东狮吼
- 河东狮子
- 河东狮子吼
- 河东白豕
- 河东饭
- 河中之虾,不人鲤鱼群
- 河中央
- 河中或沙漠中的沙
- 河中摸鱼
- 河中无水难行船
- 河中无鱼虾也贵
- 河中水浅湍急多沙石的地方
- 河中间斩竹篙
- 河伯
- 河伯不知海若
- 河伯从事