
摘要:目的 观察肾衰Ⅱ号方对5/6(A/I)肾切除慢性肾功能衰竭(CRF)大鼠残肾组织病理形态及肿瘤坏死因子-α(TNF-α)表達的影响,探讨其可能的作用机制。方法 制备5/6(A/I)肾切除CRF大鼠模型,随机分为假手术组、模型组、西药组和中药组,各给药组给予相应药物。给药60 d后,测定大鼠血肌酐(SCr)、尿素氮(BUN)、血红蛋白(Hb)、内生肌酐清除率(Ccr),观察残肾组织病理形态,免疫组化检测残肾组织TNF-α的表达。结果 与模型组比较,各给药组大鼠SCr和BUN水平显著降低、Hb和Ccr显著升高(P<0.05,P<0.01),各给药组大鼠残肾组织病理改变均有改善,各给药组大鼠TNF-α水平显著降低(P<0.01),且中药组均优于西药组。结论 肾衰Ⅱ号方可改善CRF大鼠肾功能及肾组织病理改变,其抗肾间质纤维化机制可能与其改善肾组织缺血缺氧、调节TNF-α的表达有关。
关键词:肾衰Ⅱ号方;慢性肾衰竭;肿瘤坏死因子-α;肾间质纤维化;大鼠
DOI:10.3969/j.issn.1005-5304.2017.07.013
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2017)07-0054-04
Abstract: Objective To observe the effects of Shenshuai Ⅱ Prescription on expressions of pathologic morphology and TNF-α in nephridial tissue of chronic renal failure (CRF) rats induced by 5/6th kidney (ablation/infarction, A/I); To investigate its possible mechanism of action. Methods 5/6 (A/I) nephrectomized CRF rat models were prepared and randomly divided into sham-operation group, model group, Western medicine group and TCM group. Each medication group was given relevant medicine. The levels of serum creatinine (SCr), blood urea nitrogen (BUN), hemoglobin (Hb) and endogenous creatinine clearance (Ccr) were measured after 60 days of administration. The histopathology of residual kidney was observed, and the expression of TNF-α in residual renal tissue was detected by immunohistochemistry. Results Compared with the model group, the levels of SCr and BUN significantly decreased, while Hb and Ccr significantly increased in each medication group (P<0.05, P<0.01). The pathological changes of the residual renal tissue were improved in each medication group. The expression of TNF-α protein in the rats of medication group was significantly lower than that in the Western medicine group (P<0.05, P<0.01). Conclusion Shenshuai Ⅱ Prescription can improve renal function and alleviate changes of renal pathology in CRF rats. The mechanism of anti-renal interstitial fibrosis may be related to the improvement of renal ischemia and hypoxia and the regulation of the expression of TNF-α.
Key words: Shenshuai Ⅱ Prescription; chronic renal failure; TNF-α; renal interstitial fibrosis; rats
肾间质纤维化是慢性肾脏疾病(chronic kidney disease,CKD)进展至终末期肾脏病的共同特征。有研究显示,CKD存在肾小管间质的缺血缺氧[1-2]。缺氧长期以来被认为是CKD进展的主要因素之一,通过直接调控和协同作用促纤维化因子、某些缺氧反应基因,损伤细胞的能量代谢,影响炎性细胞的功能,促进肾脏纤维化的发生和发展[3]。课题组前期研究显示,肾衰Ⅱ号方可改善慢性肾功能衰竭(CRF)大鼠肾功能、提高肾小球滤过率(GFR)、纠正贫血、增加肾血流量、降低残余肾内氧耗[4]。本研究进一步观察肾衰Ⅱ号方对5/6(ablation/infarction,A/I)肾切除大鼠残余肾组织肿瘤坏死因子-α(TNF-α)蛋白表达的影响,探讨肾衰Ⅱ号方改善肾间质纤维化(RIF)的作用机制。
1 材料和方法
1.1 动物
SPF级健康成年SD大鼠69只,雄性,8周龄,体质量190~210 g,上海西普尔-必凯实验动物有限公司,动物许可证号SCXK(沪)2008-0016。饲养于上海中医药大学附属曙光医院实验动物中心,温度(22±2)℃,相对湿度(55±2)%,12 h光照,自由饮水摄食。
1.2 药物
肾衰Ⅱ号方(党参15 g、丹参15 g、当归15 g、淫羊藿15 g、紫苏叶15 g、川芎15 g、桃仁15 g等),上海中医药大学附属曙光医院制剂科制备,浓度7.58 g/mL;氯沙坦钾片,杭州默沙东制药有限公司,批号20120330,100 mg/片;福辛普利钠片,中美上海施贵宝制药有公司,批号201211,10 mg/片,蒸馏水制备混悬液,浓度6.42 mg/mL。
1.3 主要试剂与仪器
兔抗大鼠多克隆抗体TNF-α(批号ab66579),美国Abcam公司;SABC三步法免疫组化试剂盒(批号SA1022)、DAB显色液(批号AR1022),武汉博士德公司。倒置显微镜(型号LEICA DMIL)、图像采集系统(型号LEICA DFC295),德国LEICA公司;图像分析系统(型号Image-pro-plus5.1),上海求为生物科技有限公司。
1.4 造模、分组及给药
随机选取14只大鼠为假手术组,其余55只制备5/6(A/I)慢性肾衰模型[2]。大鼠腹腔注射2%戊巴比妥钠(0.2 mL/100 g)麻醉,常规消毒、备皮,在左侧肋弓下0.5 cm、脊柱向左旁开1 cm处切口(垂直于脊柱,长约2.5 cm)。经腹膜后取左肾,分离肾包膜后,将左肾动脉的2/3分支结扎,缝合。1周后摘除右肾。4周后断尾法采血,测定肾功能指标,剔除造模失败和死亡动物共13只后,根据血肌酐(SCr)水平随机分为模型组、西药组、中药组,每组14只。大鼠剂量按成人标准体质量(60 kg)常规用量20倍给药。中药组予肾衰Ⅱ号方药液灌胃,西药组予氯沙坦钾联合福辛普利钠药液灌胃,假手术组和模型组予等量0.9%氯化钠溶液灌胃。给药体积均为2 mL,每日1次,连续60 d。
1.5 取材
大鼠腹腔注射2%戊巴比妥钠(0.2 mL/100 g)麻醉,腹主动脉采血,离心,收集血清。摘取残肾组织于10%中性福尔马林缓冲液中固定>24 h后脱水,石蜡包埋,制成3 μm切片。常规HE染色,观察肾脏组织病理形态。
1.6 检测指标
1.6.1 生化指标检测 全自动生化分析仪检测SCr、尿素氮(BUN)、血红蛋白(Hb)。用内生肌酐清除率(Ccr)代替GFR。Ccr(mL/min)=尿肌酐×24 h尿量÷血清肌酐×1440[6]。
1.6.2 肾组织肿瘤坏死因子-α表达检测 采用SABC免疫组化三步法。3 μm切片二甲苯脱蜡,梯度乙醇脱水,3%过氧化氢灭活内源性消化酶,0.01 mol/L柠檬酸缓冲液(pH 6.0)抗原修复,5%BSA封闭液封闭;适当稀释一抗,4 ℃过夜,生物素化二抗,37 ℃、30 min;滴加SABC复合物,DAB显色,苏木素复染,中性树胶封片。每个样本随机选取高倍镜下5个不同视野,分析每个视野棕黄色染色区域反应面积作为阳性面积占总视野面积的百分比,取其平均值。
1.7 统计学方法
采用SPSS18.0统计软件进行分析。计量资料以—x±s表示,组间比较采用方差分析,多重比较采用LSD、S-N-K法,组内治疗前后比较采用重复测量设计的方差分析。P<0.05表示差异有统计学意义。
2 结果
2.1 肾衰Ⅱ号方对模型大鼠给药前后生化指标的影响
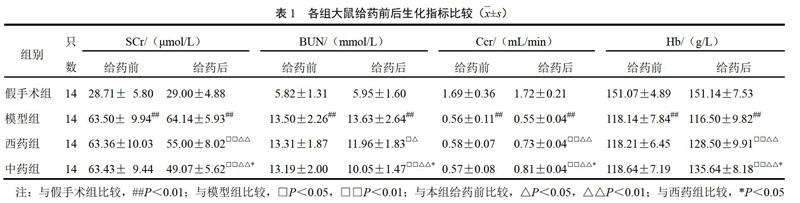
与假手术组比较,给药前后模型组SCr、BUN水平明显升高(P<0.01),Ccr、Hb水平明显降低(P<0.01);给药后与模型组比较,西药组、中药组SCr和BUN水平明显降低(P<0.05,P<0.01),Ccr和Hb水平明显升高(P<0.01);西药组、中药组给药后较给药前SCr和BUN水平明显降低(P<0.05,P<0.01),Ccr和Hb水平明显升高(P<0.01),且中药组明显优于西药组,差异有统计学意义(P<0.05)。结果见表1。
2.2 肾衰Ⅱ号方对模型大鼠残余肾组织病理形态的影响
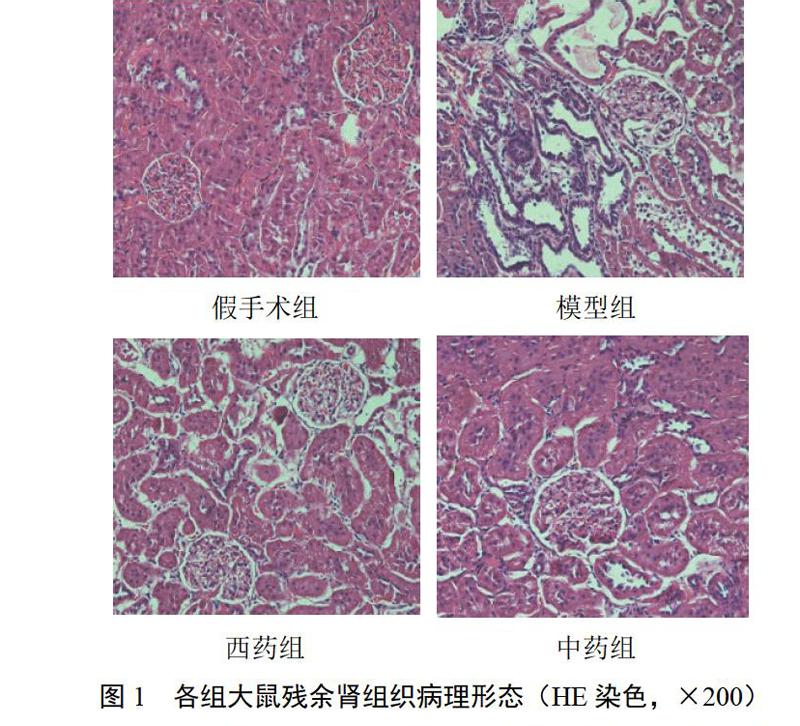
假手术组肾小球结构正常,Bowman囊腔结构清晰,肾小球基底膜较薄、无增厚;小管基底膜薄,管腔无扩张、无囊肿,管周无纤维化。肾间质无水肿、无炎症细胞浸润、无纤维化;模型组肾小球结构破坏严重,近全球性硬化,球周纤维化,毛细血管管腔闭塞、球囊粘连,肾小球基底膜弥漫增厚;肾小管扩展并充满蛋白管型;肾间质大量炎症细胞浸润,可见纤维化。西药组肾小球结构较模型组完整,Bowman囊腔结构较模型组清晰,无明显球囊粘连,肾小球硬化程度明显减轻;肾小管管腔无明显扩张,管腔内见少量蛋白管型;间质炎性细胞浸润较模型组减少。中药组肾小球结构较西药组完整,纤维化程度减轻,Bowman囊存在,无球囊粘連,囊腔结构较西药组完整;管腔无明显扩张,未见明显蛋白管型;间质炎性细胞浸润程度较西药组减轻。结果见图1。
2.3 肾衰Ⅱ号方对模型大鼠残余肾组织肿瘤坏死因子-α水平的影响
与假手术组比较,模型组大鼠肾组织TNF-α水平明显升高(P<0.01);与模型组比较,各给药组大鼠肾组织TNF-α水平明显降低(P<0.01),且中药组明显低于西药组(P<0.01)。结果见表2、图2。
3 讨论
肾血流量占心输出量的1/4,但仅有10%的氧被肾脏摄取,大多流向肾皮质以保证肾小球滤过和溶质的再吸收,肾髓质血流量较低[5]。肾皮质氧分压约为50 mm Hg,髓质氧分压只有10~20 mm Hg[6]。肾小管大量氧的需求和局部较低的氧供,导致生理性皮质和髓质的低氧压张力,肾组织内环境处于低氧状态。毛细血管对氧的通透性、氧耗、最初血流量等细小变化都能影响氧的供应和需求的平衡,在疾病状态下,平衡一旦被打破,即表现为肾小管间质缺血、缺氧。
长期以来,慢性缺氧始终被认为是导致各类原因引起CKD进展的主要因素,缺氧影响细胞能量代谢和细胞功能、红细胞和血管生成、炎症细胞的信号传导[3]。TNF-α是一种强效的促炎症细胞因子,是参与炎症性组织损伤的重要介质。TNF-α在肾小管间质中表达,主要存在于近端肾小管上皮细胞,通过减少肾脏血流、肾小球滤过率,改变毛细血管壁的屏障功能,形成毛细血管血栓,影响血细胞结构等途径参与肾脏损伤。在肾组织炎症反应中,TNF-α趋化单核細胞、中性粒细胞向炎症部位聚集,诱导内皮细胞表达黏附分子,增强巨噬细胞的细胞毒性,调节其他炎症细胞因子如白细胞介素(IL)-1、IL-6等释放[7]。TNF-α诱导肾小管不同形式的炎症基因的激活,促进肾小管间质炎症反应,导致小管间质损害,最终引起肾功能不可逆性损伤的RIF[8]。研究显示,TNF-α与肾功能之间存在显著负相关[9]。抑制肾小管间质的炎症反应,可以减少其结构和功能的破坏[10],延缓RIF进展[11]。
根据CRF临床表现,其属中医学“水肿”“关格”“虚劳”“癃闭”等范畴。其形成机制复杂,或因正虚,或因邪实,或因失治误治,每呈虚实并见,辨证除本虚外,还应注意邪实。总属本虚标实、正虚邪实。本虚主要是脾、肾两虚,可因病情进展影响到心、肺两脏,及气、血、精、阴、阳的亏损。邪实主要为外邪、痰湿、湿热、瘀血、热毒等。其中,痰湿、浊毒、瘀血既是脏腑功能失调的病理产物,又进一步加重脏腑虚损。肾衰Ⅱ号方中党参健脾益气养血,淫羊藿温肾壮阳,共为君药,培本固源,补肾与健脾协同并进,起到补火生土,健脾转相滋肾的作用。臣以四味活血药物:丹参活血养血,当归补血活血,川芎行气活血祛风,桃仁活血祛瘀,补泻兼施,使补而不留邪,泻而不伤正,气行则血行,气血同调。大黄泻下攻积、清热解毒、活血祛瘀,紫苏叶行气宽中、理气和营、“散血脉之邪”(《本经逢原》),共为佐药,使体内毒素从大便而解。全方共奏健脾补肾、益气养血、降浊化瘀之功。
本实验结果表明,肾衰Ⅱ号方可改善CRF大鼠肾功能,纠正贫血,减轻残肾组织的病理改变,下调残肾组织TNF-α的蛋白表达,其肾脏保护作用机制可能与改善肾脏血流量和缺氧环境,从而调节炎症因子的表达有关。
参考文献:
[1] MANOTHAM K, TANAKA T, MATSUMOTO M, et al. Evidence of tubular hypoxia in the early phase in the remnant kidney model[J]. J Am Soc Nephrol,2004,15(5):1277-1288.
[2] ISEKI K, IKEMIYA Y, ISEKI C, et al. Haematocrit and the risk of developing end-stage renal disease[J]. Nephrol Dial Transplant, 2003,18:899-905.
[3] HAASE V H. Hypoxia-inducible factors in the kidney[J]. American Journal of Physiology-Renal Physiology,2006,291(2):F271-F281.
[4] 杨婧,王琛,邵命海,等.肾衰Ⅱ号方对5/6肾切除大鼠肾血流量和肾内氧耗影响及其作用机制[J].中国中西医结合肾病杂志,2011,12(7):578-581.
[5] EPSTEIN F H, BREZIS M, ROSEN S. Hypoxia of the renal medulla-its implications for disease[J]. The New England Journal of Medicine, 1995,332(10):647-655.
[6] ZHANG W, EDWARDS A. Oxygen transport across vasa recta in the renal medulla[J]. American Journal of Physiology-Heart and Circulatory Physiology,2002,283:H1042-H1055.
[7] 吴金珠.TNF-α在慢性肾小球肾炎中的作用研究[J].辽宁中医药大学学报,2011,12(4):144-145.
[8] 杜义斌,吴晓,吴锋,等.灯盏花胶囊对慢性肾功能衰竭大鼠肾组织炎症因子的影响[J].中国中医药信息杂志,2014,21(12):63-65.
[9] PRUIJM M, PONTE B, VOLLENWEIDER P, et al. Not all inflammatory markers are linked to kidney function:results from a population- based study[J]. American Journal of Nephrology,2012,35(3):288- 294.
[10] LAMEIRE N, KRUSE V, ROTTEY S. Nephrotoxicity of anticancer drugs-an underestimated problem?[J]. Acta Clinica Belgica,2011, 66(5):337-345.
[11] THERRIEN F J, AGHARAZII M, LEBEL M, et al. Neutralization of tumor necrosis factor-alpha reduces renal fibrosis and hypertension in rats with renal failure[J]. American Journal of Nephrology,2012,36(2):151-161.
(收稿日期:2016-07-11)
(修回日期:2016-07-31;编辑:华强)
- 培养创新人才 服务首都建设
- 在服务北京经济社会发展中做强学科
- 融入首都区域创新体系实现地方高校与区域经济社会和谐互动发展
- 财经类院校创新型人才成长机制的建设与探索
- 精品课程建设的五大误区
- 高校辅导员素质与能力建设问题研究
- 谈如何加强大学生感恩教育
- 论奥运志愿服务在首都高校校园文化建设中的功能意义
- 简析高校工会教职工维权问题
- 我国重点行业性大学的学科发展探讨
- 从支撑到引领
- 从应对国际金融危机看特色型大学创新人才培养
- 共建 互动 共赢
- 躬耕不辍结硕果 丹心热血沃新花
- 在新形势下加强高校离退休干部思想政治建设
- 以科学发展观统领高校宣传思想工作
- 加强高校党建 推动学校科学发展
- 政府搭台 走产学合作特色办学之路
- 国际化战略:新一轮首都高等教育发展的战略选择
- 对高等教育体制改革与发展的几点思考
- 落实科学发展观与弘扬传统文化
- 以就业为导向的中药制药方向实验教学体系构建与实践
- 高校优秀教学团队的建设研究
- BOOM课堂的发展现状与前景
- 美国高校认证对我国大学教育质量保障的启示
- prodistribution
- prodivision
- prod's
- prods
- produce
- produceable
- produceableness
- produceablenesses
- produced
- producer
- producerpriceindex
- producers
- producership
- produces
- produce²
- produce¹
- producibilities
- produciblenesses
- producing
- product
- productadvertising
- product advertising
- product awareness
- productawareness
- productbase
- 蔽短
- 蔽罪
- 蔽美
- 蔽美扬恶
- 蔽翳
- 蔽翳阴蔽
- 蔽聪塞明
- 蔽膝
- 蔽芾
- 蔽茂
- 蔽蒙
- 蔽袜
- 蔽视
- 蔽视掩听
- 蔽谄
- 蔽贤
- 蔽辜
- 蔽鄣
- 蔽野
- 蔽隐
- 蔽障
- 蔽隱
- 蔽雍
- 蔾
- 蔿