摘要:目的 探討左归降糖解郁方对模拟糖尿病并发抑郁症(DD)环境下海马神经元凋亡相关蛋白Bcl-2、Bax及Caspase-8的调控作用。方法 采用受孕18 d SD大鼠胎鼠进行海马神经元原代培养,葡萄糖联合皮质酮干预构建DD模拟环境。将培养的海马神经元随机分为正常组、空白血清组、模型组、阳性药(二甲双胍+氟西汀)药物血清组和待测药(左归降糖解郁方)药物血清组,正常组和模型组给予等量培养液,其余组给予相应体积分数10%药物血清或空白血清,造模干预18 h后,Hoechst荧光染色检测海马神经元凋亡;高内涵分析技术检测凋亡相关蛋白Bcl-2、Bax和Caspase-8的表达。结果 与正常组比较,模型组大鼠海马神经元树突断裂或减少,神经网络连接降低,细胞存在明显的浓染、破碎、光点分布不均现象,Bcl-2蛋白表达显著下降(P<0.05),Bax和Caspase-8蛋白表达明显升高(P<0.05,P<0.01);与模型组比较,阳性药药物血清组和待测药药物血清组大鼠海马神经元网络连接显著恢复,Hoechst荧光染色可见细胞核明显均匀化,局部亮点明显减少,Bcl-2蛋白表达水平显著上调(P<0.05,P<0.01),Bax和Caspase-8蛋白表达水平显著下调(P<0.05,P<0.01)。结论 左归降糖解郁方对模型大鼠海马神经元凋亡的保护作用可能与调控海马神经元Bcl-2,Bax和Caspase-8的表达有关。
关键词:左归降糖解郁方;糖尿病并发抑郁症;海马神经元;Bcl-2;Bax;Caspase-8;大鼠
DOI:10.3969/j.issn.1005-5304.2017.10.009
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2017)10-0035-05
Effects of Zuogui Jiangtang Jieyu Formula on Hippocampus Neuron Apoptosis Related Proteins under Diabetes Mellitus with Depression States LING Jia1, YANG Qin2, LIU Jian2, WANG Yu-hong1,2, XU Ya-lan3, HAN Yuan-shan2, YANG Hui2, MENG Pan1 (1. Training Bases, Hunan Key Laboratory of Chinese Materia Medica Powder and Innovative Drugs Established by Provincial and Ministry, Changsha 410208, China; 2. First Hospital of Hunan University of Chinese Medicine, Changsha 410007, China; 3. Changde Vocational Technical College, Changde 415003, China)
Abstract: Objective To investigate the regulating effects of Zuogui Jiangtang Jieyu Formula (ZJJF) on Bcl-2, Bax and Caspase-8 in hippocampus neuron damage in diabetes mellitus with depression (DD). Methods Hippocampal neurons from 18 d pregnant rats were primitively cultivated, and then combination of glucose and corticosterone was used to construct DD simulation environment. Cultivated hippocampal neurons were randomly divided into normal group, blank serum group, model group, positive medicine (metformin+fluoxetine) serum group and to-be-tested medicine (ZJJF) serum group. Normal group and model group were given same amount culture medium, while other group were given relevant amont of 10% medicine serum or blank serum. After modeling intervention for 18 h,
基金项目:国家自然科学基金(81373578、81573965、81403379、81403387)
通讯作者:王宇红,E-mail:573643177@qq.com
Hoechst staining was used to detect the apoptosis of hippocampal neurons. The expression of Bcl-2, Bax and Caspase-8 was detected by high content analysis. Results Compared with the control group, hippocampal neuron dendrites ruptured or decreased, neural network connection decreased, cells showed significant staining, broken, uneven distribution of light spots, the expression of Bcl-2 protein decreased significantly (P<0.05), but Bax and Caspase-8 were increased (P<0.05, P<0.01). Compared with the model group, hippocampal neurons in both positive medicine serum group and ZJJF serum group gradually recovered. Hoechst staining showed that the nuclei were significantly homogenized, local highlights were significantly reduced, Bcl-2 protein expression levels were significantly increased (P<0.05, P<0.01), while Bax and Caspase-8 were obviously down-regulated (P<0.05, P<0.01). Conclusion ZJJF has protective effects on hippocampal neurons in DD of model rats, and its mechanism is related to regulating the expression of Bcl-2, Bax and Caspase-8 in hippocampus neuron.
Key words: Zuogui Jiangtang Jieyu Formula; diabetes mellitus with depression; hippocampal neurons; Bcl-2; Bax; Caspase-8; rats
糖尿病并发抑郁症(diabetes mellitus with depression,DD)主要表现特征即为认知功能障碍。据相关研究表明,40%~50%糖尿病患者存在不同程度的抑郁症状[1-2],DD是糖尿病最严重的并发症之一,其死亡率明显高于单纯糖尿病患者[3]。本课题组前期研究表明,DD大鼠海马组织体积显著减少,椎体细胞中存在不同程度的胞体深染和空泡变性,其中海马神经元凋亡则是海马发生损伤的主要原因[4-5]。因此,本研究拟从体外角度辅以高内涵分析技术(HCA),检测大鼠模拟DD环境下海马神经元内Bcl-2、Bax和Caspase-8等凋亡相关蛋白的表达,并初步探讨左归降糖解郁方对海马神经元的保护作用。
1 实验材料
1.1 动物
SPF级SD雌性大鼠(受孕18 d)3只,体质量350~450 g,SPF级SD雄性大鼠9只,体质量200~220 g,湖南斯莱克景达实验动物有限公司,动物许可证号SCXK(湘)2013-0004。其中雌性大鼠直接用于海马神经元原代取材,雄性大鼠饲养于湖南中医药大学第一附属医院SPF级实验动物中心。
1.2 药物
左归降糖解郁方(黄芪、熟地黄、枸杞子、山萸肉、丹参、姜黄、菟丝子、杜仲、牛膝、牡丹皮、贯叶连翘),饮片均购自湖南中医药大学第一附属医院,并由该院制剂科按一定比例水煎浓缩后制成口服液;盐酸二甲双胍片,湖南湘雅制药有限公司,批号1402115;盐酸氟西汀胶囊,法国Patheon,批号2087A。
1.3 主要试剂与仪器
皮质酮、L-多聚赖氨酸、DMSO(美国Sigma),胰蛋白酶、Ⅰ型胶原酶(美国Amresco),D-葡萄糖、DMEM/F12、胎牛血清(美国Hyclone),Neurobassal神经元基础培养基、B27添加剂、Glutamax(美国Gibco),多聚甲醛(中国科密欧),兔抗烯醇化酶多克隆抗体((NSE,中国Bioworld),Hoechst 33258(中国Beyotime),兔抗Bcl-2单克隆抗体、兔抗Bax单克隆抗体、兔抗Caspase-8单克隆抗体、小鼠抗β-tublin多克隆抗体(美国Proyeintech),DAPI、FITC标记羊抗兔IgG、R-PE标记羊抗小鼠IgG(英国Abcam)。CO48R-230型三气细胞培养箱(NEW BRUNSWICK GALAXY),OPERETTA型高内涵成像分析系统(PerkinElmer),S8PAO型体视显微镜(LEICA)。
2 实验方法
2.1 海马神经元原代培养及鉴定
将受孕18 d SD大鼠腹腔注射10%水合氯醛麻醉,取胎鼠全脑,解剖镜下夹取海马,并剥净残余脑膜及血管,剪碎后加1∶1的胰蛋白酶和Ⅰ型胶原酶消化、离心、重悬、计数,接种于预先包被L-多聚赖氨酸的96孔细胞培养板中(6×104/孔),置于培养箱中4 h后全量换成维持液(Neurobassal神经元基础培养基∶B27添加剂∶Glutamax∶双抗=96∶2∶1∶1),第3日半量更换维持液。待神经元生长至第5日,用预冷PBS洗3次×5 min,4%多聚甲醛室溫固定30 min,清洗后加0.25%Triton X-100溶液作用15 min,再加5%BSA封闭30 min,清洗,滴加兔NSE和小鼠抗大鼠β-tublin相关抗原抗体(1∶100),4 ℃湿盒过夜,清洗,加FITC标记的二抗,37 ℃孵育1 h,清洗,加细胞核染色剂DAPI室温孵育20 min,清洗,最后每孔加入50 μL PBS,用HCA系统观察分析。
2.2 药物血清制备
将SPF级雄性SD大鼠随机分为待测药药物血清组、阳性药药物血清组和空白血清组,每组3只。根据前期动物实验[6],分别对应给予临床有效3倍量的左归降糖解郁方(32.8 g/kg)、氟西汀+二甲双胍(1.8 mg/kg,0.18 g/kg)、蒸馏水,2次/d,连续3 d。末次给药后,无菌条件下腹主动脉取血并暂存于促凝管中,静置2 h后,3000 r/min离心15 min,吸取上清液,56 ℃水浴30 min灭活,0.22 μm滤膜过滤,分装后于-80 ℃超低温冰箱存放备用。
2.3 造模、分组和给药
待神经元生长至5~7 d,参照文献方法[7-8]加入高糖(150 mmol/L)和皮质酮(200 μmol/L),干预18 h,构建模拟DD损伤环境的海马神经元体外模型。将培养的海马神经元随机分为正常组、空白血清组、模型组、阳性药药物血清组和待测药药物血清组,并分别加入相应体积分数10%的药物血清及空白血清,正常组和模型组则给予等量培养液。
2.4 Hoechst荧光染色检测海马神经元凋亡
上述各组神经元经造模和干预18 h后,弃原有上清液,用预冷PBS清洗2 min×3次,再经4%多聚甲醛固定30 min,0.25%TritonX-100作用15 min,每孔加100 μL Hoechst 33258室温避光环境孵育20 min。以上各操作之间均用预冷PBS清洗5 min×3次,最终向每孔内加50 μL PBS以维持观察环境,采用HCA法进行检测。
2.5 高内涵分析技术检测海马神经元凋亡相关蛋白Bcl-2、Bax和Caspase-8的表达
神经元经造模和干预18 h后,固定、打孔,每孔加5%BSA封闭30 min,加一抗稀释液孵育1 h,加FITC或RP-E标记的二抗稀释液孵育30 min,加核染剂DAPI稀释液孵育20 min,孵育过程均室温避光进行。最终向每孔补加PBS维持观察环境,上机检测。
3 统计学方法
采用SPSS17.0统计软件进行分析。实验数据以—x±s表示,当数据满足正态性且组间方差齐时,采用方差分析;如不满足上述条件,则采用非参数检验法。P<0.05表示差异有统计学意义。
4 结果
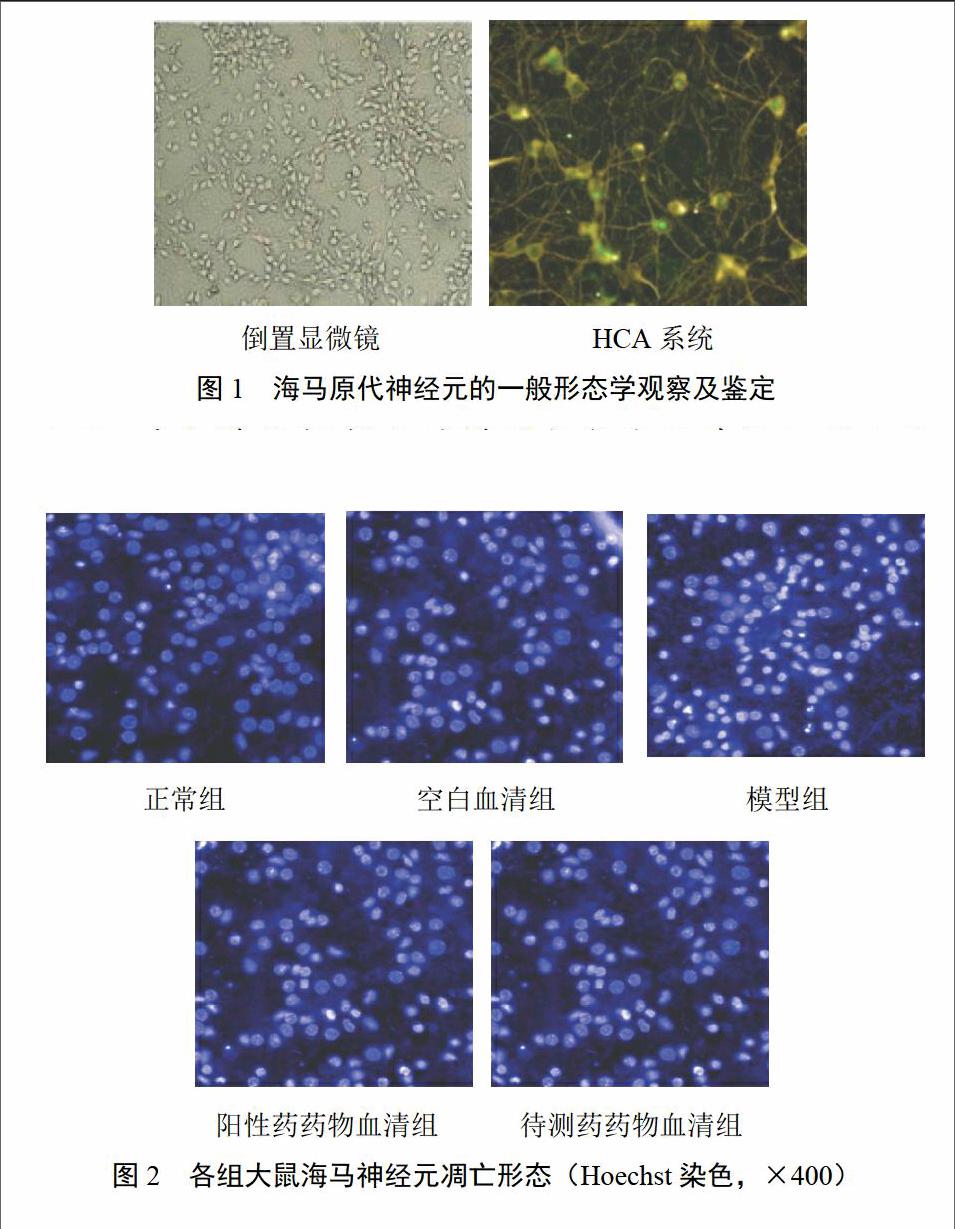
4.1 海马原代神经元的一般形态学观察及鉴定
培养5~7 d后,倒置显微镜下直接观察发现,海马神经元胞体圆润透亮,光泽度及折光性好,突起纵横交错,细小分支众多,相互连接形成均匀的神经元网络。NSE是神经元胞浆内的一种可溶性酸性蛋白,为神经元的特异性标志物。HCA检测发现,经神经元特异性标志物NSE染色后,可见绿色荧光在胞浆中呈阳性表达,随机选取10个视野,计算其呈阳性细胞数量占总细胞数的比例,结果表明阳性细胞率达95%以上,见图1。
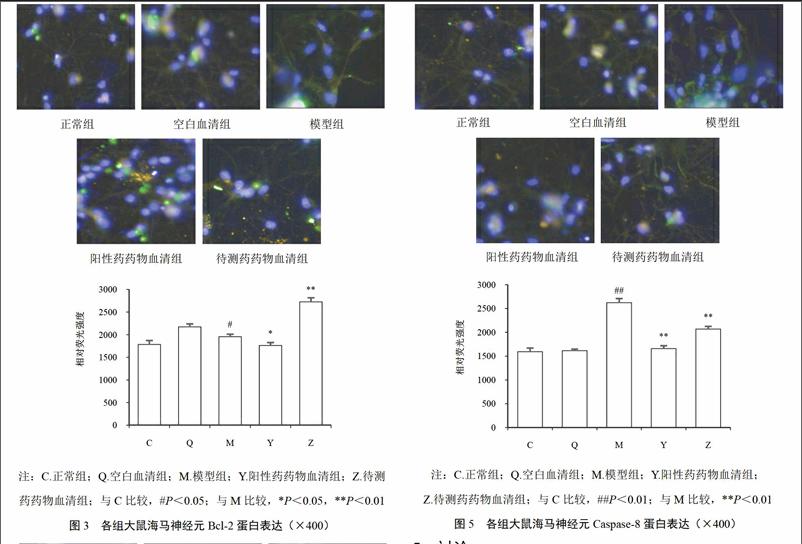
4.2 左归降糖解郁方对模型大鼠海马神经元凋亡的影响
从HCA结果可知,随机选取10个视野,正常组、空白血清组、模型组、阳性药药物血清组和待测药药物血清组中呈凋亡状态细胞比例分别为12.6%、15.1%、54.9%、35.1%和41.7%,其中正常组细胞发出的蓝色荧光分布均匀,光团完整均一,无明显凋亡特征;相比之下,模型组细胞光团分散,荧光分布不均,呈颗粒状分布,局部出现浓染,提示模型组神经元出现大量凋亡;经阳性药或待测药药物血清作用后,荧光分布均匀化,颗粒状光点明显减少。结果见图2。
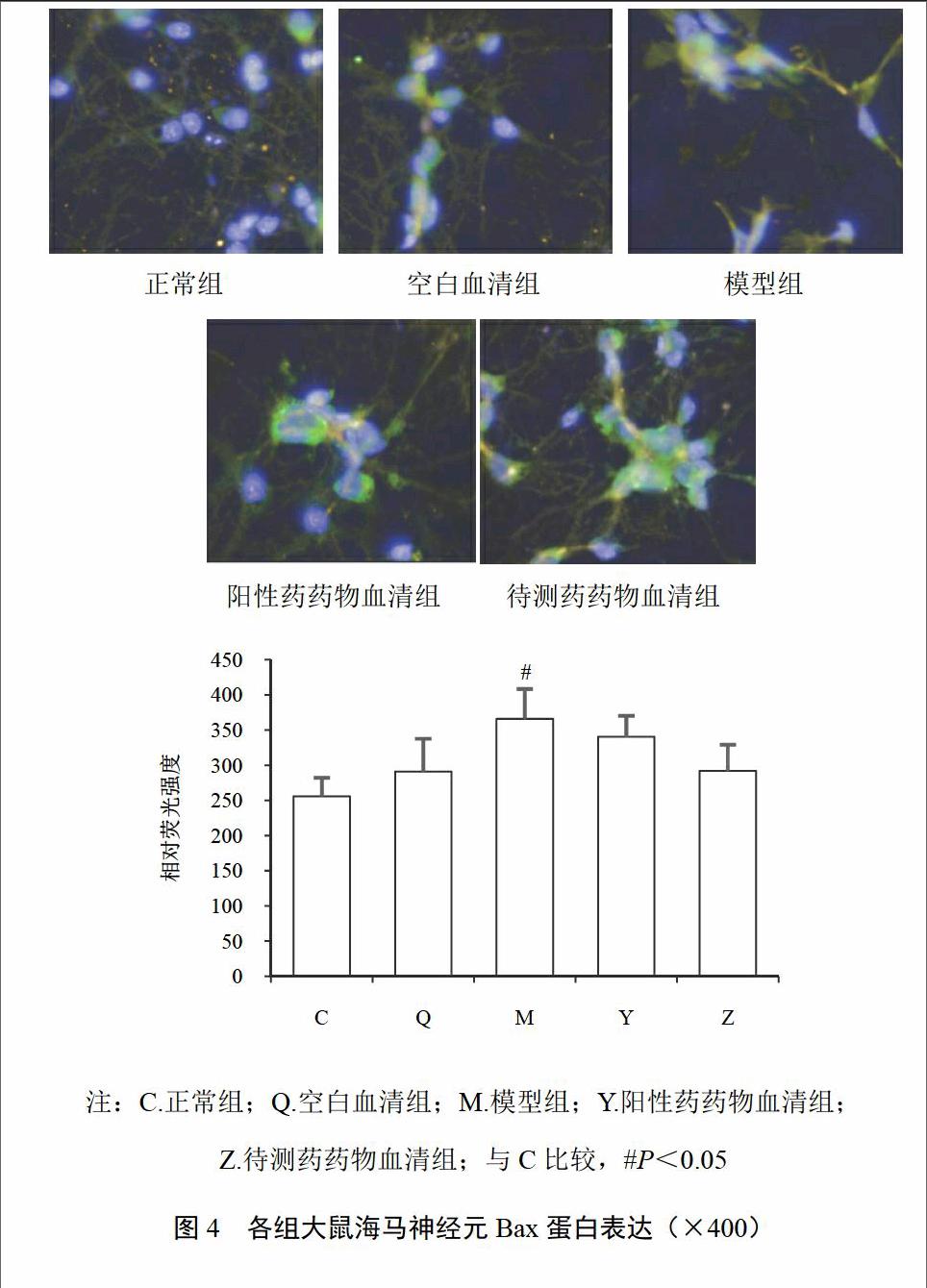
4.3 左归降糖解郁方对模型大鼠海马神经元凋亡相关蛋白表达的影响
HCA检测结果显示,与正常组及空白血清组比较,模型组大鼠海马神经元之间树突断裂或减少,网络连接明显减少,神经元内Bcl-2蛋白平均荧光强度显著降低(P<0.05),而蛋白Bax和Caspase-8的对应荧光强度明显升高(P<0.05,P<0.01);与模型组比较,待测药药物血清组和阳性药药物血清组树突连接及神经网络断裂情况得到明显修复,大鼠神经元Bcl-2蛋白平均荧光强度明显升高(P<0.05,P<0.01),Bax平均荧光强度降低,Caspase-8蛋白平均荧光强度明显降低(P<0.01),荧光强度与对应蛋白表达水平呈正相关。结果见图3~图5。
5 讨论
HCA是一种新型筛选技术,可在保证细胞完整的前提下,借助高分辨率荧光数码成像系统对待测样品的形态变化和生物分子表达进行检测,其主要特点是可通过单次检测获取大量靶点数据以实现高通量筛选,目前主要应用于药物初筛、作用靶点研究及安全性评价等方面[9]。HCA以荧光标记的待测细胞为主要模型,通过观察受试细胞中绿色荧光蛋白-靶点(标志性信号分子)融合蛋白的表达和转位变化,从而分析受试分子对特定靶点或通路的影响[10]。本研究采用DAPI标记细胞核以实现细胞定位,采用RP-E标记细胞骨架β-actin蛋白(橙黄色荧光)以观察神经元的网络变化,采用FITC标记其他目标靶蛋白(绿色荧光)以检测各靶蛋白在各干预条件下的表达趋势。
海马组织是DD发生的关键靶器官,其神经元受损是其主要表现之一。研究发现,慢性应激可引起2型糖尿病大鼠下丘脑-垂体-肾上腺轴紊乱,海马、下丘脑、垂体和肾上腺等器官的形态结构出现不同程度的器质性病变,表现为海马椎体细胞中存在不同程度的胞体深染和空泡变性,表明DD状态下海马神经元存在凋亡现象[11-12],然而其内在的分子机制并未得到深入探究。本实验通过采用高糖联合皮质酮复制DD体外模型,Hoechst 33258染色结果表明,DD的发生可引起大鼠海马神经元凋亡。细胞凋亡的发生需要启动细胞内多种基因调控和蛋白表达,其中Bcl-2家族与Caspase家族相关蛋白及基因是主要参与因子。Bcl-2家族中成员众多,主要包括抗凋亡基因Bcl-2和促凋亡基因Bax,在细胞凋亡的调控中发挥重要调节作用。Bcl-2蛋白是Bcl-2基因的编码产物,属于一种抗凋亡蛋白,主要存在于线粒体和内质网上,通过稳定线粒体膜防止线粒体内促凋亡相关蛋白泄漏,同时可阻断Ca2+从内质网中释放,使依赖Ca2+的核酸内切酶活性降低等途径阻断细胞凋亡;而Bax蛋白是Bcl-2的同源水溶性相关蛋白,主要分布在胞质中,其功能与Bcl-2相反,可通过与Bcl-2形成异源二聚体而拮抗Bcl-2的保护效应,属于一种促凋亡蛋白。因此,Bcl-2/Bax是衡量细胞是否会发生凋亡的重要指标。Caspase是凋亡过程中的公认主要相关基因,其中Caspase-8是Caspase级联反应的核心启动因子,其激活后可激活所有凋亡級联反应下游的Caspase,从而诱导细胞凋亡反应的发生,其编码产物属于凋亡相关蛋白。
本项研究显示,阳性药和待测药药物血清组均可明显抑制海马神经元凋亡,促进神经网络连接恢复;经高糖联合皮质酮处理后,抗凋亡相关蛋白Bcl-2的平均荧光强度明显减弱,促凋亡相关蛋白Bax与Caspase-8的平均荧光强度明显增强,即Bcl-2呈低表达,Bax与Caspase-8呈高表达,经左归降糖解郁方药物血清干预后,Bcl-2表达明显升高,Bax与Caspase-8的表达均呈下降趋势。提示左归降糖解郁方可能通过调控Bcl-2、Bax与Caspase-8的表达,对抗高糖与皮质酮的联合损伤作用,使海马神经元的凋亡现象被显著改善。课题组前期体内实验研究也发现,DD模型大鼠的空间学习记忆功能受到严重损伤,JNK、Bax蛋白及基因表达明显上升,Bcl-2表达下降,最终导致海马损伤、学习记忆功能障碍和抑郁发生,而左归降糖解郁方可通过抑制JNK表达,调节Bcl与Bax之间的平衡关系而抑制海马神经元凋亡[6],这提示体内与体外实验结果相对一致,同时亦佐证了左归降糖解郁方对学习记忆、神经元凋亡的调控作用。
综上所述,左归降糖解郁方可改善DD的海马功能,其可通过线粒体Bax/Bcl-2/Caspase-8途径减少海马神经元的凋亡而发挥作用,通过有效调控神经元凋亡相关蛋白可能是左归降糖解郁方治疗DD的重要机制之一,但其抗细胞凋亡的具体机制仍有待进一步研究。
参考文献:
[1] MUT-VITCU G, TIMAR B, TIMAR R, et al. Depression influences the quality of diabetes-related self-management activities in elderly patients with type 2 diabetes:a cross-sectional study[J]. Clinical Interventions in Aging,2016,11:471.
[2] 赵洪影,王瑞瑞,吴恩杰,等.1型糖尿病患儿抑郁症的患病率调查及两病相关性研究[J].中国妇幼保健,2016,31(13):2658-2660.
[3] VAN DOOREN F E, NEFS G, SCHRAM M, et al. Depression and risk of mortality in people with diabetes mellitus:a systematic review and meta-analysis[J]. PLos One,2013,8(3):e57058.
[4] 杨蕙,王宇红,张秀丽,等.慢性应激对2型糖尿病大鼠HPA轴紊乱及海马损伤的影响[J].中华中医药学刊,2014,32(11):2660-2663.
[5] WANG Y H, HUI Y, WEI L, et al. Zuogui Jiangtang Jieyu Formulation prevents hyperglycaemia and depressive-like behaviour in rats by reducing the glucocorticoid Level in plasma and hippocampus[J]. Evidence-based Complementary and Alternative Medicine,2015, 2015:158361.
[6] 孟盼,赵洪庆,杜青,等.左归降糖解郁方对糖尿病并发抑郁症大鼠海马神经元凋亡的影响[J].中国中医药信息杂志,2016,23(9):78-81.
[7] 刘检,王宇红,徐雅岚,等.改良的胎鼠海马神经元原代培养及模拟糖尿病并发抑郁环境对其的损伤作用[J].神经解剖学杂志,2016,32(4):459-465.
[8] 张秀丽,王宇红,杨蕙,等.左归降糖解郁方对大鼠海马神经元细胞的保护作用[J].湖南中医药大学学报,2014,34(12):8-12.
[9] MOUCHET E H, SIMPSON P B. High-content assays in oncology drug discovery:opportunities and challenges[J]. Idrugs,2008,11(6):422-427.
[10] 馮帆,龙隆,李微,等.应用高内涵分析技术识别雄激素受体激动剂[J].中国药理学与毒理学杂志,2014,28(1):42-50.
[11] 杨蕙.糖尿病并发抑郁症动物模型的建立及中药干预作用[D].长沙:湖南中医药大学,2013.
[12] 张秀丽,王宇红,杨蕙,等.左归降糖解郁方对糖尿病并发抑郁症模型大鼠学习记忆及海马超微结构的影响[J].时珍国医国药,2015,26(4):787-789.
(收稿日期:2017-01-13)
(修回日期:2017-02-05;编辑:华强)
- 论建筑企业营改增后对会计核算及财务指标的影响
- 浅谈基本建设投资审计研究
- 关于供销合作社内控管理中存在问题的思考
- 浅析P2P网络金融监管的国际经验与我国实践的融合
- 资产证券化与银行体系稳定性的相关研究
- 我国地方政府债券发行及置换存在的问题
- 管理层持股与企业R&D投资研究
- 加强和改进农村殡葬改革工作的思考
- 制造企业成本核算与管理问题之研究论述
- 浅谈如何加强工商管理培训提高企业管理水平
- 关于当代大学生消费观的思考
- 网络环境下高校学生收费管理系统的创新研究
- 本科生科研项目管理存在的问题与对策研究
- 浅析基层农业科研单位固定资产管理
- 浅谈通信行业混合所有制改革的合理化路径
- 浅谈经济师人力资源管理的发展现状及对策
- 国企人才流失现象分析
- 建筑施工企业营运资金管理探讨
- 关于监狱企业固定资产管理工作相关问题的探讨
- DRGs在医院精细化管理中的应用研究
- 企业固定资产管理存在的问题与对策
- 目标成本法管理在房地产开发中的重要性及运用
- 行政事业单位加强“三公”经费管理的对策探讨
- 浅谈加强地勘单位国有资产管理的措施
- 谈企业吸收合并中的办理要点
- generically
- genericalness
- genericalnesses
- genericize
- genericness
- genericnesses
- generics
- generosities
- generosity
- generous
- generously
- generousness
- generousnesses
- generous/not generous
- '-genes
- genes'
- genes
- geneses'
- geneses
- genesiac
- genesiacal
- genesis
- genesises
- genesis's
- genesitic
- 潜心苦思
- 潜心钻研
- 潜心静气
- 潜志
- 潜怀
- 潜怅
- 潜思
- 潜意识
- 潜意识广告
- 潜意识说
- 潜感
- 潜懿
- 潜戢
- 潜效益
- 潜文
- 潜映
- 潜晦
- 潜构
- 潜林
- 潜歧视
- 潜水
- 潜水器
- 潜水机器人
- 潜水的人
- 潜水艇