
摘要:目的 考察HepG2.2.15细胞对同时包载丁香苦苷和羟基酪醇纳米粒(nanoparticles co-loaded with syringopicroside and hydroxytyrosol,SH-NPs)的摄取机制。方法 采用沉淀法制备SH-NPs,以异硫氰酸荧光素为荧光标记物,采用流式细胞仪研究HepG2.2.15细胞对SH-NPs的摄取机制。结果 秋水仙素为抑制剂,孵育时间在0.5~24 h范围内,阳性细胞百分数由1.9%增加到56.4%;药物浓度为125、250、500 ?g/mL时,阳性细胞百分数分别为4.9%、3.4%、3.9%。氯喹为抑制剂,孵育时间在0.5~24 h范围内,阳性细胞百分数由7.4%增加到55.4%;药物浓度为125、250、500 ?g/mL时,阳性细胞百分数分别为19.5%、22.5%、27.6%。结论 秋水仙素与氯喹对HepG2.2.15细胞摄取有抑制作用,且HepG2.2.15细胞对SH-NPs的摄取与药物浓度、孵育时间呈正相关,推断HepG2.2.15细胞对SH-NPs细胞的摄取机制为非特异性吸附内吞。
关键词:丁香苦苷;羟基酪醇;聚乙二醇-聚乳酸乙醇酸共聚物纳米粒;HepG2.2.15细胞;摄取机制
DOI:10.3969/j.issn.1005-5304.2018.03.018
中图分类号:R285.5 文献标识码:A 文章编号:1005-5304(2018)03-0081-05
Abstract: Objective To investigate the uptake mechanism of HepG2.2.15 cells to the nanoparticles co-loaded with syringopicroside and hydroxytyrosol (SH-NPs). Methods The nanoparticles were prepared by using a nanoprecipitation method with mPEG-PLGA as nano-carrier co-loaded with syringopicroside and hydroxytyrosol. The uptake mechanism of HepG2.2.15 cells to SH-NPs was studied by fluorescence microscopy and flow cytometry using fluoresceineisothiocyanate (FITC) as a fluorescent marker. Results With colchicine as the inhibitor, the incubation time ranged from 0.5 to 24 h, the percentage of positive cells increased from 1.9% to 56.4%; When the drug concentration was 125, 250 ?g/mL and 500 ?g/mL, the positive cell percentages were 4.9%, 3.4% and 3.9%. With chloroquine as the inhibitor; the incubation time ranged from 0.5 to 24 h, the percentage of positive cells increased from 7.4% to 55.4%; When the drug concentration was 125, 250 and 500 ?g/mL, the percentage of positive cells was 19.5%, 22.5% and 27.6%. Conclusion Colchicine and chloroquine have an inhibitory effect on HepG2.2.15 cells uptake, and the uptake of SH-NPs in HepG2.2.15 cells was positively correlated with drug concentration and incubation time. It can be concluded that the uptake mechanism of HepG2.2.15 cells to SH-NPs was nonspecific adsorption endocytosis.
Keywords: syringopicroside; hydroxytyrosol; mPEG-PLGA nanoparticles; HepG2.2.15 cells; uptake mechanism
丁香苦苷(syringopicroside)和羟基酪醇(hydroxytyrosol)是木犀科植物洋丁香、朝鲜丁香或紫丁香干燥叶中的活性物质,二者体内代谢迅速,稳定性及肝靶向性差,常规给药途径不利于药效的发挥。近年来,由于肝癌发病率逐渐增高,因此,开发提高丁香苦苷和羟基酪醇靶向于肝细胞的新型递药系统是目前亟需解决的问题。
中药纳米递药系统不仅具有较强的靶向性,而且在生物利用度和缓释功能方面也具有较大优势。研究发现,納米粒(NPs)的表面用聚乙二醇(PEG)等亲水性的高分子材料修饰后,能够形成一层水化保护膜,减少巨噬细胞对纳米粒的识别和吞噬,同时能延长纳米粒血液循环时间,从而产生缓释作用,提高生物利用度,降低毒副作用,为药物输送提供了新途径[1-2]。本课题组将二者制备成聚乙二醇-聚乳酸乙醇酸共聚物(monomethoxy polyethylene glycol-poly lactide- co-glycolide,mPEG-PLGA)纳米递药系统,并且于前期进行了关于同时包载丁香苦苷和羟基酪醇纳米粒(nanoparticles co-loaded with syringopicroside and hydroxytyrosol,SH-NPs)的制剂性状研究,结果表明,SH-NPs总包封率为(32.38±2.76)%,总药物负荷为(12.01±0.42)%,粒径为(91.70±2.11)nm,多分散指数为0.22±0.01,通过透射电子显微镜观察, SH-NPs颗粒形态圆整,均匀分布,且对肝脏具有较强的靶向性[3],同时,经过HepG2.2.15细胞对SH-NPs摄取研究,发现SH-NPs能够被HepG2.2.15细胞摄取,在此基础上进一步进行细胞摄取机制的研究,选择秋水仙素和氯喹为内吞抑制剂,以异硫氰酸荧光素(fluoresceine isothiocyanate,FITC)为荧光标记物,用纳米沉淀法制备SH-NPs,以HepG2.2.15细胞为模型细胞,借助流式细胞仪研究HepG2.2.15细胞对SH-NPs的细胞摄取机制,为存在肝靶向性差、稳定性差、半衰期短等缺陷的药物的纳米化提供新思路。
1 细胞、仪器与试药
HepG2.2.15细胞株(上海博谷公司),空白NPs(自制)。
HFsafe-1200型超净工作台(Heal Force公司),HZQ-C型空气浴振荡器(哈尔滨市东联电子技术开发有限公司),H2050R型离心机(长沙湘仪离心机仪器有限公司),液氮罐(成都金凤有限公司),细胞培养板、细胞培养瓶(Corning),BD Accuri C6型流式细胞仪(Becton,Dickinson and Company),RPMI-1640液体培养基(美国Hyclone公司),10%优级胎牛血清(美国Hyclone 公司),胰蛋白酶(美国Hyclone公司),磷酸盐缓冲液(PBS,武汉博士德公司),双抗(青霉素/鏈霉素,华北制药厂),胰蛋白酶(美国Hyclone公司),碘化丙啶(PI,南京凯基公司),SH-NPs冻干粉(自制),FITC(Sigma公司,批号20130608),秋水仙素(美国Acros organics公司),氯喹(美国Acros organics公司)。
2 方法与结果
2.1 SH-NPs与FITC标记的SH-NPs制备
采用纳米沉淀法制备纳米粒[4],精密称量10%mPEG-PLGA共聚物20 mg,分散于10 mL丙酮中,超声使其溶解,形成有机相。向14.1 mg丁香苦苷和羟基酪醇混合物中加入FITC荧光标记物3 mg或不加入FITC,分散于有机相中,超声溶解,配制浓度为0.1%F-68溶液21 mL,形成水相。在1000 r/min磁力搅拌条件下,将有机相滴加到水相中,滴毕,于细胞破碎仪超声60 s,磁力搅拌1000 r/min,旋转蒸发(40 ℃)除去有机溶剂,即得FITC标记的SH-NPs(FITC-SH-NPs)或SH-NPs。
2.2 细胞摄取实验
将密度为1×104 cfu/mL的HepG2.2.15细胞播撒在12孔细胞培养板上。分别取FITC-SH-NPs、FITC溶液和空白NPs与细胞共孵育24 h。孵育后,用1 mL PBS清洗3次,消化细胞,置于相应Ep管中,1000 r/min离心5 min,最后用1 mL PBS重悬细胞。选用与FITC激发波长相近的激发光通道,用流式细胞分析仪分析细胞的摄取情况。结果见图1。空白NPs和FITC溶液与HepG2.2.15细胞作用后,阳性细胞百分数很低,分别为1.9%、3.9%,细胞内几乎没有荧光,表明空白NPs本身无荧光,且FITC分子在本实验的孵育时间内不能进入细胞,排除了空白NPs和FITC分子对结果的影响。
2.3 秋水仙素对细胞摄取抑制作用的考察
秋水仙素是一种微管形成抑制剂,能与微管蛋白结合,使微管解聚。微管不仅能维持细胞的形态,更重要的是负责将细胞器从细胞内的一处移到另一处,如将内吞形成的小泡从细胞膜移开,为形成更多的内吞小泡腾出空间。一旦微管解聚,内吞形成的小泡从细胞膜转运到核内体受到抑制,内吞受阻。本实验通过在细胞培养液中加入内吞抑制剂秋水仙素研究细胞摄取过程,结果见图2。与对照组比较,在同一浓度、同一时间抑制组对细胞摄取的阳性细胞百分数为5.4%,而不加秋水仙素的对照组对细胞摄取的阳性细胞百分数为49.9%,表明秋水仙素对细胞摄取有较强的抑制作用。
2.3.1 时间秋水仙素细胞摄取抑制作用的影响
细胞在24孔培养板中贴壁生长后,提前3 h在抑制组细胞培养液中加入360 ?g/mL秋水仙素,对照组细胞培养液中不加任何抑制剂,分别加入500 ?g/mL FITC-SH-NPs溶液,于37 ℃孵育0.5、1、2、4、24 h,PBS冲洗细胞3次,胰蛋白酶消化细胞,流式细胞仪检测,考察时间对细胞摄取抑制作用的影响,结果见图3。与对照组比较,抑制组阳性细胞百分数显著降低,细胞作用0.5、l、2 h的阳性细胞百分数相似,分别为1.9%、2.9%、4.3%,表明秋水仙素对细胞摄取的抑制作用很强;随着FITC-SH-NPs与细胞孵育时间的延长(4、24 h),阳性细胞百分数增加至42.9%、56.4%,表明秋水仙素对细胞摄取的抑制作用随时间延长逐渐减弱。
2.3.2 浓度对秋水仙素细胞摄取抑制作用的影响
细胞在24孔培养板中贴壁生长后,提前3 h在抑制组的细胞培养液中加入360 ?g/mL秋水仙素,对照组的细胞培养液中不加任何抑制剂,分别加入125、250、500 ?g/mL FITC-SH-NPs溶液,于37 ℃孵育2 h,按“2.3.1”项下方法操作,用流式细胞仪测定,考察不同浓度FITC-SH-NPs对细胞摄取抑制作用的影响,结果见图4。与对照组比较,抑制组的阳性细胞百分数明显降低,表明秋水仙素对细胞摄取存在抑制作用。125、250、500 ?g/mL FITC-SH-NPs在秋水仙素抑制后孵育相同时间,阳性细胞百分数分别为4.9%、3.4%、3.9%。
2.4 氯喹对细胞摄取抑制作用的考察
氯喹是一种趋溶酶体试剂,为弱碱性,能抑制核内体的成熟,阻断内吞进入细胞的粒子从早期核内体转运到晚期核内体以及从晚期核内体转运到溶酶体,同时升高细胞内酸性细胞器(溶酶体、核内体)的pH值。本实验通过在细胞培养液中加入内吞抑制剂氯喹研究细胞摄取过程,结果见图5。与对照组比较,氯喹抑制组对细胞摄取有较强抑制作用。
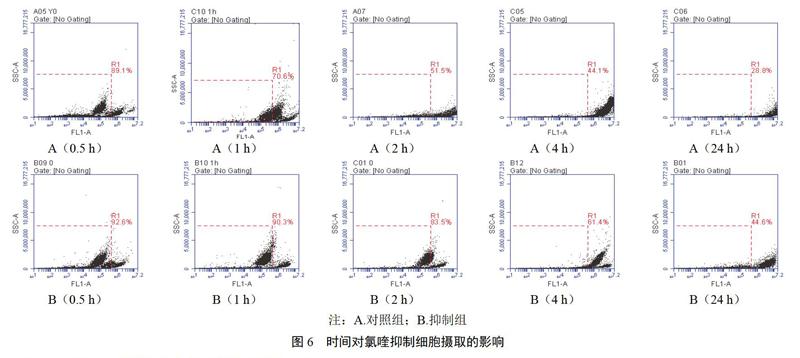
2.4.1 时间对氯喹细胞摄取抑制作用的影响
细胞在24孔培养板中贴壁生长后,提前l h在抑制组的细胞培养液中加入516 ?g/mL氯喹,按“2.3.1”项下方法操作,考察不同孵育时间(0.5、1、2、4、24 h)对细胞摄取抑制作用的影响,结果见图6。与对照组比较,抑制组阳性细胞百分数显著降低,当细胞与FITC-SH-NPs共孵育0.5、l h时,阳性细胞百分数较对照组低,分别为7.4%、9.7%,随着孵育时间的延长(2、4、24 h),阳性细胞百分数增加至16.5%、38.6%、55.4%,抑制作用逐渐减弱,表明氯喹对FITC-SH-NPs的细胞摄取有抑制作用,且与孵育时间相关。
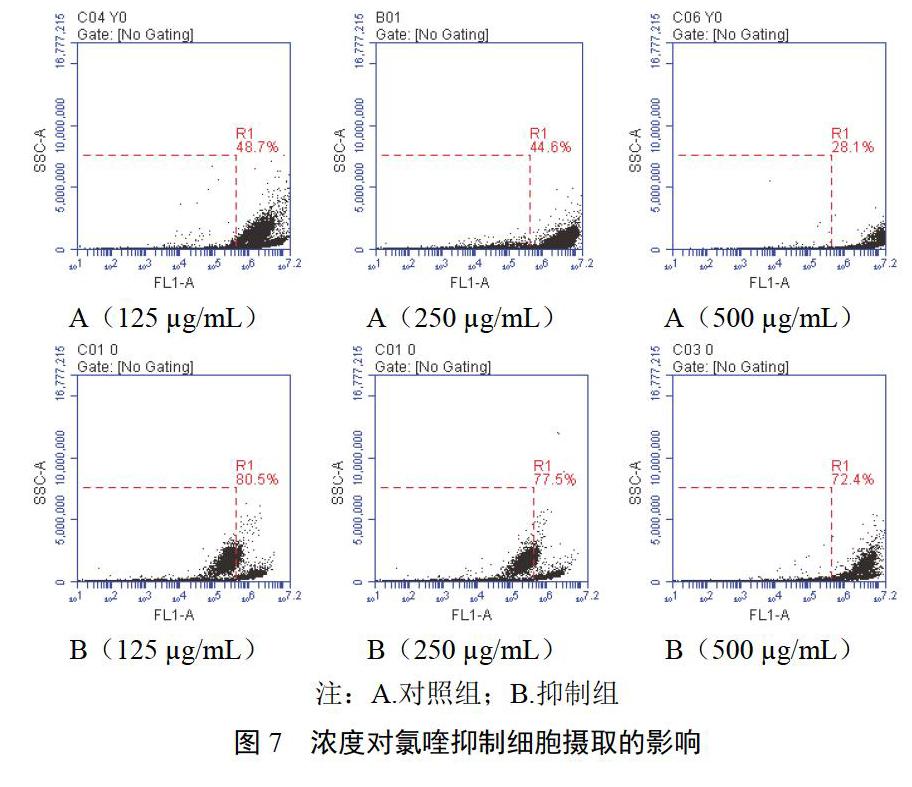
2.4.2 浓度对氯喹细胞摄取抑制作用的影响
细胞在24孔培养板中贴壁生长后,提前l h在抑制组细胞培养液中加入516 ?g/mL氯喹,按“2.3.2”项下方法考察FITC-SH-NPs浓度对细胞摄取抑制作用的影响,结果见图7。125、250、500 ?g/mL FITC-SH-NPs与细胞共孵育,阳性细胞百分数无明显差异,分别为19.5 %、22.5%、27.6%,表明短时间内细胞摄取不受浓度影响,抑制作用基本维持在同一水平。
3 讨论
近年来关于纳米载体的细胞摄取研究较多。体外细胞培养技术为测定生物材料的生物相容性提供了有效的研究方法,通过这项技术可以研究细胞和纳米载体材料间的相互作用,以纳米粒粒径、电位、包封率、载药量及体外释药行为为考察因素,考察纳米载体的细胞摄取机制[5]。纳米载体的细胞摄取实验是判断药物是否靶向于细胞内的常用方法,体外细胞培养技术为测定生物材料的生物相容性提供了有效的研究方法,通过此项技术可研究细胞和纳米载体材料间的相互作用[6]。而荧光标记技术可简单快速地进行细胞摄取的定性、定量研究,因此,本实验结合上述技术,选择2种内吞抑制剂对SH-NPs的细胞摄取机制进行了进一步的研究。
由于不同类型的纳米递药系统在与细胞相互作用时会呈现不同的分布和动力学行为,不同结构的纳米载体与细胞膜之间的相互作用力也有所区别,因此,细胞对纳米给药系统的内化过程也存在差异。目前被认可的观点是,纳米载体携带着大分子药物,通过与细胞表面的静电力、氢键等非特异性物理吸附,以吸附性内吞的形式进入细胞,完成细胞的药物转运[7-10]。因此,本实验采用內吞抑制剂秋水仙素和氯喹进行细胞摄取机制的研究,以FITC为荧光标记物,采用流式细胞仪分析细胞的摄取情况,通过分析结果可知,秋水仙素和氯喹均能一定程度抑制HepG2.2.15细胞对SH-NPs的摄取,且HepG2.2.15细胞对SH-NPs的摄取与药物浓度、孵育时间呈正相关,由此可以推断,SH-NPs被细胞内在化的过程为非特异性吸附内吞。本实验为后续研究工作奠定了基础,丰富了对纳米粒的研究内容,但仍需进一步深入。
参考文献:
[1] 魏丽莎,季艳霞,康振桥,等.肿瘤靶向纳米制剂研究进展[J].国际药学研究杂志,2014,41(1):68-74.
[2] 何黎黎,谭彦,西洛,等.PEG-PLGA嵌段共聚物空白纳米粒的制备工艺筛选[J].时珍国医国药,2016,27(1):94-96.
[3] GUAN Q, SUN S, LI X, et al. Preparation, in vitro and in vivo evaluation of mPEG-PLGA nanoparticles co-loaded with syringopicroside and hydroxytyrosol[J]. J Mater Sci Mater Med,2016,27(2):24.
[4] 王婴,李木生,吴瑞婵,等.星点设计-效应面法优化青藤碱聚乳酸-羟基乙酸纳米粒的制备工艺[J].中药新药与临床药理,2017,28(2):232- 237.
[5] 许娟,刘冲,许艺苧,等.整合素受体靶向的载胰岛素三甲基壳聚糖纳米给药系统细胞摄取及转运机制[J].药学学报,2015,50(7):893-898.
[6] YUE G G, CHAN B C, HON P M, et al. Evaluation of in vitro anti-proliferative and immunomodulatory activities of compounds isolated from Curcuma longa[J]. Food Chem Toxicol,2010,48(8/9):2011-2020.
[7] 罗晴,王雷,林彤远,等.鹰嘴豆芽素A及其聚乙二醇化纳米脂质载体在Caco-2细胞模型的摄取和转运机制研究[J].中国临床药理学杂志, 2014,30(8):715-718.
[8] 陈志鹏,张刘杰,贺佳玉,等.马钱子碱新型壳聚糖纳米粒体外肝癌细胞摄取特性的研究[J].中国药科大学学报,2014,45(6):674-680.
[9] 谭梅娥,姜雯,曾诚,等.田蓟苷固体脂质纳米粒的优化及其在Caco-2细胞模型中的吸收和转运研究[J].中草药,2017,48(10):2051-2060.
[10] 文星星,蔡蕙,温露,等.壳聚糖修饰的PLGA纳米粒的制备与体外细胞摄取[J].广东化工,2016,43(3):12-13.
(收稿日期:2017-06-10)
(修回日期:2017-07-05;編辑:陈静)
- 干旱对黑龙江省大豆品种农艺性状的影响
- 浅析生态养殖技术在水产养殖中的应用
- 设施果树栽培技术在林果业种植中的应用
- 柳根鱼网箱养殖试验
- 百合高产优质栽培技术
- 莲花湖渔业资源现状及保护对策
- 温室茄子栽培及病虫害防治技术
- 芒果栽培技术探讨
- 无公害马铃薯病虫害防控技术
- 苹果树种植管理技术
- 浅谈花生高产种植技术
- 优质油松苗木培育的关键技术
- 浅析农作物栽培管理技术创新与发展思路
- “蜂糖李”栽培技术浅析
- 大豆栽培技术与病害的防治措施研究
- 晚秋蜜桃栽培技术及病害防治措施分析
- 黔中地区楠竹(母竹)种植技术初探
- 北方地区日光温室黄瓜的栽培技术
- 黄芪病虫害的发生特点与防治技术
- 马铃薯高产栽培技术和病虫害的防治
- 探讨雷竹引种栽培关键技术
- 浅析农作物栽培无公害栽培的管理技术
- 探讨板栗品种嫁接改良技术措施
- 油松小蠹虫的特点及防治技术研究
- 试述我国道路绿化建设中植物配置现状及多样性配置的实现途径
- oilest
- oilfield
- oilier
- oiliest
- oiliness
- oilinesses
- oiling
- oil-less
- oillessness'
- oillessness
- oillessnesses
- oillessness's
- oillike
- oilman
- oilmen
- oil-painter
- oil painter
- oil painters
- oil painting
- oil-painting
- oil paintings
- oilplatform
- oil platform
- oil platform
- oilrig
- 句将山三泉
- 句尾句中语气词
- 句尾用故字例
- 句尾词
- 句度
- 句式
- 句式杂糅
- 句式派生
- 句式的选择和运用
- 句式调整
- 句式谓语
- 句式转换
- 句式选择
- 句式错综
- 句意倾向
- 句投
- 句斟字嚼
- 句斟字酌
- 句斟字酌,不苟且下笔
- 句断
- 句曲
- 句曲仙诀
- 句末助词
- 句末语助
- 句末语气助词