赵怡然 付洪涛 赵楠楠

摘要 目的:探讨丹参素对IUGR胎鼠脑神经细胞及脑组织Rho/ROCK信号通路的影响。方法:将40只孕鼠以随机数字表法分为正常组、IUGR组、IUGR+低剂量、中剂量、高剂量丹参素组,予以低蛋白饮食法建立IUGR模型,正常组、IUGR组于妊娠第12天尾静脉注射等体积生理盐水5.0 mg/(kg·d),丹参素低、中、高剂量组分别于妊娠第12天起尾静脉注射等体积不同浓度丹参素溶液,低剂量组10 μg/(kg·d),中剂量组20 μg/(kg·d),高剂量组30 μg/(kg·d),于自然分娩后6 h内测定胎鼠体质量,麻醉處死后行脑组织HE染色,选择RT-PCR、Western blot法对RhoA、ROCKⅡmRNA及蛋白表达进行测定,流式细胞术检测脑神经细胞凋亡率。结果:IUGR组胎鼠体质量明显低于正常组,IUGR+丹参素高剂量组胎鼠体质量高于中剂量组、低剂量组(P<0.05)。IUGR组RhoA、ROCKⅡ mRNA、蛋白表达及脑神经细胞凋亡率均高于正常组,而IUGR+丹参素高剂量组低于中剂量组、低剂量组(P<0.05)。结论:丹参素可调控Rho/ROCK信号通路并抑制其活性,以促进IUGR胎鼠脑神经细胞增殖,改善其生长发育。
关键词 丹参素;宫内生长受限;神经干细胞;Ras同源基因A;Rho相关螺旋卷曲蛋白激酶Ⅱ
Abstract Objective:To explore the effects of tanshinolon on Rho/ROCK signaling pathway in brain nerve cells and brain tissues of IUGR fetal rats. Methods:A total of 40 pregnant rats were randomly divided into a normal group, a IUGR group, a IUGR+ low-dose, a medium-dose and a high-dose tanshinol group. The IUGR model was established by low-protein diet. Normal group and IUGR group were injected with 5.0 mg/kg saline intravenously on the 12th day of pregnancy. Low, medium and high dose groups of tanshinolon were injected with tanshinol solution with equal volume and different concentration intravenously from the 12th day of pregnancy, respectively, with low dose group 10 μ g/(kg·d), medium dose group 20 μ g/(kg·d) and high dose group 30 μ g/(kg·d). The weight of fetal rats was measured within 6 h after natural delivery. After anesthesia, the brain tissue was stained with HE. The expressions of RhoA and ROCKⅡmRNA and protein were determined by RT-PCR and Western blot, and the apoptosis rate of brain nerve cells was detected by flow cytometry. Results:The body weight of fetal rats in IUGR group was significantly lower than that in normal group. The body weight of fetal rats in IUGR+tanshinolhigh-dose group was higher than that in medium dose group and low-dose group (P<0.05). The expression of RhoA, rock Ⅱ mRNA, protein and apoptosis rate of brain nerve cells in IUGR group were higher than those in normal group, while those in IUGR+tanshinol high-dose group were lower than those in middle dose group and low-dose group (P<0.05). Conclusion:Tanshinol can regulate Rho/ROCK signaling pathway and inhibit its activity, so as to promote the proliferation and improve the growth and development of IUGR fetal rat brain cells.
Keywords Tanshinol; Intrauterine growth restriction; Neural stem cells; Ras homologous gene A; Rho related helix protein kinase Ⅱ
中图分类号:R363;R285.5;R322.85;R714.43+1 文献标识码:A doi:10.3969/j.issn.1673-7202.2020.22.007
胎儿宫内生长受限(Intrauterine Growth Restriction,IUGR)由母体、胎盘和胎儿等多种病理因素导致,致使胎儿在宫内的生长发育受限,生长潜能下降,胎儿出生后体质量明显低于正常胎儿,IUGR增加了围生期患病率的同时提升其病死率[1-2]。还会影响胎儿远期神经系统发育,出现神经行为学后遗症,常见如:运动障碍、行为异常等,同时降低胎儿学习能力降低、注意力集中能力[3]。研究IUGR患儿的脑损伤病理机制对其防治至关重要,以往研究表明,中枢神经系统损伤后,多种炎性反应递质和细胞因子激活Ras同源基因(Ras Homolog Gene Family Member,Rho)蛋白,造成膜转位-激活效应分子,Rho相关卷曲螺旋蛋白激酶(Rho-associated Coiled-coil Forming Protein Kinase,ROCK)磷酸化,重排神经细胞骨架-生长锥塌陷及回缩-轴突停止生长,树突、轴突再生能力很弱,Rho/ROCK信号通路活化阻断中枢神经损伤后的再生[4-5]。而丹参是近年来临床上常用的活血化瘀中药,在心脑血管疾病的治疗中应用较广,其有效水溶性成分之一丹参素,对缺氧缺血性脑损伤有神经保护作用[6-7]。但丹参素对IUGR胎鼠是否具有保护作用,其机制如何,尚不清楚。因此,研究丹参素对IUGR胎鼠脑神经细胞及脑组织Rho/ROCK信号通路的影响,对产前促进IUGR胎儿生长发育有重要意义。
1 材料与方法
1.1 材料
1.1.1 动物 健康清洁级成年雄性SD大鼠20只,雌性SD大鼠40只,体质量250~300 g,自辽宁长生生物技术有限公司购入,许可证号SCXK(辽)2015-0001。动物饲养条件:18~20 ℃,湿度60% ~70%,明暗各12 h,自由饮水、摄食。
1.1.2 药物 丹参素(Danshensu,HPLC>98%,上海联硕生物科技有限公司,货号:76822-21-4)。
1.1.3 试剂与仪器 兔抗ROCKII多克隆抗体(Abcam公司,美国,批号:ab71598)、兔抗RhoA单克隆抗体(Abcam公司,美国,批号:ab40673),RIPA蛋白裂解液(索莱宝公司,批号:20160307),Trizol试剂(simgen杭州,货号:5301100),RNA提取试剂盒(天漠生物,货号:TR205-50),反转录试剂盒(BIOMIGA,美国,货号:RT0213-01),Real-timePCR扩增仪(AppliedBiosystems公司产品,美国,型号:7500),病理切片机(徕卡公司,德国,型号:RM2235),台式冰冻离心机(BECKMAN公司,美国,型号:GS-15R),NIKON显微镜及成像系统(尼康公司,日本,型号:NIKON TE2000-U)。
1.2 方法
1.2.1 分组与模型制备 分组与模型制备:运用低蛋白饮食法[8]建立模型,标准饲料、低蛋白饲料购于北京华阜康生物科技股份有限公司。将2只雌鼠与1只雄鼠合笼,次日早晨取阴道分泌物予以镜检,发现精子视为妊娠第1天,选择随机数字表法对40只雌性孕鼠进行分组,即正常组、IUGR组、IUGR+低剂量丹参素组、IUGR+中剂量丹参素组、IUGR+高剂量丹参素组,共5组,每组8只。
1.2.2 给药方法 正常组、模型组于妊娠第12天尾静脉注射等体积生理盐水5.0 mg/(kg·d),丹参素低、中、高剂量组分别于妊娠第12天起尾静脉注射等体积不同浓度丹参素溶液,低剂量组10 μg/(kg·d),中剂量组20 μg/(kg·d),高剂量组30 μg/(kg·d)直至自然分娩。
1.2.3 检测指标与方法
1.2.3.1 动物取材 5组孕鼠在自然分娩后的6 h内对胎鼠体质量进行测定,出现体质量低于正常组平均体质量减2个标准差胎鼠则表示IUGR模型建立成功。测定完成后予以麻醉并迅速处死,随机每窝取1只,取其脑组织固定于4%多聚甲醛中。
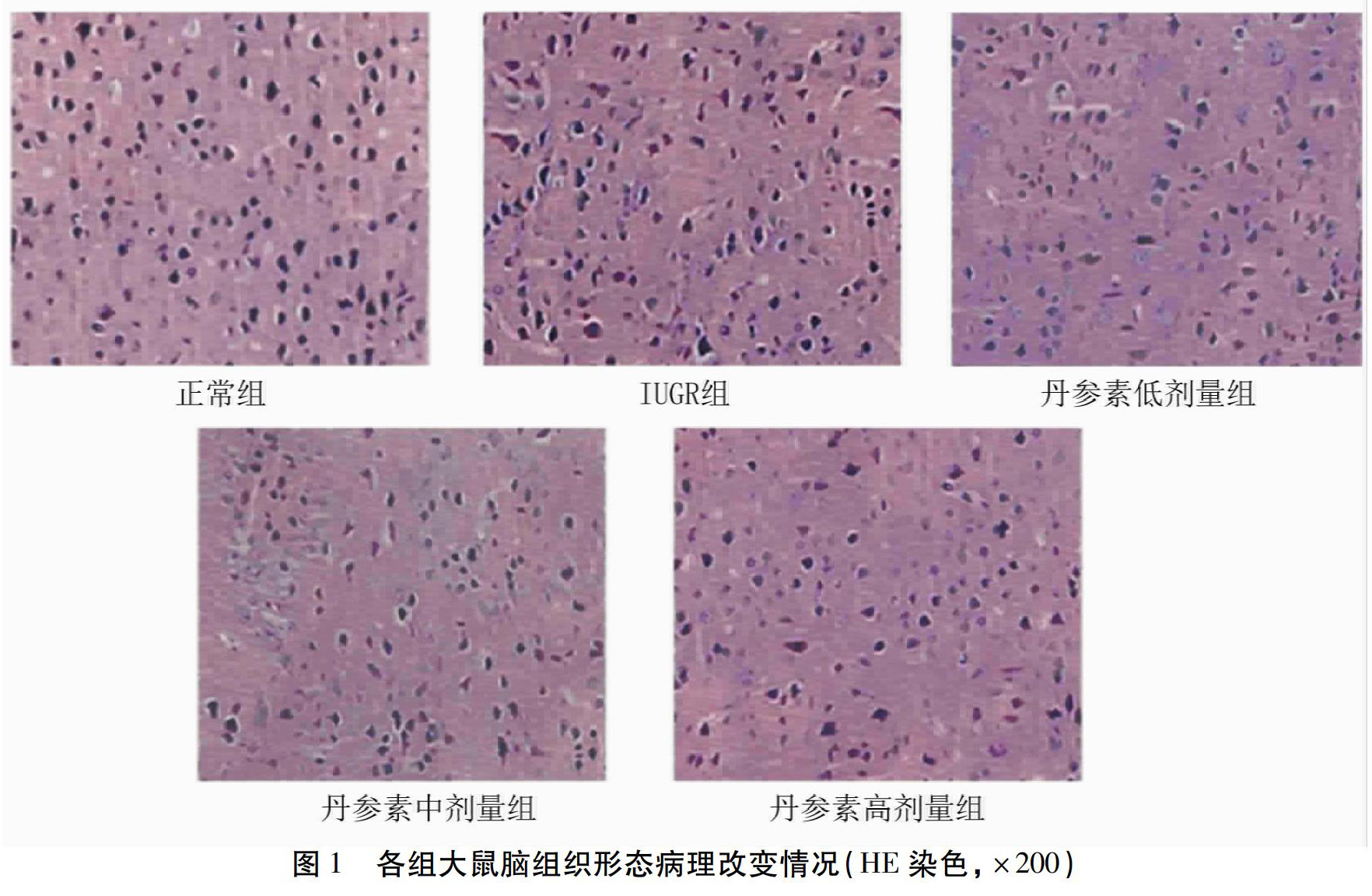
1.2.3.1 HE染色 将4%多聚甲醛固定的脑组织取出,予以脱水、包埋、切片等步骤后行HE染色,用苏木素-伊红进行染色(HE染色),于光学显微镜下,对脑组织结构改变情况进行观察。
1.2.3.2 RT-PCR检测各组胎鼠脑组织RhoA、ROCKⅡ的表达 取右脑组织置于1 mL EP管内,在-80 ℃条件下保存,总RNA运用Trizol法提取,提取完成后取2 μg RNA开始逆转录,引物序列:GAPDH上游5′-GACCACTTTGTCAAGCTCTATTTCC-3′,下游5′-GTGAGGGTCTCTCTTCCTCTTGT-3′,引物長度323 bp;RhoA上游5′-GCAGGTAGAGTTGGCTTTATGG-3′,下游5′-GTGGCATCTACTGCACTCTA-3′,引物长度231 bp;ROCKⅡ上游5′-GCAGGTAGAGTFGGCTTTATGG-3′,下游5′-GTGGCATCTACTGCACTCTA-3′,引物长度275 bp,逆转录后扩增,条件如下:94 ℃预变性2 min,94 ℃变性30 s,48 ℃退火30 s,72 ℃延伸2 min,共40个循环,最后完成72 ℃总延伸5 min,5组各取5 μL PCR产物电泳,凝胶成像仪获取图像,实验次数至少3次,2-△△CT对样本基因进行表达差异相对定量分析。
1.2.3.3 Westernblot法检测各组胎鼠脑组织RhoA、ROCKⅡ蛋白表达 取各组50~100 mg脑组织,加入蛋白裂解液后对总蛋白进行提取,先予以SDS聚丙烯凝胶电泳,后移至聚偏二氟乙烯膜(PVDF膜),一抗、二抗孵育后,运用发光底物做显影处理,处理图像,RhoA、ROCKⅡ蛋白目的条带定量并定性。
1.2.3.4 流式细胞术检测各组胎鼠脑神经细胞凋亡率 取脑组织加入裂解液,制备细胞悬液,离心5 min,将细胞计数调至1×106细胞/mL,并在6块6孔板中接种,每孔1 mL,各组做3个平行,细胞贴壁后予以试验,先吸去细胞培养液,每孔加400 μL试验药液,12 h、24 h、48 h后分别上流式细胞仪测定细胞凋亡率,重复试验3次。
1.3 统计学方法 采用SPSS 17.0统计软件进行数据分析,其中计数资料以(%)表示,采用χ2检验,计量资料以(±s)表示,采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 IUGR胎鼠模型 正常组分娩胎鼠52只,体质量(6.10±0.35)g,IUGR组55只,体质量(4.26±0.33)g,IUGR+丹参素低剂量组56只,体质量(4.95±0.31)g,IUGR+丹参素中剂量组55只,体质量(5.21±0.32)g,高剂量组54只,体质量(5.90±0.35)g,IUGR组胎鼠体质量明显低于正常组,丹参素高剂量组胎鼠体质量高于中剂量组、低剂量组(P<0.05)。
2.2 HE染色 IUGR组、IUGR+丹参素低剂量组、IUGR+中剂量组部分仔鼠均出现不同程度脑皮层变薄、脑组织水肿,无明显炎性细胞浸润。丹参素高剂量组脑组织形态病理改变程度轻于IUGR组、IUGR+丹参素低剂量组、IUGR+中剂量组,除正常组,其余各组均可见明显神经细胞核深染、固缩、细胞体积缩小,符合凋亡细胞的形态学改变。见图1。
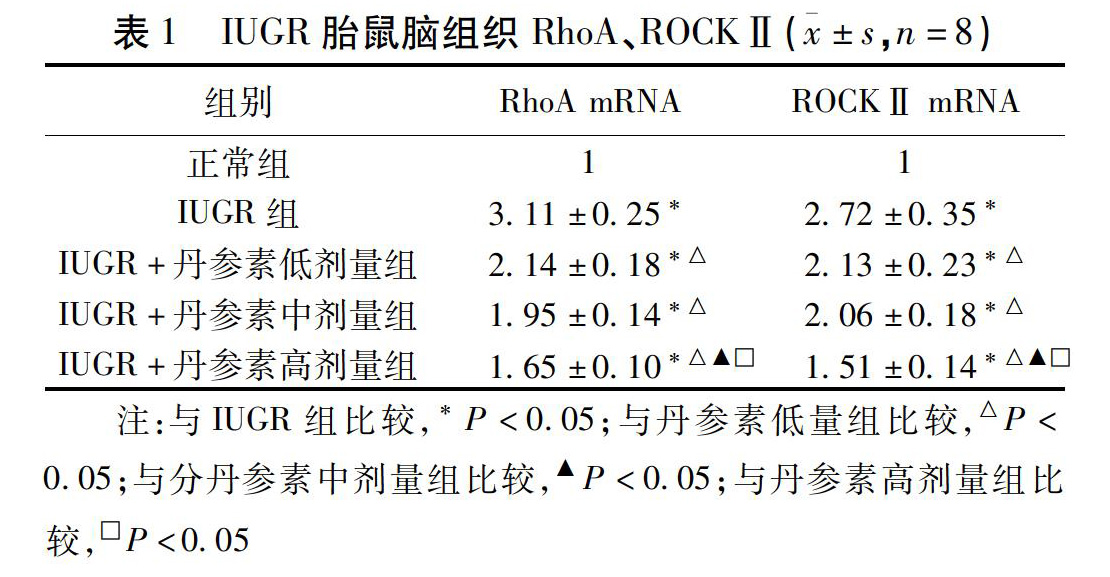
2.3 RT-PCR检测各组胎鼠脑组织RhoA、ROCKⅡ mRNA的表达 IUGR组胎鼠脑组织RhoA、ROCKⅡ mRNA明显高于正常组,丹参素高剂量组胎鼠RhoA、ROCKⅡ mRNA低于中剂量组、低剂量组(P<0.05)。见表1。
2.4 Westernblot法检测各组胎鼠脑组织RhoA、ROCKⅡ蛋白表达 IUGR组胎鼠脑组织RhoA、ROCKⅡ蛋白表达明显高于正常组,IUGR+丹参素高剂量组胎鼠RhoA、ROCKⅡ蛋白表达低于中剂量组、低剂量组(P<0.05)。见图2。
2.5 流式细胞术检测各组胎鼠脑神经细胞凋亡率 ?IUGR组胎鼠脑神经细胞凋亡率明显高于正常组,IUGR+丹参素高剂量组胎鼠脑神经细胞凋亡率低于中剂量组、低剂量组(P<0.05)。见表2。
3 讨论
胎儿宫内生长受限是围产期胎儿死亡的主要原因之一,与母体及宫内环境等多种因素关联密切,同时IUGR可由围生期窒息,低体温,低血糖等疾病引起,且对远期的神经系统发育产生影响[9-10]。中枢神经系统损伤后,机械能刺激、细胞因子及多种致炎物质与细胞膜上的G蛋白偶联受体共同作用,使Rho/ROCK活化,Rho/ROCK激活后,造成血管内皮细胞的收缩,增大细胞间距与血管通透性,组织间隙中渗入大量液体,发生脑水肿,另一方面,会造成血管平滑肌细胞的舒张功能障碍,加剧损伤区周边脑血管的收缩,供血不足,邻近脑组织出现继发性损伤,如:脑水肿、缺血、缺氧等,并发颅内压升高、脑疝等直至死亡[11]。丹参素(Tanshinol,TSN)可从植物丹参中提取,属于一种水溶性成分,可促进微循环血流,抗凝血和抗血小板聚集,在清除氧自由基,保护线粒体,改善脑损伤方面效果明显[12]。
近年来,中医药对于胎儿宫内生长受限治疗关注度较高,且获得了较大进展[13]。基于此,建立IUGR模型孕期予以丹参素干预,发现IUGR组胎鼠体质量明显低于正常组,IUGR+丹参素高剂量组胎鼠体质量高于中剂量组、低剂量组,丹参素低、中剂量组胎鼠体质量差异无统计学意义。提示IUGR胎鼠出生后体质量显著降低,而高剂量丹参素对IUGR胎鼠生长发育有明显改善作用。以往研究证实,低蛋白饮食法建立IUGR后,胎鼠对氧及营养的摄取能力显著减弱,使胎盘中有关糖原的酵解酶活性下降,葡萄糖利用率降低,出现慢性葡萄糖供应不足现象,致使胎鼠宫内生长受限[14]。
IUGR患儿往往出生后即出现神经系统方面的损害,包括:神经运动功能、行为异常等,且影响中枢神经系统的因素较多,其调节机制也较为复杂,对Rho/ROCK信号进行研究后,证实其属于调节中枢神经系统的关键信号通路[15]。通过RT-PCR、Western blot法检测RhoA、ROCKⅡmRNA及蛋白表达,流式细胞术检测脑神经细胞凋亡率发现,IUGR组RhoA、ROCKⅡ mRNA、蛋白表达、脑神经细胞凋亡率均高于正常组,而丹参素高剂量组RhoA、ROCKⅡ mRNA、蛋白表达、脑神经细胞凋亡率低于中、低剂量组,同刘方等[16]研究结果中,抑制Rho/ROCK信号通路可促进胎鼠神经元细胞增殖结果相符。沈杨等[17]研究发现,丹参素改善子痫前期模型胎鼠脑发育障碍效果显著,高剂量丹参素对生长受限胎鼠的总体改善更为有效。中枢神经系统损伤后,多种外界信号刺激下,Rho/ROCK信号通路异常活化,将信号传递给下游效应分子,下游效应分子ROCKⅡ可直接与Rho激酶的底物-球蛋白轻链磷酸化酶产生结合现象,经过一系列级联激酶反应后对肌动-球蛋白系统进行干扰,从而致使生长锥出现塌陷,神经轴突生长受到抑制,脑细胞线粒体结构、功能出现障碍,钙超载、自由基过量生成出现一系列恶性循环,造成缺血、缺氧性脑损伤[18-19]。而应用丹参素后,抑制脑组织损伤后NO的过量产生,抑制其与超氧阴离子的反应,降低羟基和NO2-生成,羟基是引起脑损伤最主要的物质,NO2-属于脂质过氧化的有力激动剂,促进脑组织损伤加重,丹参素打断一系列恶性循环,发挥脑保护作用,Rho/ROCK信号通路活性明显降低[20]。说明丹参素可通过调控Rho/ROCK信号通路对IUGR脑神经发育起改善作用,故而丹参素对于生长受限所致的发育障碍有着极为关键的修复作用。综上所述,孕期應用丹参素治疗,能明显减少胎鼠脑神经细胞凋亡,通过抑制Rho/ROCK信号通路活性,能减轻IUGR胎儿神经系统损伤,从而改善其生长发育。
参考文献
[1]Polat A,Barlow S,Ber R,et al.Volumetric MRI study of the intrauterine growth restriction fetal brain[J].European Radiology,2017,27(5):2110-2118.
[2]Fetal Abdominal Aorta:Doppler and Structural Evaluation of Endothelial Function in Intrauterine Growth Restriction and Controls[J].Ultraschall in der Medizin-European Journal of Ultrasound,2019,40(1):55-63.
[3]Biobaku F,Babata K,Friedman H,et al.Case 3:A Term Newborn with Intrauterine Growth Restriction and Severe Fetal Brain Anomalies[J].NeoReviews,2018,19(10):e616-e619.
[4]姜文文,毕伟康,李泽坤,等.Nogo-OMgp/Rho-Rock信号通路在CO中毒急性脑损伤中的作用及盐酸法舒地尔治疗的可行性分析[J].中华神经医学杂志,2020,19(5):439-448.
[5]王燕.牛磺酸调节cAMP--PKA--CREB信号通路活性促进生长受限胎鼠神经干细胞增殖的体内外实验研究[D].广州:南方医科大学,2017.
[6]钱思远,张博,李微,等.丹参素改善慢性低灌注引起小鼠学习和记忆功能障碍的机制研究[J].现代中药研究与实践,2017,31(159-6):28-31.
[7]朱淑珍.丹参素的药理活性与药物动力学研究进展[J].中西医结合心血管病(连续型电子期刊),2018,6(11):60-61.
[8]庄学玲,李常艳,刘方,等.牛磺酸促进宫内生长受限胎鼠神经干细胞分化的研究[J].中华实用儿科临床杂志,2019,34(4):290-294.
[9]Hochberg A,Krispin E,Amikam U,et al.966:Perinatal outcomes following induction for suspected intrauterine growth restriction:Extra-amniotic balloon versus prostaglandin E2[J].American Journal of Obstetrics and Gynecology,2020,222(1):S598-S599.
[10]Travis O K,Baik C,Tardo G A,et al.Placental Ischemia Stimulated Natural Killer Cells Play a Direct Role in Causing Hypertension and Intrauterine Growth Restriction in Pregnant Rats[J].The FASEB Journal,2020,34(S1):1-1.
[11]Mehra A,Sylvaine Guérit,Macrez R,et al.Nonionotropic Action of Endothelial NMDA Receptors on Blood-Brain Barrier Permeability via Rho/ROCK-Mediated Phosphorylation of Myosin[J].The Journal of Neuroence,2020,40(8):969-919.
[12]曾煦欣,陳应军,毛建文,等.丹参素对腹膜粘连组织成纤维细胞胶原合成与降解的调控[J].实用医学杂志,2018,34(13):2128-2131,2136.
[13]匡梦华,陈焱,马珏,等.丹参滴注液治疗胎儿宫内生长受限的临床治疗分析[J].世界中医药,2016,11(3):427-429.
[14]许继志,陈铁强,张路.PI3k/AKT信号通路在宫内发育迟缓新生大鼠海马组织中的表达及意义[J].中南医学科学杂志,2018,46(2):127-131.
[15]姜文文,毕伟康,李泽坤,等.Nogo-OMgp/Rho-Rock信号通路在CO中毒急性脑损伤中的作用及盐酸法舒地尔治疗的可行性分析[J].中华神经医学杂志,2020,19(5):439-448.
[16]刘方,王燕,刘敬,等.牛磺酸抑制Rho/ROCK信号通路活性促进生长受限胎鼠神经干细胞增殖的研究[J].中华实用儿科临床杂志,2017,32(2):130-134.
[17]沈杨,胡娅莉,张焱,等.丹参素改善子痫前期模型小鼠仔代发育的实验评价[J].南京中医药大学学报,2011,27(5):459-462.
[18]卢祖琳,刘敬,李芳,等.孕鼠补充牛磺酸抑制生长受限胎鼠脑组织Rho—ROCK信号通路活性促进神经轴突发育[J].中华围产医学杂志,2017,20(1):38-44.
[19]Fujita Y,Yamashita T.Axon growth inhibition by RhoA/ROCK in the central nervous system[J].Frontiers in Neuroscience,2014,8(338):338.
[20]Mehra A,Sylvaine Guérit,Macrez R,et al.Nonionotropic Action of Endothelial NMDA Receptors on Blood-Brain Barrier Permeability via Rho/ROCK-Mediated Phosphorylation of Myosin[J].The Journal of Neuroence,2020,40(8):969-919.
(2020-09-22收稿 责任编辑:苍宁)
- 当代图像语言文化的传播特点
- 谈古典舞艺术的技法与身法
- 试论如何掌握二胡作品的演奏风格
- 探讨舞台表现力对舞蹈剧目表演的重要性
- 高职音乐舞蹈教学中学生音乐感的培养
- 西洋管弦乐专业中国化特色培养教学研究
- 舞蹈表演中舞蹈文化的表现路径探讨
- 交响乐序曲《红旗颂》的曲式思维赏析
- 美育视野下湖南省理工科大学生音乐素养提升的对策探讨
- 戏曲曲牌《水龙吟》溯源研究
- 艺术演进被推向文化置换
- 浅谈欧阳予倩的戏剧创作观
- 金银错——细金装饰的工艺启迪
- 上海佛教建筑地域文化呈现
- 《晋书》中少数民族首领的历史书写
- 汶川黄龙祠《玉皇殿楹联》书法保护研究
- 中日两国英文电影片名翻译策略的比较研究
- 基于语料库的近义词对比研究
- “三维转换”视角下安徽旅游词汇汉俄翻译策略研究
- 浅谈《萨宾女人》中的真与假
- 浅析萨克雷《名利场》中的语言表达艺术
- 《俄狄浦斯王》的戏剧创作结构分析
- 我们如何接近“艺术”
- 《狄康卡近乡夜话》中的民间口头文学研究
- 谈钱选花鸟画的意象美
- dire
- direct
- directable
- directaction
- direct action
- direct actionist
- direct actionists
- direct actions
- directadvertising
- directcompetitor
- directcost
- directcosting
- direct current
- direct currents
- direct debit
- directdebit
- directdeposit
- directdialling
- directed
- directee
- directer
- directest
- directexport
- directimport
- directing
- 吃鸽子
- 吃麦粥
- 吃麻油唱曲子——油腔滑调
- 吃黄汤
- 吃黄连
- 吃黑
- 吃黑枣
- 吃黑枣儿
- 吃黑财
- 吃黑道的
- 吃黑钱
- 吃黑饭
- 吃黑饭,护漆柱
- 吃黑饭, 护漆柱。
- 吃黑饭,护黑主
- 吃鼻子
- 吃齐心猪
- 吃,吞食
- 吃𤆵肉
- 吃𫘴亦醉
- 各
- 各不为礼
- 各不相干
- 各不相让
- 各不相谋