陈鑫
摘要:高考为综合考查学生的能力水平,图表信息的读取能力的要求越来越高,特别对数函数在高中化学中的应用越来越多,主要以常用对数浓度曲线类试题的形式考查弱电解质的电离、酸碱中和、盐类水解等。该类试题充分考查应用数学知识解决化学问题的能力。因此教学中理解和掌握对数函数在化学中中的应用非常重要。
关键词:对数函数;高中化学;应用
中图分类号:G4? 文献标识码:A? 文章编号:(2021)-002-295
一、对数的由来
16世纪末至17世纪初的时候,当时在自然科学领域(特别是天文学)的发展上经常遇到大量精密而又庞大的数值计算,于是数学家们为了寻求化简的计算方法而发明了对数。
在数学史上,认为苏格兰数学家——纳皮尔(Napier,1550-1617年)男爵是对数的发明者,他于1614年出版了名著《奇妙的对数定律说明书》。将对数加以改造使之广泛流传的是纳皮尔的朋友布里格斯,他通过研究《奇妙的对数定律说明书》,感到其中的对数用起来很不方便,于是与纳皮尔商定,使1的对数为0,10的对数为1,这样就得到了现在意义的以10为底的常用对数。
二、对数函数在化学应用中的特点
特点:对数函数表示相关化学量、某化学平衡体系的组成或某一反应物某几种物质间的量关系,具有直观、形象的优点。
常见类型:pH与某种离子浓度关系图、物质的量分数与pH的关系图、pH与溶液稀释倍数的关系图、相关粒子浓度的对数及负对数之间的关系等。
溶液酸性、中性或碱性的判断依据是:[H+]和[OH-]的浓度的相对大小。在任意温度时溶液[H+]>[OH-]时呈酸性,[H+]=[OH-]时呈中性,[H+]<[OH-]时呈碱性。但当溶液中[H+]、[OH-]较小时,直接用[H+]、[OH-]的大小关系表示溶液酸碱性强弱就显得很不方便。为了免于用氢离子浓度负幂指数进行计算的繁琐,丹麦生物化学家泽伦森(Soernsen)在1909年建议将此不便使用的數值用对数代替,并定义为“pH”。数学上定义pH为氢离子浓度的常用对数负值,即:pH=-lg[H+]。在标准温度(25℃)和压力下, pH值是一个介于0和14之间的数,当pH<7的时候,溶液呈酸性,当pH>7的时候,溶液呈碱性,当pH=7的时候,溶液呈中性。
结合图像分析电离平衡、水解平衡、溶解平衡,判断粒子浓度关系是近几年全国卷的命题热点,对考生来说是一个难点。图像类型总结如下:
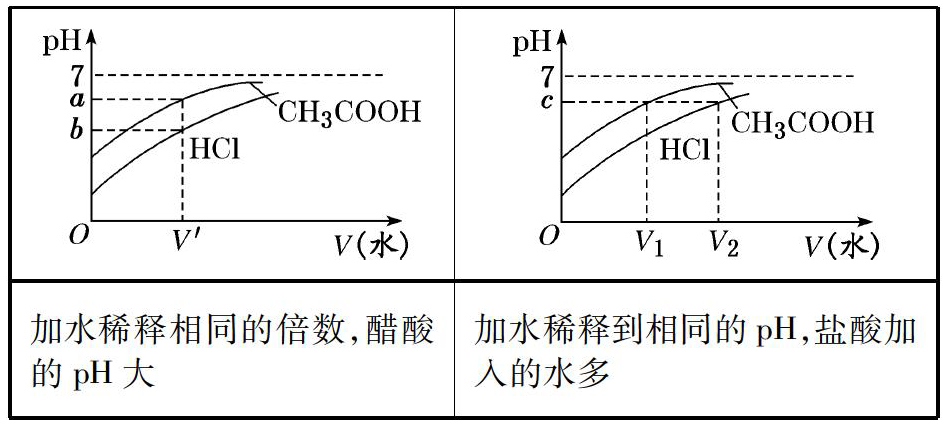
1.相同体积、相同浓度的盐酸、醋酸
加水稀释相同的倍数,醋酸的pH大加水稀释到相同的pH,盐酸加入的水多
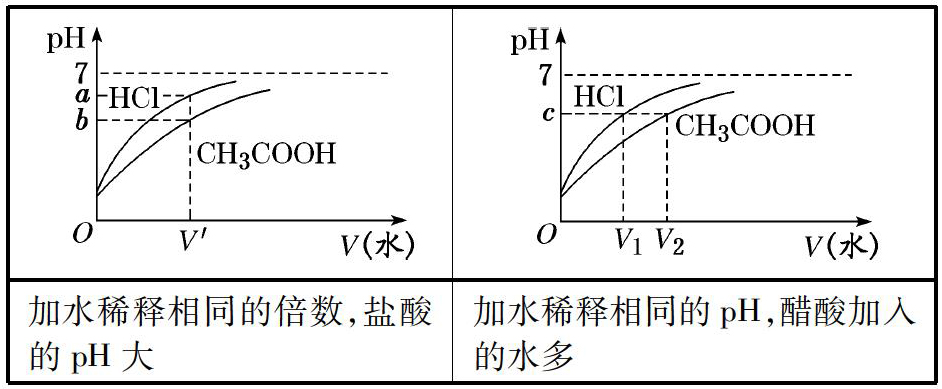
2.相同体积、相同pH的盐酸、醋酸
加水稀释相同的倍数,盐酸的pH大加水稀释相同的pH,醋酸加入的水多
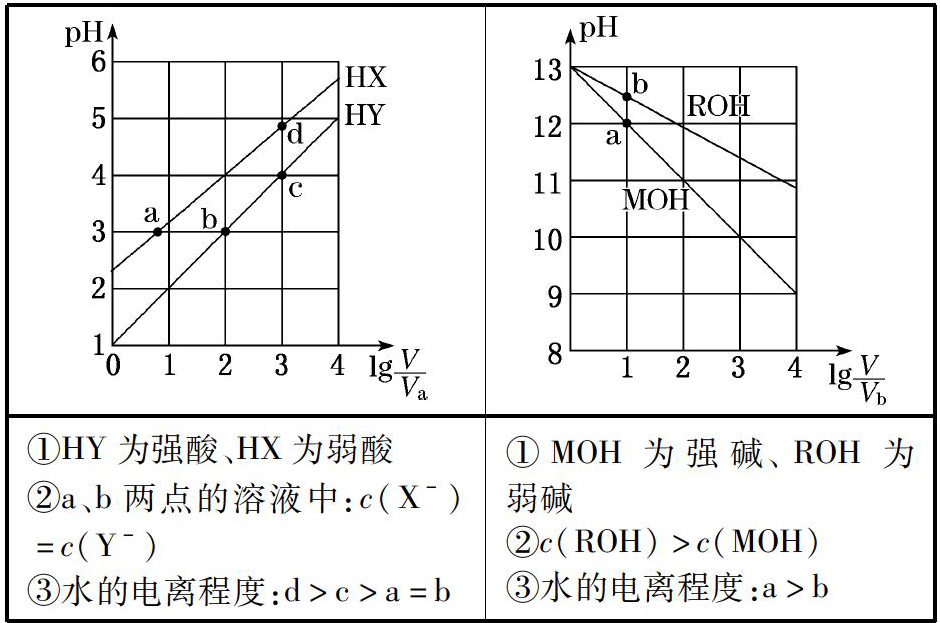
3.pH与稀释倍数的线性关系
①HY为强酸、HX为弱酸
②a、b两点的溶液中:c(X-)=c(Y-)
③水的电离程度:d>c>a=b①MOH为强碱、ROH为弱碱
②c(ROH)>c(MOH)
③水的电离程度:a>b
4.例题
例1.25 ℃时,有pH=2的HX溶液和HY溶液各1 mL,分别加水稀释,溶液pH随溶液体积变化的曲线如图所示。下列说法正确的是(? )
A.b、c两点对应HY的电离平衡常数:K(c)>K(b)
B.a、b两点对应的溶液中:c(X-)>c(Y-)
C.等物质的量浓度的HX和HY的混合溶液中:
c(Y-) D.分别向10 mL 0.1 mol·L-1 HX溶液和10 mL 0.1 mol·L-1 HY溶液中滴加相同浓度的氢氧化钠溶液,恰好完全反应时,消耗氢氧化钠溶液的体积较大的是HX 例2.常温下,浓度均为0.10 mol·L-1、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随lgVV0的变化如图所示,下列叙述正 确的是(? ) A.该温度下HB的电离常数约等于1.11×10-5 B.相同条件下NaA溶液的pH大于NaB溶液的pH C.溶液中水的电离程度:a=c>b D.当lgVV0=3时,若两溶液同时升高温度,则c(B)c(A)比值减小 例3常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述错误的是 基金项目:湖南省教育科学“十三五”规划一般资助课题“积极青少年发展观下的高中幸福课堂实践研究”阶段性成果(课题批准号:XJK18BJC038)
- 抓住改革发展机遇推动报刊业做大做强做优
- 我国科技期刊存在的问题及解决思路
- 全国10城市10月电视收视排行TOP10
- 全国12城市10月广告投放频道TOP5
- 2009年10月报刊广告刊登额排行榜
- 月度大事
- 明天我们如何做记者
- 媒体的社会责任和利益追求
- 传媒业的“免费经济学”
- 把握产经新闻与广告资源平衡的技巧
- 县域:地方法制报开拓的第二市场
- 《奥普拉脱口秀》将停 谈话类节目式微
- 大媒体 大平台 大品牌 大机制
- 危机 契机 转机
- 手机杂志:广告营销价值新高地
- 手机杂志的未来猜想:人人皆媒体
- 手机杂志能否步电子杂志后尘
- 湖北卫视的“一线”梦
- 从华谊公司融资渠道拓展看中国影视业的发展
- 农村电视受众爱看什么
- 解析都市报发展的三大趋势
- 张向东:打造中国最年轻的省会城市党报
- 供应链重构:党报改革转型路径
- 周莉:大浪淘沙,不进则退
- 真实 责任 公开
- getting in
- getting off
- getting on
- getting on for
- getting out
- getting rid of employees
- getting there
- getting up
- get tired
- get-to
- get to
- get-together
- get together
- get-togetherness
- get-togethers
- get together with
- get together (with sb)
- get to grips with sth / come to grips with sth
- get to know
- get to know sb
- get to like
- get too big for your boots
- get to sb
- get to sleep
- get tough with
- 经历的年代久远
- 经历的年数
- 经历的年数很多
- 经历的日子
- 经历的日子久
- 经历的时间不会太久,愿望可以实现
- 经历的时间很短
- 经历的时间很长
- 经历的时间极为久远
- 经历的时间极长
- 经历的时间短
- 经历的时间较久
- 经历的过程
- 经历磨难与波折
- 经历考验或磨炼
- 经历艰难
- 经历过
- 经历重重艰难险阻
- 经历险境
- 经历,经过
- 经历,遇到的事情
- 经历,遭遇
- 经历,阅历
- 经受
- 经受一次挫折