尉言勋 杜松庭
化学反应机理图示题的考查最早出现在2014年全国卷第9题,考查H2O2的分解机理,后来出现在江苏、浙江高考试题的非选择题中,近几年北京卷、新课标卷对基元反應及反应机理的考查逐年增多,比如2019新课标Ⅰ卷第28题,2018全国卷Ⅰ卷第28题、Ⅱ卷第8题均有考查。这类试题符合新课标的理念,“源于教材而高于教材”,体现了化学核心素养中的宏观辨识与微观探析,从不同层次认识物质的多样性,以及由微观和宏观相结合的视角分析和解决实际问题,在备考过程中要给予高度重视与关注。一、机理简单介绍
1. 反应机理是用来描述某反应物到反应产物所经由的全部基元反应,就是把一个复杂反应分解成若干个基元反应,以图示的形式来描述某一化学变化所经由的全部反应,然后按照一定规律组合起来,从而阐述复杂反应的内在联系,以及总反应与基元反应内在联系。
2. 反应机理详细描述了每一步转化的过程,包括过渡态的形成,键的断裂和生成,以及各步的相对速率大小等。典型的是基元反应碰撞理论和基元反应过渡态理论。
3. 反应机理中包含的基元反应是单分子反应或双分子反应。完整的反应机理需要考虑到反应物、催化剂、反应的立体化学、产物以及各物质的用量。
4. 认识化学反应机理,任何化合物的每一步反应都应该是在该条件下此类化合物的通用反应。二、考查类型及典例解析
1. 水煤气变换能垒图的考查。
水煤气变换反应常常借助于催化剂而进行。近年来整体式(构件型)蜂窝状WGSR催化剂与负载型催化剂引起了人们极大兴趣,尤其是负载金超微粒子催化剂。负载型金催化剂的突出特点是具有较高的低温催化活性、较好的抗中毒性和稳定性,同时作为一种贵金属催化剂,金催化剂的价格要远远低于铂和钯。某些性质上的突变使得高分散金催化剂的研究成为催化领域中一个新的热点。
【例1】(2019·新课标Ⅰ,28节选)水煤气变换[CO(g)+H2O(g)═CO2 (g)+H2 (g)]是重要的化工过程,主要用于合成氨、制氢以及合成气加工等工业领域中。回答问题:
(3)我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图1所示,其中吸附在金催化剂表面上的物种用*标注。
可知水煤气变换的△H___0(填“大于”“等于”或“小于”),该历程中最大能垒(活化能)E正=______eV,写出该步骤的化学方程式______________________。
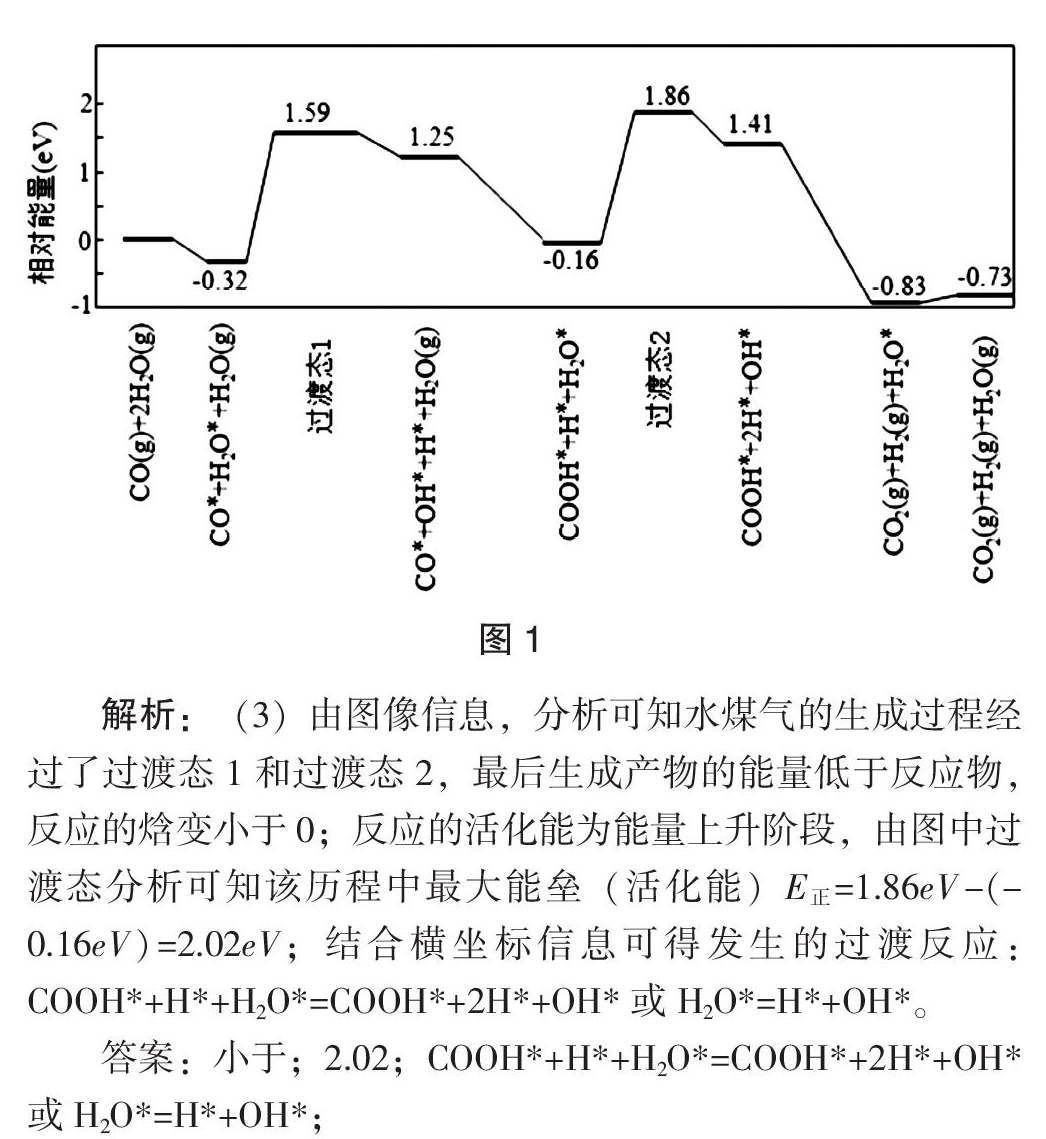
点评:本题涉及焓变大小、E正计算、书写方程式,题目来源于我国科学家发表在顶级刊物Science中的文章“沉积在α-MoC上单层金原子对水煤气的低温催化反应”,试题以文章中的单原子催化能量变化的理论计算模型为情境,增强了试题的陌生度,起点高但落脚点低,让学生认识、分析催化吸附机理及反应过程中的能量变化。注意:该历程中最大能垒(活化能)E正,结合坐标信息计算和书写反应化学方程式。
2. 有效碰撞理论的考查。
在化学反应中,反应物分子不断发生碰撞,大多数碰撞无法发生反应,只有少数分子的碰撞才能发生化学反应,能发生有效碰撞的分子是活化分子。普通反应物分子形成活化分子所需要的能量叫活化能。而活化分子的碰撞也不一定都能发生有效碰撞。发生有效碰撞不仅有能量的因素,还有空间因素,只有同时满足这两者的要求才能发生有效碰撞。
(1)分子运动

解析:A. 第一步反应快,所以第一步的逆反应速率大于第二步的逆反应速率,故A正确;B. 根据第二步和第三步可知中间产物还有NO,故B错误;C. 根据第二步反应生成物中有NO2可知NO2与NO3的碰撞仅部分有效,故C正确;D. 第三步反应快,所以第三步反应的活化能较低,故D错误。
答案:A C
点评:本题类似于2014年新课标Ⅰ卷第9题,同样给予了反应的机理,涉及反应速率快慢判断、中间产物和活化能的分析等知识点,侧重考查学生分析判断能力,注意反应速率由慢反应决定。
3. 催化反应历程。
化学反应中,反应分子原有的某些化学键,必须解离并形成新的化学键,这需要一定的活化能。在某些难以发生化学反应的体系中,加入有助于反应分子化学键重排的第三种物质(催化剂)其作用可降低反应的活化能。催化剂只能加速反应趋于平衡,不能改变反应的平衡常数。
【例3】(2018·北京,7)我国科研人员提出了由CO2和CH4转化为高附加值产品 CH3COOH的催化反应历程。该历程示意图如图4所示。
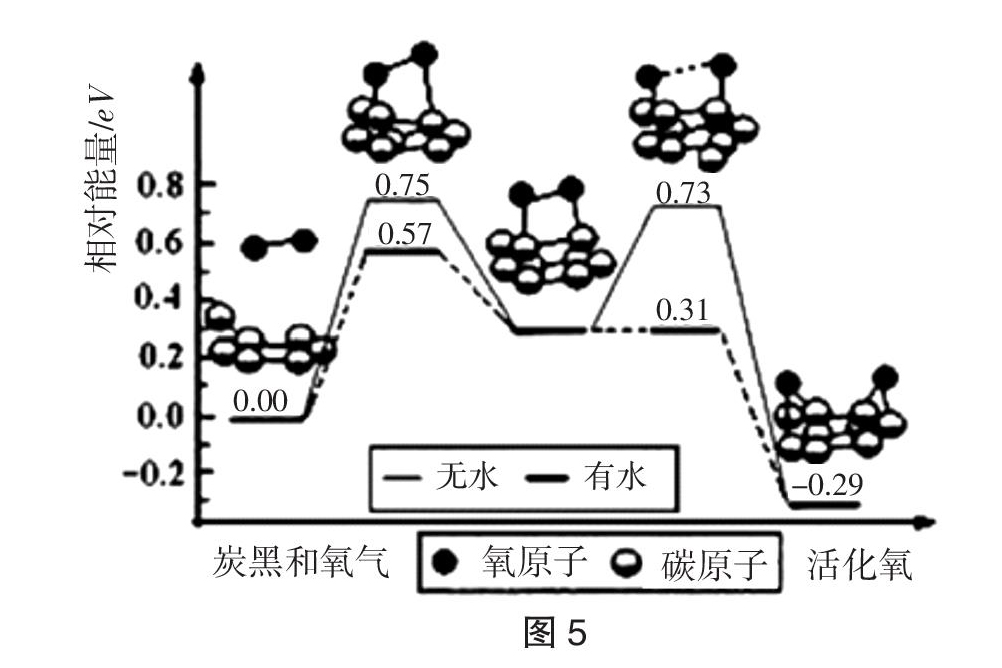
下列说法不正确的是(???? )
A. 生成CH3COOH总反应的原子利用率为100%
B. CH4→CH3COOH过程中,有C-H键发生断裂
C. ①→②放出能量并形成了C-C键
D. 该催化剂可有效提高反应物的平衡转化率
解析:A. 图中分析,1mol甲烷和1mol二氧化碳反应生成1mol乙酸,原子利用率为100%,故A正确;B. 由图中信息甲烷在催化剂作用下经过选择性活化,甲烷分子中碳原子会与催化剂形成新的共价键,必有C-H键发生断裂,故B正确;C. ①→②的焓值降低,为放热过程,有C-C键形成,故C正确;D. 催化剂只加快反应速率,不改变化学平衡转化率,故D错误。
答案:D
点评:本题涉及基元反应的过渡态理论,考查学生提取图表信息的能力,以及转化信息、应用信息的能力。注意题干信息的理解应用,通过分析化学反应过程,反应过程中催化剂的作用和能量变化、化学键的变化,间接实现对化学素养的考查。
4. 雾霾中的反应机理。
所谓灰霾天气,就是指由于空气中含有的氮氧化物、颗粒物的总量过大,导致空气能见度偏低,大气中出现浑浊。霾的本质则是“细粒子污染”,形成的主要原因则是工业废气,汽车尾气中的污染物质经过一系列化学反应,造成二次污染,散播到大气中的尘埃、硫酸颗粒、硝酸颗粒、有机碳氢化合物等粒子悬浮在空中,从而使大气变得混浊,造成能见度偏差。
【例4】(2018·海南,12)(4分)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧。活化过程的能量变化模拟计算结果如图5所示。活化氧可以快速氧化SO2 。下列说法正确的是(????? )
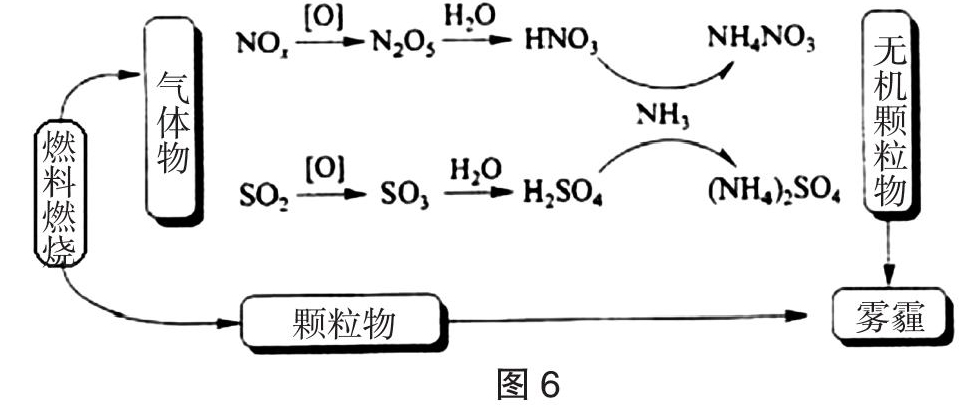
A. 每活化一个氧分子吸收0.29eV能量
B. 水可使氧分子活化反应的活化能降低0.42eV
C. 氧分子的活化是O-O的断裂与C-O键的生成过程
D. 炭黑颗粒是大气中SO2转化为SO3的催化剂
解析:A. 由图中信息,最终结果为活化氧,体系能量降低,则每活化一个氧分子放出0.29eV能量,故A错误;B. 根据能量图分析,没有水加入的反应活化能为E=0.75eV,有水加入的反应的活化能为E=0.57eV,所以活化能降低0.75eV-0.57eV=0.18eV,故B错误;C. 根据图像分析,氧分子活化过程O-O键断裂,生成C-O键,故C正确;D. 由题意活化氧可以快速氧化SO2,而炭黑颗粒可以活化氧分子产生活化氧,故D正确。
答案:C D
点评:本题考查催化反应过程机理的分析,催化剂可以改变反应历程,降低反应活化能,加快化学速率,明确多步反应历程中最大的活化能为整个反应的活化能是解题关键,整体难度中等。
【例5】(2018·新课标Ⅱ,8)研究表明,氮氧化物和二氧化硫在形成雾霾时与大气中的氨有关(如图6所示)。下列叙述错误的是

A. 雾和霾的分散剂相同
B. 雾霾中含有硝酸铵和硫酸铵
C. NH3是形成无机颗粒物的催化剂
D. 雾霾的形成与过度施用氮肥有关
解析:A. 雾的分散质是水,霾的分散质是固体颗粒,但其分散剂均为空气,A正确;B. 如图中信息所示,氮氧化物和二氧化硫转化为铵盐形成无机颗粒物,B正确;C. 氨气是反应物,参与了反应,不符合催化剂的定义,C错误;D. 过度施用氮肥会导致大气中氨气的含量增加,更利于生成无机颗粒物,因此雾霾的形成与过度施用氮肥有关,D正确。
答案:C
点评:题目以雾霾形成机理的最新研究成果为素材,考查雾霾形成过程中无机颗粒物的化学基本概念,涉及分散系、雾霾成份雾霾的催化过程和机理,图中展示了氮元素及其化合物的相互转化。侧重考查学生利用所学化学知识分析环境污染的原因,体现化学在生态环境和污染治理的巨大作用,化学在推进生态文明建设、解决生态环境问题等方面的贡献。
5. Bormi-Haber循环。
玻恩-哈伯循环是一种用于计算反应热的方法,由德国科学家马克斯·玻恩和弗里茨·哈伯发明。有时反应热很难或甚至无法直接测出,但根据盖斯定律,反应热的大小与反应物及生成物的初状态与末状态有关,与反应的途径无关,因此如果能够测出各个反应途径的反应热,那么原反应的反应热也就可以计算出来了。
【例6】(2018·新课标Ⅰ,28节选)Li是最轻的圆体金属,采用Li作为负极材料的电池具有小而轻、能量密度大等优良性能,得到广泛应用。回答下列问题:
(4)Li2O是离子晶体,其晶格能可通过图7(a)的Bormi-Haber循环计算得到。

可知,Li原子的第一電离能为________kJ·mol-1,O=O键键能为_______kJ·mol-1,Li2O晶格能为________kJ·mol-1。
解析:(4)Li原子的第一电离能为气体基态锂原子失去1个电子所需要的能量,所以其第一电离能为kJ/mol=520kJ/mol;O=O键键能为将1mol O2分(g)解离为2mol 氧原子(g)所需能量,其键能等于2×249kJ/mol=498kJ/mol;晶格能是气态离子形成1mol离子晶体释放的能量,所以其晶格能为2908kJ/mol。
答案:520;498;2908
点评:本题是2018 年新课标Ⅰ卷结构考查的创新点,题目给出氧化锂晶体的能量变化图,考查学生运用所学知识,结合电离能、键能以及晶格能等基本概念,阅读、提取和分析应用 Born-Haber 循环给出的能量变化数据,解答实际问题的能力。
6. 加成反应机理的考查。
有机分子中键能小、极性大、位阻小的部分,一般优先发生化学反应,产物以能量最低、最稳定的产物为主。有机分子中官能团能够体现化学反应的基本原理,所以加成反应中碳碳双键是反应的关键所在。
【例7】(原创) 1,3—丁二烯烃与HBr的 1,2 和 1,4 加成是高中有机学习中一个易混淆的概念,學生常把它混淆为2个反应,其实这是一个反应的2种取向,因为它们的反应机理、反应中间体是相同的,只是取向不同而已。其反应机理如图8所示,下列说法不正确的是(???? )
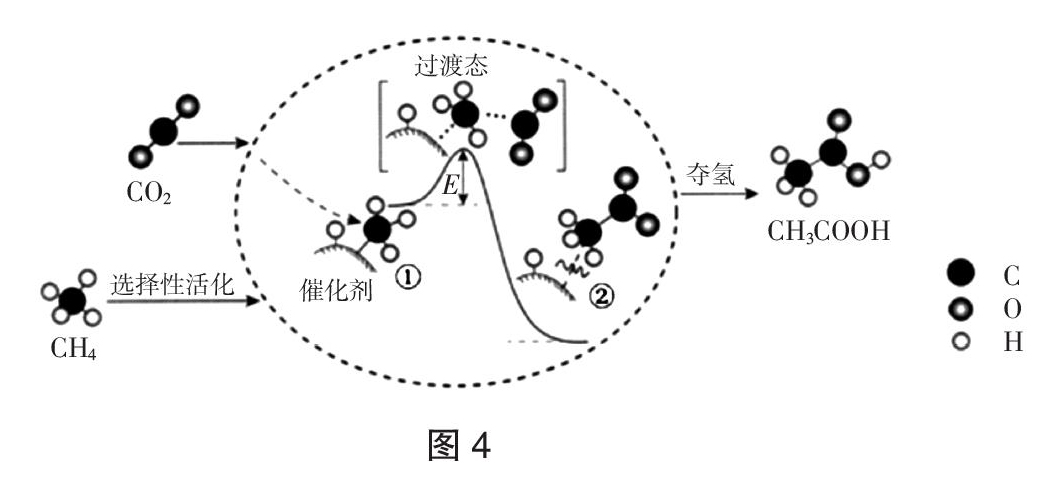
已知:“游离基”,是指化合物的分子在光热等外界条件下,共价键发生均裂而形成的具有不成对电子的原子或基团。
A. 1,3-丁二烯与H+ 作用后生成了一个具有共轭体系的三中心两电子的烯丙基型碳正离子
B. 该反应不可能产生 1,3 加成,因为 2,4双游离基是不稳定产物
C. 无论温度是否发生明显变化,2种产物均同时产生,且没有主次取向
D. 1,3-丁二烯与HI也可以发生1,2 和 1,4 加成
解析:卤素负离子对共轭的烯丙基型碳正离子的2号位进攻则生成1,2加成产物,卤素负离子对共轭的烯丙基型碳正离子的 4 号位进攻则生成 1,4 加成产物,不可能发生1,3加成,A、B项正确;1,2-和1,4-加成产物的比例不仅受共轭二烯结构的影响,也随温度、溶剂和催化剂体系等的改变而改变,C项不正确;HI与HBr结构相似,可以与1,3—丁二烯发生1,2 和 1,4 加成,得到两种反应产物,D项正确。
答案:C
点评:有机化学反应的本质是原物质化学键的断裂和新物质化学键的生成,遵从质量守恒和能量守恒、能量越低越稳定原则。影响共轭二烯烃加成反应的因素主要有键能的大小、极性的强弱以及发生化学反应的空间位阻大小3个方面。本题侧重考查学生结合选项对反应机理图形的分析,引导学生了解两种加成的反应机理、反应中间体是相同的,只是取向不同,侧重考查学生的分析判断能力。
总之,对反应机理的考查看上去很“高大上”,从而使学生形成畏难情绪。如果学生可以克服畏难心理,凭借扎实的基础知识和沉着冷静的心态读题审题,将题中信息与已有知识紧密结合,学生就会发现问题的落脚点往往是考查读取图表信息的能力以及利用题目给予的新信息解决问题的能力。解答时应结合反应历程示意图,从题目提取出隐含的信息,进而解决问题。
责任编辑?? 李平安
- 小学语文课堂教学效率影响因素分析
- 基于核心素养的小学语文高效课堂构建策略研究
- 浅论小学语文作文教学的有效性策略
- 浅谈小组合作在数学课堂教学中的运用
- 浅析情景教学法在小学数学教学中的应用
- 提高小学高年级数学课堂合作学习效果的实施策略
- 让小组合作在小学数学中绽放别样的精彩
- 加强小组合作 优化小学篮球教学
- 小组学习在小学数学课堂教学中的实践研究
- 小学数学教学中有效情境的创设与利用研究
- 小学思政教育的实践分析与创新探索
- 基于读写融合创新小学英语教学
- 英语学科核心素养下的小学英语读写教学方法研究
- 思维导图在小学英语课中的运用
- 情景教学模式在小学低年级语文口语交际教学中的应用探究
- 创设有效情境,优化农村小学语文教学
- 小组合作学习在小学语文教学中的应用研究
- 小学数学教学中学生减少计算错误的对策研究
- 小学双语班学生数学应用题解题过程中遇到的困难分析及对策
- 小学数学几何图形教学的常见问题及教学方法
- 浅谈农村小学数学课堂教学中存在的问题及策略
- 农村小学低段汉字笔顺错误的原因及改进对策
- 活用歌曲与歌谣 润色英语课堂
- 浅谈小学英语阅读教学技巧与方法
- 小学群文阅读的方法研究
- friend's
- friendship
- friendships
- fries
- frieze
- friezed
- friezeless
- friezelike
- friezer
- friezes
- friezing
- friezy
- frigate
- frigates
- friges
- fright
- frighted
- bostonmatrix
- boston matrix
- bot
- botanical
- botanically
- botanicals
- botanies
- botanist
- 李鸦儿
- 李鸿章
- 李麻子
- 杏
- 杏仁
- 杏仁茶
- 杏叶草
- 杏园
- 杏坊
- 杏坛
- 杏坛渔父
- 杏奴
- 杏子
- 杏子红
- 杏帘
- 杏帘在望
- 杏干
- 杏年玉貌
- 杏月
- 杏林
- 杏林得意
- 杏林春暖
- 杏林春满
- 杏林董奉
- 杏树