李健辉 王琤 邹龙涛 黎阳 老启芳 黄冰

摘要:目的 探讨经化疗的肿瘤重症患者发生应激性高血糖的危险因素。方法 选取广西医科大学附属肿瘤医院ICU自2018年1月至2021年1月收治的83例经化疗的肿瘤重症患者,其中44例发生应激性高血糖(SRH组),39例血糖正常组(N组)。采用单因素分析和多因素logiStic分析对经化疗的肿瘤重症患者应激性高血糖的危险因素进行分析。结果 经单因素分析,显示:患者身体质量指数(BMI)<18.5 kg/m2、ICU住院时长、机械通气时长、入ICU时白蛋白(ALB)<28g/L、入ICU时前白蛋白(PA)是经化疗的肿瘤重症患者发生应激性高血糖的相关因素(P<0.15)。多因素logiStic回归分析提示<18.5 kg/m2和入ICU 时ALB<28g/L是经化疗的肿瘤重症患者发生应激性高血糖的独立危险因素。结论 消瘦和低白蛋白血症是经化疗的肿瘤重症患者发生应激性高血糖的独立危险因素。
关键词:肿瘤危重症,应激性高血糖
【中图分类号】R246.5 【文献标识码】A 【文章编号】1673-9026(2021)04-006-02
應激性高血糖(StreSS-related hyPerglycaemia,SRH)指人体处于休克、创伤、感染、心脑血管意外等急性生理应激状态下,以下丘脑-垂体-肾上腺轴兴奋为主的一系列神经内分泌反应和细胞因子作用下出现的血糖的短暂升高[1]。这是机体的一种自我保护机制,但长时间的的高血糖状态严重影响患者预后。本研究旨在探讨经化疗的肿瘤重症患者发生应激性高血糖的危险因素。
1.资料与方法
1.1 研究对象?回顾性收集广西医科大学附属肿瘤医院ICU自2018年1月至2021年1月收治的化疗后的肿瘤患者的临床资料共83例,其中男性45例,女性38例。年龄18~93岁,平均50.53±13.98岁。纳入标准:年龄≥18岁;6个内月接受过化疗的非肝、胰腺恶性肿瘤患者;排除标准:ICU住院时间不足24h;糖尿病患者或入院空腹血糖(FPG)≥7.0mmol/L或糖化血红蛋白(HbA1c)≥6.5%;有肝和胰腺肿瘤转移者;有肝、胰腺手术史者;资料不完整者。本研究通过广西医科大学附属肿瘤医院医学伦理委员会审核。
1.2 分组方法?按患者入住ICU期间是否发生应激性高血糖分为应激性高血糖组(SRH组)和血糖正常组(N组)。应激性高血糖定义为:既往无糖尿病患者住院期间2次及以上FPG≥7.0mmol/L,或随机血糖≥11.1mmol/L[2-3]。
1.2 研究方法?对性别、年龄、APACHE Ⅱ评分、术后转入、ICU住院时长、机械通气时长、贫血、凝血功能异常、ALB、PA、总胆红素水平(TBIL)等发生SRH的危险因素进行单因素分析和logiStic回归分析。
1.3 统计学方法?应用SPSS25.0软件进行数据分析,正态分布的计量资料用均数±标准差(),组间比较采用t检验。不服从正态分布的计量资料用中位数(四分位数)[M(QL,QU)]。分类变量以率(%)表示,比较采用x2检验。采用logiStic回归分析,先行单因素分析,以P<0.15为标准,进行自变量筛选,再行多因素分析。当P<0.05时,认为差异有统计学意义。
2.结果
2.1 一般资料?本研究共纳入83例患者,其中男性45例(54.2%),女性38例(45.8%);年龄18~93岁,平均(54.53±13.98)岁,其中年龄≥60岁有32例(38.60%);实体恶性肿瘤67例(80.7%),血液系统恶性肿瘤16例(19.30%)。(见表1?和表2?)
2.2 两组患者年龄及性别构成比的比较?两组患者的平均年龄及性别构成比差异均无统计学意义(P>0.05),具有可比性。(见表3和表4)
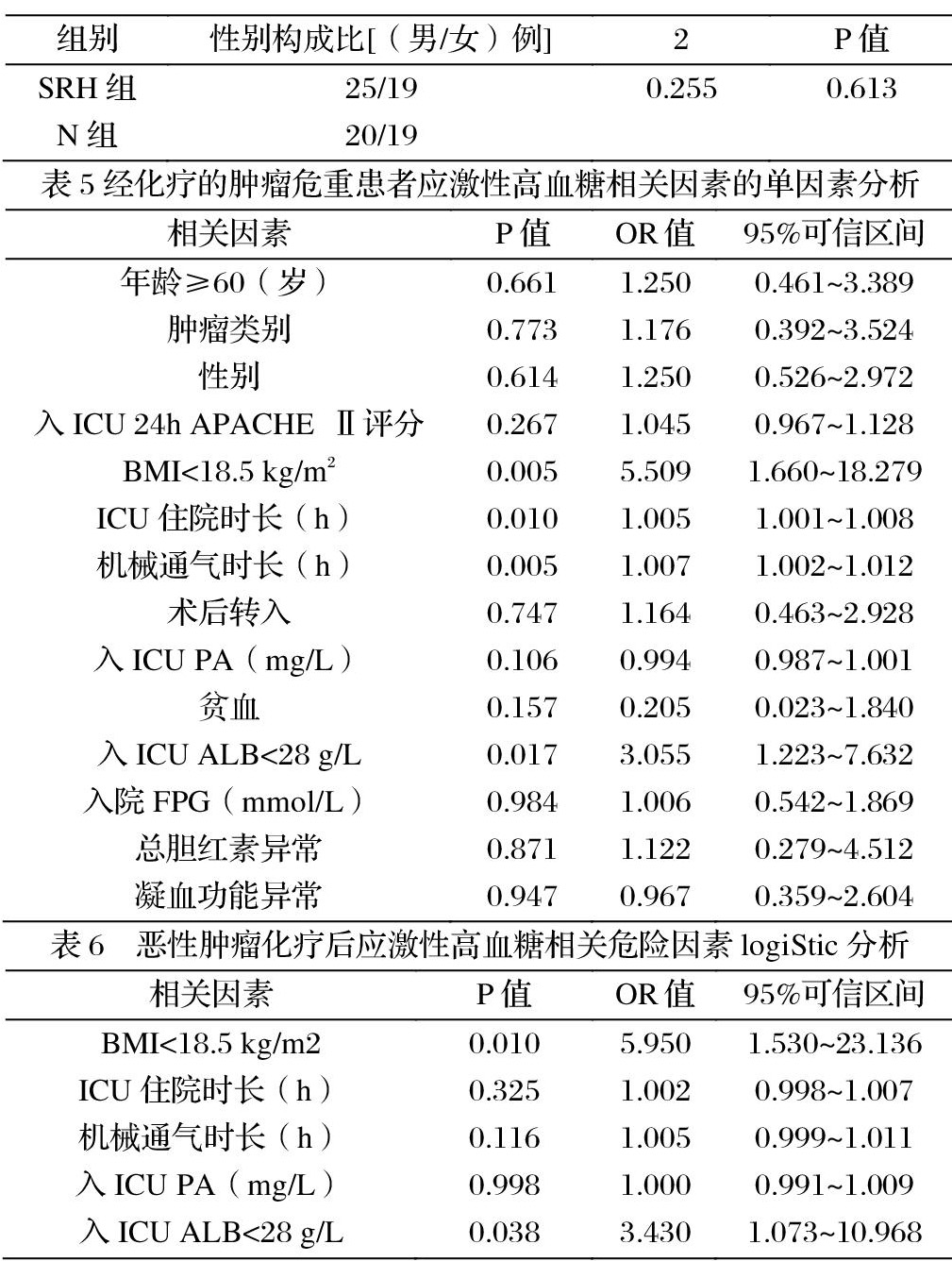
2.3 logiStic回归分析结果?经化疗的肿瘤危重症患者发生SRH的单因素分析:对14个指标进行单因素分析,显示:BMI<18.5 kg/m2、ICU住院时长、机械通气时长、入ICU时ALB、入ICU时PA等5个指标P<0.15,是经化疗的肿瘤危重症患者发生SRH的相关因素,可纳入logiStic回归方程。(见表5) 经化疗的肿瘤危重症患者发生SRH的多因素logiStic分析:将经化疗的肿瘤危重症患者发生SRH的5个相关因素作为协变量放入logiStic回归模型,以P<0.05作为检验水准。结果显示BMI<18.5 kg/m2和入ICU时ALB<28g/L是经化疗的肿瘤危重症患者发生SRH的独立危险因素。(见表6)
3.讨论
SRH在重症患者中的发病率非常高,可能与ICU病房的某些特殊疗法相关:机械通气、血管活性药的输注、肾脏替代治疗、体外循环和体外生命支持、控制性地体温、长期约束患者、人工喂养和都被认为介导了危重病患者SRH的发展[4]。本研究收集的所有病例均是经化疗的恶性肿瘤化患者,肿瘤不断消耗患者机体的营养物质,经过化疗,免疫力低下,在疾病的急性期,SRH机体的一种自我保护机制,可增加患者的生存机会,但由于SRH长时间的存在,就可能增加了死亡风险。
消瘦提示患者有发生影响不良的风险,而营养不良是恶性肿瘤常见的并发症。我国79.4%的肿瘤患者存在不同程度的营养不良[5]。肿瘤患者严重营养不良的会改变葡萄糖代谢,这通常会导致葡萄糖的产生、清除和吸收受损。肿瘤的生长伴随着慢性得炎症反应,而炎症反应会使患者食欲下降、发热,加重营养不良。这种慢性得炎症还会使肿瘤患者肌肉减少,炎症信号得得持续存在打破骨骼肌蛋白质转换的平衡,肌肉持续被消耗。肿瘤的某些治疗手段同样会加重营养不良,化疗就是其中之一,化疗药物的不仅会让患者恶心呕吐、味觉改变和厌食,还能然干扰正常细胞的代谢[6]。外科手术不仅会带来创伤,消化道肿瘤的手术还会引起胃潴留、短肠综合征、营养吸收障碍等并发症。有研究指出,发生严重的营养不良时,葡萄糖吸收受损会导致氧化应激[7]。一项关于235非洲营养不良儿童的研究显示,虽然SRH的发病率只有16.6%,但是死亡率却高达56.4%[8]。Martin等人开发了一个癌症体重减轻分级系统,将体重减轻比率、BMI与生存率联系起来[9],并且发现体重减轻15%,BMI<20 kg/m2的恶性肿瘤患者中位生存期仅有4.3个月。营养不良使患者抵抗力下降,加重感染等应激因子对机体的刺激,增加SRH的发生风险。正确地评估恶性肿瘤患者的营养风险和营养状况是使其能获得最佳治疗的关键。
肝脏是人体最大的解毒器官,是人体对药物代谢的主要器官,大部分化疗药物都经肝脏清除,化疗药通过各种途径造成化疗相关性损伤肝损伤(chemotheraPy-aSSociated liver injury,CALI)。化疗的治疗周期长,通常采用联合多种不同类别的化疗药物的方案,化疗药物的肝毒性就被叠加起来[10]。化疗药物造成肝损伤的机制可能是:1.化疗药物或其代谢产物通过直接的毒性作用干扰肝细胞的代谢,使其结构被破坏;2.化疗药物充当抗原触发体液免疫和细胞免疫使干细胞坏死;3.因化疗药物的联合使用,药物之间的互相作用使肝脏的解毒功能下降,加重药物对肝细胞的毒性。
几乎所有血浆蛋白都是通过肝脏合成,肝细胞受损时,蛋白质的合成功能下降,人体会血浆蛋白含量会随之下降。ALB的分子量约为66kDa,半衰期为21天。完全由肝脏合成,是血浆中含量最高的蛋白质。低蛋白血症可能通过促进肉芽肿形成和减少胶原合成,从而抑制固有免疫反应,从而使患者易患感染和其他术后并发症。有研究指出低白蛋白血症与化疗药物甲氨蝶呤清除延迟有关却引起了高胆红素血症,延长患者的住院时间[11]。不论是恶性肿瘤本身或其引起的并发症及治疗恶性肿瘤的手段都可能引起ALB的减少导致低白蛋白血症。SPoelStra等人的研究发现葡萄糖清除率与血浆白蛋白浓度相关(r=0.67,P=0.001),营养不良时葡萄糖清除障碍与胰岛素敏感性下降有关[12]。低白蛋白血症引起葡萄糖代谢的紊乱,可能增加经化疗的肿瘤重症患者SRH的发生率。
综上所述,消瘦和低白蛋白血症是经化疗肿瘤重症患者发生SRH的独立危险因素。提高SRH的识别率能提高患者的治疗效果,改善预后。本研究样本量有限,属于回顾性研究,期待将来出现多中心大样本的研究。
参考文献
[1]KrinSley JS,PreiSer JC,HirSch IB.Safety and efficacy of PerSonalized glycemic control in critically ill PatientS:A 2-year before and after interventional trial[J].Endocr Pract,2017,23(3):318-330.
[2]张凯,史晓阳,任琛琛,等.非糖尿病患者妇科手术后并发应激性高血糖的危险因素分析[J].河南医学研究,2020,29(29):5391-5394.
[3]赵海燕.ICU危重症患者应激性高血糖影响因素分析[J].创伤与急危重病医学,2019,7(01):26-27.
[4]SrinivaSan V.StreSS hyPerglycemia in Pediatric critical illneSS:the intenSive care unit addS to the StreSS![J].J DiabeteS Sci Technol.2012,6(1):37-47.
[5]Song C,Cao J,Zhang F,et al.Nutritional riSk aSSeSSment by Scored Patient-generated Subjective global aSSeSSment aSSociated with demograPhic characteriSticS in 23,904 common malignant tumorS PatientS[J].Nutr Cancer,2019,71(1):50-60.
[6]吴国豪.重视恶性肿瘤患者的营养不良及防治[J].中国肿瘤临床,2014,41(18):1145-1149.
[7]BandSma RH,SPoelStra MN,Mari A,et al.ImPaired glucoSe abSorPtion ?in children with Severe malnutrition[J].J?Pediatr,2011,158(2):282
[8]Tumwebaze A,Kiboneka E,Mugalu J,et al.Prevalence and outcome of StreSS hyPerglycaemia among Severely malnouriShed children admitted to Mulago referral and teaching hoSPital in KamPala,Uganda[J].BMC Nutr,2018,4:49.
[9]Martin L,SeneSSe P,GioulbaSaniS I,et al.DiagnoStic criteria for the claSSification of cancer-aSSociated weight loSS[J].J Clin Oncol,2015,33:90-9.
[10]夏林玉,徐卫云.乳腺癌化疗相关性肝损伤的研究进展[J].西部医学,2017,29(05):737-740.
[11]ReiSS SN,Buie LW,Adel N,et al.HyPoalbuminemia iS Significantly aSSociated with increaSed clearance time of high doSe methotrexate in PatientS being treated for lymPhoma or leukemia[J].Ann Hematol,2016,95(12):2009-2015.
[12]SPoelStra MN,Mari A,Mendel M,et al.KwaShiorkor and maraSmuS are both aSSociated with imPaired glucoSe clearance related to Pancreatic β-cell dySfunction[J].MetaboliSm,2012,61(9):1224-30.
廣西医科大学附属肿瘤医院重症医学科?530021;广西医科大学附属肿瘤医院营养科?530021
- 高职学生现状、问题及对策分析
- 网络信贷视角下大学生信用风险防控教育机制研究
- 解析高校新生思想政治教育主题班会载体建设
- 高职大学生心理健康问题探讨
- 大学生村官创新创业能力培养管理研究
- 论艺术疗愈对大学生心理健康的积极影响
- 基于“一带一路”的人才需求与商务英语教学改革研究
- 内涵式发展:新时代辅导员队伍建设的必然趋势
- 基于微课的翻译翻转课堂教学模式研究
- 大学体育课程文化危机与文化构建研究
- 基于通识教育视野下的高校体育教学改革研究
- 高职会计专业建设标准探究
- 全民健身背景下高校体育资源的社会化研究
- 社交媒体环境下高校英语教学中学生跨文化交际能力的培养
- 浅谈体验式教学法在秘书实务课程中的应用
- 基于写作大赛的高职院校英语专业写作课程改革探索
- 中国古代体育文化对现代体育发展的启示
- 试论现代装饰绘画教学中的三个关键点
- 浅析高校音乐专业钢琴教学中学生音乐表现力的培养
- 浅谈“外开”教学在芭蕾舞训练中的重要性
- 基于赏析视角的高校民族音乐教育教学研究
- 高职院校贯彻落实党委领导下的校长负责制运行机制的路径选择
- 基于“试错”教育理念下的高校创新创业教育模式构建与实践
- 高校推动创新创业教育的现状评析及对策思路
- 国学教育热背景下高职院校传统文化教育的理性思考
- shimmering
- shimmeringly
- shimmers
- shimmery
- shin
- shin bone
- shine
- shined
- shineless
- shines
- shine/shiny
- shine²
- shine¹
- shingle
- shinglers
- shingles
- shingling
- shinier
- shiniest
- shinily
- shininess
- shininesses
- shining
- shinned
- shinning
- 败残的叶
- 败残花柳
- 败毒
- 败毒菜
- 败法
- 败法乱纪
- 败浥
- 败火
- 败灭
- 败瓦颓垣
- 败相
- 败神
- 败税
- 败笔
- 败笔成丘
- 败类
- 败絮
- 败絮其中
- 败绩
- 败绩失据
- 败群
- 败群之羊
- 败群之马
- 败肉
- 败胃口