古贤君 林栩 凌霄雁 郑心彤 黄海庭 梁钊 覃卿 杜秀日


【摘要】 目的 探討miR-155对足细胞凋亡的影响,并深入研究其机制。
方法 MPC5细胞(经H2O2预处理)分为miR-155抑表达组、miR-155过表达组、对照(空质粒)组、空白组。分别采用荧光实时定量RT-PCR和Western?blot法检测线粒体自噬通路相关因子FOXO1、PINK1、Parkin、LC3?Ⅱ、Beclin1、p62及凋亡相关因子Caspase-3、Bax、Bcl-2?mRNA或蛋白表达;JC-1探针检测线粒体膜电位;ELISA检测细胞内ROS含量;CCK8、流式细胞术检测细胞活性及凋亡。
结果 相较于对照组,miR-155抑表达组的FOXO1、PINK1、Parkin、LC3?Ⅱ、Beclin1和Bcl-2表达明显升高,细胞活性和线粒体膜电位明显增加(P<0.05),p62、Caspase-3和Bax的表达明显降低,ROS含量和细胞凋亡率显著下降(P<0.05);miR-155过表达组的FOXO1、PINK1、Parkin、LC3?Ⅱ、Beclin1、Bcl-2的表达明显下调,细胞活性和线粒体膜电位明显降低(P<0.05),p62、Caspase-3和Bax表达,细胞内ROS含量和细胞凋亡率显著升高(P<0.05)。对照组与空白组的结果比较无统计学意义(P>0.05)。
结论 上调miR-155表达,可促进足细胞凋亡,其机制可能与miR-155靶向FOXO1,抑制线粒体自噬,促进足细胞氧化应激损伤有关。
【关键词】 足细胞;miR-155;线粒体自噬;凋亡
中图分类号:R692.6 文献标志码:A DOI:10.3969/j.issn.1003-1383.2020.05.002
Study?on?the?mechanism?of?miR-155?regulating?mitophagy?on?podocyte?injury
GU?Xianjun1,2,LIN?Xu1,LING?Xiaoyan1,ZHENG?Xintong1,HUANG?Haiting1,2,LIANG?Zhao2,QIN?Qing2,DU?Xiuri2
(1.Nephrology?Department?of?Affiliated?Hospital,2.Graduate?School,Youjiang?Medical?University?for?Nationalities,Baise?533000,Guangxi,China)
【Abstract】 Objective To?investigate?the?effect?of?miR-155?on?podocyte?apoptosis?and?further?study?its?mechanism.
Methods MPC5?cells(pretreated?with?H2O2)?were?divided?into?miR-155?inhibition?group,miR-155?overexpression?group,control(empty?plasmid)?group?and?blank?group.Real-time?quantitative?RT-PCR?and?Western?blot?were?used?to?detect?mRNA?or?protein?expressions?of?mitophagy?pathway-related?factors(FOXO1,PINK1,Parkin,LC3?Ⅱ,Beclin1,p62),apoptosis-related?factors(Caspase-3,Bax,Bcl-2mRNA.)?or?protein?expression.JC-1?probe?was?used?to?detect?mitochondrial?membrane?potential.ELISA?was?used?to?detect?intracellular?ROS?content.CCK8?and?flow?cytometry?were?used?to?detect?cell?viability?and?apoptosis.
Results Compared?with?the?control?group,the?expression?of?FOXO1,PINK1,Parkin,LC3Ⅱ,Beclin1,and?Bcl-2?in?the?miR-155?inhibition?group?increased?significantly,while?cell?activity?and?mitochondrial?membrane?potential?increased?significantly(P<0.05).The?expression?of?p62,Caspase-3?and?Bax?decreased?significantly,and?the?content?of?ROS?and?apoptotic?rate?decreased?significantly(P<0.05).In?addition,the?expression?of?FOXO1,PINK1,Parkin,LC3,Beclin1,and?Bcl-2?in?the?miR-155?overexpression?group?decreased?significantly,cell?activity?and?mitochondrial?membrane?potential?decreased?significantly(P<0.05),and?the?expression?of?p62,Caspase-3?and?Bax?increased?significantly,the?content?of?ROS?and?apoptotic?rate?increased?significantly(P<0.05).There?was?no?significant?difference?in?the?above-mentioned?results?between?the?control?group?and?the?blank?group(P>0.05).
Conclusion Up-regulating?miR-155?expression?can?promote?podocyte?apoptosis,and?the?mechanism?may?be?related?to?mir-155?targeting?FOXO1,inhibiting?mitochondrial?autophagy?and?promoting?oxidative?stress?injury?of?podocytes.
【Key?words】 podocytes,miR-155,mitophagy,apoptosis
足细胞损伤是狼疮性肾炎(LN)患者肾功能障碍的重要机制。过量的氧自由基(ROS)可致足细胞凋亡[1]。线粒体是ROS产生的“能量工厂”,线粒体自噬可提高线粒体质量控制,是细胞抗氧化应激的主要机制之一,亦是抗细胞凋亡的重要途径。既往研究表明,miR-155在LN的发生发展中发挥重要作用,其可直接靶向降解FOXO1?mRNA[2],抑制FOXO1表达;而FOXO1可与PINK1启动子区域结合,激活PINK1/Parkin通路,诱导线粒体自噬。本研究拟探究miR-155对足细胞凋亡的影响,并从线粒体自噬角度深入探讨其机制,旨在从全新的角度阐明LN的发病机制,为LN的临床诊治提供新的思路及靶标。
1 材料与方法
1.1 主要试剂及仪器
H2O2(Sigma,323381);TRIzol?Reagent(Invitrogen,15596026);逆转录试剂盒(Takara,RR047a);SYBR?Green?qPCRMix(Monad,MQ10301);BCA蛋白定量试剂盒(Solarbio,PC0020);ECL化学发光底物(超敏)(Biosharp,BL523A);Annexin?V-FITC/PI试剂盒(Solarbio?CA1020-50T);ROS检测试剂盒(mlbio,ml009876-1);E.Z.N.A.@miRNA?Kit(Omega);CCK8试剂盒(Solarbio,CA1210);JC-1探针(Invitrogen,T3168);RPMI-1640培养基(Solarbio,31800);Opti-MEM?I(上海吉玛生物)。miR-155过/抑表达重组质粒(上海吉玛生物)。抗体:Anti-FOXO1?antibody(ab70382),Anti-PINK1?antibody(ab216144),Anti-Parkin?antibody(ab77924),Anti-p62?antibody(ab109012),Anti-Beclin1?antibody(ab210498),Anti-Bax?antibody(ab182733),Anti-Caspase-3?antibody(ab197202),Anti-Bcl-2?antibody(ab182858),Anti-LC3?Ⅱ?antibody(CST?12741),Anit-β-actin?antibody(ab8227),山羊抗鼠二抗(Sigma,A9309)、山羊抗兔二抗(Sigma,A9169)。實时定量PCR(Agilent?Technologies,G8830-64001);多功能酶标仪(美国MD,FilterMax?F3);电泳仪(Bio-Rad,PowerPac?Basic);凝胶成像系统(上海天能,Tanon?5200);流式细胞仪(BD?FACSMelody)。
1.2 细胞株及分组
小鼠肾小球足细胞MPC5(购自上海复旦大学细胞中心),分为miR-155抑表达组、miR-155过表达组、对照(空质粒)组和空白组。
1.3 实验方法
1.3.1 细胞培养及质粒转染
MPC5细胞用含10%BSA及1%双抗的RPMI-1640培养基,于37℃、5%CO2条件下培养,细胞融合至80%进行传代。将MPC5接种到6孔板中,无血清培养,待细胞密度达到50%~60%。在50?μL无血清培养液中加入0.8?μg?DNA混匀,使用前轻轻混匀RNAi-Mate试剂。用30?μL?Opti-MEM?I稀释4?μg?RNAi-Mate试剂轻轻混匀,室温放置5?min。将稀释好的DNA和RNAi-Mate试剂混合,定容到100?μL;轻柔混匀,室温放置30?min,将100?μL?DNA/RNAi-Mate复合物加到含有细胞和培养基的培养板中,来回轻柔摇晃细胞培养板,使DNA/RNAi-Mate混合物均匀覆盖细胞。转染4~6?h后将培养基更换为含10%BSA的完全培养基继续培养24?h。并使用H2O2(10?μmol/L)进行预处理24?h后,收集miR-155抑表达组、miR-155过表达组、对照(空质粒)组和空白组的细胞样品进行后续检测。
1.3.2 荧光实时定量RT-PCR
从GenBank获得相应mRNA序列,采用Primer?5.0软件设计PCR引物,引物序列见表1。应用TRIzol试剂提取各组细胞总RNA,逆转录试剂盒将RNA逆转录成cDNA;然后按照说明书,采用SYBR?Green?Ⅰ染料法进行定量PCR,PCR反应程序:95℃预变性30?s;94℃?5?s,60℃退火30?s,72℃?30?s扩增40个循环;72℃延伸10?min。采用2-△△Ct法来进行数据分析。
1.3.3 Western?blot
细胞裂解后提取总蛋白,采用BCA法测定蛋白浓度后配平,5×Loading?buffer混匀,沸水浴5?min;每条泳道上样50?μg蛋白,SDS-PAGE电泳,切胶,湿法转膜后,5%脱脂奶粉浸泡,室温放置约1?h。加入1∶3000稀释后的一抗于4℃孵育过夜,1×TBST清洗3次,每次10?min;然后用1∶3000稀释的二抗于37℃孵育1?h,1×TBST清洗3次,每次15?min;显色曝光后进行底片扫描,统计分析蛋白灰度值。
1.3.4 CCK8检测细胞活性
以2×103/孔的浓度将细胞接种于96孔板,每组设置5个副孔。按照EnoGeneCellTM?Counting?Kit-8(CCK-8)细胞活力检测试剂盒说明书操作,每孔加入100?μL?CCK8与DMEM-F12以1∶10配制的工作液,96孔板在培养箱中避光孵育4?h后,酶标仪测定450?nm处吸光度。根据吸光度评价细胞活性。
1.3.5 Annexin?Ⅴ/PI试剂盒检测细胞凋亡
收集细胞,1500?g离心10?min,弃去上清。PBS清洗两次,重悬于0.5?mL?binding?buffer。加入Annexin?Ⅴ-FITC至终浓度为1?μg/mL,37℃避光孵育30?min。1000?g低温离心5?min,弃去染液。加入PI至终浓度为5?μg/mL,4℃避光孵育30?min,使用流式细胞仪激发波长488?nm,发射波长515?nm检测FITC荧光,激发波长488?nm,发射波长560?nm检测PI荧光。
1.3.6 ELISA试剂盒检测细胞内ROS含量
离心收集细胞放入-20℃冰箱冰冻后取出,室温溶解后重复冰冻。反复冻融三次,1000?g离心10?min,收集上清液。ROS试剂盒放置室温下复温,按照说明书要求稀释洗涤液,标准品现用现配。根据待测样本数量及标准品数量安装板条数,每个样品和标准品均做复孔设置。按照浓度范围稀释标准品,每孔加入50?μL,每个样品孔分别加入50?μL待测样本。立即加入50?μL生物素标记的抗体,盖上膜板,轻轻振荡摇晃混匀,37℃恒温孵育1?h。弃液,每孔加满洗涤液振荡洗涤30?s,重復洗涤3次,甩干洗涤液。每孔加入80?μL的亲和链霉素-HRP,振荡混匀,37℃恒温孵育30?min。甩干孔内液体,洗涤液洗涤3次。每孔加入底物A和底物B各50?μL,轻轻振荡混匀,37℃避光温育10?min。取出酶标板,迅速加入50?μL终止液,5?min内酶标仪读取450?nm波长处OD值。根据标准曲线和稀释倍数计算每个样品中ROS的含量。
1.3.7 JC-1探针检测线粒体膜电位
将MPC5细胞种于60?mm细胞培养皿中,融合达到60%~70%后按照实验分组进行处理。JC-1(200×)预先用超纯水按照1∶160的体积比进行稀释混匀。将混合液与JC-1(5×)缓冲液按照4∶1进行混合,为JC-1工作液。JC-1(5×)缓冲液稀释成1×JC-1缓冲液待用。细胞处理完毕后用PBS缓冲液冲洗2次,加入1?mL胰蛋白酶消化2?min,同等体积培养基终止消化,1000?r/min离心5?min,PBS冲洗,1000?r/min离心5?min。细胞重悬于0.5?mL?DMEM,加入0.5?mL?JC-1工作液,充分吹打混匀后置于培养箱中染色20?min。取出培养皿,1000?r/min离心5?min,去除上清。JC-1缓冲液充分洗涤MPC5细胞后,取0.5?mL?JC-1缓冲液重悬细胞,流式细胞仪分析足细胞线粒体膜电位变化。线粒体膜电位较低时,JC-1荧光探针为单体,呈绿色。
1.4 统计学方法
采用GraphPad?Prism?5和SPSS?22.0统计学软件进行数据分析,计量资料数据以(±s)表示,进行单因素方差分析,两两比较采用LSD-t检验。检验水准:α=0.05,双侧检验。
2 结果
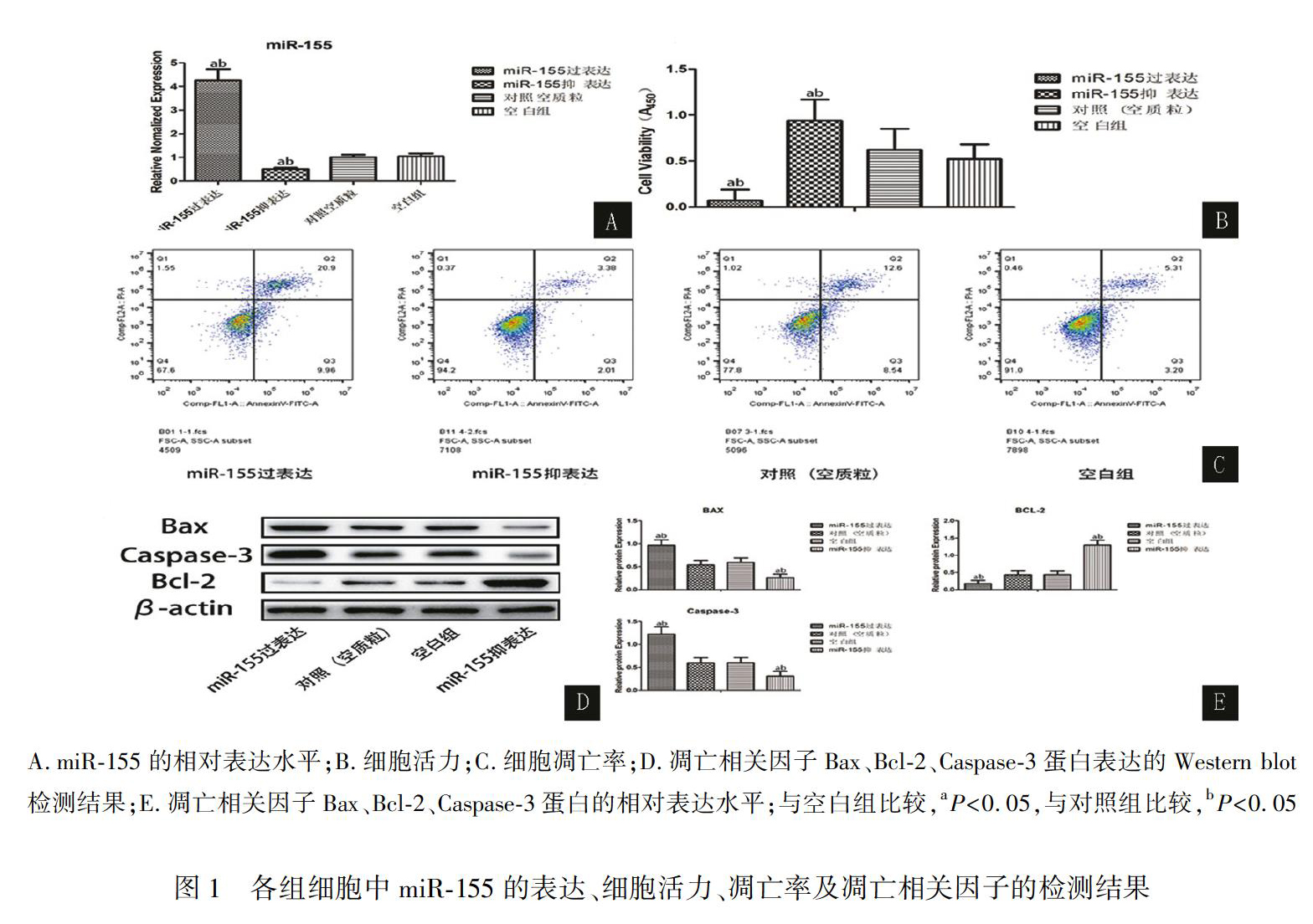
2.1 miR-155对足细胞活力及凋亡的影响
分别采用CCK8法、流式细胞术、荧光实时定量RT-PCR及Western?blot检测足细胞活力、凋亡率、miR-155表达及凋亡相关因子Bax、Bcl-2、caspase-3蛋白表达。实验结果显示:相对于对照组,过表达miR-155组的miR-155表达显著升高,细胞活力显著下降,凋亡率、Bax、caspase-3表达显著升高(P<0.05),Bcl-2表达显著下调(P<0.05);抑表达miR-155组的miR-155表达显著降低,细胞活力显著上调,凋亡率、Bax、caspase-3表达显著降低(P<0.05),Bcl-2表达显著上调(P<0.05);对照组与空白组结果比较无统计学意义(P>0.05)。结果见图1,表2。
2.2 miR-155对足细胞线粒体膜电位及ROS生成的影响
采用ELISA法检测足细胞内ROS水平,JC-1探针检测线粒体膜电位,实验结果显示,相对于对照组,过表达miR-155组细胞内ROS水平显著升高,线粒体膜电位显著降低(P<0.05);抑表达miR-155组的细胞内ROS水平显著降低,线粒体膜电位显著升高(P<0.05);对照组与空白组结果比较无统计学意义(P>0.05)。结果见图2,表3。
2.3 miR-155对足细胞自噬标志蛋白LC3Ⅱ、Beclin1、p62表达的影响
采用荧光实时定量RT-PCR、Western?blot检测足细胞中自噬标志蛋白LC3Ⅱ、Beclin1、p62?mRNA及蛋白表达。实验结果显示,相对于对照组,过表达miR-155组的LC3Ⅱ、Beclin1?mRNA及蛋白表达显著下调(P<0.05),p62?mRNA及蛋白表达显著上升(P<0.05);抑表达miR-155组的细胞LC3Ⅱ、Beclin1?mRNA及蛋白表达显著上调(P<0.05),p62?mRNA及蛋白表达显著降低(P<0.05);对照组与空白组结果比较无统计学意义(P>0.05)。结果见图3,表4。
2.4 miR-155对足细胞线粒体自噬通路的影响
采用荧光实时定量RT-PCR、Western?blot检测线粒体自噬信号通路FOXO1、PINK1、Parkin?mRNA及蛋白表达。结果显示,与对照组比较,过表达miR-155组FOXO1、PINK1、Parkin?mRNA及蛋白表达显著下调(P<0.05);抑表达miR-155组FOXO1、PINK1、Parkin?mRNA及蛋白表达显著升高(P<0.05);对照组与空白组结果比较无统计学意义(P>0.05)。结果见图4,表5。
3 讨论
系统性红斑狼疮(SLE)是一种危害多器官的慢性、炎症性的自身免疫性疾病[3]。LN是SLE的临床常见并发症,其特征是广泛的肾脏病变,与SLE的预后密切相关。据统计,30%~70%的SLE患者会产生肾脏损伤[4]。足细胞损伤是LN患者肾功能障碍的重要机制,而氧化应激是促进足细胞损伤的重要因素。大量文献指出,慢性损伤刺激、炎症和免疫性反应等均可引起足细胞氧化应激,产生过量的ROS,导致足细胞足突消失,最终致足细胞损伤、凋亡,而足细胞作为肾小球滤过屏障的重要细胞成分,长时间的足细胞损伤会影响肾小球选择性滤过作用,进一步加重肾小球硬化、蛋白尿和肾功能衰竭等疾病的进展[5]。因此,深入研究氧化应激致足细胞损伤的分子机制有利于进一步阐明LN的发病机制。
microRNAs是一类小的非编码RNA,在人类细胞和组织中广泛表达,其通过结合靶mRNAs的3UTR的特异性互补序列来调控蛋白合成,从而维持细胞分化、增殖、凋亡、自噬和氧化应激等多种过程的动态平衡[6]。大量研究证实,多种microRNAs参与了LN的发病机制;microRNAs在LN外周血循环中的异常表达,可作为自身免疫性疾病的诊断和预后生物标志物[7]。其中,miR-155与炎症反应、氧化应激和免疫调控关系十分密切,且与多种肾脏疾病发病机制相关,包括SLE和LN。研究发现,miR-155在LN患者外周血单核细胞中的表达显著升高[8],表明miR-155参与了LN的发生发展机制。转化生长因子-β1(TGF-β1)可促进肾小球硬化,而研究发现下调miR-155在足细胞中的表达,可减轻TGF-β1诱导的足细胞损伤,降低足细胞凋亡率,表明miR-155与足细胞损伤、凋亡的分子机制密切相关[9]。在细胞凋亡机制中,Bcl-2和Bax是其中最有代表性的抑凋亡和促凋亡基因;Caspase家族是调控细胞凋亡的关键执行者,激活Caspase-3表达,可诱导细胞凋亡。本研究发现,在H2O2诱导的足细胞氧化应激模型中,上调miR-155的表达,可显著降低足细胞活力,升高Bax、caspase-3的表达,降低Bcl-2的表达,促进足细胞凋亡,而下调miR-155表达的结果则相反,与既往研究结果一致[9],表明miR-155通过介导足细胞损伤进而参与了LN的发生发展机制。
线粒体是细胞内ROS产生、先天免疫和细胞凋亡等关键功能的中心;若线粒体质量异常则会导致代谢综合征、神经退行性和自身免疫性等多种疾病[10]。线粒体自噬即细胞为维持线粒体稳态和自身功能而特异性清除自身异常线粒体的一种免疫防御反应,也是保障细胞内氧化还原稳态的重要途径。研究表明,足细胞自噬活性降低是肾损伤的关键因素之一,其自噬相关标志物(Beclin-1、LC3Ⅱ、p62等)与LN病理类型具有显著相关性[11],促进细胞线粒体自噬可减少足细胞损伤[12]。而抑制人肾上皮细胞线粒体自噬,可破坏线粒体完整性并降低细胞活力,进而诱导凋亡[13]。本研究发现,过表达miR-155可促进细胞内ROS生成,并降低线粒体膜电位和LC3Ⅱ、Beclin1的表达,促进p62的表达,抑制线粒体自噬,表明miR-155参与氧化应激致足细胞凋亡的机制与其对线粒体自噬的调控有关。
线粒体自噬涉及多种途径,其中PINK1/Parkin信号通路在线粒体自噬过程中发挥关键作用。研究指出,PINK1/Parkin通过诱导线粒体自噬,可进一步清除受损线粒體并改善线粒体动力学和功能,减少ROS的过量蓄积,保护细胞免于更严重的氧化应激损伤[14]。FOXO1(Forkhead?box?O1)是叉头状转录因子超家族的成员,可调控细胞的增殖与分化、自噬、氧化应激和线粒体功能等,为多种细胞抗氧化应激的关键介质。FOXO1蛋白可直接与PINK1的启动子区域结合,调节其转录;过表达FOXO1可激活PINK1/Parkin通路诱导线粒体自噬,进而降低ROS水平,减轻线粒体结构损伤并改善细胞功能[15]。并且,FOXO1是SLE相关肾损伤疾病的保护因子,其表达与狼疮性疾病活动呈负相关;增加FOXO1的表达,可改善LN引起肾脏结构和功能损伤[16]。既往研究发现,miR-155可通过结合FOXO1?3UTR的特异性互补序列来调控其蛋白合成,提示miR-155可能通过调控FOXO1的表达,进而参与线粒体自噬的机制。本研究发现,上调足细胞中miR-155的表达,可抑制FOXO1、PINK1和Parkin的表达,抑制线粒体自噬,而下调miR-155的结果则与之相反,表明miR-155通过靶向FOXO1,调控PINK1/Parkin诱导的线粒体自噬,进而参与了氧化应激致足细胞凋亡过程。
由此推測,LN发生后,可上调患者体内miR-155的表达,而miR-155可通过靶向FOXO1,抑制PINK1/Parkin介导的线粒体自噬,降低线粒体膜电位和细胞活性,增加ROS生成并促进促凋亡因子的表达,导致足细胞损伤和凋亡,进一步加重LN患者肾脏损伤及功能障碍。
综上所述,上调miR-155表达,可促进足细胞凋亡,其机制可能与miR-155靶向FOXO1,抑制线粒体自噬,促进足细胞氧化应激损伤有关,表明miR-155调控线粒体自噬致足细胞凋亡是LN发生发展过程中的重要机制,提示miR-155可能是LN诊断及治疗的潜在靶标,对LN的防治具有重要的意义。
参 考 文 献
[1]? D'AGATI?V?D.The?spectrum?of?focal?segmental?glomerulosclerosis:?new?insights[J].Curr?Opin?Nephrol?Hypertens,2008,17(3):271-281.
[2]? HOU?L?K,CHEN?J,ZHENG?Y?H,et?al.Critical?role?of?miR-155/FoxO1/ROS?Axis?in?the?regulation?of?non-small?cell?lung?carcinomas[J].Tumour?Biol,2016,37(4):5185-5192.
[3]? DORRAJI?S?E,HOVD?A?K,KANAPATHIPPILLAI?P,et?al.Mesenchymal?stem?cells?and?T?cells?in?the?formation?of?Tertiary?Lymphoid?Structures?in?Lupus?Nephritis[J].Sci?Rep,2018,8(1):7861.
[4]? ALMAANI?S,MEARA?A,ROVIN?B?H.Update?on?lupus?nephritis[J].Clin?J?Am?Soc?Nephrol,2017,12(5):825-835.
[5]? NAGATA?M.Podocyte?injury?and?its?consequences[J].Kidney?Int,2016,89(6):1221-1230.
[6]? MOLES?R.MicroRNAs-based?therapy:a?novel?and?promising?strategy?for?cancer?treatment[J].Microrna,2017,6(2):102-109.
[7]? NAKHJAVANI?M,ETEMADI?J,POURLAK?T,et?al.Plasma?levels?of?miR-21,miR-150,miR-423?in?patients?with?lupus?nephritis[J].Iran?J?Kidney?Dis,2019,13(3):198-206.
[8]? KHOSHMIRSAFA?M,KIANMEHR?N,FALAK?R,et?al.Elevated?expression?of?miR-21?and?miR-155?in?peripheral?blood?mononuclear?cells?as?potential?biomarkers?for?lupus?nephritis[J].Int?J?Rheum?Dis,2019,22(3):458-467.
[9]? LIN?X,ZHEN?X,HUANG?H?T,et?al.Role?of?MiR-155?signal?pathway?in?regulating?podocyte?injury?induced?by?TGF-β1[J].Cell?Physiol?Biochem,2017,42(4):1469-1480.
[10] LIU?L,LIAO?X?D,WU?H,et?al.Mitophagy?and?its?contribution?to?metabolic?and?aging-associated?disorders[J].Antioxid?Redox?Signal,2020,32(12):906-927.
[11] JIN?J,TU?Q?D,GONG?J?G,et?al.Autophagy?activity?and?expression?pattern?of?autophagy-related?markers?in?the?podocytes?of?patients?with?lupus?nephritis:association?with?pathological?classification[J].Ren?Fail,2019,41(1):294-302.
[12] WU?L?L,FENG?Z,CUI?S?Y,et?al.Rapamycin?upregulates?autophagy?by?inhibiting?the?mTOR-ULK1?pathway,resulting?in?reduced?podocyte?injury[J].PLoS?One,2013,8(5):e63799.
[13] ZHAO?Y?L,SUN?M?J.Metformin?rescues?Parkin?protein?expression?and?mitophagy?in?high?glucose-challenged?human?renal?epithelial?cells?by?inhibiting?NF-κB?via?PP2A?activation[J].Life?Sci,2020,246:117382.
[14] MA?M,LIN?X?H,LIU?H?H,et?al.Suppression?of?DRP1-mediated?mitophagy?increases?the?apoptosis?of?hepatocellular?carcinoma?cells?in?the?setting?of?chemotherapy[J].Oncol?Rep,2020,43(3):1010-1018.
[15] LI?W,DU?M?M,WANG?Q?Z,et?al.FoxO1?promotes?mitophagy?in?the?podocytes?of?diabetic?male?mice?via?the?PINK1/parkin?pathway[J].Endocrinology,2017,158(7):2155-2167.
[16] WANG?X,WANG?G,ZHANG?X,et?al.Inhibition?of?microRNA-182-5p?contributes?to?attenuation?of?lupus?nephritis?via?Foxo1?signaling[J].Exp?Cell?Res,2018,373(1-2):91-98.
(收稿日期:2020-03-24 修回日期:2020-04-14)
(編辑:潘明志)
基金项目:国家自然科学基金(81860131);广西自然科学基金(2017GXNSFAA198288);百色市科学研究与技术开发计划项目(百科20160608)
作者简介:古贤君,女,在读硕士研究生,研究方向:足细胞损伤机制研究。E-mail:50317917@qq.com
通信作者:林栩。E-mail:linyyfyy@163.com
[本文引用格式]古贤君,林栩,凌霄雁,等.miR-155调控线粒体自噬对足细胞损伤的机制研究[J].右江医学,2020,48(5):326-333.
- 复杂地质条件下的岩土工程勘察方法
- 道路桥梁施工中混凝土裂缝成因分析及应对措施探讨
- 煤化工废水处理中的问题及解决方法探析
- 关于深化农业技术推广体制改革的思考与对策
- 基于煤化工废水零排放
- 煤化工发展中的环保工作
- 浅析茄子栽培技术与病害防治
- 浅析环保工程中污水处理工艺及方法
- 探析设施农业气象服务对农作物种植的影响
- 化工安全生产与环境保护管理措施研究
- 乡村振兴背景下的土地整治问题
- 现代煤化工面临的环保问题及解决路径
- “我思”的演变
- 论康德与魏宁格“天才理论”的共通性
- 论网络交际用语中的字母缩略语
- 从“三美论”视角解读《杳杳寒山道》英译本
- 文学传统与伦理政治
- 论巴金“激流三部曲”里的家长形象
- 明清色情小说与表达自由
- 从“神话思维”到“理性思维”的初次尝试
- 弗洛罗夫斯基在俄罗斯思想史中的学术地位评价
- 以礼密臣为代表的“文明观”视域下的甲午战争
- 北宋皇帝、后妃及子女死亡因素考
- 抗战时期(1937-1938)军事工业内迁长沙研究
- 《独立评论》中知识分子经济主张研究
- ruins
- ruin²
- ruin¹
- rule
- rule book
- rulebook
- ruled
- rule out
- ruler
- rule/regulation
- ruleress
- rulers
- rulerships
- rules
- rules and regulations
- rule sb/sth out
- rule sth/sb ↔ out
- rule/throw sth out of court
- rule with a rod of iron
- rule²
- rule¹
- ruling
- rulingly
- rulings
- ruling²
- 嘱咐,告诫
- 嘱寄
- 嘱托
- 嘱托不行
- 嘱托告诫
- 嘱托寄命
- 嘱置
- 嘲
- 嘲人不识字
- 嘲人健忘
- 嘲人受骗上当
- 嘲人文字粗劣
- 嘲人文理不通
- 嘲剧
- 嘲咍
- 嘲咻
- 嘲哂
- 嘲哮
- 嘲哳
- 嘲唅
- 嘲啁
- 嘲喧
- 嘲嗤
- 嘲嘲
- 嘲噱