许敏霞


【摘 要】本文结合近几年广东高考化学试题及广州市模拟试题中的化学工艺流程题,分析试题特点并从中思考广东新高考对考生能力的要求,从而进一步提出有效突破这类题型的备考方法。
【关键词】高考化学;工艺流程;试题特点分析;高三备考复习
一、规范化学用语的表达,提高化学学科书面表达能力
在近年高考及广州市模拟考试的化学工艺流程题中很多设问都涉及文字的表达、化学方程式及离子方程式的书写,这些化学用语的表达实际上涉及有关反应原理的理解,涉及所要描述的化学事物性质和变化的认识。(如表1)规范学生化学用语的表达,提高化学书面表达能力能有效提高学生对基础知识、基本技能的掌握及综合运用能力的提高。因此,规范化学用语的表达提高书面表达能力至关重要,它是决定考生有效答题的关键。
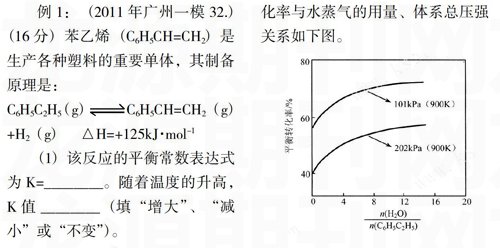
例1:(2011年广州一模32.)(16分)苯乙烯(C6H5CH=CH2)是生产各种塑料的重要单体,其制备原理是:
C6H5C2H5(g) ?C6H5CH=CH2(g)+H2(g) △H=+125kJ·mol-1
(1)该反应的平衡常数表达式为K=________。随着温度的升高,K值________(填“增大”、“减小”或“不变”)。
(2)实际生产中常以高温水蒸气作为反应体系的稀释剂(稀释剂不参加反应)。C6H5C2H5的平衡转化率与水蒸气的用量、体系总压强关系如下图。
①由上图可得出:
结论一:其他条件不变,水蒸气的用量越大,平衡转化率越____
_____________;
结论二:___________________
_____________;
②加人稀释剂能影响C6H5C2H5平衡转化率的原因是:
_________________________。
(3)某些工艺中,在反应的中途加人O2和特定的催化剂,有利于提高C6H5C2H5的平衡转化率。试解释其原因:
_________________________。
答案:(1)
■ (2分)
增大(3分)
(2)①高(1分)其他条件不变,体系总压强越大,平衡转化率越小。(3分)
②总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,相当于反应体系减压,故平衡向气体物质的量增大的方向移动,C6H5C2H5的平衡转化率增大。(4分)(或答:总压不变时,加入稀释剂,参与反应的各物质浓度同等程度减小,浓度商的计算结果小于平衡常数K,故平衡向正反应方向移动,C6H5C2H5的平衡转化率增大。)
(3)O2将反应生成的H2消耗掉,减小了H2的浓度,同时该反应放热使体系升温,两种因素均使平衡向正反应方向移动。(3分)
启示:从以上两位同学的答题可看出,语言表达缺乏严密的逻辑性,在第(2)②、(3)小问中均不能用正确的化学术语表达分析问题的成果。在答题时没有将前提条件,前因后果表述清楚,化学原理分析没有做到书写规范,用词准确。反映出学生对概念原理的理解程度和灵活运用能力不足,对基础知识、基本技能掌握程度和综合运用能力不够。因此,教师在备考复习中应做到以下几点:(1)规范教学,提高学生的书面表达能力;(2)规范审题、思维;(3)规范书写、表达;(4)规范格式、步骤。
二、通过读图、表、数据分析提高对信息的提取和加工能力
新课程考试大纲将化学学习能力的要求分为“接受、吸收、整合化学信息的能力”,“化学实验与探究能力”,“分析问题和解决(解答)化学问题的能力”三个方面。并通过具体题目查考生这三方面的能力。获取和加工应用信息能力的具体要求为:能准确理解、提取文字、符号、图像(图表)、公式、模型等相关的信息;能鉴别和筛选试题所提供的相关信息,正确建立新信息与已有知识的联系,用于解答问题;能从现实生活、生产实际或科学实验中获取有效信息,并进行初步加工、储存或应用。
例2:(2012年广州一模32.)(16分)绿矾(FeSO4·7H2O)的一种综合利用工艺如下:
(1)绿矾与NH4HCO3在溶液中按物质的量之比1:2反应,有CO2生成,反应的离子方程式为__________________。
(2)隔绝空气进行“焙烧”,铁元素的转化途径是FeCO3
FeO ? ? ? ?Fe,实际作还原剂的是CO。写出“焙烧”过程中各步反应的化学方程式____________。
(3)“除杂”步骤为:向母液中通入含臭氧的空气、调节pH、过滤,除去的杂质离子是________
____________。
(4)母液“除杂”后,欲得到(NH4)2SO4粗产品,操作步骤依次为真空蒸发浓缩、冷却结晶、______________。浓缩时若温度过高,产品中将混有NH4HSO4,运用化学平衡移动原理解释其原因__________________。
(5)绿矾的另一种综合利用方法是:绿矾脱水后在有氧条件下焙烧,FeSO4转化为Fe2O3和硫的氧化物。分析下表实验数据(如表2),为了提高SO3的含量,可采取的措施是:__________________
【答案】
(1)Fe2++2HCO3-=FeCO3↓+CO2↑+H2O(3分)
(2)FeCO3 ?FeO+CO2↑(1分)
CO2+C ?2CO(1分)
FeO+CO ?Fe+CO2(1分)
(3)Fe2+(3分)
(4)过滤(2分) ?NH4++H2O
NH3·H2O+H+,温度过高NH3挥发使平衡向右移动,溶液酸性增强生成NH4HSO4。(3分)
(5)增大空气通入量(2分)
启示:该试题背景看似熟悉,但各小题信息量和思维强度都比较大,充分考查学生吸收、整合信息的能力。其中第(1)小题要求学生结合提示信息和质量守恒定律书写离子方程式,只要基本功过关作答比较容易;第(2)小题要求学生将流程图中的信息与小题题干中的各项信息进行整合,并在质量守恒定律、氧化还原反应原理的指导下综合分析,落点是化学方程式,切入很容易,但要答到全对学科思维水平要求较高;第(3)小题要求学生分析流程中的“物质线”,确定主体离子和杂质离子,再结合所学知识分析该除杂步骤的目的;第(5)小题,学生要从大量的实验数据中准确提取实验目的,并运用控制变量的方法归纳数据中反映的规律,再运用于实际问题的解决,对信息的加工和重组能力要求相当高。因此,在备考复习中要尽量注重化学学科思维方法的梳理和优化,时刻穿插着学生读图、解图的训练,总结读图、解图的规律,那将大大提高学生分析图表、提取信息、分析问题的能力。
三、计算能力
随着理综改革的不断深入,化学计算是完成学科内综合的有力工具,能将学科内各个知识点综合考查,以考查学生的综合能力,可见化学计算十分重要。在近几年的高考年报中也反复强调需要加强化学计算。
在2012年的高考化学工艺流程题中第(5)小问考查了有关平衡常数的计算;2013年高考化学工艺流程题则在第(4)小问考查了无机物的有关计算。而学生对于化学计算却出现越来越回避的态度,不论难易宁可不要,有同学甚至谈计算色变。可见提高学生的计算能力非常重要。教师在备考复习中应做到:(1)弱化化学计算的难度及技巧;(2)强化化学计算的基础,加强学科内综合;(3)加强学生数据计算能力;(4)规范要求计算步骤、单位格式及有效数值的表示。
- 通络法治疗化疗相关性手足综合征的临床观察
- 桃核承气汤合甘麦大枣汤加减治疗老年性谵妄临床研究
- 中医延续性护理对提高特发性肺纤维化患者生活质量调查研究
- 熏动洗一体化治疗腕关节僵硬的护理效果观察
- 不同频次冰刺激对急性缺血性脑卒中患者吞咽障碍的效果观察
- 针灸联合推拿治疗对血瘀型腰椎间盘突出症患者疼痛和下肢功能的影响
- 通元针法结合高压氧治疗脑梗塞昏迷患者24例临床观察
- 针灸联合舒筋接骨丸对骨质疏松椎体压缩性骨折PKP术后恢复的临床观察
- 基于数据挖掘孟如教授治疗类风湿关节炎的用药规律研究
- 中医综合疗法治疗慢性盆腔炎50例
- 中医古籍中小儿疳证载方初探
- 基于文献数据挖掘分析玫瑰糠疹的中医用药规律
- 健脾温阳法治疗高脂血症的探讨
- 3种常用民族药减肥消脂作用的筛选研究
- 补气宁神汤对气虚型不寐症患者睡眠及生活质量的影响
- 中药骨科熏洗方联合扶他林乳胶剂治疗踝骨关节炎的疗效观察
- 岭南地区中医药预防新型冠状病毒肺炎临床思路与探讨
- 痔术后肛缘水肿的治疗进展
- 补肺活血法治疗慢性阻塞性肺疾病稳定期探究
- 从阴火论治糖尿病研究进展
- 参苓承气汤作用于治疗脓毒症患者腹腔内高压脾虚气滞型患者疗效机制的探讨
- 云南春燥环境对小鼠气道黏蛋白MUC5ac、纤毛蛋白DPCD及相关指标影响的研究
- 三七多糖含量测定方法比较
- 不同pH条件下五倍子中β-PGG水解产物分析及其含量研究
- 熊磊教授辨治小儿厌食症验案解析
- gape
- gaped
- gapes
- gaping
- gapingly
- gapings
- gap-junctional
- gapless
- gappier
- gappiest
- gaps
- garage
- garageable
- garaged
- garages
- garaging
- garb
- garbage
- garbage can
- garbage cans
- garbage collector
- garbaged
- garbage in, garbage out
- garbages
- garbage/trash
- 寅宾
- 寅川
- 寅年吃了卯年的租儿
- 寅年吃了卯年粮,惹得旁人说短长
- 寅年用了卯年(粮)
- 寅忧夕惕
- 寅恭
- 寅支卯粮
- 寅时
- 寅时点兵,卯时上阵
- 寅月
- 寅木
- 寅正
- 寅清
- 寅用卯年
- 寅畏
- 寅老
- 寅虔
- 寅谀
- 寅谊
- 寅重
- 寅饯
- 密
- 密不可分
- 密不透风