
摘 要 冰胶是在低于体系凝固点以下,通过聚合或交联反应制备的疏松的、大孔状的凝胶,其在分析化学领域的应用,主要是将分子印迹技术的构效预知性、特异识别性与冰胶的多孔结构和高通量结合,构成“分子印迹冰胶法”; 分子印迹冰胶法在蛋白质分离纯化方面,对于保持蛋白质的生物活性,有独特的优势。冰胶通常制备成颗粒包埋型分子印迹冰胶填充柱或整体柱,也可制备成分子印迹选择性分离膜;所选的模板成分可以是无机离子、小分子或大分子,也可以是大分子上的某些片段;既可以是单分子(片段、离子),也可以是多种分子(片段、离子)的混和物,即混和模板法;既可以直接是目标物本身,还可以是目标物质的结构类似物、同位素标记物及目标物质的片段,即虚拟模板法;甚至还可直接以复杂样品中的高丰度组分作为模板制备分子印迹冰胶,使高丰度组分被选择性吸附,从而使低丰度成分的信号增强,即待定模板法。
关键词 冰胶; 分子印迹; 填充柱; 整体柱; 分离膜; 模板分子; 评述
1 引 言
在室温及以上温度下单体通过聚合制备出的多孔聚合物叫常规凝胶, 如在0℃~20℃下进行聚合反应,因温度低于溶剂的凝固点,此时含有单体或聚合物前体的半凝固反应体系发生聚合或交联,其产物在室温下解冻, 除水后形成疏松的、大孔状的凝胶聚合物叫冰冻凝胶,简称冰胶(Cryogel);当以水为溶剂时,水既为分散剂,同时又充当致孔剂,通过相分离形成冰胶的超大孔结构,即水凝结成的冰晶生长并连为一体,形成完全相连的冰冻骨架,点缀于其中的富含反应物的液态有机微相,反应后形成孔壁, 并保持双链结构;冰晶的形状与尺寸决定了冰胶内部相连的大孔的形状与尺寸[1,2]。
通过选择合适的模板、单体、交联剂分子,或通过不同方法在冰胶内部孔表面进行化学修饰或接枝改性,得到具有不同形貌、不同孔结构与不同识别功能的活性位点,在提高选择性的同时,兼顾增加吸附容量[3]。冰胶的弹性孔壁本身具有较好的力学稳定性,在多次压缩50%以上,或经多次干燥、溶涨后,冰胶的孔结构与性能均不变,极有利于干态储藏、再生和重复使用[4]。利用冰胶的温敏特性,改变温度,冰胶整体发生膨胀与收缩,冰胶内部的孔结构也会随之而变化,从而改善分子印迹冰胶整体柱的柱效,改善分离[5,6]。
Bereli等[7]于2008年开始了分子印迹冰胶法(Molecular imprinting cryogel, MIC)的研究,它将冰胶的大孔结构和高通量特性与分子印迹技术的构效预知性和特异识别特性结合,构成了一种独特的亲合分离技术[8],应用于从复杂环境水样及血液、尿液、发酵液、细胞破裂上清液等生物样品中快速、高选择性地进行手性识别、生物分离、去除重金属离子、定向解毒等[9,10],亲合性提取小分子、无机离子以及多肽、蛋白质、核酸等生物大分子,甚至可直接固定与分离病毒粒子、细胞器、细胞及微生物等[11]。
2 结构与性质
冰胶制备过程如图1所示。当以水为溶剂时,将模板物质、结构单体、功能单体、交联剂(或聚合物如聚乙烯醇(pVA)与交联剂戊二醛(GA)[12])加入水中,在0℃~
20℃时,由(NH4)2S2O8、 S2O8等氧化剂与NaHSO3、N,N,N,N-四甲基乙二胺等还原剂组成的引发体系引发低温自由基聚合反应,再经室温解冻并洗去模板分子后,得到具有合适空间结构的分子印迹冰胶[3,4]。
图1 分子印迹冰胶制备过程示意图
Fig.1 A schematic representation for preparation of molecular imprinting cryogel
2.1 单体与交联剂
目前,冰胶聚合物的结构单体主要为:甲基丙烯酸羟乙酯(HEMA)[3]、丙烯酰胺(AAM)[13]、N,N-二甲基丙烯酰胺(DMAM)[14]、N-异丙基丙烯酰胺(NIPAm)[15]、乙烯己内酰胺(VCL)[16]、乙二醇二甲基丙烯酸酯(EGDMA)[17]及2-丙烯酰胺基-2-甲基丙烷磺酸(AMPS)[18]等。部分结构单体如图2所示。因pHEMA有较好的化学惰性、较高的机械强度、较好的化学稳定性和生物稳定性,以及较好的生物相容性,故HEMA应用最多[19]。
功能单体具有与目标物质类似的空间结构与官能团,可进一步增加冰胶对目标分子的选择特性或吸附容量,并提高对生物样品的相容性。如表 1所示,功能单体多为N-甲基丙烯酰胺衍生物,它的功能基多为氨基酸甲酯系列,能提供酯基、亚氨基, 与目标物质形成较强的极性键、氢键、配位键或范德华力[20]。
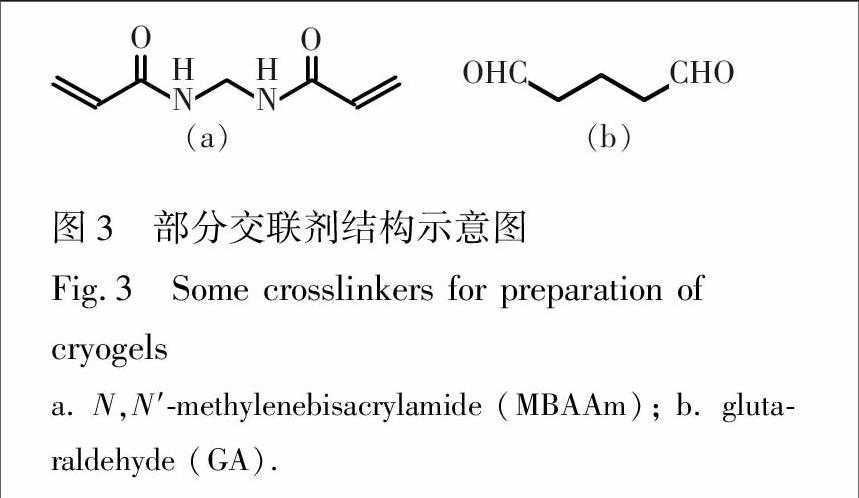
加入交联剂后,可得到力学性能较好的具有三维立体网状结构的冰胶,使其具有适当的硬度与溶胀性质;其上的官能团亦可增加对目标物质的识别能力[11]。如图3所示,N,N′-亚甲基双丙烯酰胺(MBAAm)是目前应用最多的交联剂,它除可使冰胶结构三维化外,其分子上的亚胺基与羰基还可与桥键性金属离子(如Cu2+)部分配位,利用金属离子的残余键位与目标分子(如氨基酸)上的咪唑基、巯基、吲哚基等发生配位,增加与生物分子的亲合性,应用于对多肽和蛋白质的纯化[21];此外,EGDMA [22](图2b)、戊二醛(GA)[23]亦可作交联剂。
2.2 模板分子
制备分子印迹冰胶的模板物质可以是Fe3+ [23], BrO3[24], AsO3
4[25]等简单的无机离子,也可以是雌二醇(E2)[23]、L-谷氨酰胺[26]、L-谷氨酰胺[27]、L-组氨酸[28]等小分子,同时,还可以是多种小分子共同充当模板成分,即混合模板或多模板法[29],如Denizli等[8]以E2、4-壬基酚(4-NP)及莠去津(ATR)的混和物为模板,用以去除水体中的E2和ATR。
溶菌酶(Lys)[30]、胆红素(BIL)[31]、人血清蛋白(HSA)[19]、α-2b干扰素[32]、碳酸酐酶(CAH)[33]等生物大分子均可充当模板物质;当获得某些生物大分子有困难时,可利用这些大分子的某个片段为模板制备冰胶,以选择性识别大分子,从而降低成本。如免疫球蛋白G(IgG)的Fab片段[34]和Fc片段[35]都曾作为模板制备分子印迹冰胶以吸附人血浆中的IgG。
以目标物质的结构类似物、同位素标记物等为模板,因具有与目标分子相近的空间结构与官能团,所制备出的冰胶同样可能对目标物质有较好的选择性,此即虚拟模板法(Dummy template)[25]。虚拟模板法可解决目标物质有毒、成本高的问题,更重要的是,可避免直接模板法可能存在的“模板渗漏”,排除由此引起的对目标物质定量精密度的干扰,提高检测的可靠性和准确性[36,37]。如Baggiani等[18]制备了六氟代双酚A(FBPA)分子印迹冰胶分析双酚A(BPA)。
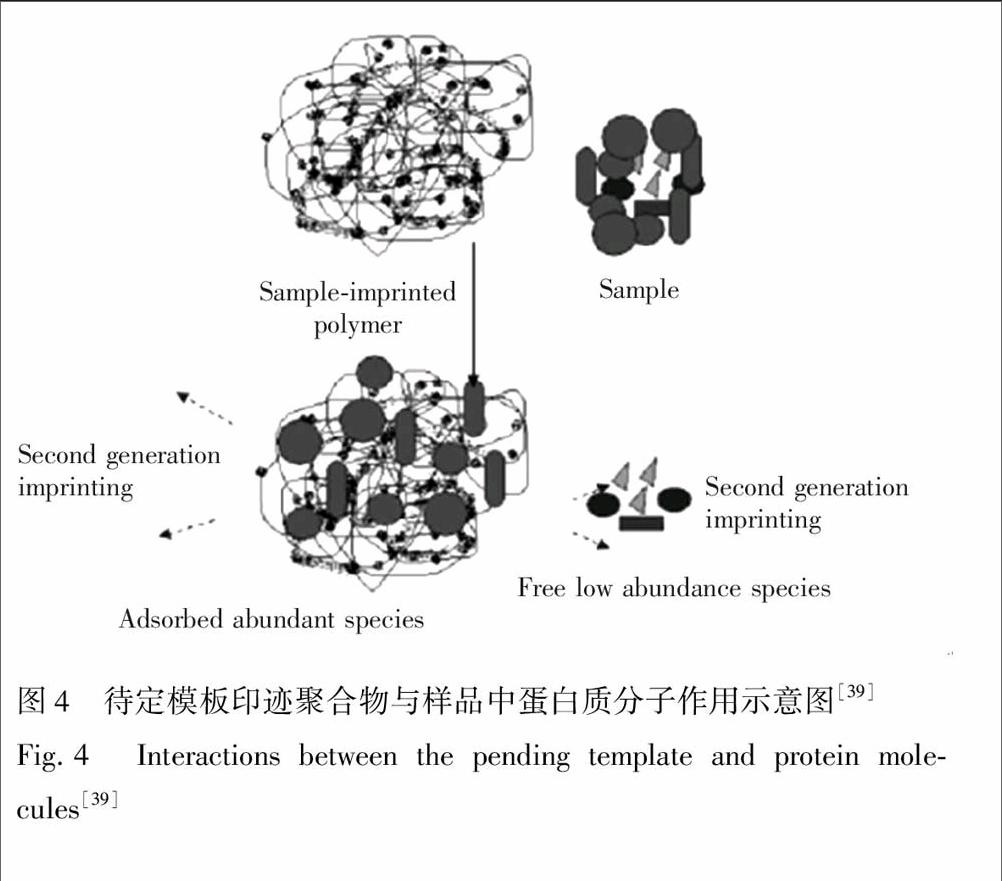
待定模板法(Pending template)是根据冰胶结构将对样品中高丰度组分优先印迹的原理,通过待定模板法获得分子印迹,除掉样品中的高丰度杂质[38]。如图4所示,直接以含多种蛋白质的鸡蛋清为模板,制备出同时含酸
图4 待定模板印迹聚合物与样品中蛋白质分子作用示意图[39]
Fig.4 Interactions between the pending template and protein molecules[39]
性基团和碱性基团的两性电解质冰胶整体柱,用于处理鸡蛋清样品时,样品中多个高丰度蛋白质组分被印迹,其信号因可被分子印迹冰胶特异性吸附去除而降低,低丰度蛋白质的信号增强[39]。
2.3 孔结构及其影响因素
冰胶表面及内部特定的印迹腔体与官能团性质,共同影响对目标物质的亲合程度与可接近程度。可利用表面吸附分析(BET)、孔径、吸附等温线等方法,讨论模板与聚合物基体的化学结构、空间结构及酸效应、盐效应、pH值等条件与萃取富集效率和选择性的相关性。控制适当原料配比与反应条件,可调整冰胶内部孔径大小与分布,产生适度的大孔、介孔与微孔的平衡,使冰胶兼有较高的传质速度和大的比表面积,表现出良好的吸附与色谱行为[40]。
因为制备温度不同,冰胶孔结构及吸附容量与常温凝胶有较大差别。Ran等[41]以牛血清白蛋白(BSA)为模板,分别在
20℃和25℃制备了2-丙烯酰胺基-2-甲基-1-丙烷磺酸(AMPS)、NIPAm和AAM的共聚凝胶,前者具有更多、更规则的50~100 μm孔腔,其对BSA的吸附容量为后者的2.8倍。
制备冰胶时,水凝固成的冰晶占据了80%~90%, 甚至更大的空间,聚合反应只在冰晶缝隙间的非凝固微液相内发生,反应完成后, 经室温解冻,得到具有超大孔(1~100 μm i.d.)、结构疏松的冰胶,其孔壁厚度为1~10 μm至15~50 μm,其中还含有介孔(2~50 nm i.d.)、微孔(<2 nm),总孔容积(20~40 cm3/g);冰胶内部的大孔结构相互连通,流体流动通道大,因而具有良好的流体力学性质,回压低,扩散阻力小,传质快而高效,无机离子、小分子、生物大分子, 甚至细胞,均可透过冰胶;当冰胶用于复杂环境水样及生物样品中的目标物质的选择性吸附和脱附时,平衡时间都短,可高通量快速处理大体积水样[42]。
孔径对冰胶吸附性能与选择性的影响较为复杂。孔径越大,样品流速越大,处理样品的速度越快,但此时冰胶内部比表面积小,作用位点少,同时,目标物与冰胶接触时间太短,不利于有效的吸附目标物质;孔径越小、壁越薄,处理样品的速度越慢,但此时冰胶具有较大的比面积,可提供较高的吸附容量[43]。
选择带有特定官能团的模板分子、单体或聚合物前体、或往冰胶骨架上通过修饰R、COO等疏水性官能团或OH、NH2和SH等亲水性官能团,可改变冰胶表面及内部腔体的极性;还可引入SO3或NR+3等离子性基团,使冰胶带上不同性质的电荷,甚至还可使冰胶分子同时带上正、负电荷,成为既亲油又亲水的双亲分子; 不同极性及离子性的目标物质均可与其通过静电作用、范德华力或氢键,甚至可与金属离子形成较强的配位键,产生高的选择性以及高的吸附容量,使冰胶具有需要的分析性能、离子交换性能、催化性能[4,19]。
同时,冰胶的超孔结构也有利于大面积地将短分子链接枝到冰胶孔壁,提高对生物大分子的吸附容量,并加快分子在冰胶内部的传质[10,11]。如Savina等[45]将AAc接枝到pAAM冰胶上,所得冰胶对低分子量配基(如Cu2+)的吸附容量随接枝度的增加而线性增大;其对大分子量配基如Lys的吸附容量,当接枝度低于40%时,也随接枝度的增加而线性增大;当接枝度由60%增至70%时,吸附量急剧增加3倍。如图5所示,该冰胶与Lys间发生的是类似于蛋白质-聚合物间的触手型相互作用。
此外,冰胶与无机纳米粒子复合,可调整冰胶内部孔壁厚度与孔径大小,改善冰胶力学性能、吸附性能与分析性能,并可使其多功能化[45];一方面,在冰胶中添加微纳尺度的炭黑、Al2O3、SiO2、碳纳米管等多孔无机填料,可以起到补强剂的作用,制备出有机、无机复合的冰胶,增加冰胶的强度,使孔结构更为坚固,增加耐压性[23];另一方面,可利用纳米粒子超高的比表面积,增加凝胶对目标物质的吸附性能;此外,通过添加磁性成分制备出的磁性离子印迹聚合物,不仅具有特定的分子识别位点,而且具有磁响应特性,在外加磁场作用下,易于分离回收,广泛应用于医药、水处理和环保等领域[26];含Tb3+的分子印迹冰胶荧光纳米颗粒,兼有选择性识别与荧光监测含组氨酸残基的蛋白质(如Lys和Cyt C)的功能[46]。
3 冰胶在分析化学中的应用
3.1 材料的赋形
冰胶可制备成粉末状、片状、棒状、整体材料等形状。通过改变冰胶赋形,进一步改善冰胶性能,如制备成冰胶分子印迹整体柱,可直观考察目标物质及其结构类似物的竞争性保留机制,或制备成冰胶包埋分子印迹颗粒,进一步提高比表面积从而提高吸附量,或制备成冰胶分子印迹分离膜,从而实现高通量、快速处理大量生物样品的目的。
3.1.1 颗粒包埋与整体柱
将分子印迹颗粒均匀分散,包埋于冰胶中,可形成“颗粒包埋结构冰胶”,其与目标分子的作用位点位于冰胶骨架的表面或亚表面,比表面积增大,作用位点增多,对目标分子有更好的可接近性,吸附容量显著提高[43,47]。如将胆固醇(Chol)印迹的微球包埋于pHEMA中所制备的冰胶,比表面积增加4.5倍,可去除水体中80% Chol,并可重复使用20次[48];将E2分子印迹颗粒(5~10 μm)包埋于pHEMA中制备的冰胶,可去除水体中88%的E2[49]。
在普通HPLC色谱柱中,固定相多为表面多孔型填料,孔径较小,同时,因为固定相粒子形状与尺寸的非均匀性,即使在最紧密填充的情况下,固定相粒子间的空间也占色谱柱总容积的27%或以上,固定相与目标分子间的作用位点较少,对目标分子的容量因子较小;分子印迹冰胶整体柱内具有大孔、介孔及微孔,可以实现快速的对流传质。同时,冰胶内印迹腔体对目标分子具有特异性空间结构识别功能,以及与目标分子间存在官能团相互作用,尤其是冰胶内孔表面经化学修饰、接枝修饰及与无机纳米粒子复合改性后,与目标物质的作用位点数大增,其对目标物质的容量因子更大,因而具有更高的柱效[51]。如可将分子印迹颗粒包埋入冰胶中,制备成分子印迹冰胶整体柱, 分析或分离天然水体和红酒样品中的BPA [18]、鱼眼和链球菌培养物中的玻尿酸(HA)[11]等,以获得较高的吸附容量及选择因子。
3.1.2 分离膜 为了能更高效地从大量生物样品中快速分离、纯化蛋白质,可将分子印迹冰胶制备成分离膜。如图6所示,Asliyuce 等[14]先利用乙肝表面抗体(anti-HBs)、EGDMA、HEMA共聚制备出分子印迹颗粒,再将其与引发剂、HEMA置于两片玻璃间,获得分子印迹pHEMA冰胶膜,并切割成直径25 mm的圆片,用以纯化乙肝阳性人体血浆中的anti-HBs。该冰胶印迹分离膜在流动相线速度为0.50 mL/min下使用10次后,其对anti-HBs的吸附容量仅降低5%。
3.2 分子印迹冰胶法的应用
3.2.1 小分子 分子印迹冰胶法应用于选择性识别小分子,目前主要用于快速定向去除复杂环境样品中的雌激素等内分泌干扰物,以改善一般污水处理厂对环境雌激素去除效果差的现状[51]。如以分子印迹冰胶整体柱可完全去除水溶液中痕量的E2(2 μg/L),废水样品流速可达50 mL/min,比普通整体柱高10倍以上[17];以pVA冰胶流动床可在4 min内去除废水中100% E2和86% ATR[15];此外,分子印迹冰胶法还应用于BPA[8]、谷氨酸(Glu)[52]的分析研究。
3.2.2 大分子 在温和条件下制备蛋白质分子印迹冰胶,可保持蛋白质的生命活性,抑制蛋白质的变性和构象改变,从而保持更高的选择性,故分子印迹冰胶法应用于选择性分析、分离纯化或去除生物样品中的蛋白质[11]、快速监控疾病、提取动物源药物,有独特的优势[26]。如以分子印迹冰胶提取人血浆中的BIL[53]、去除人血清中的HSA[19]、吸附胰岛素(INS)[20]、提取鸡蛋清里的Lys[30]、吸附α-2b干扰素[32]、从牛红细胞中纯化CAH[33]等。
3.2.3 无机离子 无机金属离子和结构单体、功能单体及交联剂等成分低温共聚,解冻后洗去离子,留下无机离子的空位而被“记忆”下来,所得离子印迹冰胶即对无机离子有选择性吸附作用。无机离子的电荷数、几何构型和配位数、几何尺寸、与配体间相互作用的专属性都会对离子印迹冰胶的选择性、吸附容量、吸附动力学行为产生影响[54]。如以离子印迹冰胶法测定贫血病人血浆中的Fe3+[23]、高选择性去除饮用水中的低浓度溴酸盐(<10 μg/L)[24]、吸附除去废水样品中的As(V)[25]等。
分子印迹冰胶在分析化学中的应用例子见表 2。
4 其它应用
利用冰胶官能团上的N, O, S等原子先与Cu2+, Co2+, Zn2+, Ni2+等过渡金属离子部分配位,再让目标分子上的N, O, S与金属离子进一步配位至饱和,使冰胶与目标分子间的相互作用叠加上作用力更强、定向性更高、结合快速、热力学稳定的配位作用,有利于提高对目标分子的吸附量[40];基于与过渡金属离子间配位作用制备的分子印迹冰胶具有催化效应[55],如冰胶单体与过渡金属离子配位后聚合得到的冰胶仿酶材料,其对降解农药(如对氧磷)的催化性能比未印迹的冰胶高数十倍至数百倍[18, 43];由脂肪固定化酶、AAM、MBAAm、AAc及AA共聚得到的分子印迹冰胶,当其应用于催化三油酸甘油酯(Olein)与甲醇间的酯交换反应时,其传质性能、催化性能及稳定性均优于常规凝胶固定化酶[56]。
5 结论与展望
分子印迹冰胶法将分子印迹技术的构效预知性、特异识别性与冰胶大孔结构的快速高通量及其可控孔结构、化学与机械稳定性结合,构成了一种独特的亲合分离技术。分子印迹冰胶法具有很好的生物相容性,且有利于保持蛋白质的生物活性。分子印迹冰胶可制备成填充柱或整体柱,也可制备成分离膜。分子印迹冰胶法分离的对象可以是小分子、大分子及无机离子。冰胶中应用模板的方法有常规模板法、虚拟模板法、单一模板法、混和模板法、待定模板法等。
然而,目前所制备的冰胶强度偏低,但冰胶强度对于其实际应用有不利影响。例如, 将分子印迹冰胶整体柱应用于高效液相色谱分析时,冰胶须有足够的机械强度,至少能承受约50 MPa的柱压,才能保证其分析性能的稳定性和分析数据的重现性;再如,将分子印迹冰胶膜应用于排污口及河道等处以快速富集、去除特定污染物时,冰胶自身机械强度及其与支撑体间的附着强度,都会影响其承压性、耐冲击性及使用成本。
除了将冰胶与高模量纳米级无机填料复合,增大冰胶连续相整体强度外,在冰胶配料中增大交联剂含量、在冰胶分子的主链或支链中引入极性官能团或芳环等刚性基团以及通过交联聚合等方法,可进一步提高冰胶的内聚力与机械强度,将对保证冰胶材料的持久有效性及工程实用性有重要意义。
References
1 Gun′ko V M, Savina I N, Mikhalovsky S V. Adv. Colloid Interface Sci., 2013, 187: 1-46
2 YANG Chun, LUAN Xin-Jie, ZHAO Mei-Feng, HU Xiao-Ya. Journal of Instrumental Analysis, 2013, 32 (2): 249-252
杨 春, 栾新杰, 赵美凤, 胡效亚. 分析测试学报, 2013, 32(2): 249-252
3 Lan H, Gan N, Pan D, Hu F, Li T, Long N, Qiao L. J. Chromatogr. A, 2014, 1331: 10-18
4 Hu Y, Wang Y, Chen X, Hu Y, Li G. Talanta, 2010, 80(5): 2099-2105
5 Tamahkar E, Bereli N, Say R, Denizli A. J. Sep. Sci., 2011, 34(23): 3433-3440
6 Liu H, Liu M, Bai L, Sun S, Liu Y, Yang G. Talanta, 2011, 85(2): 1193-1198
7 Bereli N, Andac M, Baydemir G, Say R, Galaev I Y, Denizli A. J. Chromatogr. A, 2008, 1190(1-2): 18-26
8 Denizli A, Say R, Pikin E. React. Funct. Polym., 2003, 55(1): 99-107
9 Cetin K, Denizli A. Colloids Surf. B, 2015, 126: 401-406
10 FAN Hong-Tao, SUN Ting, DONG Jia, TONG Gui-Feng, SUI Dian-Peng. Chemistry, 2009, (1): 10-14
范洪涛, 孙 挺, 董 佳, 仝桂锋, 隋殿鹏. 化学通报, 2009, (1): 10-14
11 Unluer O B, Ersoz A, Denizli A, Demirel R, Say R. J. Chromatogr. B, 2013, 934: 46-52
12 Yuling H, Yangyang W, Xiaoguang C, Yufei H, Gongke L. Talanta, 2010, 80(5): 2099-2105
13 Xue W, Champ S, Huglin M B, Jones T G J. Eur. Polym. J., 2004, 40(3): 467-476
14 Asliyuce S, Uzun L, Rad A Y, Unal S, Say R, Denizli A. J. Chromatogr. B, 2012, 889: 95-102
15 Le Noir M, Plieva F M, Mattiasson B. J. Sep. Sci., 2009, 32(9): 1471-1479
16 Hajizadeh S, Xu C, Kirsebom H, Ye L, Mattiasson B. J. Chromatogr. A, 2013, 1274: 6-12
17 Le Noir M, Plieva F, Hey T, Guieysse B, Mattiasson B. J. Chromatogr. A, 2007, 1154(1-2): 158-164
18 Baggiani C, Baravalle P, Giovannoli C, Anfossi L, Giraudi G. Anal. Bioanal. Chem., 2010, 397(2): 815-822
19 Andac M, Galaev I Y, Denizli A. Colloids Surf. B, 2013, 109: 259-265
20 Cavus A, Baysal Z, Alkan H. Colloids Surf. B, 2013, 107: 84-89
21 Luo Q, Zou H, Xiao X, Guo Z, Kong L, Mao X. J. Chromatogr. A, 2001, 926(2): 255-264
22 Uygun M, Uygun D A, Ozcalskan E, Akgol S, Denizli A. J. Chromatogr. B, 2012, 887-888: 73-78
23 Aslyüce S, Bereli N, Uzun L, Onur M A, Say R, Denizli A. Sep. Purif. Technol., 2010, 73(2): 243-249
24 Hajizadeh S, Kirsebom H, Galaev I Y, Mattiasson B. J. Sep. Sci., 2010, 33(12): 1752-1759
25 Onnby L, Pakade V, Mattiasson B, Kirsebom H. Water Res., 2012, 46(13): 4111-4120
26 WANG Ying, LI Nan. Chemical Industry and Engineering Progress, 2010, 29: 2315-2323
王 颖, 李 楠. 化工进展, 2010, 29: 2315-2323
27 Reddy P S, Kobayashi T, Abe M, Fujii N. Eur. Polym. J., 2002, 38(3): 521-529
28 Bereli N, Saylan Y, Uzun L, Say R, Denizli A. Sep. Purif. Technol., 2011, 82: 28-35
29 Zhang C, Jia X, Wang Y, Zhang M, Yang S, Guo J. J. Sep. Sci., 2014, 37(4): 419-426
30 Bereli N, Anda M, Baydemir G, Say R, Galaev I Y, Denizli A. J. Chromatogr. A, 2008, 1190(1-2): 18-26
31 Baydemir G, Andac M, Percin I, Derazshamshir A, Denizli A. J. Mol. Recognit., 2014, 27(9): 528-536
32 Erturk G, Bereli N, Tumer M A, Say R, Denizli A. J. Mol. Recognit., 2013, 26(12): 633-642
33 Uygun M, Karagozler A A, Denizli A. Artif. Cells Nanomed. Biotechnol., 2014, 42(2): 128-137
34 Asliyuce S, Uzun L, Say R, Denizli A. React. Funct. Polym., 2013, 73(6): 813-820
35 Bereli N, Erturk G, Tumer M A, Say R, Denizli A. Biomed. Chromatogr., 2013, 27(5): 599-607
36 Rabieizadeh M, Kashefimofrad S M, Naeimpoor F. J. Sep. Sci., 2014, 37(20): 2983-2990
37 Andac M, Galaev I Y, Yavuz H, Denizli A. Methods in Molecular Biology(Clifton, N.J.), 2015, 1286: 233-237
38 Kubo T, Hosoya K, Otsuka K. Anal. Sci., 2014, 30(1): 97-104
39 Yang C, Luan X, Zhao M, Liu G, Wang J, Qu Q, Hu X. Electrophoresis, 2013, 34(9-10): 1383-1389
40 HUANG Jian-Xiang, HU Yu-Ling, HU Yu-Fei, LI Gong-Ke. Chinese J. Anal. Chem., 2012, 40(4): 643-650
黄健祥, 胡玉玲, 胡玉斐, 李攻科. 分析化学, 2012, 40(4): 643-650
41 Ran D, Wang Y, Jia X, Nie C. Anal. Chim. Acta, 2012, 723: 45-53
42 Lan H, Gan N, Pan D, Hu F, Li T, Long N, Qiao L. J. Chromatogr. A, 2014, 1331: 10-18
43 GUO Yong, GUO Tian-Ying. Polym. Bull., 2013, (1): 112-126
郭 勇, 郭天瑛. 高分子通报, 2013, (1): 112-126
44 Savina I N, Mattiasson B, Galaev I Y. Polymer, 2005, 46(23): 9596-9603
45 WANG Mei, DENG Fang. Polym. Bull., 2014, (9): 97-102
王 玫, 邓 芳. 高分子通报, 2014, (9): 97-102
46 Uzun L, Uzek R, Senel S, Say R, Denizli A. Mater. Sci. Eng. C, 2013, 33(6): 3432-3439
47 Burova T V, Grinberg N V, Kalinina E V, Ivanov R V, Lozinsky V I, Alvarez-Lorenzo C, Grinberg V Y. Macromol. Chem. Phys., 2011, 212(1): 72-80
48 Caktu K, Baydemir G, Ergun B, Yavuz H. Artif. Cells Nanomed. Biotechnol., 2014, 42(6): 365-375
49 Koc I, Baydemir G, Bayram E, Yavuz H, Denizli A. J. Hazard. Mater., 2011, 192(3): 1819-1826
50 Kuyukina M S, Ivshina I B, Kamenskikh T N, Bulicheva M V, Stukova G I. Int. Biodeter. Biodegr, 2013, 84: 118-125
51 Srivastava A, Shakya A K, Kumar A. Enzyme Microb. Technol., 2012, 51(6-7): 373-381
52 Aydoan C, Anda M, Bayram E, Say R, Denizli A. Biotechnol. Prog., 2012, 28(2): 459-466
53 Baydemir G, Bereli N, Andac M, Say R, Galaev I Y, Denizli A. Colloids Surf. B, 2009, 68(1): 33-38
54 Yamamoto T, Ohmori T, Kim Y H. Carbon, 2010, 48(3): 912-915
55 Babac C, Yavuz H, Galaev I Y, Pikin E, Denizli A. Reac. Funct. Polym., 2006, 66(11): 1263-1271
56 YANG Chun, ZHAO Mei-Feng, LUAN Xin-Jie, LIU Guo-Feng, WANG Jian, HU Xiao-Ya. Modern Chemical Industry, 2013, 33(10): 80-82
杨 春, 赵美凤, 栾新杰, 刘国锋, 王 建, 胡效亚. 现代化工, 2013, 33(10): 80-82
57 Baydemir G, Bereli N, Andac M, Say R, Galaev I Y, Denizli A. React. Funct. Polym., 2009, 69(1): 36-42
58 Baydemir G, Anda M, Perin I, Derazshamshir A, Denizli A. J. Mol. Recognit., 2014, 27(9): 528-536
59 Bereli N, Saylan Y, Uzun L, Say R, Denizli A. Sep. Purif. Technol., 2011, 82(0): 28-35
60 Erturk G, Bereli N, Ramteke P W, Denizli A. Appl. Biochem. Biotech., 2014, 173(5): 1250-1262
61 Ergun B, Baydemir G, Andac M, Yavuz H, Denizli A. J. Appl. Polym. Sci., 2012, 125(1): 254-262
Research Progress of Molecular Imprinting Cryogel
- 南水北调中线工程水源地可持续发展评价
- 漯河市澧河改道工程对沙河和澧河河势影响分析
- 基于鱼类生物量法的河道生态需水过程研究及应用
- 东平湖湿地水质动态及其净化功能分析
- 调水后受水区水环境的演化及重金属污染评价
- 鄱阳湖入江水道和长江南京段泥沙表面特性研究
- 南水北调东线江苏段深化治污重点方向及措施
- 区域用水总量控制模糊综合评价研究
- 郑州市最严格水资源管理绩效评估体系及应用
- 河湖水系连通实践经验与发展趋势
- 近57年来和丰县气温和降水量的趋势性及突变特征近
- 时间序列分析方法在郑州市降水量预报中的应用
- 气候变化和人类活动对泾河上游径流的影响
- 云南南盘江上游旱灾风险定量评估研究
- 近10年黄河宁蒙河段凌情特征分析
- 基于地质统计学理论的海拉尔河流域降水时空变异性研究
- 基于地表温度和植被指数特征空间的泾河流域土壤水分监测
- 城镇化和闸坝对沙颍河流量的影响
- 近55年以来漳卫河流域干旱演变特征
- 岩溶区渗漏通道的示踪试验
- 贵州望谟里拉沟泥石流灾害特征
- 基于SWAT模型的农业干旱评价方法与应用
- 海河流域1961年—2010年极端气温与降水变化趋势分析
- 南水北调东线八里湾泵站渗透稳定分析
- 肥城盆地矿井水特征识别与开发利用
- oversupplied
- oversupplies
- oversupply
- oversupplying
- oversure
- oversurely
- oversureness
- over-surenesses'
- oversurenesses
- oversureness's
- oversureties
- oversurety
- oversusceptibleness
- oversusceptiblenesses
- oversusceptibly
- oversuspicious
- over-suspicious
- oversuspiciously
- oversuspiciousness
- oversuspiciousnesses
- overswarm
- oversweeten
- oversweetened
- oversweetening
- oversweetens
- 奋用
- 奋疾
- 奋矜
- 奋矜之容
- 奋笔
- 奋笔书写
- 奋笔疾书
- 奋笔直书
- 奋管疾书
- 奋管直书
- 奋羽
- 奋羽高扇
- 奋翅
- 奋翅鼓翼
- 奋翔
- 奋翮云霄
- 奋翼
- 奋翼振鳞
- 奋翼跃鳞
- 奋翼青云
- 奋翼高挥
- 奋翼高飞
- 奋肣
- 奋臂
- 奋臂一呼