摘 要 通过4步化学反应对磁性Fe3O4@SiO2纳米粒子进行化学修饰,设计和制备了一种N,N′二(5四唑亚甲基)胺修饰的金属螯合磁性纳米粒子。用X射线光电子能谱(XPS)、Zeta电位对该新型吸附剂进行了表征。用静态吸附法研究了螯合Cu吸附剂对溶菌酶、细胞色素C和α糜蛋白酶的吸附性能以及溶液pH值、盐浓度、蛋白初始浓度对吸附量的影响。结果表明,吸附剂对蛋白质的吸附主要通过金属配位机理进行,且符合Langmuir吸附模型,对溶菌酶、细胞色素C和α糜蛋白酶的最大吸附量分别20.0、13.5和17.9 mg/g。此外,将螯合Cu吸附剂用于混合蛋白质样品的吸附,发现此吸附剂对混合蛋白质样品中的溶菌酶具有选择性吸附作用,说明此金属螯合吸附剂在蛋白质选择性分离富集中具有一定应用价值。
关键词 磁性分离; 金属螯合; 吸附剂; 蛋白质
20160225投稿;20160422接受
本文系国家自然科学基金(Nos. 21275115, 21475104, 21575114)和长江学者高校创新团队项目 (No. IRT15R55) 资助
Email: ymwei@nwu.edu.cn
1 引 言
固定化金属亲和(IMAC)吸附剂在生物大分子分离和纯化过程中应用广泛。该类吸附剂一般由基质、金属离子以及在二者之间起到键合连接作用的螯合配体组成。 传统的基质有大孔硅胶、琼脂糖、有机聚合物等,但这些基质存在传质慢、分离操作困难等缺点。近年来,磁性材料因具有大的比表面积、超顺磁性、低毒性、良好的生物相容性以及磁响应性高等特点[1],作为吸附剂的基质在蛋白质等物质的分离纯化中获得了广泛应用。配体的作用是将金属离子固定在基质上,同时对分离选择性有重要影响。迄今为止,文献中已报道了多种配体,主要分为4种类型[2~5]: (1)二齿配体,如水杨醛,氨基异羟肟酸,8羟基喹啉; (2)三齿配体,如亚氨基二乙酸(IDA),磷酸丝氨酸,二甲基吡啶胺,羧甲基脯氨酸和N(2甲基吡啶)氨基乙酸; (3)四齿配体,包括次氮基三乙酸(NTA)和羧甲基化天冬氨酸; (4)五齿配体,如N,N′,N′三羧甲基乙二胺和四乙烯五胺。最近,文献[6,7]报道了一种基于1,4,7三氮杂环壬烷的多齿配体,其在蛋白质分离中具有良好效果。这些配体绝大多数属于氨羧型配体,其中三齿和四齿的螯合配体能同时兼顾与金属离子稳定结合并使金属离子留有足够的空轨道固定蛋白质,实验证明,这些配体更为适合作为IMAC材料的配基。
四唑基团的解离程度与羧基接近,且具有较好的稳定性[8]。在我们的前期研究中发现,四唑对金属离子具有螯合作用[9]。本研究以四唑代替IDA中的羧基,设计一种不同于氨羧型配体的氨基四唑型三齿配体,采用四氧化三铁(Fe3O4)磁性纳米粒子为基质,制备一种新型金属螯合吸附剂,并研究了固定Cu吸附剂对蛋白质的吸附性能。
2 实验部分
2.1 仪器与试剂
UV2550型紫外分光光度计(日本Shimadzu公司); PHI5400 X射线光电子能谱仪(XPS, 美国PE公司); Masterzeta 2000动态光散射仪(英国Malvern公司); JY200C凝胶电泳仪(北京JUNYI公司)。
正硅酸乙酯(TEOS, 98%,上海晶纯生化科技股份有限公司); 4(氯甲基)苯基三甲氧基硅烷(95%,上海百灵威化学技术有限公司); 三(2氨基乙基)胺和溴乙腈购自国药集团化学试剂有限公司; 溶菌酶(Lysozyme, Lys)购于Amresco公司; 细胞色素C(Cytochrome C, CytC)、α糜蛋白酶(Chymotrypsin, αChy)购于LSBIO公司; 牛血清白蛋白(Bovine serum albumin, BSA)购于Wolsen公司; 卵清蛋白(Ovalbumin, OVA)、肌红蛋白(Myoglobin, Myo),购于Sigma公司。
2.2 实验方法
2.2.1 Fe3O4@SiO2的制备 参考文献[10]和[11]制备。
2.2.2 Fe3O4@SiO2的修饰 将3.0 g Fe3O4粒子置于100 mL三颈瓶中,加入30 mL重蒸甲苯,超声分散,逐滴加入0.75 mL 4(氯甲基)苯基三甲氧基硅烷,110℃下搅拌反应24 h。用甲苯、甲醇分别洗涤,40℃干燥。将干燥后的粒子、30 mL重蒸四氢呋喃(THF)、0.1 mL重蒸吡啶加入到100 mL三颈烧瓶中,再加入0.6 mL三(2氨基乙基)胺,65℃反应24 h得到氨基化Fe3O4@SiO2。向THF、甲醇、乙腈洗涤后的粒子中加入30 mL乙腈、2.43 g K2CO3作为缚酸剂、0.3 g KI作为催化剂和1.1 mL溴乙腈,80℃反应24 h,得到氰基化Fe3O4@SiO2。用乙腈、甲醇、N,N二甲基甲酰胺(DMF)分别洗涤所得粒子。最后,在粒子中加入30 mL DMF,0.63 g叠氮钠和0.52 g氯化铵,120℃反应16 h。反应结束,用DMF、甲醇、蒸馏水分别洗涤,真空干燥,得到N,N′二(5四唑亚甲基)胺修饰的磁性纳米粒子,即氨基双四唑型磁性纳米粒子。
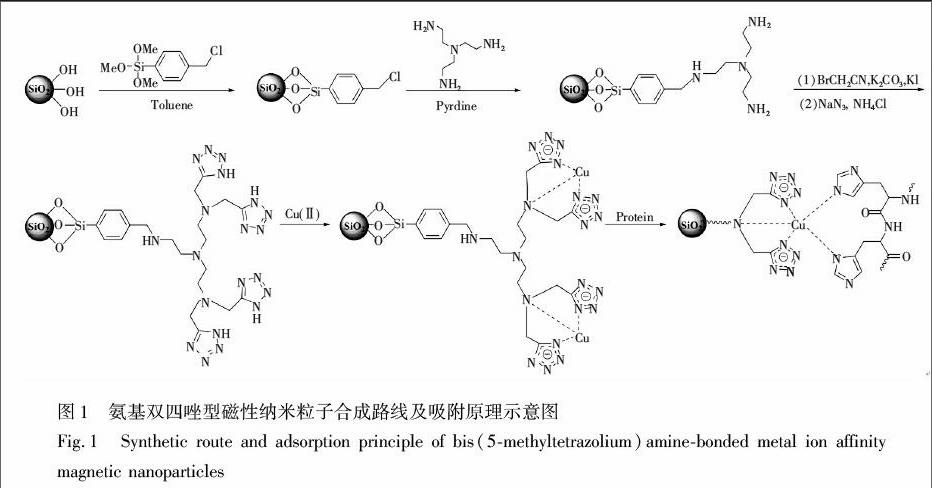
称取0.5000 g氨基双四唑型粒子于100 mL锥形瓶中,加入25 mL 5 mmol/L CuSO4溶液,25℃吸附12 h,在磁铁吸附下除去上清液,再用少量pH 5.0, 0.1 mol/L乙酸乙酸钠溶液清洗,除去未螯合的Cu, 真空干燥,即得到金属螯合磁性纳米粒子。其合成路线及吸附原理如图 1所示。
2.2.3 蛋白质吸附研究 (1) 溶液pH值的影响 在放置10 mg吸附剂的50 mL离心管中,分别加入5 mL用0.2 mol/L NaCl配制的、不同pH值的0.3 mg/mL Lys、CytC和αChy溶液。将混合吸附剂的蛋白质溶液超声分散1 min,并置于摇床振荡,结果表明,25℃下1 h可以达到吸附平衡。磁铁分离取上清液,用0.45 μm膜过滤,紫外分光光度计分别测定溶液的吸光度,计算平衡浓度,根据式(1)计算吸附量:
2.2.4 吸附剂的吸附选择性 配制浓度分别为1 mg/mL的OVA, BSA, Lys和Myo混合溶液。取0.2000 g 吸附剂和2 mL混合液,25℃吸附1 h。收集上清液,吸附剂用20 mmol/L磷酸盐缓冲液(pH 7.4)清洗3次,再用1.0 mL 0.2 mol/L NaCl淋洗。然后,加入1 mL含0.5 mol/L NaCl和0.7 mol/L咪唑的缓冲液进行洗脱。收集该过程的上清液、淋洗液和洗脱液,用10%十八烷基磺酸钠聚丙烯酰胺凝胶电泳(SDSPAGE)对溶液进行分析。
3 结果与讨论
3.1 XPS表征
根据分子结构,四唑基团解离后形成的四唑环状阴离子具有强的给电子能力,可充当配位基团。因此,本研究模拟金属螯合吸附色谱中最常用的配体—亚氨基二乙酸结构,设计合成了一种氨基双四唑型配体。该配体通过N和两个四唑阴离子环与金属配位,因此属于三齿配体。
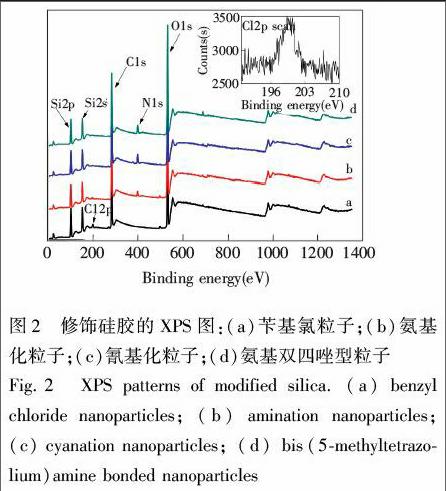
为了验证氨基双四唑型配体结构,用XPS表征了修饰过程中每种粒子的元素含量及其存在环境。从图2可见,经4(氯甲基)苯基三甲氧基硅烷修饰后出现Cl元素(1.68%, w/w)的特征峰。该粒子与三(2氨基乙基)胺反应后,Cl元素的特征峰消失,出现了N元素(2.57%)特征峰。对于氰基化粒子和氨基双四唑型粒子,虽然元素的特征峰不变,但是N含量分别增加到4.57%和5.22%,说明粒子表面的氮元素增多,与配体的结构符合。为进一步确认四唑的形成,对四唑型吸附剂XPS测定的N元素进行了N1s分峰处理。可以分为结合能为402.39, 401.06, 400.25, 399.48和398.62 eV的5种N1s特征峰,其中398.62 eV对应于叔胺N原子,400.25 eV对应CNHC的特征峰,402.39, 401.06和399.48 eV属于四唑环上N原子的特征峰[12]。N1s分峰结果表明,吸附剂表面有四唑基团生成。
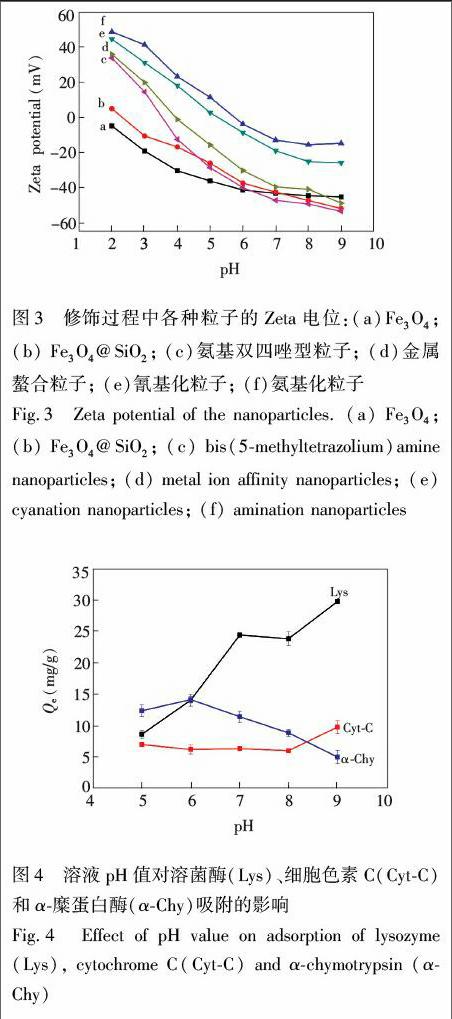
氨基化的粒子由于强烈的质子化倾向,具有较大的Zeta电位值; 粒子表面接枝氰基后,质子化能力降低,Zeta电位值下降。经四唑基修饰后,四唑环在低pH值下发生部分解离变成负离子,故Zeta电位值继续降低。当粒子螯合铜后,表面正电荷增多,导致不同pH值下的Zeta电位值均大于四唑基粒子。由图3可知,在pH 2~9范围内,Zeta电位的大小顺序为:氨基化粒子>氰基化粒子>金属螯合粒子>氨基双四唑型粒子。随着pH值增加,所有粒子的Zeta电位都呈下降趋势,这是因为在溶液pH值增加的过程中,粒子表面质子化减弱,而表面残存的硅羟基解离程度增大,使表面负电荷逐渐增多。吸附剂Zeta电位的变化证明了合成每步反应都是成功的。
3.3 吸附剂对蛋白质的吸附性能
3.3.1 溶液pH值的影响 由图4可见,随着pH值的升高,Lys, CytC和αChy的吸附量呈现不同的变化趋势。Lys的吸附量随pH值升高而呈现出整体上升的趋势; CytC的吸附量在酸性溶液中保持不变,在碱性环境中增加。这符合金属螯合吸附作用在中性和弱碱性溶液最大的特点[13]。但是,αChy的吸附却呈现出随pH增大而减小的趋势。该现象与其分子结构有关:αChy表面有两个裸露的组氨酸His57和His40,His57存在于催化三联体中,仅起催化作用,His40作用面积较小,但空间取向较灵活,在金属螯合吸附中可与金属产生配位作用,从而使αChy在吸附剂表面产生吸附行为[14],但可能由于静电作用力参与程度较大的缘故,使蛋白吸附随pH增大而减小。3种蛋白吸附量与金属螯合色谱中Lys、CytC、αChy的保留时间随pH变化趋势一致[7],也支持了蛋白与吸附剂之间存在螯合作用的机理。
3.3.2 盐浓度的影响 当NaCl浓度小于0.4 mol/L时,3种蛋白吸附量均随NaCl浓度的增加而降低; 当NaCl浓度大于0.4 mol/L时,Lys、CytC和αChy吸附量分别减小至8.90、5.08和10.73 mg/g; 继续增大NaCl浓度,吸附量保持不变。这种现象与蛋白和吸附剂之间存在的配位和静电作用有关。在低离子强度范围内,随着离子强度增加,吸附量明显降低,反映蛋白质与吸附剂之间存在弱静电作用; 当盐浓度大于0.4 mol/L后,蛋白质与吸附剂之间静电作用被完全屏蔽,蛋白质的吸附作用以配位作用为主。
3.3.3 吸附等温线 蛋白质的吸附量随着Lys、CytC、αChy的初始浓度增大而增大,在Lys, CytC和αChy初始浓度分别为0.7, 0.2和0.3 mg/mL时达到最大吸附量,蛋白质的初始浓度继续增加,吸附量不再变化。分别用Langmuir和Freundlich模型对吸附数据进行拟合。由表1可见,3种蛋白质的吸附更符合Langmuir吸附等温线,说明吸附剂对3种蛋白质的吸附是以单分子层吸附为主。这符合金属螯合的吸附机理,即蛋白质与固定相表面的金属离子活性位点配位,从而形成单分子吸附。另外,从Langmuir拟合,计算出Lys、CytC和αChy的最大吸附量分别为20.0 mg/g, 13.5 mg/g和17.9 mg/g。
3.4 混合蛋白质中Lys的分离提纯
图5为混合蛋白质纯化前后的SDSPAGE凝胶电泳图。与混合标准蛋白质电泳带(泳道2)相比,当蛋白质被吸附后,上清液中仅包含BSA、OVA和Myo,不存在Lys,说明Lys被完全吸附。淋洗液中无蛋白条带,但在洗脱液中只有Lys条带,说明氨基双四唑型吸附剂能从混合蛋白质中选择性萃取出Lys。吸附剂对其它3种蛋白质均有吸附作用,但是对Lys的吸附作用更强,所以当它们混合后,Lys优先占据了吸附剂上的活性位点,其它蛋白质保留在上清液中。因此,吸附剂在蛋白质分离纯化具有选择性。
4 结 论
设计和制备了一种氨基双四唑型金属螯合磁性纳米粒子吸附剂,并用XPS和Zeta电位对其结构进行表征。以pH效应和盐效应验证了螯合金属Cu的吸附剂对蛋白质的吸附符合金属螯合吸附机理。用吸附剂对混合蛋白质样品进行萃取分离,证明了此吸附剂对蛋白质具有选择性吸附能力,说明此吸附剂在蛋白质分离领域具有一定的应用价值。
References
1 CHEN Bo, LIU Chang, ZHAO XueSong, PAN XueJun. Chinese J. Anal. Chem., 2016, 44(2): 205-211
陈 波,刘 旸,赵雪松,潘学军. 分析化学, 2016, 44(2): 205-211
2 Pfaunmiller E L, Paulemond M L, Dupper C M, Hage D S. Anal. Bioanal. Chem., 2013, 405(7): 2133-2145
3 Chaouk H, Hearn M T W. J. Chromatogr. A, 1999, 852(1): 105-115
4 GabercPorekar V, Menart V. J. Biochem. Biophys. Methods, 2001, 49(13): 335-360
5 Yao X P, Fu Z J, Zhao Y G, Wang L, Fang L Y, Shen H Y. Talanta, 2012, 97: 124-130
6 Mooney J T, Fredericks D, Hearn M T W. J. Chromatogr. A, 2011, 1218(1): 92-99
7 Petzold M, Coghlan C J, Hearn M T W. J. Chromatogr. A, 2014, 1351: 61-69
8 Lei G H, Xiong X H, Wei Y M, Zheng X H, Zheng J B. J. Chromatogr. A, 2008, 1187: 197-204
9 CHEN YouNing, GAO Li, HE MaoFang, WEI YinMao. Chem. J. Chinese Universities, 2014, 35(7): 1596-1602
陈佑宁,高莉,贺茂芳,卫引茂. 高等学校化学学报, 2014, 35(7): 1596-1602
10 Liu J, Sun Z K, Deng Y H, Zou Y, Li C Y, Guo X H, Xiong L Q, Gao Y, Li F Y, Zhao D Y. Angew. Chem. Int. Ed., 2009, 48(32): 5875-5879
11 Chen H, Deng C H, Zhang X M. Angew. Chem. Int. Ed., 2010, 49(3): 607-611
12 Kaminker R, Motiei L, Gulino A, Fragala I, Shimon L J W, Evmenenko G, Dutta P, Iron M A, Boom M E. J. Am. Ceram. Soc., 2010, 132(41): 14554-14561
13 LI Rong, DI ZeMei, CHEN GuoLiang. Chinese J. Anal. Chem., 2002, 30(5): 552-555
李 蓉, 邸泽梅, 陈国亮. 分析化学, 2002, 30(5): 552-555
14 Anspach F B. J. Chromatogr. A, 1994, 676(2): 249-266
Abstract A bis(5methyltetrazolium)aminebonded magnetic nanoparticle adsorbent was prepared by chemically modifying magnetic nanoparticles Fe3O4@SiO2 via four steps chemical reactions. The physical properties of the adsorbent were characterized by Xray photoelectron spectroscopy (XPS) and Zeta potential. The static adsorption behavior of lysozyme, cytochrome C and chymotrypsin on the chelated Cu adsorbent, as well as the influences of the pH value of solution, ion strength and initial protein concentration on the adsorption capacity were evaluated with batch method. The results illustrated that the adsorption of protein proceeded via metal coordination mechanism and was also in accordance with Langmuir adsorption model, and the maximum adsorption capacities of lysozyme, cytochrome C and chymotrypsin were calculated to be 20.0 mg/g, 13.5 mg/g, and 17.9 mg/g, respectively. In addition, the chelated Cu adsorbent was employed to adsorb protein mixture, showing that this new type of adsorbent had selective adsorption to protein mixture. These results illustrated that the metalchelated adsorbent had potential application value in selectively separating and enriching proteins.
Keywords Magnetic separation; Immobilized metal ion affinity; Adsorbent; Protein
- 初语古典诗词教学艺术探微
- 多元智能理论与文言文教学
- 劈柴须照纹 轻松又省时
- 寻找活水 抒写真我
- 环环相扣的叙事 精彩纷呈的描写
- 浅谈高中议论文写作中论据的提炼
- 欲扬先抑兴味多
- 一见钟情的文章开头技法
- 作文的审题要注意背景性词语
- “感动中国“体,让学生思想与文采共飞扬
- 语文自主创新阅读教学模式初探
- 阅读教学要引导学生实现“三个转变”
- 授予学生语文个性化阅读的自主权
- “昔我往矣,杨柳依依”何以有名
- 在朗读教学中感受标点符号的魅力
- 提高高中生演讲能力训练尝试
- 移情于物 抒写真我性灵
- 也谈如何提高学生的作文水平
- 新材料作文,莫让材料成摆设
- 细节处显工夫 微小里见真情
- 谈新材料作文中的“隐性话题”
- 煽情让写作更多情
- 零落中寻求统一
- 阅读教学应向“学语习文”回归
- 加强阅读积累培养学生能力
- bannering
- bannerless
- bannerlike
- banner-line
- banner-lines
- banners
- bannertowing
- banner towing
- banning
- bannister
- bannisters
- banquet
- banqueted
- banqueteer
- banqueteers
- banqueter
- banqueters
- banquetings
- banquets
- bans
- deallocations
- dealmaker
- dealmaking
- deal-off
- deal-out
- 新张
- 新张大吉
- 新德里
- 新思想之输入,即新言语输入之意味
- 新思潮派
- 新恨
- 新愁
- 新愁旧恨
- 新愁旧憾
- 新愁旧憾旧怨新愁
- 新意
- 新感觉派
- 新战士打靶
- 新户纳祥
- 新房
- 新手
- 新手刚显露才能
- 新扎
- 新打剪刀——难开口
- 新打的剪刀
- 新打的剪刀——难开口
- 新打的茅房还有三天香
- 新技巧派
- 新技术产业
- 新技术革命