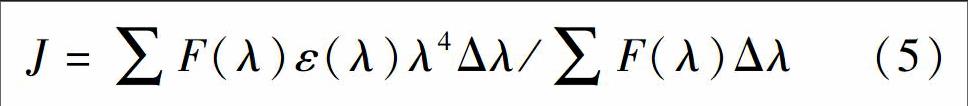
摘 要 在不同温度及模拟血液pH值条件下,采用荧光光谱法和紫外可见吸收光谱法研究了哈巴俄苷(Harpagoside, HAR)与人血清白蛋白(Human serum albumin, HSA)的结合反应。结果表明,HAR有规律地使HSA内源荧光猝灭,猝灭常数随温度升高而降低,其猝灭机制为两者形成复合物而引起的的静态猝灭; 不同条件下两者结合常数KA均大于105 L/mol,结合位点数n≈1。由Van′t Hoff方程计算获得了不同条件下HAR与HSA相互作用的热力学参数,由ΔG、ΔH和ΔS均小于0可知,两者结合的主要作用力是氢键和范德华力,且两者结合是吉布斯自由能降低的自发过程。根据Frster非辐射转移理论计,计算了不同条件下HAR与HSA的结合距离r在4.01~4.28 nm范围内,表明两者结合过程发生了非辐射能量转移。同步荧光光谱表征结果表明,HAR使HSA的色氨酸和酪氨酸残基所处的微环境极性增强,疏水性减弱,导致HSA构象发生了一定程度的改变。
关键词 玄参; 哈巴俄苷; 人血清白蛋白; 荧光猝灭; 结合反应
1 引 言
中药活性成分是中药防治疾病的物质基础。从细胞和分子水平研究中药及其有效成分的作用机理,对中药的深入研究与开发具有重要意义。药物与生物大分子的相互作用研究,一直是药理学、药物化学、分子生物学等领域关注的热点问题。现阶段,在药物与蛋白质相互作用研究方面,主要针对它们之间的结合部位、作用力、结合位点数、热力学常数,以及由此引起的蛋白质构型变化等方面[1,2]。人血清白蛋白(Human serum albumin, HSA)是血浆中含量最丰富的蛋白质,具有维持内生理环境相对稳定作用,可与药物小分子结合,并将其运输至身体的各个部位,是药物发挥药效和生理功能的重要载体和靶分子。应用多种光谱法获得中药有效成分与HSA相互作用的各种数据,进而分析两者之间相互作用机理,对于揭示中药药理活性、进行药物分子设计和开发及药物的临床应用等具有重要的指导意义[1~5]。
中药玄参为玄参科(Scrophulariaceae)玄参属(Scrophularia)植物玄参(Scrophularia ningpoensis Hemsl.)的干燥根,具有清热凉血、滋阴降火、解毒散结之功效[6~9]。哈巴俄苷(Harpagoside, HAR)为环烯醚萜类化合物,是玄参中的主要化学成分和药理活性成分之一,现代药理学研究表明,HAR苷具有抗炎、镇痛、抗血小板聚集、保护血管内皮层细胞、保护神经元及提高免疫力等作用[10~14]。目前,关于HAR与HSA的结合反应研究未见报道。因此,本研究以HSA为模型蛋白,利用荧光光谱法和紫外可见吸收光谱法研究HAR与HSA的结合作用机制,获取了两者相互作用的结合参数、结合位点数、作用力类型以及HAR对HSA构象的影响。
2 实验部分
2.1 仪器与试剂
F4500荧光光度计、UV4010紫外可见分光光度计(日本日立公司); HH2数显恒温水浴锅(上海江星仪器有限公司); UPTII10T优普超纯水器(四川优普超纯科技有限公司); PHS3C pH计(上海康仪仪器有限公司); Eppendorf移液器(德国Eppendorf公司)。
哈巴俄苷(本实验室从玄参中分离得到,NMR鉴定结构,HPLC鉴定纯度>98%)用50%乙醇配制成1.0 × 103 mol/L储备液,于4.0℃暗处保存,用时逐级稀释至所需浓度; 人血清白蛋白(0.2 g/mL,批号为201511052,华兰生物工程重庆有限公司),用0.05 mol/L 缓冲溶液TrisHCl(pH 7.40)配制成2.0×105 mol/L的储备液4.0℃暗处保存,用时稀释至所需浓度; 0.05 mol/L的TrisHCl缓冲溶液(pH=7.40)和0.04 mol/L BrittonRobinson缓冲溶液(BR,用0.2 mol/L NaOH调节至pH 4.0, 7.0和9.0); 乙醇、三羟甲基氨基甲烷、乙酸、硼酸等试剂均为分析纯; 实验用水为超纯水。
2.2 实验方法
荧光光谱和同步荧光光谱:在10 mL定量比色管中加入1.0 mL缓冲溶液、2.0 mL 2.0 × 106 mol/L HSA、适量HAR,使HAR浓度分别为4.0\, 6.0\, 15\, 30\, 40\, 50\, 60\, 70和80 μmol/L,用去离子水定容后,在24℃、37℃和50℃下恒温水浴2 h(整个体系保持NaCl浓度为0.9%,以维持生理条件下的离子强度)。固定激发波长λex=280 nm,激发和发射狭缝均为5 nm,用1 cm石英比色皿在280~500 nm范围内扫描HSA及HSAHAR体系的荧光光谱[15]。固定Δλ=60 nm和15 nm(Δλ=λem-λex),记录HAR与HSA相互作用的同步荧光光谱; 在240~500 nm范围内的扫描HAR与HSA相互作用的紫外光谱[15]。
紫外吸收光谱:在10 mL定量比色管中加入1.0 mL缓冲溶液、2.0 mL 20 μmol/L的HSA和HAR,用去离子水定容后,在24℃、37℃和50℃下水浴恒温2 h。以相应溶液的空白为参比,在紫外可见分光光度计上,记录HASHAR体系在250~500 nm范围内的紫外吸收光谱(1 cm的石英比色池)。
3 结果与讨论
3.1 荧光猝灭机制及猝灭常数
许多分子能通过与荧光物质相互作用(如激发态反应、分子重排、能量转移、形成基态复合物及碰撞猝灭等)而使其荧光强度下降的现象,称为荧光猝灭[16,17]。HSA的内源荧光主要来源于色氨酸残基,当小分子与HSA结合,会使色氨酸残基的微环境发生改变而使其荧光强度发生改变[15]。在HSA溶液中,随着HAR不斷加入,其浓度不断增大,同时HSA的荧光强度逐渐降低(图1),表明HAR可以有效猝灭HSA的内源荧光。
静态猝灭和动态猝灭。静态猝灭主要是由于猝灭剂分子和荧光物质发生结合作用,形成了复合物而导致淬灭; 动态猝灭主要是由于热运动和分子碰撞引起的。不同猝灭机制可以根据温度对结合常数的影响及测定荧光寿命的方法区别[16,18]。
判断体系的荧光猝灭机制,可对猝灭过程的实验结果,按照SternVolmer方程[16]进行处理。
根据SternVolmer方程,用F0/F对[Q]作图(SternVolmer曲线),呈一条直线(图2),通过该直线的斜率可计算得到动态猝灭常数Ksv。在不同温度和pH值条件下,根据SternVolmer曲线计算得到HAR对HSA的荧光猝灭常数(表1)。
通常,对于静态猝灭,猝灭常数Ksv随温度的升高而减小; 而对于动态猝灭,猝灭常数Ksv随温度的升高而增大[19,20]。根据实验数据所得计算结果(表1),HAR与HSA结合反应的动态猝灭常数Ksv随着温度的升高而减小,表明HAR对HSA的荧光猝灭机制为静态猝灭。通常情况下,小分子猝灭剂对生物大分子的最大碰撞猝灭速率常数的阈值为2.0×1010 L/mol·s,如果计算所得的猝灭速率常数小于此阈值,表明为动态猝灭机理; 若猝灭速率常数大于此阈值,则猝灭过程可能包含了静态猝灭过程[18]。由计算所得的数据(表1)可知,在不同条件下,HAR对HSA的荧光猝灭速率常数Kq值均远大于最大碰撞猝灭速率常数的阈值,进一步说明了HAR对HSA的荧光猝灭机制为静态猝灭。根据以上分析,HAR对HSA的荧光猝灭过程主要是由两者之间结合形成复合物而引起的静态猝灭。
3.2 结合常数和结合位点数
HAR对HSA的荧光猝灭机理主要为静态猝灭。对于静态猝灭过程,假设化学小分子Q在蛋白质分子上有n个独立且等同的结合位点,小分子化合物与蛋白质大分子相互作用的结合常数KA及结合为点数n,可采用Scatchard方法,由公式(2)求出[20,21]。
lg[(F0-F)/F]=lgKA + nlg[Q](2)
以lg[(F0-F)/F]为纵坐标,lg[Q]为横坐标作图,根据双对数曲线的斜率和截距可以得到HAR与HSA相互作用的结合常数KA及结合位点数n。
在不同实验条件下,HAR与HSA按照静态猝灭形成复合物模型,通过实验数据得到双对数曲线(图3)均呈良好的线性关系(线性回归系数>0.99)。根据双对数曲线计算得到HAR与HSA相互作用的结合常数KA在1.20 × 105~2.98 × 106 L/mol之间,表明两者之间有较强的结合作用; 结合位点数n在1.09~1.44之间,数值接近于1,表明两者可能形成一个结合位点(表2)。在不同温度和pH值条件下,HAR与HSA相互作用的结合常数存在一定差异,说明体系的温度和pH值对HAR与HSA的结合反应有影响。
3.3 相互作用的热力学参数和主要作用力
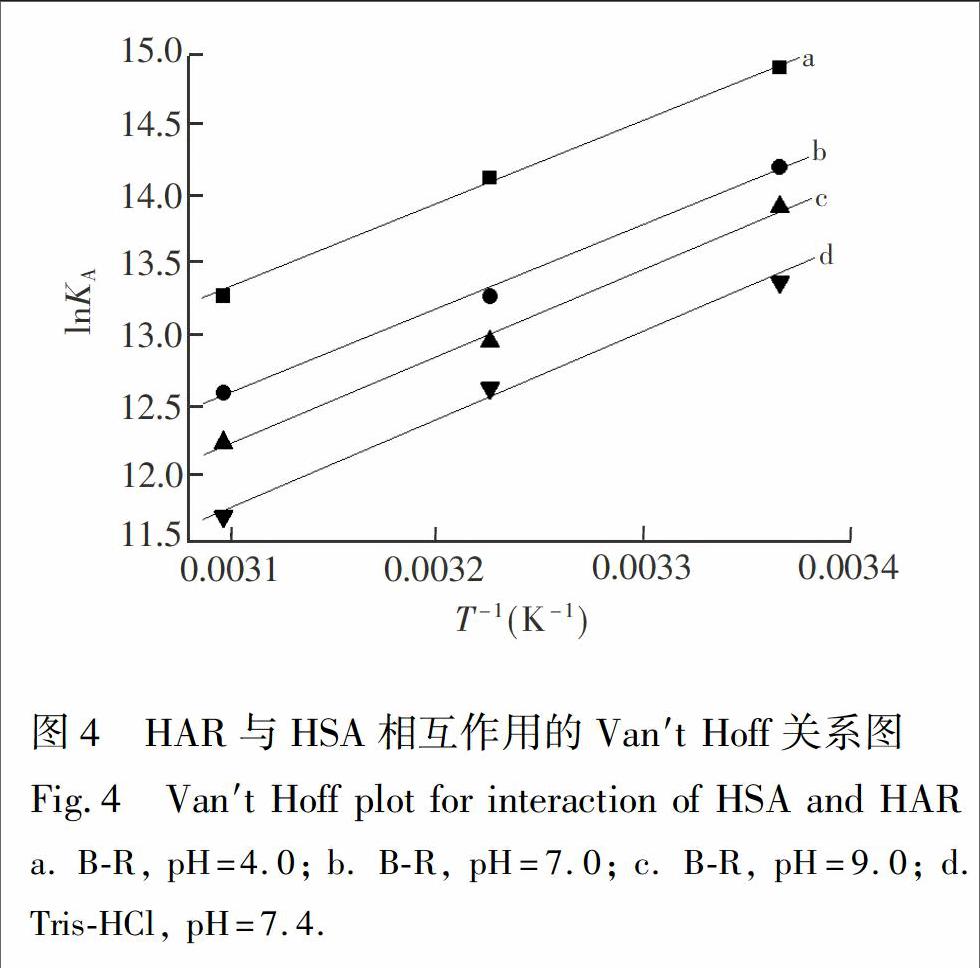
化合物(包括药物小分子)与蛋白质等生物大分子之间常借助氢键、静电引力、范德华力和疏水作用力等非共价结合形成超分子复合物。不同化合物与蛋白质结合的作用力类型不同,根据热力学常数的符号与大小判断作用力类型[4,22]。ΔG(自由能变)、ΔH(焓变)和ΔS(熵变)可通过Van′t Hoff方程[23]进行计算:
其中,KA为对应温度下的结合常数,R为摩尔气体常数,以lnKA对1/T作图(图4),由斜率和截距分别可以求出焓变ΔH和熵变ΔS,再由公式(4)可计算出不同条件下反应的吉布斯自由能变ΔG。 从热力学角度看,在一定温度和压力下,化合物与蛋白质结合反应能否自发进行取决于体系的吉布斯自由能变ΔG,ΔG<0,有利于反应自发进行。根据反应前后热力学焓变ΔH和熵变ΔS的相对大小,判断化学小分子与生物大分子之间的主要作用力类型的规律:当ΔH>0、ΔS>0时, 为疏水作用力; 当ΔH<0、ΔS>0时,为静电作用力; 当ΔH<0、ΔS<0时,为氢键和范德华力[24]。通过实验数据计算了不同条件下HAR与HSA结合反应的热力学常数(表2),结果表明:不同条件下HAR与HSA结合反应的自由能变ΔG均小于0,表明两者结合过程是自发进行的; 热力学焓变ΔH和熵HSA结合过程中氢键和范德华力是主要相互作用力。
3.4 结合距离
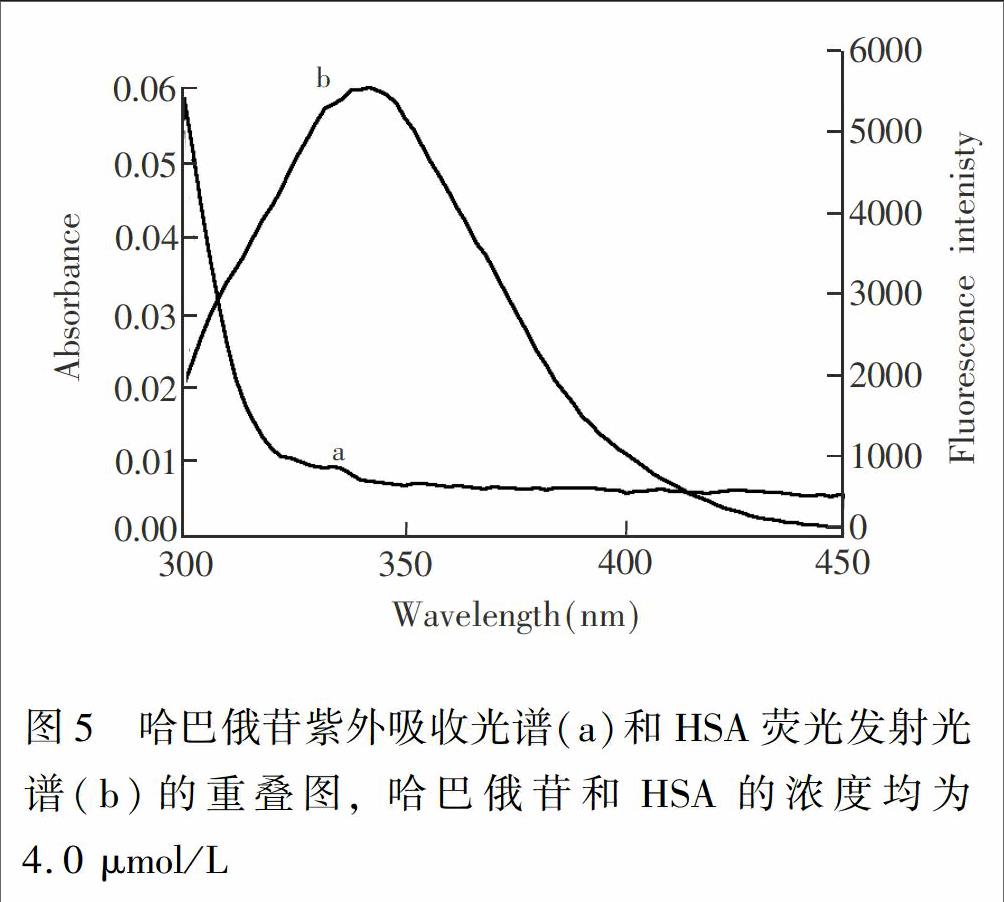
HSA有较强的荧光,且与HAR的吸收光谱有较大的重叠,作为给体(HSA)的荧光光谱和作为受体(HAR)的吸收光谱的重叠,可以说明两者有一定程度的能量转移。根据Frster非辐射能量转移理论,当HAR在HSA上的结合位点与色氨酸的距离小于7 nm时,将发生非辐射能量转移[4~5]。HSA荧光发射光谱与HAR吸收光谱间的光谱重叠(见图5)积分J可由式(5)求得[23]:
其中, F(λ)为HSA在波长λ处的荧光强度, ε(λ)则为HAR在波长λ处的摩尔消光系数,J为重叠面积。
能量转移效率E与HSAHAR结合距离r及临界能量转移距离R0有关,可由以下公式求得[21~23]:
其中, R0是指能量转移效率E=50%时的临界距离, K2为偶极空间取向因子(取值2/3), N为介质的折射指数(取值1.336), Φ为给体的光量子效率(取值0.118)。
依据公式(5)求得HAR紫外吸收光谱与HSA荧光发射光谱的重叠的积分J,再根据式(6)和(7)计算得HAR与HSA结合反应的R0,E、和r(表3)。结果表明,HAR与HSA反应的结合距离r为4.08~4.29 nm, 小于7 nm,且符合了0.5R0
荧光光谱其最大发射波长的偏移与蛋白质氨基酸残基周围的微环境有关,同步荧光光谱可以提供关于蛋白质构象改变的信息。对于蛋白质的同步荧光光谱,Δλ=15 nm时只表现酪氨酸残基的荧光; Δλ=60 nm时仅表现色氨酸残基的荧光[19,24]。
固定HSA的量,随着HAR浓度增大,酪氨酸和色氨酸残基的同步荧光强度均发生明显的猝灭(图6)。随HAR浓度增大,色氨酸残基的发射峰波长有明显的红移,而酪氨酸残基的发射峰波长在HAR浓度较高时有红移现象,说明HAR的加入使HSA的构象发生了一定程度的改变,可能使色氨酸和酪氨酸残基所处的微环境极性增强,疏水性减弱。
4 结 论
本研究采用荧光光谱结合紫外可见吸收光谱,在不同pH值和温度条件下,研究了HAR与HSA的相互作用,获得了两者结合反应的荧光猝灭机制、结合常数、结合位点数、结合距离、作用力类型、构象变化等相关信息。结果表明,HAR对HSA的主要荧光猝灭机制为两者形成复合物而引起的静态猝灭,结合位点数为1,氢键和范德华力是两者结合的主要相互作用力,两者相互作用存在非辐射能量转移,HAR使HSA的络氨酸和色氨酸殘基周围的微环境发生了一定改变。HAR与HSA有较强的结合常数,说明HAR能够通过HSA被运输到各个靶器官,进而产生药理功效。
- 龙血树
- 田野上的阅兵式
- 读书改变人生
- 小树的愿望
- 怎样把心理活动写具体
- 填成语
- 伟人
- 问号的自画像
- 乡村的早晨
- 克伦威尔
- 可爱的笨鸟
- 狡猾的串供
- 会学比学会重要
- 无心插柳柳成荫,无意作诗诗成行
- 片段也精彩
- 花开的声音
- 九峰山之旅
- 如果我能变小
- 乡间骑车乐
- 美丽的花坛
- 多变的夏天
- 老师,我想对您说
- 牵牛花与篱笆
- 抢电脑大战
- 我最熟悉的一个人
- victimage
- victimhood
- victimhoods
- victimise
- victimised
- victimises
- victimising
- victimization
- victimizations
- victimize
- victimized
- victimizers
- victimizer, victimiser
- victimizes
- victimizing
- victims
- victor
- victoress
- victorian
- victorianist
- victorianly
- victorians
- victories
- victorious
- victoriously
- 一领大衣
- 一颗一粒的粮食
- 一颗心吊在嗓子眼上
- 一颗心悬在半天云里
- 一颗心放进肚子里
- 一颗明珠土里埋——早晚得出头
- 一颗星,保夜晴
- 一颗红心
- 一颗老鼠屎,败坏一锅汤
- 一颗豆
- 一颗赤诚的心
- 一颗针两头是尖,不能缝衣;一个人三心二意,一事无成
- 一颗钉子能救一个马掌,一个马掌能救一匹马
- 一颗麦子一道缝,一个人儿一个性
- 一颗黄豆磨不成浆
- 一颠一颠地跑
- 一颠一颠地跑,奔忙
- 一颦一笑
- 一风吹
- 一飞冲天
- 一食万钱
- 一食三起
- 一食十八种
- 一飡之德
- 一餐