
摘 要 建立了气泡微萃取结合气相色谱/质谱技术(GCMS)测定尿中咖啡因的方法。对影响萃取效率的实验条件进行了优化,确定了最佳萃取条件:三氯甲烷作为萃取溶剂,萃取溶剂暴露体积1 μL,气泡体积1.6 μL,搅拌速度300 r/min,萃取时间5 min,盐度15%(m/V),气泡与磁子间距离1 cm。在优化条件下,所建立方法在咖啡因浓度0.005~10 mg/L范围内有较好的线性关系,相关系数可达0.986,检出限为0.003 mg/L。在人尿液中添加不同浓度的咖啡因(0.050、0.500和5.000 mg/L),回收率为89.2%~107.5%,相对标准偏差小于8%(n=6)。
关键词 气泡微萃取; 咖啡因; 气相色谱/质谱; 尿
1 引 言
咖啡因(Caffeine)是一种嘌呤类生物碱,即1,3,7三甲基黄嘌呤,属中枢神经系统兴奋剂,适量摄入能够缓解疲劳、振奋精神、提高注意力[1,2,],被广泛用作食品添加剂[3]。同时,咖啡因也是一种毒品,不当使用会造成上瘾、神经过敏和睡眠紊乱等不良反应,严重者甚至会导致中毒或死亡[4~7]。因此,对人体检材中咖啡因的测定具有非常重要的意义。由于人体检材基体复杂,在进行仪器分析前需对其进行适当前处理,但以液液萃取、固相萃取为代表的传统样品前处理技术存在操作步骤繁琐、耗时耗力、要消耗大量对人体和环境有毒有害的有机溶剂等缺点[8,9],因此,亟待开发绿色高效的新型样品前处理技术。
近年发展起来的气泡微萃取技术(BIDSDME)采用向萃取溶剂微滴中引入适量空气的手段,在置于样品溶液中的微量注射器针尖形成气泡,萃取一定时间后,将气泡抽回到微量注射器中, 完成萃取过程。该技术不仅保留了单滴液相微萃取的简便快速、成本低廉、对环境友好等优点[10,11],而且还具有萃取溶剂微滴表面积更大、使比重大的萃取溶剂(如二氯甲烷、三氯甲烷等)微滴在萃取过程中更加稳定等优点,目前,已被成功用于对水样、土壤、牛尿等样品中的农药、除草剂和雌激素等目标分析物的萃取[12~15]。
此前,Shrivas等將0.5 μL三氯甲烷暴露于7 μL微量样品中,完成了对咖啡因的萃取分离[16]。该方法虽有所需样品量少、无基质效应等优点,但受萃取溶剂量少和萃取过程只能在无搅拌条件下进行等因素限制,其萃取效率还比较低。受此启发,本研究将暴露于样品溶液的萃取溶剂体积增至1 μL,并向其中引入了0.6 μL空气,通过优化搅拌速度、萃取时间和盐度等实验参数,结合GC/MS,建立了测定尿中咖啡因的BIDSDMEGC/MS分析方法。
2 实验部分
2.1 仪器与试剂
6890/5975气相色谱/质谱联用仪(美国Agilent公司),HP5毛细管色谱柱(30 m×0.32 mm × 0.50 μm, 美国Agilent公司); WH220 plus磁力搅拌器(德国Wiggens公司); MettlerAE 163十万分之一分析天平; 微量注射器(5 μL,美国Agilent公司); MilliQ Element纯水机(美国Millipore公司)。
咖啡因标准品(纯度为97%,北京世纪奥科生物技术有限公司); 二氯甲烷、三氯甲烷、四氯化碳、甲苯、乙酸乙酯、正己烷和环己烷(分析纯,天津利安隆博华医药化学有限公司); 咖啡粉(1+2原味)购于当地超市。
2.2 样品预处理
自愿者在实验前36 h内未摄入任何含咖啡因的饮料或食品。将15 g咖啡粉用150 mL开水冲泡,凉温后由自愿者饮用,采集自愿者饮用咖啡前所排尿液作为空白,采集饮用咖啡后1~24 h内所排尿液作为待测样品。代谢咖啡因测定于尿样采集后1 h内完成。测定过程中向待测尿液加入适量NaCl,使其盐度保持在15%(m/V),尿样的初始盐度参照标准方法进行测定[17]。
具体萃取过程: 取1 mL尿样于盛有磁子的具塞小瓶中,用微量注射器吸入1.1 μL有机溶剂,再吸入0.6 μL空气,用微量注射器刺穿瓶塞,伸入尿样液面以下,缓慢推出空气和1 μL有机溶剂(保留在微量注射器金属针管中的0.1 μL有机溶剂用于提高对气泡的固定作用), 在注射器针尖形成气泡,以300 r/min转速萃取5 min后,停止搅拌,仔细将整个气泡抽回微量注射器后,直接向GC/MS进样。BIDSDME萃取装置为自行搭建,其结构如图1 所示。
2.3 仪器工作参数
2.3.1 气相色谱条件 HP5毛细管色谱柱,柱温保持在200℃,每次信号采集时间为5 min; 进样口温度为250℃; 采用分流进样模式,分流比为10∶1; 载气为高纯(纯度≥99. 999%)氦气,流量为1.3 mL/min。
2.3.2 质谱条件 离子源为电子轰击离子(EI)源,电子轰击能量为70 eV,离子源温度为230℃,传输线温度为150℃,采用全扫描(SCAN)模式; 相对保留时间4.67 min,根据碎片离子峰的相对强度大小,选取离子m/z 194,109和 82对目标分析物进行定性[22]; 溶剂延迟时间为3 min。
2.4 标准溶液的配制
咖啡因标准储备液:准确称取咖啡因10.00 mg,用甲醇溶解并定容至10 mL,配制成1 mg/mL的溶液作为标准储备液,4℃避光保存。
咖啡因工作溶液:吸取适量的标准储备液于10 mL容量瓶中,用去离子水定容, 使其质量浓度分别为0.005、0.010、0.050、0.100、0.500、1.00、5.00和10.00 mg/L。
3 结果与讨论
3.1 萃取条件的优化
3.1.1 萃取溶剂的选择 萃取溶剂的选取对萃取效率具有重要影响。萃取溶剂须满足:(1)不溶或难溶于样品溶液; (2)对目标分析物具有很好的选择性,并尽可能少的萃取样品基体成分; (3)密度适宜,使得萃取微滴在样品中所受重力和浮力的合力尽可能小,从而保证在萃取过程中微滴不易从针尖易位或脱落等条件[14,18]。根据以上原则,考察了二氯甲烷、三氯甲烷、四氯化碳、甲苯、乙酸乙酯、正己烷和环己烷7种有机溶剂对水样中咖啡因的萃取能力,结果表明,三氯甲烷的萃取效率最好。因此选取三氯甲烷作为萃取溶剂。
3.1.2 气泡体积的选择 气泡体积为吸入的有机溶剂和空气的体积之和。由萃取溶剂和所引入空气体积共同决定,对萃取效率有显著影响。首先考察了三氯甲烷暴露体积(0.5、1.0、1.5、2.0、2.5和3.0 μL)对萃取效率的影响。由图2可见,萃取效率随着三氯甲烷暴露体积的增加而提高,但当体积超过1 μL时, 引入空气会导致气泡易位甚至掉落,因此选取三氯甲烷暴露体积为1 μL。其次,考察了引入空气体积(0、0.2、0.4、0.6、0.8和1.0 μL)对萃取效率的影响。由图3可见,随着引入空气体积的增加,萃取效率和精密度在逐渐提高,当引入空气体积增至0.6 μL时,萃取效率和精密度达到了最佳,而后随气泡体积的增大而下降。因此,选取引入空气体积为0.6 μL,最终确定气泡体积为1.6 μL。
3.1.3 搅拌速度的选择 提高搅拌速度可以有效增大传质速率,从而进一步提高萃取效率,但搅拌速度过高会损害气泡的稳定性。考察了不同搅拌速度(0、100、150、200、250、300、350、400、450和500 r/min)对萃取效率的影响,结果表明,随着转速增加,萃取效率不断提高,但当转速超过300 r/min时,易造成气泡偏离针尖, 甚至掉落,因此,选取转速为300 r/min。
3.1.4 萃取时间的选择 萃取时间也是影响萃取效率的重要参数。考察了萃取时间(1, 5, 10, 15, 20, 25和30 min)对萃取效率的影响。由图4可见,在15 min内,随着萃取时间延长,萃取效率也在逐渐提高,但当萃取时间超过15min时,萃取效率会明显下降,原因可能是三氯甲烷具有挥发性和部分水溶性,萃取时间过长,导致三氯甲烷的挥发和/或溶解损失。另外,在分析尿样过程中发现,当萃取时间超过6 min时,气泡在被抽回的过程中有少量掉落,因此选取萃取时间为5 min。
3.1.5 pH值和盐度的选择 pH值会影响某些目标物分子在样品溶液中的存在形式,因而会通过改变目标分子在水相和有机相间的分配比,因而會通过改变目标分子在水相和有机相之间的分配比来影响萃取效率。本研究采用1 mol/L HCl和1 mol/L NaOH对咖啡因标准液pH值进行调控,考察了pH值对萃取效率的影响。结果表明,在pH 2~7范围内,萃取效率随pH值增加而明显提高。原因是咖啡因属于弱碱性化合物,在酸性条件下,其主要以离子形式存在,在水相中的溶解度较大; 随着pH值增加,咖啡因主要以分子形式存在,在有机相/水相间的分配比会增大所致[19]。为了尽量保证样品的原始状态和减少操作步骤,本研究未对pH值进行调控。
利用盐析效应可以降低目标物在样品溶液中的溶解度,进而提高萃取效率。在静态(无搅拌条件下)和动态(搅拌条件下)两种模式下,考察了NaCl含量(m/V)对萃取效率的影响。由图5可见,采用动态模式有利于提高萃取效率,并且在静态模式下,增加盐度对萃取效率有抑制作用,该现象与文献[16]报道结果完全一致。在动态模式下,起初萃取效率随着盐度增加而提高,当盐度增至15%时,萃取效率达到了最佳,随后萃取效率下降。出现以上现象的原因可能是,盐的存在不仅可提高咖啡因在有机相和水相间的分配比,同时大量盐的阴阳离子还会抑制咖啡因在水相中的自由扩散,在静态模式下,第二种效果起了主导作用; 在动态模式下,当盐度较低时,第一种效果起主导作用,而当盐度较高时,则第二种效果起了主导作用。为了获取最佳萃取效率,本研究选取盐度为15%。
3.1.6 气泡与磁子间距离的选择 在实际萃取过程中,气泡与磁子间距离的变化也会影响萃取效率,距离越小,样品液体搅动越剧烈,萃取效率也越高,但同时气泡受到的扰动也越加严重。通过考察不同距离时的萃取效率发现,气泡与磁子间距离d=1 cm时萃取效果最佳。 综上所述,选择三氯甲烷为萃取溶剂,萃取溶剂暴露体积1 μL,气泡体积为1.6 μL,转速300 r/min,萃取时间5 min,盐度15% (m/V),气泡与磁子间的距离1 cm作为最佳的萃取条件,用于后续实验。
3.2 检出限、线性范围、加标回收率及富集倍数
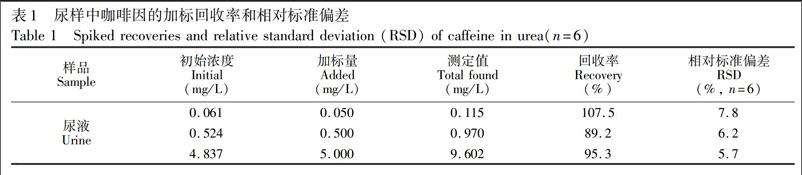
配制不同浓度的咖啡因标准溶液,在上述最佳条件下进行萃取实验,检出限按信噪比等于3进行计算,分别以总离子流峰面积y对为质量浓度x(mg/L)做工作曲线。本方法检出限为0.003 mg/L,线性范围为0.005~10 mg/L,其线性方程为y=1213x+875,r=0.982。向尿样中添加不同浓度的咖啡因标准,使其理论浓度分别为0.050、0.500和5.000 mg/L,利用本方法测得平均回收率为89.2%~107.5%,相对标准偏差(RSD, n=6)为5.7%~7.8%(结果见表1),说明本方法精密度和准确度均比较好,并且不存在基质效应。对含0.1 mg/L咖啡因的水样进行测定,计算出富集倍数为37。
3.3 实际尿样分析
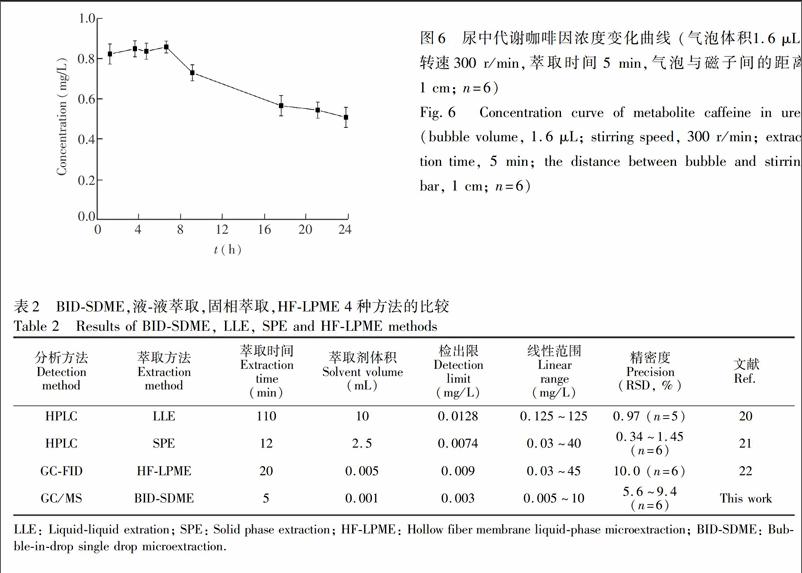
利用本方法对尿中咖啡因24 h内的代谢浓度进行了分析(图6),结果表明,自愿者第一次排尿(1.2 h)中的咖啡因浓度为0.821 mg/L,并且在7 h内基本保持恒定,此后尿中咖啡因浓度逐渐降至0.506 mg/L,说明本方法完全可用于对尿样中咖啡因的测定。
3.4 液泡微萃取与其它方法的比较
将本研究方法与液液萃取(LLE)、固相萃取(SPE)和中空纤维保护的液相微萃取(HFLPME)方法进行了比较。由表2可知,本方法所需萃取溶剂体积仅为HFLPME的1/5,远少于LLE和SPE,萃取时间明显短于其它方法。
本方法通过向萃取溶剂微滴引入空气形成气泡,增大了溶剂微滴的表面积,提高了目标分析物的传质速率,从而获得了较高的方法灵敏度; 同时,还增大了萃取溶剂微滴在尿样中所受浮力,降低了自身重力的影响,从而提高了微滴在萃取过程中的稳定性,使其在搅拌条件下能够顺利完成对咖啡因的萃取和富集。本方法可在10 min内完成对尿样中咖啡因的分析,与传统液液萃取法相比,具有快速、灵敏、准确、对环境友好等优点[20~22],具有很好的应用前景。
References
1 Ataka S, Tanaka M, Nozaki S, Mizuma H, Mizuno K, Tahara T, Sugino T, Shirai T, Kajimoto Y, Kuratsune H, Kajimoto O, Watanabe Y. Nutrition, 2008, 24(3): 233-238
2 Maridakis V, O′Connor P J, Tomporowski P D. Int. J. Neurosci., 2009, 119(8): 1239-1258
3 AlOthman Z A, Aqel A, Alharbi M K E, BadjahHadjAhmed A Y, AlWarthan A A. Food Chem., 2012, 132(4): 2217-2223
4 Bonsignore A, Sblano S, Pozzi F, Ventura F, Dell′Erba A, Palmiere C. Forensic Sci. Med. Pathol., 2014, 10(3): 448-451
5 Holmgren P, NordénPettersson L, Ahlner J. Forensic Sci. Int., 2004, 139(1): 71-73
6 Riesselmann B, Rosenbaum F, Roscher S, Schneider V. Forensic Sci. Int., 1999, 103(S1): S49-S52
7 Kerrigan S, Lindsey T. Forensic Sci. Int., 2005, 153(1): 67-69
8 Song A Y. Anal.Sci., 2016, 32(6): 645-652
9 ZHANG HaiXia, ZHU PengLing. Chinese J. Anal. Chem., 2000, 28(9): 1172-1180
張海霞, 朱彭龄. 分析化学, 2000, 28(9): 1172-1180
10 George M J, Marjanovic L, Williams D B G. Talanta, 2015, 144: 445-450
11 Williams D B G, George M J, Meyer R, Marjanovic L. Anal.Chem., 2011, 83: 6713-6716
12 George M J. Int. J. Environ. An. Ch., 2016, 96 (3): 247-256
13 Xie H Y, Yan J, Jahan S, Zhong R, Fan L Y, Xiao H, Jin X Q, Cao C X. Analyst, 2014, 139: 2545-2550
14 George M J S. Afr. J. Chem., 2014, 67: 56-60
15 Williams D B G, George M J, Marjanovic L. J. Agric. Food Chem., 2014, 62(31): 7676-7681
16 Shrivas K, Wu H F. J. Chromatogr. A, 2007, 1170(12): 9-14
17 GB/T 5750.42006, Standard Examination Methods for Drinking WaterOrganoleptic and Physical Parametes. National Standards of the People's Republic of China
生活饮用水标准检验方法感官性状和物理指标. 中华人民共和国国家标准. GB/T 5750.42006
18 Spietelun A, Marcinkowski L, de la Guardia M, Namies'nik J. Talanta, 2014, 199: 34-45
19 Sanghavi B J, Srivastava A K. Electrochim. Acta, 2010, 55(28): 8638-8648
20 WANG Yao, LIAO Jie, LI Li, DONG FangTing, ZHAO YuLan. J. Anal. Sci., 2003, 19(5): 410-412
王 瑶, 廖 杰, 黎 力, 董方霆, 赵玉兰. 分析科学学报, 2003, 19(5): 410-412
21 Atia N N, York P, Clark B J. J. Sep. Sci., 2009, 32(7): 931-938
22 Xiong J, Chen J, He M, Hu B. Talanta, 2010, 82: 969-975
- 关注校级运动会中由学生运动能力所引发的安全问题
- 易发课堂安全事故的八个“时段”
- 注意安全
- 利用篮球场进行耐久跑教学的几种练习形式
- 组织基层田径比赛工作中的几个常见问题及其纠正方法
- 铅球教学中的“五个关注”
- 差在毫秒
- 体育教学中常用音频与视频处理
- 怎样引导学生利用课本学习武术套路
- 武术基本功串联的方法
- 仰卧推起成“桥”教学设计
- 篮球“行进间投篮”教学设计
- 乒乓球 “单线与复线法”教学基本部分
- 原地侧向推实心球教学片断
- “迎面接力”教学课设计
- 前滚翻交叉转体180°接后滚翻
- 木质地板上如何设置运动标志
- 球式哑铃的制作
- “抢牌”裁判方法值得商榷
- 就几个常用队列口令与同行商榷
- 实施《国家学生体质健康标准》亟待落实的五项工作
- “器”的检验
- 2012年上半年《体育教学》专栏讨论系列选题公告
- 摭谈在体育课中促进学生行为规范的处理技巧
- 在体育课中如何促进学生的文明行为
- saving
- saving grace
- saving grace/redeeming feature
- saving graces
- savingly
- savingness
- savings
- savingsaccount
- savings acˌcount
- savingsandcreditcooperative
- savings and credit coˌoperative
- savingsandloanassociation
- savings and loan association
- savings and loan associations
- savings and loan associˌation
- savings bank
- savingsbank
- savior
- saviour
- saviouress
- saviourhood
- saviours
- saviourship
- savor
- savour
- 后脑勺上长疮——自己看不见以为别人也看不见
- 后脑勺上长疮——自己看不见,以为别人也看不见
- 后脑勺上长着反骨
- 后脑勺儿
- 后脑勺子
- 后脑勺子长眼睛
- 后脑勺拍巴掌
- 后脑勺拍巴掌——背后整人
- 后脑勺的头发——一辈子不见面
- 后脑勺长反骨
- 后脑勺长疙瘩
- 后脑壳
- 后脑壳上的头发
- 后脑壳上的头发——摸得到看不到
- 后脑海
- 后脑瓢儿
- 后脖子
- 后脚
- 后脚坍
- 后脚就到
- 后脸儿
- 后腰
- 后腿
- 后腿短的兔子爬不上高山
- 后臀尖