

摘要: 基于《普通高中化学课程标准(2017年版)》的课程理念,依据“物质的量及其相关物理量”教与学的要求,对“物质的量”进行单元教学整体设计,探索如何激发学生兴趣、化解学习难点、启迪高级思维、促进学科核心素养发展。
关键词: 课程标准; 物质的量; 学科核心素养; 单元教学设计
文章编号: 10056629(2018)9004606 中图分类号: G633.8 文献标识码: B
“物质的量”是占据化学计量核心地位的物理量,基于物质的量认识物质组成及其化学变化是学习化学科学的重要方法。受抽象概念密集、学生认知水平和教师PCK等因素的影响[1~4],物质的量的教与学长期以来都是高中化学的难点。
基于《普通高中化学课程标准(2017年版)》的课程理念,依据“物质的量及其相关物理量”教与学的要求(见表1),借鉴近年来的相关研究成果[5~8],对“物质的量”进行了单元教学设计。
1 单元教学目标
(1) 建构“阿伏伽德罗常数”“摩尔”“物质的量”“摩尔质量”“气体摩尔体积”“物质的量浓度”等核心概念,体验“归纳”“类比”“定义”等方法的应用。
(2) 理解“n=N/NA”“n=m/M”“n=V/Vm”“n=c·V(aq)”“c(浓)·V(浓)=c(稀)·V(稀)”“c=1000mL·ρ·w/M·1L”等计算公式,能正确运用公式进行简单计算。
(3) 基于物质的量认识物质组成及其变化,体验物质的量在定量分析中的价值。
(4) 通过“摩尔质量与相对分子(原子)质量数值关系”的数学认证,学习运用数学方法解决化学问题,领悟选择“0.012kg 12C所含碳原子数”定义NA的匠心。
(5) 通过围绕“阿伏伽德罗定律”的分析推理,深化对气体摩尔体积的认识,建构并理解阿伏伽德罗定律及其重要推论,体验“控制变量法”“抓主要矛盾”“证据推理”等方法的应用。
(6) 通过“配制1.00mol·L-1NaCl(H2SO4)溶液”的实验探究,学会依据实验目的与原理选择实验仪器、规范实验操作、评价实验结果。
2 教学主体环节
2.1 建构核心概念,掌握基本运算
以实验中的真实问题为起点,从化学计量的实际需要出发,研究如何在难以直接称量的微观粒子与可称量的宏观物质之间架设桥梁?建构固体质量、气体体积或溶液体积与微粒数目间的换算关系。
2.1.1 情境引发问题,问题驱动创新
以实验室制备氢气的真实实验为情境,引发“①‘Zn+2HClZnCl2+H2↑可傳递出哪些定量信息?②实际操作中怎样定量控制反应物的投入?③如何分析制备一定体积的氢气理论上需要的锌的质量和盐酸的体积?”等问题的讨论,达成化学需要一种新的计量方法,在固体质量(m)、气体体积(V)或溶液体积[V(aq)]与微粒数目(N)之间架设桥梁的共识。
2.1.2 聚焦微粒集体,架设宏微桥梁
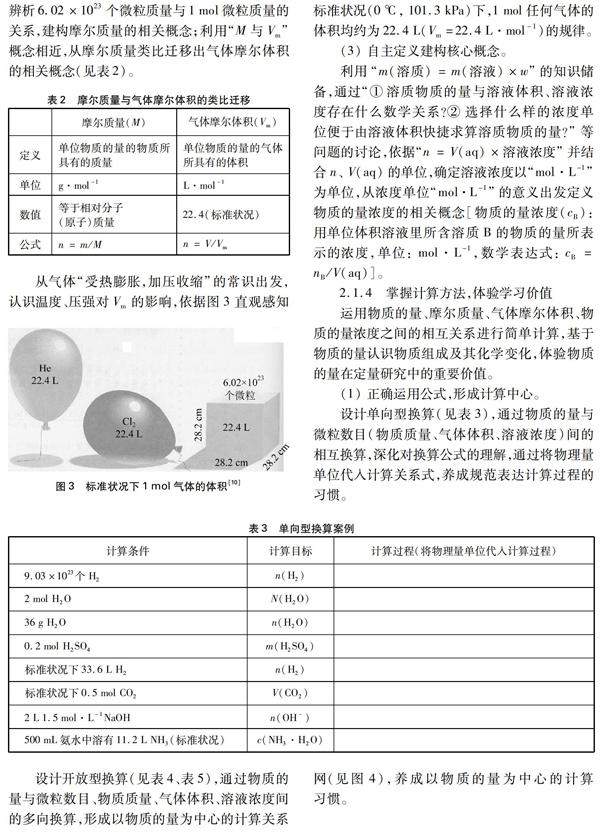
以“6.02×1023个微粒的质量”为情境(见图1),通过“①如何由固体质量求算微粒数目?②如何解决单个微粒无法直接称量的难题?③选择多大规模的微粒集体能给实际应用带来最大便捷?”等问题的讨论,发现“6.02×1023个微粒”的质量(以克为单位)与其相对分子(原子)质量数值相等的事实,
作出用“6.02×1023个微粒的集体”在难以直接称量的微观粒子与可称量的宏观物质之间架设桥梁的选择。
通过“微粒的数目=物质质量/单个微粒的质量”“微粒集体的数目=物质质量/微粒集体的质量”“6.02×1023个微粒集体的数目=物质质量/6.02×1023个微粒集体的质量”的思维进阶,为核心概念建构奠定基础。
2.1.3 把握概念关联,实施因材施教
梳理物质的量及其相关物理量的内在知识关联,灵活选择概念建构的认知路径,引导学生在自主建构核心概念的过程学会选择和使用方法。
(1) 顺藤摸瓜建构核心概念。
利用“6.02×1023是阿伏伽德罗常数的近似值”“NA是物理量单位摩尔的基准”“摩尔是物质的量的单位”“每摩尔物质含NA个构成微粒”等核心概念间的内在关联,从“6.02×1023”出发,通过顺藤摸瓜渐次完成对“阿伏伽德罗常数、摩尔、物质的量”的学习进阶(见图2)。
(2) 类比迁移建构核心概念。
利用“n=N/NA与n=m/M”的计算原理相同,从“n=N/NA”类比迁移出“n=m/M”,通过剖析“n=m/M”的物理意义及各物理量的单位,辨析6.02×1023个微粒质量与1mol微粒质量的关系,建构摩尔质量的相关概念;利用“M与Vm”概念相近,从摩尔质量类比迁移出气体摩尔体积的相关概念(见表2)。
(3) 自主定义建构核心概念。
利用“m(溶质)=m(溶液)×w”的知识储备,通过“①溶质物质的量与溶液体积、溶液浓度存在什么数学关系?②选择什么样的浓度单位便于由溶液体积快捷求算溶质物质的量?”等问题的讨论,依据“n=V(aq)×溶液浓度”并结合n、 V(aq)的单位,确定溶液浓度以“mol·L-1”为单位,从浓度单位“mol·L-1”的意义出发定义物质的量浓度的相关概念[物质的量浓度(cB): 用单位体积溶液里所含溶质B的物质的量所表示的浓度,单位: mol·L-1,数学表达式: cB=nB/V(aq)]。
2.1.4 掌握计算方法,体验学习价值
运用物质的量、摩尔质量、气体摩尔体积、物质的量浓度之间的相互关系进行简单计算,基于物质的量认识物质组成及其化学变化,体验物质的量在定量研究中的重要价值。
(1) 正确运用公式,形成计算中心。
设计单向型换算(见表3),通过物质的量与微粒数目(物质质量、气体体积、溶液浓度)间的相互换算,深化对换算公式的理解,通过将物理量单位代入计算关系式,养成规范表达计算过程的习惯。
设计开放型换算(见表4、表5),通过物质的量与微粒数目、物质质量、气体体积、溶液浓度间的多向换算,形成以物质的量为中心的计算关系网(见图4),养成以物质的量为中心的计算习惯。
(2) 拓展分析视角,体验学习意义。
以“一氧化碳还原氧化铁”为例,通过质量、微粒数和物质的量关系的转换(见图5),形成“化学反应中各物质的物质的量之比等于化学方程式中的化学计量数之比”“物质组成中的微粒数目之比等于各微粒的物质的量之比”的结论。
以“锌和1mol·L-1盐酸反应制备氢气”为例,依据“Zn+2HClZnCl2+H2↑”计算实验室制备标准状况下2.24L H2,理论上需要消耗锌的质量和盐酸溶液的体积。引导学生学会基于物质的量认识物质组成与化学变化,形成以物质的量为中心的定量分析视角,体验在化学计量中引入物质的量的意义。
2.2 探究真实问题,引导深度学习
以学习过程中的情感体验“神”“奇”“爽”为抓手(见图6),引导学生围绕“为什么摩尔质量以g·mol-1为单位时,在数值上等于其相对原(分)子质量?”“为什么标准状况下,1mol任何气体的体积均约为22.4L?”“如何知道溶液的物质的量浓度?”等问题展开深度探究。
2.2.1 数学认证,在问题解决中拓展视野
以“为什么选择‘0.012kg 12C所含有的碳原子数作为摩尔的基准?”“为什么摩尔质量(M)以g·mol-1为单位时,在数值上等于其相对原子质量(Ar)或相对分子质量(Mr)?”为探究主题,以数学推演为探究方法,通过问题解决拓展学生视野,欣赏选择“0.012kg 12C所含的碳原子数”定义NA的慧眼与匠心。
2.2.2 分析推理,在问题解决中学习方法
以“为什么标准状况下,1mol任何气体的体积均约为22.4L?为什么相同条件下1mol不同固(液)体物质的体积不同?”为探究主题,以分析推理为探究手段,从影响物质体积大小的因素出发,运用“控制变量”“抓主要矛盾”“证据推理”“逻辑推理”“数学推导”等研究方法,逐步得出“1mol不同固体或液体体积不同”“同温同压下,相同体积的气体具有相同数目的分子(阿伏伽德罗定律)”“标准状况下,1mol任何气体的体积均约为22.4L”“同温同压下,气体的体积比等于分子的物质的量之比”“同温同压下,气体的密度比等于摩尔质量之比”等结论(见图7)。通过问题解决学习研究方法,建构思维模型。
2.2.3 实验探究,在问题解决中提升能力
以“如何用氯化钠固体配制100mL 1.00mol·L-1 NaCl溶液?”为探究主题,以实验探究为探究形式,结合物质的量浓度的数学表达式,认识实验的关键在于“精确控制溶质物质的量和溶液体积”,并依据实验精度要求选择实验仪器,在明确容量瓶的构造与使用方法的基础上,明确溶液配制的实验流程(见图8),依据流程规范实验操作,分组完成100mL 1.00mol·L-1NaCl溶液的配制。
3 设计说明与建议
“物质的量”单元教学设计力求体现《普通高中化学课程标准(2017版)》的课程基本理念,以期達到在建构和运用知识的过程中激发学生的学习兴趣、化解学习难点,在探究和解决问题的过程中启迪高级思维、促进学科核心素养发展的效果。
3.1 教学目标指向学科核心素养
从化学知识与技能的学习、化学思想观念的建构、科学探究与问题解决能力的发展、创新意识和社会责任感的形成等多个方面体现化学学科核心素养的水平要求,让学科核心素养的发展水平可观察、能评价。
教学目标(1)~(3),面向全体学生,指向高中毕业生应该达到的合格要求所对应的学业质量水平。教学目标(4)~(6),关注差异发展,指向化学学业水平等级考试要求所对应的学业质量水平。
3.2 注重知识关联和认知思路的结构化
从“横向延伸”和“纵向发展”两条线索,基于知识关联和认知路径,梳理物质的量及其相关核心知识间的内在联系(见图9)。存在递进关系的概念,采用“连横”策略循序渐进完成概念的横向延伸;存在并列关系的概念,采用“合纵”策略类比迁移促成概念的纵向发展。
从影响物质体积大小的因素出发,结合问题解决过程中的方法应用,建构探究物质体积大小影响因素及规律的思维模型(见图7)。
3.3 真实问题情境促进学习方式转变
选择“实验室用锌和稀盐酸反应制备氢气”的真实情境,导出“实验中怎样定量控制反应物的投入?如何分析制备一定体积的氢气理论上需要的锌的质量和盐酸的体积?”等实际问题,结合问题解决的进程逐步展开建构学习、探究学习和问题解决学习。
基于“100mL 1.00mol·L-1NaCl溶液”的真实任务,采用小组合作、实验探究、讨论交流等多样化方式,通过设计实验方案,实施实验操作,评价实验结果等,学会溶液配制的基础知识与基本技能。
3.4 实验探究活动强调高级思维过程
设置配制“1.00mol·L-1 NaCl溶液”和“1.00mol·L-1 H2SO4溶液”的学生实验,引导学生依据实验目的计算所需NaCl质量和浓硫酸体积、选择实验仪器、规范实验操作,依据实际操作评价实验结果。在探究活动过程中手脑并用,强调高级思维过程。
3.5 课时安排建议
“物质的量”单元教学设计建议分4课时组织实施,其中“建构核心概念,掌握基本计算”安排2课时、“探究真实问题,引导深度学习”安排2课时。
参考文献:
[1]钟志健. “物质的量”教学难度成因剖析[J]. 化学教学, 2014,(10): 8~12.
[2]龙琪. “摩尔”概念难点成因及化解策略[J]. 化学教学, 2015,(4): 32~37.
[3]姚梦娟, 张霄, 吴晗清.“阿伏伽德罗常数”学习困境分析与对策探讨[J]. 化学教育, 2017,(19): 14~17.
[4]张莹, 刘晶. SOLO视角下学生“物质的量”学习的思维发展水平研究[J]. 化学教学, 2015,(11): 14~18.
[5]龙琪. 基于不同认知风格的物质的量计算的教学策略[J]. 化学教育, 2014,(1): 15~17.
[6]沈芹, 王后雄. 化学教材“二次开发”: 特点与途径——以人教版“物质的量”为例[J]. 化学教学, 2013,(1): 9~10, 24.
[7]杨德红. 基于学生认知逻辑的学科单元知识的逻辑架构[J]. 化学教学, 2017,(1): 44~47.
[8]丁樱. 基于认知发展理念构建“物质的量”单元教学策略[J]. 化学教育, 2016,(5): 5~8.
[9]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版)[S]. 北京: 人民教育出版社, 2018: 4.
[10]菲利普斯著. 王祖浩译. 科学发现者·化学: 概念与应用(中册)[M]. 杭州: 浙江教育出版社. 2008: 436.
- 浅谈维金斯气柜密封装置设计要点
- 基于STM32单片机的物料搬运小车
- 基于大数据下的老年用户穿戴设备设计研究
- 基于HTML5+Nodejs+百度人脸识别音乐播放器的设计与实现
- 浅谈工业设计和农机装备设计与制造
- 智能压缩垃圾箱设计研究
- 写字机器人书写笔迹的鉴别
- 建筑工地出入口门禁系统的设计及衍生应用分析
- 某室内中庭消防安全性论证
- 基于Axure的中职学生拖延症APP原型设计
- 清单式管理在住培管理中的应用价值探讨
- 前列腺特异性抗原检测意义的探讨
- 我国本土社会工作机构管理的研究
- 档案管理在医院党建工作中的作用
- 演唱技巧及情感分析对声乐演唱的重要性
- 论实战训练对高职篮球运动员技战术水平的影响研究
- 关于依法规范基层经营环节药械广告发布行为的研究
- 反射率测量与应用
- 基于地域特色的城市规划展览馆展示形式探究
- Micro RNA用途专利的检索技巧
- 党建理论在藏族地区扶贫工作中的体现
- 基层纪检监察工作的效能提升措施研究
- 化纤生产企业科学管理的研究
- 医院管理中开展精细化管理的策略
- 论社会主义核心价值观教育与高校校园文化建设的契合
- flashingly
- flash-in-the-pan
- flashless
- flashlight
- flashlights
- flashly
- flashness
- flash-on
- flash-out
- flashs
- flash's
- flashy
- flash²
- flash¹
- flask
- flasks
- flat
- flatbedscanner
- flatbed scanner
- flatfish
- flatfishes
- flatly
- flat-mate
- flatmate
- flatmates
- 伸谢
- 伸进物体里取出
- 伸钩索铁
- 伸长
- 伸长和缩短
- 伸长脖子看
- 伸长脖颈
- 伸雪
- 伸颈远望
- 伸马
- 伺
- 伺候
- 伺候主人及其子弟读书的未成年的仆人
- 伺察
- 伺察防备
- 伺弄
- 伺晨
- 伺望
- 伺机
- 伺机伤人
- 伺机做坏事
- 伺机反间
- 伺机恣意行事
- 伺机窃位
- 伺机窃取