杨歌 韩诗邈 赵丽萍 朱超 黄渊余 屈锋


摘?要?基于毛细管电泳-指数富集配体系统进化技术(CE-SELEX)建立了免疫球蛋白G(IgG)的Fc片段的核酸适配体筛选方法。通过毛细管区带电泳方法分析IgG完整蛋白、Fc与Fab片段的样品的纯度、荷电性质及是否吸附的特征,并比较三者与核酸库的亲和力。结果表明,IgG与核酸库形成明显的复合物,而Fc和Fab片段与核酸库的亲和力很弱。在筛选Fc片段的适配体时,选择Fab片段作为反筛靶,对去除非特异性结合序列无显著作用。设计了针对Fc片段的适配体筛选方案,在优化的孵育条件(10 mmol/L Na2HPO4-KH2PO4 (pH 7.17),0.05 mmol/L Mg2+,37℃孵育25 min)下,经3轮筛选获得Fc片段的核酸适配体Seq Fc1~3,KD值为0.071~0.321 μmol/L,经胶体金比色分析方法验证了其亲和力与特异性。
关键词?免疫球蛋白;免疫球蛋白G Fc片段;核酸适配体筛选;毛细管电泳;毛细管电泳-指数富集配体系统进化
1?引 言
免疫球蛋白(Immunoglobulin,Ig)是免疫系统在抗原刺激下,由效应B细胞分泌的可与相应抗原发生特异性结合的蛋白质。免疫球蛋白由两个不同的功能单元Fab和Fc片段组成。其中,Fab片段中包含了3个可变的互补决定区,用于结合特定的抗原表位;Fc片段能以多种方式参与免疫系统的调控[1],可结合带有Fc受体(FcγR)的免疫细胞,通过抗原呈递细胞将抗原呈递给自适应免疫系统的效应细胞,发挥清除作用[2,3]。另外,Fc片段是许多蛋白质的靶标,可作为衔接分子的配体发挥调控功能。Fc片段与相关效应分子的相互作用是免疫球蛋白功能实现的关键。
多种免疫球蛋白(IgA、IgD、IgE、IgG、IgM)均具有不同的生物分布与功能,在特定的触发条件下发挥独特的效应机制。IgG是最常用的免疫球蛋白,在大多数抗体反应中都涉及IgG介导的效应功能。IgG在基于抗体的疗法中表现出良好的安全性,已成为治疗传染病的首选治疗性抗体[3]。研究表明,可通过操纵IgG、Fc与Fc受体之间的相互作用改善IgG效应功能[4],如诱变靶向IgG Fc核心或受体相互作用位点附近的氨基酸残基以及Fc片段的糖基化等[5~7]。筛选Fc片段的特异性识别配体,可提供潜在的IgG Fc片段与其受体之间相互作用调节因子,进而控制IgG效应功能。
核酸适配体是通过体外筛选获得的与目标分子有高亲和力与特异性的寡核苷酸序列,可作为化学配体参与分子间相互作用调控,并可通过pH、光敏等方式形成可逆的调控开关[8,9]。目前,已有免疫球蛋白IgM、IgE与IgG的核酸适配体报道。Zumrut等[10]通过“配体引导选择”方法(LIGS),经13轮筛选获得膜结合IgM(mIgM)的DNA适,可特异性结合B细胞淋巴瘤上的mIgM,用于癌症相关的生物标志物检测[11]。Bowser[12]通过毛细管电泳-指数富集的配体系统进化技术(CE-SELEX)方法经4轮筛选获得了人IgE的DNA适配体。Miyakawa等[13]通过Ni-NTA亲和树脂层析柱,经10轮筛选获得人IgG的RNA适配体,用于人IgG纯化。上述适配体筛选均使用了抗体整体蛋白,由于Fc片段在免疫过程中也发挥特定的功能,因此,针对抗体的Fc片段筛选适配体也很有意义。本研究基于CE-SELEX建立了免疫球蛋白IgG的Fc片段的核酸适配体筛选方法。首先通过毛细管电泳方法评价IgG及其功能片段样品的质量以及其与核酸库的亲和力。在此基础上,设计了Fc片段的筛选策略,优化了筛选条件,并筛选获得了Fc片段的核酸适配体,可能作为人IgG的潜在的效应功能调控因子。
2?实验部分
2.1?仪器与试剂
Beckman P/ACE MDQ毛细管电泳仪,配荧光检测器(美国Beckman-coulter公司);AUV220万分之一电子天平(日本岛津公司);FE20实验室pH计(瑞士梅特勒-托利多公司);Fresco21低温离心机、PICO21台式高速离心机(美国赛默飞世尔科技有限公司);S1000TM Thermal Cycler PCR仪、300V/400mA/75W Power凝胶电泳仪、水平电泳槽(美国BIO-RAD公司);?KDM型控温电热套(山东鄄城华鲁仪器公司);熔融石英毛细管(i.d. 75 μm,邯郸市鑫诺光纤色谱有限公司)。
H3BO3、Na2B4O7、NaOH、MgCl2、KCl(分析纯,北京化工厂);?NaH2PO4、KH2PO4(分析纯,国药集团化学试剂有限公司)。IgG(150 μg/mL,CUSABIO);IgG的Fc片段(5 mg/mL,CUSABIO);IgG 的 Fab片段(5 mg/mL,CUSABIO)。
55nt、70nt、80 nt FAM标记的ssDNA核酸库: 5-FAM-AGC AGC ACA GAG GTC AGA TG-N-CCT ATG CGT GCT ACC GTG AA-3(两端為20 nt引物区固定序列,中间为N nt的随机序列)。引物P1: 5-AGC AGC ACA GAG GTC AGA TG-3,标记荧光的引物5-FAM-P1: FAM-5-AGC AGC ACA GAG GTC AGA TG-3),引物P2: 5-TTC ACG GTA GCA CGC ATA GG-3(生工生物工程(上海)股份有限公司)。2×Taq Plus PCR Master Mix、 5 mL dd H2O、 500 μL Nuclelc Acid Dye Gene Green、1 mL 6×DNA Loading Buffer、 300 μL 50 bp DNA Ladder、 50 g琼脂糖(天根生化科技有限公司)。
2.2?实验方法
2.2.1?溶液配制?毛细管电泳分离缓冲溶液: 50 mmol/L硼酸硼砂溶液(pH 8.7);蛋白与核酸孵育溶液: PBS缓冲液(pH 7.2)、5 mmol/L Na2HPO4-KH2PO4缓冲液(pH 7.17);缓冲液均经 0.22 μm滤膜过滤后使用。蛋白质溶液: 配制所需浓度的母液。再根据实验需要,用孵育缓冲溶液稀释。核酸溶液: 核酸固体粉末,使用前需按照说明用纯水溶解,振荡混匀,配制100 μmol/L母液,于94℃变性处理5 min,冷却至室温,备用。根据实验需要,用孵育缓冲溶液稀释。
2.2.2?毛细管电泳条件?75 μm内径的熔融石英毛细管,总长度 50.2 cm,有效长度 40 cm。UV检测波长214 nm;LIF检测激发和发射波长为488 nm和520 nm。电泳缓冲液: 50 mmol/L pH 8.7硼酸盐缓冲液。进样: 0.5 psi,5 s;分离电压: 20 kV;分离温度: 25℃。每个样品进样前依次使用0.1 mol/L NaOH、 H2O 和电泳缓冲液分别冲洗毛细管3 min。新毛细管使用前,依次用 1 mol/L NaOH、 0.1 mol/L NaOH 和蒸馏水冲洗30 min活化。实验前,用0.1 mol/L NaOH,H2O和电泳缓冲液冲洗毛细管5 min。
2.2.3?PCR扩增条件及产物浓缩和纯化?参考本课题组前期研究方法[14]。
2.2.4?序列分析与亲和力表征?核酸序列高通量测序由生工生物公司完成,使用M-fold软件分析序列二级结构。平衡解离常数(Dissociation constant,KD)计算参考NECCEEM方法,计算公式如下[15,16]。
其中,[P]0为蛋白质浓度;[DNA]0为适配体浓度;A1为游离适配体峰面积;A2为蛋白质-配体复合物峰面积;A3为复合物解离区的峰面积。
2.2.5?胶体金比色分析
(1)AuNPs 制备?采用柠檬酸盐还原法制备AuNPs,加热 100 mL 1 mmol/L HAuCl4 溶液至沸腾;在同步搅拌下快速加入194 mmol/L 柠檬酸钠溶液2 mL,沸腾15 min后取出反应烧瓶,并将反应溶液缓慢冷却至室温。(2)比色分析?在96孔板中,将25 μL胶体金溶液与等体积的5 μmol/L核酸序列孵育10 min,分别加入25 μL浓度梯度的靶蛋白,室温孵育15 min,加入10 μL 900 mmol/L NaCl 溶液,观察胶体金溶液颜色变化。
3?结果与讨论
3.1?Fc片段的适配体筛选方案
IgG含有Fc片段和Fab片段。首先分别评估Fc片段和Fab片段与核酸库的结合力。若Fc片段与核酸库具有一定的亲和力,二者可形成较稳定的复合物,在CE电泳图中显示有复合物峰或解离区,则可直接以Fc片段作为靶标进行筛选;若Fc片段与核酸库亲和力极弱,则需以IgG为靶标进行筛选,获得与完整IgG结合的核酸序列(其中包括结合Fc片段和Fab片段的所有序列),然后用Fab片段作为反筛靶,去除与Fab片段结合的序列,进而获得可结合Fc片段的序列。前者直接进行正筛选,后者需要先筛选IgG的适配体,再进行反筛,间接获得Fc片段的核酸适配体。
3.2?IgG、Fc和Fab的CZE分析
筛选前,分别对IgG、Fc片段、Fab片段进行毛细管区带电泳(Capillary zone electrophoresis,CZE)分析,考察其纯度、荷电性质、在毛细管壁有无吸附等。图1为3种组分的CZE分析图。IgG在2.8 min出峰,峰形对称,无明显杂质峰,说明IgG样品纯度较高。增加IgG浓度,其峰面积呈倍数增加,说明其在毛细管中无明显吸附。Fc片段样品在3.1 min有明显的尖锐峰,浓度增加,峰面积也呈倍数增加,但该峰前出现弥散的非尖锐峰,并随浓度增加增大,推断是杂质峰或Fc片段的其它形态。通过峰面积归一化法,计算Fc片段纯度为82.1%。若靶标中存在杂质,可能会竞争结合核酸序列,也给复合物准确收集带来困难。Fab片段在2.6 min出峰,浓度增加时,峰面积也增加。此峰略有拖尾,并有小的雜质峰。采用归一化法,计算Fab片段纯度为96.2%。由图1可见,3种组分的迁移时间在2.6~3.1 min之间,与核酸库的迁移时间(6~7 min)有明显差异,不会影响后续的复合物分离与收集。3种组分的峰面积与浓度呈正相关,说明它们在毛细管内吸附很弱,故可用熔融石英毛细管直接进行适配体筛选。
3.3?IgG、Fc和 Fab与不同长度ssDNA库的结合分析
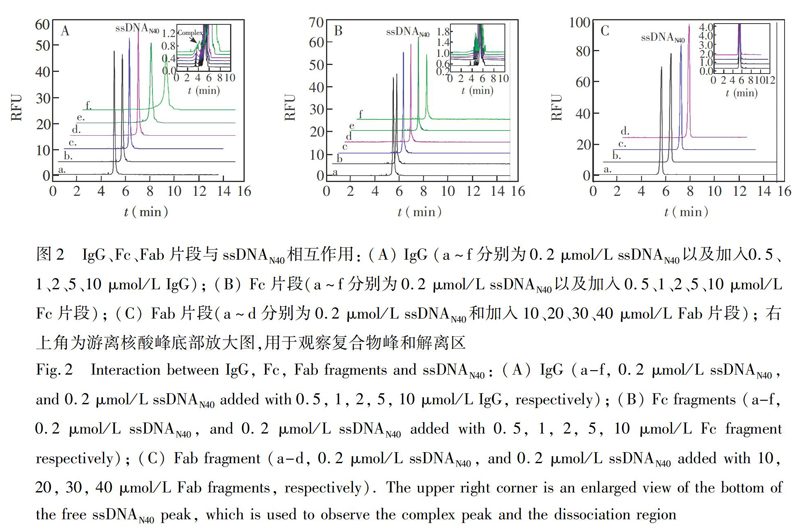
因核酸库的随机序列长度对靶标的结合有明显影响,故需要进行序列长度优化。选择3种随机序列长度40、29和15 nt(ssDNAN40、ssDNAN29、ssDNAN15)的核酸库,分别与3种靶标混合孵育。首先,在0.2 μmol/L ssDNAN40中加入不同浓度IgG(PBS缓冲液,pH 7.2,37℃孵育10 min),用CZE分析其混合物。在图2A中,5.25 min为核酸库峰,加入0.5 μmol/L IgG后,核酸库峰降低,未见复合物峰与解离区;当IgG为2 μmol/L时,核酸库峰降低,并在其峰前出现复合物峰;IgG增加至10 μmol/L,核酸库峰明显降低,复合物峰面积继续增大。在图2B中,加入不同浓度的Fc(0.5~5 μmol/L)时,核酸库峰面积没有明显降低。若Fc增加至10 μmol/L,核酸库峰面积降低,但没有明显的复合物峰,而核酸库峰前出现解离区。上述结果表明,Fc与ssDNAN40的亲和力小于IgG。在Fc与ssDNAN40浓度比高达50∶1时,仍无复合物峰出现,仅能观察到复合物的解离区。在图2C中,加入10~40 μmol/L Fab后,核酸库峰面积没有降低,也未见复合物峰和解离区,说明Fab片段与ssDNAN40作用极弱,在Fab与ssDNAN40浓度比高达200∶1时,也未见复合物峰和解离区。
由图3A可见,在29 nt的核酸库ssDNAN29中加入5 μmol/L IgG后,ssDNAN29峰的迁移时间从5.9 min明显后移至6.2 min,在3.5 min(左上角放大图)可见IgG与ssDNAN29的复合物弥散峰。加入Fc和Fab,ssDNAN29峰有所降低,但迁移时间没有改变,且Fc和Fab与ssDNAN29未形成明显的复合物峰。复合物峰面积IgG>Fab与Fc。由图3B可见,在15 nt的核酸库ssDNAN15中加入IgG、Fc和Fab,其结果与ssDNAN29非常相似。当靶标与核酸库浓度比为25∶1时,两种核酸库与IgG、Fc、Fab的结合没有明显差异。IgG形成的复合物峰最大,亲和力更强;Fc片段和Fab片段与核酸库的作用较弱。完整IgG与核酸库的亲和力强于其功能片段Fc与Fab,说明核酸序列与IgG的结合并非完全发生在功能片段上,而也可能结合在蛋白的其它区域。如果使用完整蛋白作为靶标,筛选功能片段的适配体,则非特异性结合的干扰更大。在筛选Fc的适配体时,由于Fab与核酸库的亲和力极弱,且仅以Fab反筛也无法去除结合于IgG其它区域的核酸序列。因此,拟直接筛选Fc片段的核酸适配体。由于Fc与3种长度核酸库的亲和力都很弱,需进行相互作用条件的优化,以促进复合物形成,提升亲和力。
3.4?Fc片段的适配体筛选
3种长度的核酸库与Fc片段结合力相当,而较长的核酸库在次级库及高通量测序建库时,纯化回收率较高,因此,选择ssDNAN40用于Fc片段的适配体筛选。为提高ssDNAN40与Fc片段的亲和力,优化了二者的相互作用条件。孵育缓冲液为5 mmol/L Na2HPO4-KH2PO4(pH 7.17),0.05 mmol/L Mg2+,Fc与ssDNAN40核酸库在37℃孵育25 min后,进行CZE分析。由图4A可见,在优化的孵育条件下,Fc与ssDNAN40结合,可形成明显的复合物Complex Fc。相同条件下,Fab与ssDNAN40没有明显结合。收集复合物(图4B),经不对称PCR扩增和纯化,得到第1轮的次级库(Sub-library-2)用于第2轮筛选(图4C),重复筛选步骤得到第2轮的次级库(Sub-library-3)(图4D)。经4轮筛选后,KD从第1轮的(928.3±57.5) μmol/L降为第4轮的(51.76±15.9) μmol/L(图4E),次级库的亲和力随筛选轮次增加。第3轮和第4轮筛选的亲和力相当,故从第3轮次级库中选择候选核酸序列。
将第3轮筛选的次级库PCR扩增后送至生工生物科技有限公司进行高通量测序,从测序结果中选择频数最高的3条序列Seq Fc1~Seq Fc3(表1)。经M-fold模拟序列二级结构及预测热力学参数,结果显示,这些序列普遍形成茎环结构(图5)。Seq Fc1与Seq Fc2的ΔG低于Seq Fc3,说明二者较Seq Fc3更易折叠成稳定的二级结构。Seq Fc1与Seq Fc2熔解温度Tm均高于Seq Fc3,说明二者的二级结构稳定性高于Seq Fc3。测定3条候选适配体序列的亲和力,其KD值为0.071~0.321 μmol/L。
3.5?纳米金比色法验证适配体亲和力与特异性
利用AuNPs比色法快速验证3条候选序列对Fc结合的特异性。在25 μL AuNPs溶液中分别加入等体积的4 μmol/L Seq Fc1、2、3,室温混合孵育15 min 后,加入 NaCl,溶液呈酒红色。分别加入 0.05、0.1、0.2、0.5、1、2和5 μmol/L的Fc片段,溶液由酒红色向蓝色转变 (图6A)。加入0.2 μmol/L Fc片段,Seq Fc1 和Seq Fc2的溶液已呈现为紫色。而加入0.5 μmol/L Fc,Seq Fc3溶液才呈现紫色。3条序列的颜色转变点处的Fc浓度不同,Fc浓度越低,表明其亲和作用更强,亲和力表征结果与CE方法一致。3条适配体溶液中分别加入相同系列浓度的Fab,AuNPs溶液仍保持酒红色(图6B),说明3条序列均不能结合Fab,而与Fc片段能够特异性结合。
4?结 论
基于CE-SELEX建立了免疫球蛋白IgG Fc片段的DNA适配体筛选方法,通过对IgG完整蛋白、Fab片段与Fc片段與核酸库的亲和力表征,设计针对Fc片段的适配体筛选策略。结果表明,IgG可与核酸库形成明显的复合物,而Fc片段和Fab片段与核酸库的亲和力很弱。在Fc片段适配体筛选过程中,选择Fab片段作为反筛靶,对去除Fc片段的非特异性结合序列无显著作用。在优化条件下,经3轮筛选直接获得Fc片段的特异性核酸适配体。此适配体有望用于IgG的效应功能调控。
References
1?Chan K R,Ong E Z,Mok D Z,Ooi E E. Expert. Rev. Anti-Infect. Ther.,2015,13(11): 1351-1360
2?Roopenian D C,Akilesh S. Nat. Rev. Immunol.,2007,7(9): 715-725
3?Fonseca M H G,Furtado G P,Bezerra M R L,Pontes L Q,Fernandes C F C. Int. J. Biol. Macromol.,??2018,119: 306-311
4?Shen Y,Li H,Zhao L,Li G,Chen B,Guo Q,Gao B,Wu J,Yang T,Jin L,Su Y. PLoS One,??2017,12(8): e0183326
5?Suzuki T,Ishii-Watabe A,Tada M,Kobayashi T,Kanayasu-Toyoda T,Kawanishi T,Yamaguchi T. J. Immunol.,2010,184(4): 1968-1976
- 洛阳市农村地区养老现状及对策分析
- 传统村落文化记忆的传承演变与发展路径
- 振兴中华“老字号”品牌研究
- 精准扶贫措施后返贫现象的原因分析与对策
- 乡村振兴战略下离婚妇女宅基地权益保护研究
- 2008—2017年甘肃省农业投入与产出状况分析
- 河北省乡村旅游存在问题及完善路径
- 基于GIS的旅游景点个性化定制研究
- 柔性管理在企业经济管理中的作用分析
- 构建基于多元需求的企业营销人员培训体系
- 张家口滑雪场地资源开发现状分析
- 偏远地区无人机配送发展策略的SWOT分析
- 软件开发视域下农村无线宽带建设方案研究
- 基于农业智能车的双车会车研究
- 浅谈农业机械作业事故产生原因及预防措施
- 畜牧兽医防疫工作重要性及对策研究
- 全域旅游视野下高职旅游人才培养模式研究
- 提高农业技术推广服务水平的具体措施
- 农村信用社思想政治工作方法创新探讨
- 浅析林业资源管理促进生态健康发展的措施
- 浅谈公园植物配景设计
- 城市生态绿道在园林景观规划中的应用研究
- 试论野外地质勘探工作中的环境保护策略
- 大生态背景下森林资源发展路径初探
- 浅析园林施工与养护结合的策略
- nonconsciously
- nonconsciousness
- nonconsciousnesses
- nonconscriptable
- nonconscription
- nonconscriptions
- nonconsecutive
- nonconsecutively
- nonconsecutiveness
- nonconsecutivenesses
- nonconsensual
- non-consent
- nonconsent
- nonconsenting
- nonconsentings
- nonconsents
- nonconsequence
- non-consequence
- nonconsequences
- nonconsequent
- nonconservation
- nonconservational
- nonconservations
- nonconservative
- nonconservatives
- 一团和气
- 一团和蔼
- 一团或一堆东西颜色很黑
- 一团混乱
- 一团漆黑
- 一团火
- 一团火精神
- 一团糟
- 一团糨糊
- 一团线
- 一团面
- 一团面泥——想怎么捏就怎么捏
- 一团面泥——想怎么捏,就怎么捏
- 一围粗
- 一国三公
- 一国三公,吾谁适从
- 一国不容二主
- 一国不容二主。
- 一国两制
- 一国军事主管部门派驻外国使馆的军事代表
- 一国如狂
- 一国对他国称臣
- 一国或一地的长者
- 一国所属的海域
- 一国独有的技艺