何浩延 黄恩奇 黎柱均 舒博文 徐邦牢 刘大渔


摘要现有细菌定量检测多依赖专业实验室,检测周期较长。针对此问题,本研究基于微流控芯片液滴数字化分析,建立了一种细菌定量检测方法。采用具有平行液滴分析单元的微流控芯片,其特点在于使用了注射器真空驱动液滴产生方法。借助刃天青显色反应引起的荧光强度改变,可指示液滴内活性细菌的存在。通过计算细菌阳性液滴的比例,采用泊松分布算法,计算出原始样品中的细菌密度。实验结果表明,本方法可在3.5 h内完成细菌定量分析,动态检测范围为105~108 CFU/mL,相对标准偏差(RSD)低于5%。本方法具有操作简便和分析速度快的优势,有望广泛用于细菌快速定量检测。
关键词微流控芯片; 液滴数字化分析; 注射器真空; 细菌; 定量检测
1引 言
细菌定量检测对于食品安全、环境监测和疾病诊断均具有重要作用。由于细菌定量检测经常在资源有限的情况下进行,而且对于检测时间要求很高,因此需要简便快速的检测方法。目前,用于细菌定量检测的方法主要包括培养计数法[1,2]、荧光定量分析PCR[3]、流式细胞术[4,5]等,以及一些基于新型生物传感器的检测方法[6]。这些技术仍存在一定的局限性,如检测周期较长、操作步骤繁琐、依赖于大型设备和专业技术人员[7,8]。因此,迫切需要建立操作简便、分析快速的细菌定量检测方法。
液滴数字化分析是近年发展起来的一种高精度定量分析方法。液滴数字化分析的原理是利用液滴技术将待测靶标随机分配到大量相互独立的微滴中,每个液滴中最多含有一个靶细胞,每个微滴相当于一个独立的微反应器; 继而针对待测靶标在微液滴中的直接或间接信号,区分阳性和阴性液滴。阳性微滴判读为1,阴性微滴判读为0[9,10],可根据泊松分布[11]原理进行计算,实现待测靶标的绝对定量分析。与传统的分析技术相比,液滴数字化分析最突出的特点是其具有不依赖标准品的绝对定量分析能力。此外,基于大规模液滴分散体系的数字化分析在检测灵敏度和定量分析精度等方面也显著优于传统定量分析方法。鉴于微流控技术是大规模液滴操控的有利工具,微流控芯片成为数字化液滴分析的主要平台[11]。
自液滴数字化分析提出以来,此技术被广泛用于多种类型的定量生物分析中, 包括核酸[12~16]、蛋白[17~19]和细胞分析[20~23],以及数字化细菌分析。得益于微液滴对于反应信号的相对富集作用,以及数字化分析方法的高检测精度,数字化细菌分析在分析时间和定量分析精度等方面均显著优于传统的细菌定量分析。 Boedicker等[24]利用阿尔玛蓝指示细菌活性,结合液滴数字化分析技术,最快可在2 h内检测出样品中的活性细菌,并且能够在7 h内获得细菌的耐药性信息。Kang等[25]结合DNA酶传感器与液滴数字化分析技术,能够在3 h内得到血液样品中的细菌定量分析信息,其实际密度与理论值的相关性良好(R2=0.999),测定下限达到1 CFU/mL。Kaushik等[26]结合刃天青显色原理与液滴数字化分析技术,将细菌与显色体系限制在约20 pL的液滴中,能够在1 h内得到细菌的耐药性信息。Scheler等[27]用含绿色荧光蛋白的大肠杆菌验证了液滴数字化分析的定量分析能力,与平板计数法结果的相关性良好(R2=0.9964),结合刃天青显色法原理,在3~4 h得到样品中细菌的耐药性信息。
液滴数字化分析不依赖标准品的绝对定量分析能力,以及在灵敏度和定量分析精度方面的优势,非常有利于现场快速细菌检测,然而,此技术在该领域的应用还鲜有报道。其主要原因在于微流控芯片上的液滴发生多依赖基于气压或注射泵等流体驱动装置, 这类装置体积较大且操作繁琐,难以应用于现场快速检测[26,28]。相比较而言,正压驱动液滴发生方式使用广泛,文献已经报导了基于负压的液滴发生方法[29~32]。在负压驱动的液滴发生体系中,仅需要一个简单的注射器即可驱动油水两相液体流动,并发生液滴。这种液滴发生方法操作简便,无需复杂结构流体控制设备,因而有望将液滴数字化细菌分析拓展到现场快速检测领域。
微流控芯片技术在生物样品分析中得到广泛的应用[33]。 本研究基于负压驱动液滴微流控芯片,建立了一种细菌定量检测方法。采用具有平行液滴分析单元的微流控芯片,其特点在于使用了注射器真空驱动的流动聚焦式液滴发生方法[34]。利用单个注射器,即可实现多个分析单元中的快速平行液滴发生和捕获。以大肠杆菌为模式分析对象,借助刃天青显色反应,实现数字化液滴细菌定量分析。依据显色反应阳性液滴的比例,使用泊松分布原理计算原始样品中的大肠杆菌密度。实验结果表明,本方法具有操作简便和分析速度快的优势,有望用于细菌的现场快速定量检测。
2实验部分
2.1仪器与试剂
IX71倒置荧光显微镜(日本Olympus公司); 麦氏比浊仪(梅里埃公司); PH030A型干燥箱(上海一恒公司); URE2000/35深紫外光刻机(中国科学院光电技术研究所); KS180EI 超声波清洗机(宁波海曙科生公司); Spin Master51 甩胶机(上海凯美特公司); PDCM等离子体清洗机(成都铭恒公司)。
H2SO4(98%)、H2O2(30%)(广州化学试剂厂); SU8 3025光刻胶及显影液(美国Microchem公司); 聚二甲基硅氧烷(PDMS)前体和引发剂(美国 Dow Corning公司); 十六烷和礦物油(上海生工公司); ABIL EM90 表面活性剂(德国Degussa AG公司);
2.2微流控芯片
微流控芯片包含具有图形化结构的PDMS顶层和无结构的玻璃底层(图1)。PDMS层包含一组6个辐射状排列分析单元,汇聚于同一出口,即负压施加点。每个单元包括上游的液滴发生器以及下游的液滴储存池。PDMS层使用标准光刻倒模工艺加工[35],等离子处理后,与玻璃底层封接。加工完成的芯片经紫外线照射1 h,并于使用之前保存1周。与芯片连接的特氟龙毛细管经高压消毒后保存备用。
2.3实验方法
2.3.1样品准备将细菌悬液与MH肉汤以1∶9 (V/V)比例加入无菌试管,获得梯度密度细菌悬液。将107 CFU/mL菌液5倍倍比稀释,获得一组5个梯度密度细菌悬液。实验前,向待测样品溶液中加入刃天青储备液至终浓度为400 μmol/L,另外以1∶50 (V/V) 比例加入ProLong Live抗淬灭剂。在3组平行实验中,对这5个梯度密度细菌悬液进行同步液滴数字化显色分析。
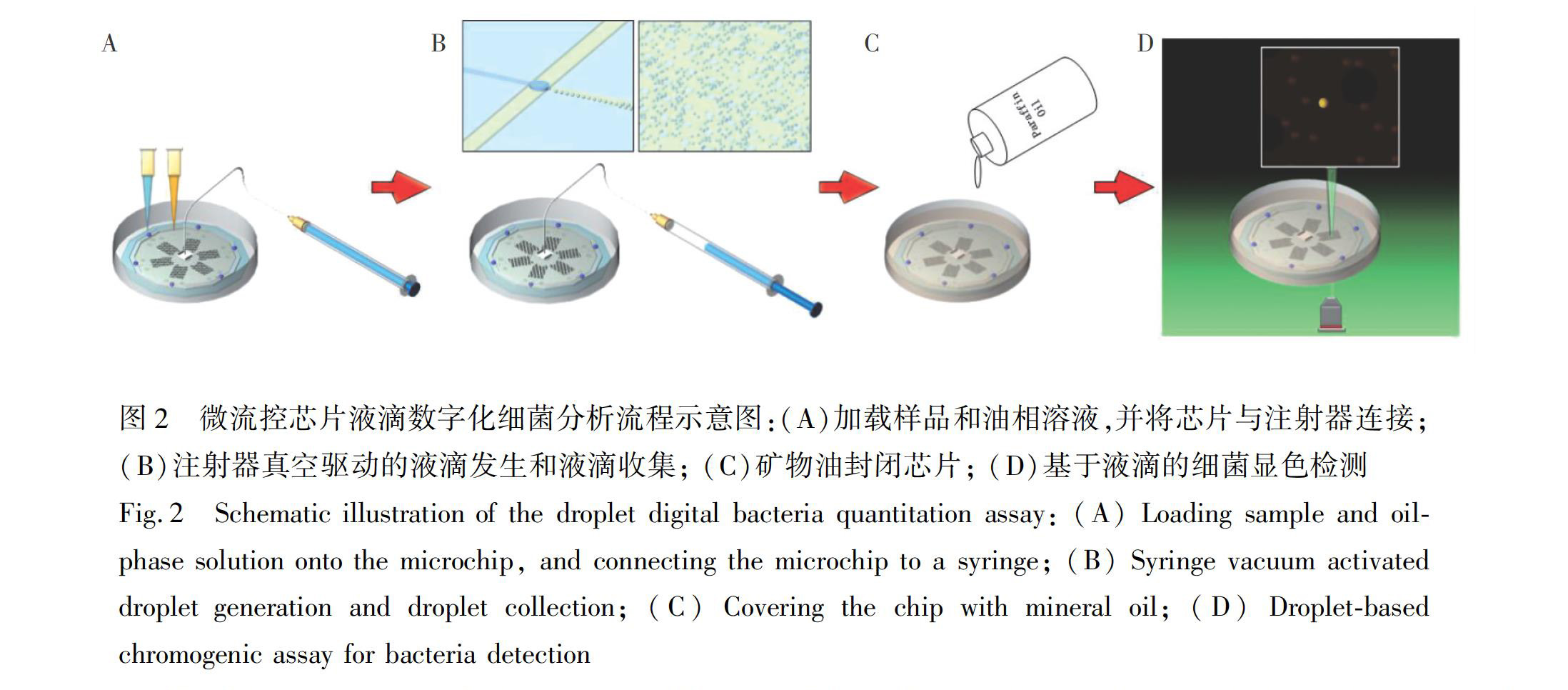
2.3.2液滴数字化显色分析液滴数字化显色分析流程如图2所示,具体操作如下:(1)使用特氟龙毛细管将注射器与芯片出口连接,将样品溶液和油相溶液分别加载到芯片的样品池和油相池; (2)拉动注射器针柄,利用注射器真空产生的负压驱动油相和水相溶液流动,引发液滴发生。待液滴充满液滴收集池,于芯片出口端剪断特氟龙管; (3)将芯片转入培养皿,用石蜡油淹没,37℃下孵育一定时间; (4)用荧光显微镜观察芯片并成像,使用Image J软件计数刃天青显色反应阳性液滴数(n1)和阴性液滴数(n2)。样品中细菌密度D(CFU/mL)=
2.3.3平板计数用生理盐水将2.3.1节制备的5个梯度密度细菌悬液分别10倍倍比稀释7次。每份细菌悬液用平板计数法平行检测3次,每次取1 mL样品加入到培养皿中。培养皿中加入适量溶解的营养琼脂,摇匀后,室温下固化,37℃培养24 h。依据GB4789.22016《食品安全国家标准,食品微生物学检验,菌落总數测定》的原则,选取各组中具有适宜菌落数目的平板进行计数,并计算平均值,再根据稀释倍数推算出原始样品的细菌密度。
3结果与讨论
3.1注射器真空驱动的液滴发生
在注射器真空作用下,液滴分析单元的末端压力接近于0,而入口端液面压力为1个大气压,这种压力差存在于每个分析单元。因此,利用一个注射器可实现多个分析单元内的同步液滴发生。在大气压驱动下,水相和油相共同进入芯片通道。在十字型通道结构液滴发生器处,油相剪切力作用于水相,因而将水相切割为液滴。液滴的尺寸由液滴发生器处通道尺寸以及油相和水相的流速决定。对于注射器真空驱动的液滴发生,由于压力是恒定的,液滴发生频率和液滴尺寸主要通过调节通道尺寸实现。
本实验中,液滴发生器十字型通道的尺寸为:水相孔径20 μm,油相孔径175 μm,深度40 μm。在注射器真空驱动下,6个平行单元的液滴发生频率介于180~193 Hz之间,生成的液滴可在3 min内充满液滴收集池。成像分析(图3)显示,收集池内液滴变化范围介于25.69~33.01 μm之间,每个单元内的液滴体积相对标准偏差(RSD)<2%,均符合正态分布(p>0.05)。由此可见,这种注射器真空驱动发生的液滴均一性较好,满足数字化分析要求。不同分析单元的液滴体积偏差的原因是单元内流动阻力的细微差异造成的流速差异。由于液滴数字化分析引入了体积校正,不同单元内液滴体积的偏差并不影响定量分析结果。
3.2液滴反应体系的稳定性
PDMS材质芯片在长时间培养中存在水分迁移问题[36]。如图4所示,原生PDMS芯片中的液滴在连续培养中体积持续降低,3 h内液滴体积可减少95%以上,提示存在水相油相PDMS的水蒸汽迁移途径。本研究从两个方面采取措施,有效控制水分迁移问题:一是芯片底层采用密闭的玻璃材料,部分降低蒸发效应; 二是在PDMS顶层覆盖矿物油,降低蒸发。如图4所示,在优化的芯片反应条件下,37℃孵育3 h后,液滴体积只降低了13.54% ± 5.65%; 孵育6 h后,液滴体积也只降低了20.79% ± 4.68%。
实验中还发现了油水界面成分串扰问题。在使用7500氟化油、十六烷和石蜡油的液滴体系中,均发现细菌穿梭于油水界面(图5)以及液滴内刃天青的油相扩散(图6),明显影响了液滴显色实验的稳定性和灵敏度。这些现象的产生可能是由于油水界面的屏蔽作用不足。本研究通过调整表面活性剂浓度改善液滴稳定性。结果表明,即使增加表面活性剂浓度,也不能完全消除7500氟化油、十六烷液滴体系存在的成分串扰,但添加3% ABIL EM90的石蜡油则可完全杜绝此问题。这是因为外表面活性剂增强了油水界面的稳定性,同时石蜡油具有较高的粘度,遏制了细菌游出。
3.3液滴内的细菌指示显色反应
液滴细菌显色反应以刃天为指示剂。刃天青指示细菌活性的原理是:在活性细菌的多种还原酶作用下,无荧光的刃天青转变为有荧光的试卤灵。鉴于液滴内细菌数量对于显色反应信号强度的影响,显色反应条件的优化均使用单细菌分散体系。本研究借助Syto 9染色,确定了适宜的输入细菌密度为1.5×106 CFU/mL。 在此输入密度下,理论上,100%的液滴内细菌数≤1,即每个液滴最多包裹1个细菌。
测定了刃天青显色信噪比相对孵育时间的变化,由图7A可见,培养2 h后,开始出现显著区别于噪声的荧光(+)信号。根据图7A的结果分析培养5 h的阳性液滴数量稳定时间,如图7B所示,3.5 h后,阳性液滴数不再增加,因此,后续实验均采用3.5 h作为反应终点时间。相较于传统试管方法12 h左右的显色反应时间,液滴显色反应所需时间大幅缩短,这得益于液滴分散对于样品和显色信号的相对富集效应。在液滴分散体系内只有部分液滴内包裹细菌,相应地液滴显色反应结果表现为“全”或“无”的形式,而宏观反应体系呈现的是平均反应强度。对于包裹细菌的液滴,液滴内细菌密度较宏观体系提高。例如,直径30 μm的液滴中包含单个细菌情况下,液滴内细菌密度约为9×106 CFU/mL,其密度相对于106 CFU/mL密度的细菌悬液提升9倍,而相对于105 CFU/mL的细菌悬液提升了90倍。由于液滴的封闭效应,液滴内的显色信号快速蓄积,因而可在较短时间内达到检测限。由于不同种类细菌存在代谢活性差异,这种液滴数字化显色分析方法的普适性需要通过测试更多种类细菌进行验证。
為了验证液滴刃天青显色方法对于细菌的特异性指示效果,借助图像指示,在1个液滴细菌分散体系内随机抽取100个不含菌的液滴和100个含活性菌液滴,使用非参数秩和检验分析了两组液滴内荧光强度的差异。结果表明,两组细菌的显色信号具有显著性差异(p<0.05),提示液滴刃天青显色法可特异性指示活性细菌 。
3.4液滴数字化分析对细菌定量分析效果的评价
选取5倍系列稀释获得的一系列梯度密度细菌悬液进行液滴数字化分析,并与平板接种计数方法进行了相关性分析。由图8可见,液滴数字化分析获得的系列细菌密度与理论浓度具有良好的线性关系(R2=0.99)。相关性分析结果表明,在105 ~108 CFU/mL范围内,液滴数字化方法测定的每个样品密度的RSD均小于5%,表明本方法具有良好的定量分析精度,液滴数字化分析与平板接种计数所获得的定量分析结果一致。
液滴数字化分析的定量分析效果取决于分散体系的规模,分散单元的数目越多,定量分析范围越宽,分析精度也越高。为了分析单元数目和每个单元内液滴数目,本研究发展的液滴数字化分析使用了约4×104左右的液滴数,实验结果表明,已经可获得足够的定量分析精度。如引入在线或离线样品预富集方法,采用本方法可望分析更低密度的细菌样品,。后续将进行更多种类细菌的测试,以评价方法在细菌分析中应用的普适性。
4结 论
建立了一种基于微流控液滴数字化显色分析的细菌快速定量分析方法。利用注射器真空发生液滴,操作简便可靠; 芯片采用平行分析单元设计,可提供适宜的测试通量。本方法定量分析精度高,定量分析RSD低于5%; 分析时间短,可在3.5 h内获得细菌定量分析信息。上述特点使得这种细菌定量分析方法非常适用于资源有限条件下的细菌快速检测。
References
1Austin B.Antonie Van Leeuwenhoek, 2017, 110(10): 1247-1256
2Wong I, Atsumi S, Huang W C, Wu T Y, Hanai T, Lam M L, Tang P, Yang J, Liao J C, Ho C M.Lab Chip, 2010,? 10(20): 2710-2719
3Salipante S J, Jerome K R.Clin. Chem., 2019,? 66(1): 117-123
4Adan A, Alizada G, Kiraz Y, Baran Y, Nalbant A.Crit. Rev. Biotechnol., 2017,? 37(2): 163-176
5FANG HanShu, LANG MingFei, SUN Jing. Chinese J. Anal. Chem., 2019,? 47(9): 1293-1301
方涵书, 郎明非, 孙 晶. 分析化学, 2019,? 47(9): 1293-1301
6Behera B, Vishnu G K A, Chatterjee S, Sitaramgupta V V, Sreekumar N, Nagabhushan A, Rajendran N, Prathik B H, Pandya H J.Biosens. Bioelectron., 2019,? 142: 111552
7Kumar S, Nehra M, Mehta J, Dilbaghi N, Marrazza G, Kaushik A.Sensors (Basel), 2019,? 19(20): 4476-4498
8Rajapaksha P, Elbourne A, Gangadoo S, Brown R, Cozzolino D, Chapman J.Analyst, 2019,? 144(2): 396-411
9Boedicker J Q, Li L, Kline T R, Ismagilov R F.Lab Chip, 2008,? 8(8): 1265-1272
10Kaminski T S, Scheler O, Garstecki P.Lab Chip, 2016,? 16(12): 2168-2187
11Basu A S.SLAS Technol, 2017,? 22(4): 369-386
12Men Y, Fu Y, Chen Z, Sims P A, Greenleaf W J, Huang Y.Anal. Chem., 2012,? 84(10): 4262-4266
13Bahder B W, Soto N, Komondy L, Mou D F, Humphries A R, Helmick E E.Plant Dis., 2019,? 103(8): 1918-1922
14Sanmiguel J, Gao G, Vandenberghe L H.Methods Mol. Biol., 2019,? 1950: 51-83
15Nie M, Zheng M, Li C, Shen F, Liu M, Luo H, Song X, Lan Y, Pan J Z, Du W.Anal. Chem., 2019,? 91(3): 1779-1784
16Hu Y, Xu P, Luo J, He H, Du W.Anal. Chem., 2017,? 89(1): 745-750
17Lee S, Lee W, Kim H, Bae P K, Park J, Kim J.Biosens. Bioelectron., 2019,? 131: 280-286
18Ng A, Fobel R, Fobel C, Lamanna J, Rackus D G, Summers A, Dixon C, Dryden M, Lam C, Ho M, Mufti N S, Lee V, Asri M, Sykes E A, Chamberlain M D, Joseph R, Ope M, Scobie H M, Knipes A, Rota P A, Marano N, Chege P M, Njuguna M, Nzunza R, Kisangau N, Kiogora J, Karuingi M, Burton J W, Borus P, Lam E, Wheeler A R.Sci. Transl. Med., 2018,? 10(438): 438-449
19Li N, Men W, Zheng Y, Wang H, Meng X.Molecules, 2019,? 24(23): 4384-4398
20Beneyton T, Krafft D, Bednarz C, Kleineberg C, Woelfer C, Ivanov I, VidakovicKoch T, Sundmacher K, Baret J C.Nat. Commun., 2018,? 9: 2391
21 LIN DongGuo, LIN JinQiong, LI PeiWen, YANG Na, XU BangLao, LIU DaYu. Chinese J. Anal. Chem., 2018, 46(1): 1-10
林冬果, 林锦琼, 李佩文, 杨 娜, 徐邦牢, 刘大渔. 分析化学, 2018, 46(1): 1-10
22Dolega M E, Abeille F, PicolletD'Hahan N, Gidrol X.Biomaterials, 2015,? 52: 347-357
23Thibault D, Jensen P A, Wood S, Qabar C, Clark S, Shainheit M G, Isberg R R, van Opijnen T.Nat. Commun., 2019,? 10: 5729
24Boedicker J Q, Li L, Kline T R, Ismagilov R F.Lab Chip, 2008,? 8(8): 1265-1272
25Kang D K, Ali M M, Zhang K, Huang S S, Peterson E, Digman M A, Gratton E, Zhao W.Nat. Commun., 2014,? 5: 5427
26Kaushik A M, Hsieh K, Chen L, Shin D J, Liao J C, Wang T H.Biosens. Bioelectron., 2017,? 97: 260-266
27Scheler O, Pacocha N, Debski P R, Ruszczak A, Kaminski T S, Garstecki P.Lab Chip, 2017,? 17(11): 1980-1987
28Ma Y D, Luo K, Chang W H, Lee G B.Lab Chip, 2018,? 18(2): 296-303
29Zhang Q, Zeng S, Qin J, Lin B.Electrophoresis, 2009,? 30(18): 3181-3188
30Hsieh K, Zec H C, Chen L, Kaushik A M, Mach K E, Liao J C, Wang T H.Anal. Chem., 2018,? 90(15): 9449-9456
31Teo A, Li K H, Nguyen N T, Guo W, Heere N, Xi H D, Tsao C W, Li W, Tan S H.Anal. Chem., 2017,? 89(8): 4387-4391
32Li Y, Jiang Y, Wang K, Wu W.Anal. Chem., 2018,? 90(20): 11925-11932
32WANG ZhiLe, WANG ZhuYuan, ZONG ShenFei, CUI YiPing.Chinese Optics, 2018,? 11(3): 513-530
王志樂, 王著元, 宗慎飞, 崔一平. 中国光学, 2018,? 11(3): 513-530
33SHI Yang, SHAO XiaoGuang. Chinese Journal of Chromatography, 2019, 37(9): 89-94
石 杨, 邵小光. 色谱, 2019, 37(9): 89-94
34Xu B, Du Y, Lin J, Qi M, Shu B, Wen X, Liang G, Chen B, Liu D.Anal. Chem., 2016,? 88(23): 11593-11600
35Chuang Y C, Chu C K, Lin S Y, Chen L J.Soft Mat., 2014,? 10(19): 3394-3403
- 丰富探究经历,培养学生数感
- 巧用学生“三心”,培育问题意识
- 树立数据分析观念,提升数学素养
- 在活动中体验数学 在生活中感悟数学
- 如何根据学情确定复习材料
- 让计算课更加生动有趣
- “亲近民俗数学”班本课程的实践与研究
- “观察—猜想—操作—验证—实践”五步教学法
- 创新能力的培养要从娃娃抓起
- 借“错”发挥 精彩纷呈
- 核心素养下如何追求灵动的“苏式”课堂
- 精设“陷阱”,“诱”出计算的精彩
- “让”当先,“引”适时,“学”“思”相得益彰
- 引领深度对话 助推思维生长
- 基于学情分析的教学活动设计
- 数学教学应贴近生活
- 六年级简便计算总复习教学研究
- 追寻好玩的数学课
- 创新情境诚可贵 教材情境价更高
- 以图为媒介,开启数学思维之门
- 浅谈积累数学基本活动经验的现状与策略
- 例谈拓展练习的点睛之笔
- 浅谈如何在解决问题中培养学生的画图策略
- 是什么?为什么?怎么办?
- “异分母分数加减法”教材比较分析
- denouncing
- dens
- den's
- dense
- densely
- densen
- denseness
- densenesses
- denser
- densest
- densities
- density
- dent
- dental
- dental floss
- dental flosses
- dentalities
- dentality
- dentalization
- dentally
- dentals
- dented
- denting
- dentist
- dentistries
- 杜口绝言
- 杜口裹舌
- 杜口裹足
- 杜句驱疟
- 杜嘿
- 杜园
- 杜墙不出
- 杜如晦
- 杜威
- 杜子春
- 杜宇
- 杜宇啼
- 杜宇啼血
- 杜宇魂
- 杜审言
- 杜家村
- 杜少陵集详注
- 杜布切克
- 杜康
- 杜康仪狄
- 杜康造酒
- 杜延年
- 杜弊
- 杜律
- 杜微慎防