都明理 徐娇 朱楚然


摘要:镜检北柴胡、狭叶柴胡、三岛柴胡染色体数目,利用流式细胞技术测定基因组大小,为柴胡基因组测序奠定基础。采用常规压片及显微镜方法观测柴胡体细胞染色体数目,以柴胡嫩叶为材料,采用LB01解离液和碘化丙啶荧光染料,利用基因组大小已知的番茄(H-1706、潘那利)作为内标,采用流式细胞术对其基因组大小进行测定。结果表明,北柴胡、三岛柴胡体细胞染色体数目分别为12、26条,基因组大小估测分别为989.80 Mb和2.14 Gb;狭叶柴胡群体内存在2种类型:一种类型的叶片窄,成熟植株的根外皮为棕红色,染色体数为12条;另一种叶片较宽,成熟植株的根外皮为浅黄色,染色体数为26条,基因组大小估测分别为782.50 Mb和1.92 Gb。3种柴胡的染色体数目确定和基因组大小估测可为柴胡全基因组测序和细胞学等研究提供依据。
关键词:柴胡;流式细胞技术;基因组大小;染色体数目
中图分类号: S567.23+9.01? 文献标志码: A? 文章编号:1002-1302(2019)11-0191-03
柴胡是多年生草本植物,以干燥根入药,是我国常用的大宗中药材之一,具有疏散退热、疏肝解郁、升举阳气等功效。《中华人民共和国药典》2015版一部规定,柴胡正品药材为伞形科植物北柴胡(Bupleurum chinense DC.)和狭叶柴胡(B. scorzonerifolium Willd.)的干燥根[1]。三岛柴胡(B. falcatum L.)为日本药用柴胡栽培品种,在我国也有种植[2]。
随着测序技术的发展,越来越多药用植物的全基因组完成了测序[3-5]。药用植物全基因组信息的明确将快速推动其分子水平相关研究的深入开展,有助于人们了解和利用其遗传及代谢机制。全基因组测序前通常需确定染色体数目,预估基因组大小。目前进行基因组大小评估的主要方法包括孚耳根微显影法[6]、流式细胞术[7]以及Survey测序法[8]。流式细胞術具有操作简单和分辨率、准确率高的优点,被广泛地应用于测定不同物种(如黄芩[9]、巴戟天[10]、灵芝[11]等)基因组大小的研究中。
柴胡属植物体态呈禾草状,形态变异大,花、果结构相对来说变异较小,但其种类划分仍是植物分类鉴定方面的难点之一。同时,柴胡属是一个染色体多基数的属,基数以6、7、8常见[12]。姜传明等对黑龙江省及东北柴胡属的研究发现,三岛柴胡为二倍体,2n=20或2n=26;北柴胡染色体数目为 2n=12 或2n=24,推测其可能为四倍体;狭叶柴胡为二倍体,染色体数目为2n=12[13-14]。郭丽华的研究表明,北柴胡、三岛柴胡、狭叶柴胡染色体数目分别为2n=24、2n=26、2n=12[15]。刘宏伟在对北柴胡品种川北柴1号的染色体镜检中发现,其染色体数目为2n=12[16]。邵天玉在对北柴胡和狭叶柴胡的染色体进行比较研究时发现,北柴胡和狭叶柴胡的染色体数目分别为2n=18和2n=8[17]。可见同一种柴胡的染色体数目也存在很大变化。柴胡属不同种基因组大小预测可见报道的有6个种,包括三岛柴胡,为2.72 Gb,不包括北柴胡和狭叶柴胡[18-19]。本研究镜检拟进行基因组测序的柴胡样品染色体数目,并预测基因组大小,旨在为柴胡全基因组测序奠定基础。
1 材料与方法
1.1 试验材料
北柴胡选择中柴2号品种,狭叶柴胡选择黑龙江省明水县种植品种,三岛柴胡选择河北安国种植品种。从各产区种植点收集种子,统一种植于中国医学科学院药用植物研究所栽培育种试验基地。基因组大小估测试验中作为内标(对照)的番茄为Solanum lycopersicon(H-1706番茄,基因组大小为950 Mb)和S. pennellii(潘那利番茄,基因组大小为 1.25 Gb)。
1.2 试验方法
1.2.1 染色体数目测定 柴胡种子萌发后,待根长至 0.5 cm 时取根尖,置于饱和对二氯苯和α-溴代萘水溶液中,在4 ℃冰箱中预处理12 h后,用甲醇与冰醋酸(V甲醇 ∶ V冰醋酸=3 ∶ 1)固定1 h以上,1 mol/L盐酸45 ℃处理45 min,蒸馏水冲洗,然后用卡宝品红染色,常规压片,显微镜观察并选取分散良好的分裂相照相。
1.2.2 流式细胞技术测定柴胡基因组大小
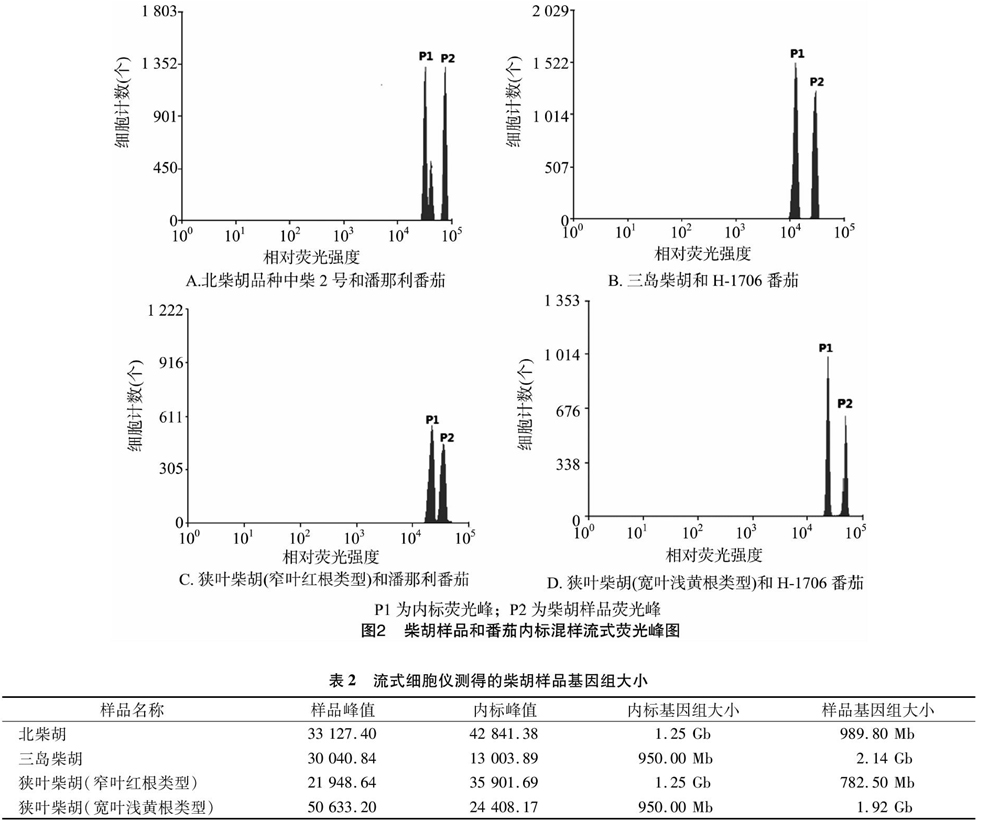
1.2.2.1 细胞核悬液的制备与DNA特异性染色 采集柴胡样品的新鲜叶片组织,每个样品取20~50 mg,分别置于加入1 mL LB01解离液(配方见表1)的培养皿中,并迅速用锋利的刀片将其快速切碎。温和地吸取培养皿中的解离液过滤至1.5 mL 的EP管中,加入100 μL碘化丙啶荧光染料,置于 4 ℃ 冰箱中避光染色10 min,随即上机检测。对照样品的处理方法同上,并将待测样品与对照样品进行混合制样(细胞核悬液进行等比例混匀),每个上机样品中有3 000~5 000个细胞核。
1.2.2.2 基因组大小测定及计算 上机前将样品振荡5 s,采用488 nm的蓝光激发,收集625/26通道的荧光,检测PI发射的荧光强度以确定DNA相对含量;再通过流式细胞仪自带的软件Summit 5.2分析数据并进行显著性统计分析。基因组大小计算方法:待测样本基因组大小=对照样本基因组大小×[(待测样本G0/G1峰荧光强度)/(对照样本G0/G1峰荧光强度)],其中G0/G1表示处于G0和G1细胞分裂期的细胞数量比值。
2 结果与分析
2.1 染色体数目测定
采用传统的根尖染色体制片法进行镜检,结果(图1)发现,北柴胡品种中柴2号和三岛柴胡的体细胞染色体数目分别为12、26条;狭叶柴胡存在2种类型,一种类型叶片窄,成熟植株的根外皮为棕红色,体细胞染色体数为12条,另一种类型叶片宽,成熟植株的根外皮为浅黄色,体细胞染色体数为26条。
2.2 基因组大小的测定
以2种番茄(H-1706番茄和潘那利番茄)为内标,分别测定4个柴胡样品的基因组大小,测定样品和内标混合后的PI发射荧光强度,结果(图2)发现,峰P1和P2分别为番茄内标和柴胡样品的荧光峰,可见两者分度较好,无重叠现象。根据“1.2.2.2”节中的公式计算得到,北柴胡、三岛柴胡基因组大小分别为989.80 Mb、2.14 Gb;狭叶柴胡群体中2种类型植株,窄叶红根类型的基因组大小为782.50 Mb,宽叶浅黄根类型的基因组大小为1.92 Gb(表2)。
3 结论与讨论
染色体有种属特异性,不同地区居群所产生的形态变异与它们的染色体数和核型变异相联系,因此染色体变异可较为直接地反映物种在环境条件作用下的遗传变异性,染色体资料是从本质上探讨分类和进化的有效资料之一。柴胡属不同种染色体数目变化较大,存在多种基数,同一种内也存在不同基数和不同倍性现象。基数x为4,是伞形科中发现的最低染色体基数。北柴胡已报道的基数有x=6和x=10,已报道的北柴胡多倍体类型有四倍体2n=4x=24和八倍体2n=8x=48[12],本研究测定的北柴胡样品染色体数目为2n=12,应为基数x=6的二倍体。三岛柴胡染色体数目同样存在不同情況的报道,本研究测得26条染色体,是报道中较常见的类型,结合以往报道,三岛柴胡样品应为基数x=13的二倍体。狭叶柴胡样品中存在2种类型,其中窄叶类型根外皮为棕红色,应为真正的狭叶柴胡,染色体数目为2n=12,也是较常见的类型;宽叶类型根外皮为浅黄色,可能是种植过程中混合了其他柴胡种质。
借助流式细胞仪来测定植物基因组大小具有简单、快速、准确的特点,所以应用得越来越广泛。但在实际的测定过程中,提取液、提取材料、内标植物的选择均可能对其基因组大小估测的准确性有一定影响。笔者后期又利用二代高通量测序技术(Illumina Hiseq 2000)测定了北柴胡、狭叶柴胡(窄叶红根类型)和三岛柴胡的基因组大小,测序数据采用 Kmer=17进行分析,预估3种柴胡基因组大小分别为 1.03 Gb、746.52 Mb和2.08 Gb(待发表),该结果与流式细胞术测得的结果基本相符,表明流式测定结果可靠,而以往报道预测的三岛柴胡基因组大小为2.72 Gb[18],可能是由于材料的差异或是试验过程的差异。
致谢:感谢中国科学院植物研究所公共技术服务中心提供的流式细胞技术,感谢中国科学院植物研究所公共技术服务中心的杨素华工程师在流式细胞术测定柴胡基因组大小试验中提供的帮助。
参考文献:
[1]国家药典委员会. 中华人民共和国药典(一部)[M]. 北京:中国医药科技出版社,2015:198.
[2]刘 敏,余 马,李玉婵,等. 北柴胡和三岛柴胡根系构型差异研究[J]. 时珍国医国药,2017,28(5):1198-1199.
[3]王云生. 基于高通量测序的植物群体基因组学研究进展[J]. 遗传,2016,38(8):688-699.
[4]Xu H B,Song J Y,Luo H M,et al. Analysis of the genome sequence of the medicinal plant Salvia miltiorrhiza[J]. Molecular Plant,2016,9(6):949-952.
[5]Urasaki N,Takagi H,Natsume S,et al. Draft genome sequence of bitter gourd (Momordica charantia),a vegetable and medicinal plant in tropical and subtropical regions[J]. DNA Research,2017,24(1):51-58.
[6]Olszewska M J,Osiecka R. The relationship between 2 C DNA content,systematic position,and the level of nuclear DNA endoreplication during differentiation of root parenchyma in some dicotyledonous shrubs and trees. Comparison with herbaceous species[J]. Biochemie und Physiologie der Pflanzen,1984,179(8):641-657.
[7]Baumgarth N,Roederer M. A practical approach to multicolor flow cytometry for immunophenotyping[J]. Journal of Immunological Methods,2000,243(1/2):77-97.
[8]唐 其,马小军,莫长明,等. 罗汉果全基因组Survey分析[J]. 广西植物,2015,35(6):786-791.
[9]张琳琳,曹 博,白成科. 应用流式细胞术测定药用植物黄芩基因组大小[J]. 中国农学通报,2013,29(25):130-135.
[10]王云鹏,肖博允,熊文波,等. 流式细胞术测定巴戟天基因组大小[J]. 中药新药与临床药理,2018,29(5):657-660.
[11]李秋实,徐 江,朱英杰,等. 基于流式细胞技术的灵芝基因组大小估测[J]. 菌物学报,2013,32(5):899-906.
[12]梁乾隆,王长宝,马祥光,等. 中国柴胡属染色体数目和核型研究[J]. 植物科学学报,2013,31(1):11-22.
[13]姜传明,路 芳,彭一良. 东北柴胡属染色体数目[J]. 黑龙江农垦师专学报,2002(4):59-60.
[14]姜传明,路 芳,徐 娜,等. 黑龙江省柴胡属染色体数目[J]. 哈尔滨师范大学自然科学学报,1992,8(4):96-99.
[15]郭丽华. 北柴胡、南柴胡和三岛柴胡比较生物学的研究[D]. 哈尔滨:东北农业大学,2003.
[16]刘宏伟. 秋水仙素对北柴胡的诱导研究[D]. 绵阳:西南科技大学,2017.
[17]邵天玉. 北柴胡和狭叶柴胡的比较研究及其类缘分析[D]. 延吉:延边大学,2007.
[18]Das A B,Mallick R. Karyotype diversity and interspecific 4C DNA variation in Bupleurum[J]. Biologia Plantarum,1993,35(3):355-363.
[19]Suda J,Kyncl T,Freiova R. Nuclear DNA amounts in Macaronesian angiosperms[J]. Annals of Botany,2003,92(1):153-164.
- 微生态制剂在水产养殖业中的应用
- 紫云英配施化肥对土壤腐殖质各组分的影响
- 水稻新品种两优1598特征特性及高产栽培技术
- 生物炭、磁性炭的制备与应用研究进展
- 有机肥替代部分化肥对马铃薯生长的影响
- 生态智慧园林理念在公园植物景观设计中的应用
- 辽宁鞍山地区油松人工林经营措施
- 景宁县望东垟高山湿地自然保护区伯乐树资源调查与保护
- 繁昌县古树名木资源调查及特征分析
- 青桐栽培技术研究
- 间伐修枝对幼龄落叶松生长与林下植物的影响
- 宽甸县森林不同龄组碳储量研究
- 退化林的形成原因与治理修复对策
- 福建省重点生态公益林区顺昌县景观格局变化分析
- 大棚葡萄栽培管理技术
- 大豆分离蛋白对鲜切苹果保鲜效果的研究
- 不同采收期对猕猴桃果实耐贮性的影响
- 油用牡丹产业化的制约因素及对策
- 冬小麦化肥减量有机肥配施栽培技术
- 铜陵地区再生稻栽培技术及效益分析
- 望江县水稻生产的灾害风险与防灾技术
- 寒地水稻生殖生长阶段高产栽培技术
- 水稻机插秧同步侧深施肥技术试验
- 双季早稻机插同步侧深施肥减量增效栽培技术示范
- 塞罕坝自然保护区唇形科几种野生药用植物的形态特征与药用价值分析
- enjoyments
- enjoys
- enjoy yourself
- enlarge
- enlargeable
- enlarged
- enlargedly
- enlargedness
- enlargednesses
- enlargement
- enlargements
- enlarge on
- enlarge on sth
- enlargers
- enlarges
- enlarging
- enlargingly
- enlighten
- enlightened
- enlightenedly
- enlightenedness
- enlightenednesses
- enlightener
- enlighteners
- enlightening
- 芳林新叶催陈叶,流水前波让后波
- 芳枝
- 芳桂
- 芳椒
- 芳樽
- 芳气
- 芳泽
- 芳洁
- 芳洁的厅堂
- 芳洁的屋舍
- 芳洁的心地
- 芳津
- 芳洲
- 芳流
- 芳润
- 芳澤
- 芳灵蕙性
- 芳烈
- 芳物
- 芳猷
- 芳甸
- 芳睐
- 芳缄
- 芳羞
- 芳翰