周凤鸣 缪礼鸿 刘蒲临

摘要:氮磷含量超标是导致水体富营养化的主要原因,向水体中投加有机碳源能促进生物絮团的形成并净化水质。以产朊假丝酵母固体菌剂为研究对象,探究其对生物絮团的形成、氨氮与总磷去除效果的影响。结果表明,以膨化玉米粉作为固态载体吸附产朊假丝酵母去除氨氮和总磷效果最佳;在试验水体中投加10 mg/L活性产朊假丝酵母固体菌剂与10 μL/L活性菌液,均有明显降低水中氨氮、总磷含量的作用,其中投加活性固体菌剂效果最明显,光照培养9 d后其氨氮与总磷的去除率分别为50.49%和38.24%,比空白对照组提高了67.63%和55.51%。通过相差显微镜观察得出,投加固体菌剂后,在水体中能形成明显的生物絮团结构,原生动物与原生藻类数量明显增加。比较室内、室外2种培养条件下试验结果表明,室外培养条件下投加固体菌剂水样氨氮和总磷去除率分别为69.52%和 53.69%,较空白对照组提高了17.99%和30.57%;室内培养条件下,投加固体菌剂水样氨氮和总磷去除率分别为 55.37% 和42.79%,较空白对照组提高了51.00%和41.13%。在人工接种铜绿微囊藻的水体中投加固体菌剂培养 10 d 后,铜绿微囊藻的生长受到明显抑制,氨氮与总磷去除率分别达98.70%与40.48%,表明向水体中投加产朊假丝酵母固体菌剂具有调控水体生物群落的作用并能提高对氨氮和总磷的去除率。
关键词:产朊假丝酵母;固体菌剂;生物絮团;氨氮;总磷;铜绿微囊藻
中图分类号:X172 ? 文献标志码: A ?文章编号:1002-1302(2019)14-0295-05
水产高密度养殖系统中存在的高污染、高发病率问题已经成为制约养殖业健康发展的关键因素。生物絮团技术的发展为上述问题的解决提供了新的方法[1-2]。生物絮团是由水体中的细菌、藻类、浮游动植物与有机碎屑等经过生物絮凝而成的具有自我繁殖能力的团聚物[3],这种团状物质能在净化水质的同时为水产养殖动物提供优质生物饵料等[4-6]。有研究表明,向水体中投加一定量的碳源能促进生物絮团的形成,常用的碳源有葡萄糖、蔗糖、稻壳、麦麸、玉米粉等,载体的选择应综合考虑碳源的费用、生物降解率以及载体分散性[7]。陈海兵将稻壳粉与益生菌混合添加到养殖水体中,不仅降低了养殖成本,而且有助于异养微生物有效吸收降解水体中的氨氮、亚硝酸盐氮等有害物质并维持养殖水体的稳定性[8]。叶建勇等研究发现,投加甘蔗渣悬浮颗粒和芽孢杆菌能有效促进水体中生物絮团的形成,提高氨氮、亚硝态氮等有害物质的降解量,有效改善水质[9]。
笔者所在实验室前期研究表明,投加产朊假丝酵母(Candida utilis)液态菌剂能够较好地去除水体中氨氮与总磷[10]。本研究將产朊假丝酵母与有机固体载体相结合,探究其投入水体后对生物絮团形成和氮磷去除率的影响,以期为人工调控养殖水体微生物群落和富营养化水体的生物修复提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种与材料 产朊假丝酵母SG607,由笔者所在实验室分离并保存。铜绿微囊藻(Microcystis aeruginosa)905,购自中国科学院水生生物研究所藻种保藏中心。藻种经活化后于光照度为2 000 lx、光—暗周期为14 h—10 h的 25 ℃ 人工气候箱中培养。膨化玉米粉等固体载体均为市购。
1.1.2 培养基 产朊假丝酵母采用醇母浸出粉胨葡萄糖(YPD)培养基[11]和氨基酸废液培养基[12]培养,铜绿微囊藻采用BG11培养基[13]培养。
1.1.3 试验水样 以取自湖北省武汉市某中心公园的景观池塘水作为本试验用的天然水样。为比较投加菌液与固体菌剂对水中氨氮含量影响,模拟配制天然加富水样,即在天然水样中补加 8.0 mg/L NH4Cl和0.6 mg/L NaH2PO4。
1.2 试验方法
1.2.1 产朊假丝酵母菌液及固体菌剂制备 将保存的产朊假丝酵母SG607菌株接种到YPD培养基平板上,30 ℃活化培养 2 d,取经活化的菌种接入YPD液体培养基中,于30 ℃、170 r/min条件下培养20 h后,转接到氨基酸废液培养基中,于30 ℃、170 r/min条件下培养18 h,制备成酵母菌液;将菌液与固体载体按质量比1 ∶ 2混合均匀后,制备成固体菌剂,备用。
1.2.2 不同产朊假丝酵母固体菌剂对水样中氨氮与总磷去除率的影响 取2 mg不同载体的固体菌剂分别加入到盛有200 mL天然加富水样的三角瓶中,以不进行任何处理的水样为空白对照,以加入 2 μL 菌液的水样为菌液空白对照,于人工气候箱中光照培养7 d后,测定其氨氮、总磷质量浓度,每个处理3次重复。
1.2.3 活性产朊假丝酵母及灭活产朊假丝酵母对水样中生物絮团形成及氨氮、总磷去除率的影响 取2 μL活性菌液、2 mg 活性固体菌剂分别加入到盛有200 mL天然加富水样的三角瓶中,以添加等量的无菌水、灭活菌液、膨化玉米粉、灭活固体菌剂作为对照,于人工气候箱中光照培养9 d,测定细菌活菌数及氨氮、总磷质量浓度,并使用荧光相差显微镜观察拍照,每个处理3次重复。
1.2.4 室内外不同培养条件下产朊假丝酵母菌剂对氨氮与总磷去除率的影响 室内培养在人工气候箱中进行,分别取2 μL菌液、2 mg固体菌剂加入到盛有200 mL天然加富水样的三角瓶中培养,空白对照瓶中添加2 μL无菌水。室外试验在60 cm×30 cm×50 cm的塑料箱中进行,分别取650 μL菌液、650 mg固体菌剂投加至装有65 L天然加富水样的长方形塑料箱中,空白对照组中加入650 μL无菌水,连续培养13 d后,测定水中细菌活菌数与氨氮、总磷质量浓度,每个处理3次重复。
1.2.5 产朊假丝酵母SG607菌液及固体菌剂对天然加富水样中铜绿微囊藻生长的影响 在200 mL天然加富水样中接入藻细胞浓度为1.15×107 CFU/mL的铜绿微囊藻2 mL,然后分别加入2 μL菌液、2 mg固体菌剂,对照组采用2 μL无菌水、2 μL无菌载体分别替代2 μL菌液、2 mg固体菌剂,在光照培养箱中培养10 d,取样测定藻细胞数及氨氮、总磷质量浓度。每个处理3次重复。
1.2.6 藻细胞数、细菌总数、氨氮质量浓度和总磷质量浓度的测定 藻细胞数的测定采用血球计数板计数法,测定3次取平均值;水中细菌总数的测定采用牛肉膏平板涂布法;藻液经0.45 μm微孔滤膜过滤后测定滤液中氨氮、总磷质量浓度,氨氮质量浓度的测定采用苯酚次氯酸盐法,总磷质量浓度的测定采用钼酸铵分光光度法,本研究涉及所有水体常规理化指标的测定参照《水和废水监测分析方法》(第四版)[14]。
1.2.7 试验时间与地点 室外水样试验于2016年9月8—30日在湖北省武汉市东西湖区常青公园进行,当时气温范围为20~32 ℃;室内水样试验于2016年5—10月在武汉轻工大学资源与环境微生物实验室人工培养气候箱中完成。
2 结果与分析
2.1 不同载体吸附产朊假丝酵母对水样氨氮与总磷去除率的影响
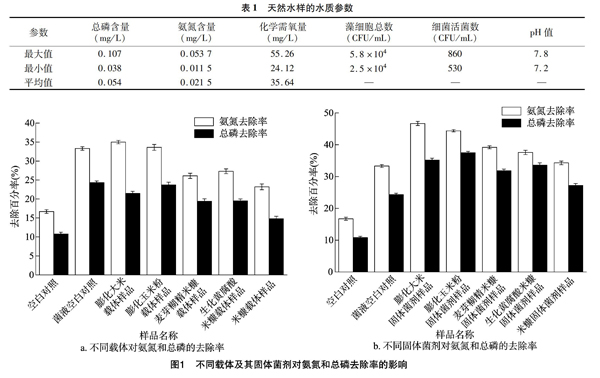
为研究不同载体吸附产朊假丝酵母SG607对水中氨氮与总磷去除率的影响,分别将不同载体及其吸附后的固体菌剂投加至天然加富水样(水质参数见表1)中,光照培养1周后比较水样中氮磷含量。结果(图1)表明,相较于空白对照组,投加载体和固体菌剂的处理均具有一定降解氨氮与总磷的效果,其中投加固体菌剂的处理效果更好,且不同载体吸附产朊假丝酵母降解氨氮与总磷效果有明显差异,其中膨化大米和膨化玉米粉吸附产朊假丝酵母投入天然加富水样后的氨氮与总磷去除率较高,其氨氮去除率分别为46.7%和44.4%,分别较空白对照高179.64%和165.87%;总磷去除率分别为35.2%和37.5%,分别较空白对照高225.93%和247.22%。综合考虑,后续试验均选用膨化玉米粉为载体。
2.2 产朊假丝酵母固体菌剂对生物絮团形成及氨氮、总磷去除率的影响
各处理水样的显微观察结果(图2)显示,与对照(图2-a)相比,添加固体载体及其固体菌剂的水样中均能观察到少量原生动物和丝状藻类。投加菌液的水样中藻类长势良好、生物絮团结构明显且在藻类周边能观察到少量酵母细胞(图2-e)。投加载体、灭活固体菌剂与固体菌剂的水样中均观察到黑色固体颗粒(图2-b、图2-d、图2-f),其中投加 10 mg/L 固体活性菌剂的水样中生物絮团形成良好,且该水样中的藻类、原生动物最丰富(图2-f),氨氮及总磷去除率最高分别达50.49%和38.24%(图3),与空白对照相比其氨氮和总磷的除率分别提高了67.63%和55.51%,与投加灭活固体菌剂的对照相比其氨氮与总磷去除率分别提高了21.45%和19.69%。
2.3 不同培养条件对产朊假丝酵母固体菌剂去除氨氮及总磷的影响
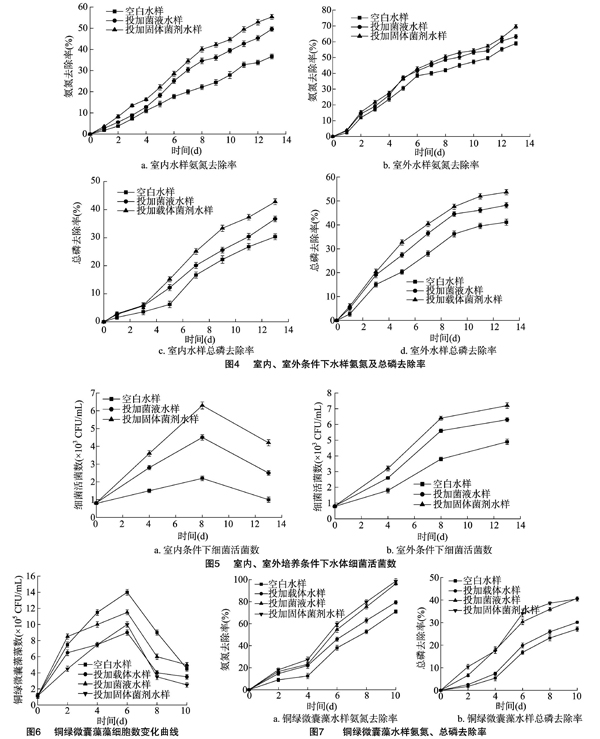
将产朊假丝酵母菌液与固体菌剂分别加入天然加富水樣中,比较在室内和室外2种不同条件下对氨氮和总磷的去除效果。结果(图4)表明,室外空白对照组氨氮与总磷去除率(分别为58.92%和41.12%)均高于室内空白对照组(分别为36.67%和30.32%);室外培养条件下,投加固体菌剂水样氨氮及总磷去除率分别为69.52%和53.69%,较投加菌液水样分别提高了9.98%和11.37%,比空白水样提高了 17.99% 和30.57%。室内培养条件下,投加固体菌剂水样氨氮、总磷去除率分别为55.37%、42.79%,较投加菌液水样去除率提高了11.72%、16.63%,比空白提高了51.00%、41.13%。
在2种不同的培养条件下,投加固体菌剂的水样中细菌活菌数均高于投加菌液(图5),室外培养时投加固体菌剂水样的细菌活菌数最高为7.2×103 CFU/mL,比投加菌液与空白水样分别增加了14.29%、46.94%;室内培养13 d时投加固体菌剂细菌活菌数为4.2×103 CFU/mL,比较投加菌液与空白水样增加了68%和320%,且室内水样细菌活菌数在第8天达到最高峰,而室外细菌活菌数在第13天仍呈增长趋势,表明室外条件下细菌活菌数高于室内培养,环境中微生物对试验水体中细菌活菌数有一定影响。
2.4 产朊假丝酵母SG607对天然加富水样中铜绿微囊藻生长的影响
由图6可知,在培养第6天时,各水样中的铜绿微囊藻细胞数均达到最大值。添加菌液、载体及其固体菌剂后,铜绿微囊藻的生长均受到明显抑制;添加固体菌剂后水样中的铜绿微囊藻细胞数在培养第6天时高于加入载体水样,但在第8天后均低于其他处理组。
如图7所示,添加固体菌剂水样氨氮去除率最高达 98.70%,与空白水样相比提高38.96%,添加固体菌剂与投加菌液水样中总磷去除率差异较小,最高分别为40.48%与 40.76%,与空白水样相比分别提高了49.21%与50.24%。
3 讨论
本研究比较测定了米糠、膨化玉米粉等不同含碳载体及其吸附产朊假丝酵母后制备的固体菌剂对水体中氨氮和总磷的去除率,得出膨化玉米粉作为载体吸附产朊假丝酵母的处理效果最佳。有研究表明,玉米经膨化加工后,淀粉被充分糊化,具有很好的水溶性[15]。膨化玉米粉比表面积大,具有较好的吸附性,投加到水中后分散性和悬浮性好,能为细菌、藻类、原生动物等微生物提供良好的附着基和有机碳源,有利于水体中的微生物生长和生物絮团的形成。
本研究表明,投加固体菌剂水样中的氮磷去除效果明显优于只投加载体或菌液的处理,其水样中的细菌活菌数与原生动物数量均为最高。这可能是由于产朊假丝酵母菌剂具有促进水体中多种微生物生长的作用,使水体中有更多的氮磷营养元素被吸收转化成微生物的生物量。Cai等研究表明,当藻类与酵母一起培养时,水中生物的多样性与生物活性提高[16]。此外,人工投加碳源能在一定程度上促进生物絮团的形成和微生物群落结构的变化,从而降低水中氮磷含量[17-18]。
本研究结果表明,室外培养条件下投加固体菌剂及空白对照水体的氨氮及总磷去除率与细菌活菌数均明显高于室内人工气候箱中培养的水体。从试验条件分析二者的区别主要在于光照、温度和溶解氧含量。已有研究表明,随着室外气温的升高,水体的温度也逐渐升高,氨氮的降解系数逐渐增大[19-20],且自然条件下光照与溶解氧更充足,水中耗氧与有机物分解速度快,更有利于水中浮游生物的生长和氮磷的吸收转化[21]。
投加产朊假丝酵母固体菌剂与菌液均能在一定程度上抑制铜绿微囊藻的生长并降低水中氮磷含量,可能是由载体及酵母菌剂的添加促进了水体中其他原生藻类及异养细菌的生长,与铜绿微囊藻竞争营养所致。有研究表明,天然加富水体中原生藻类与铜绿微囊藻之间具有一定竞争关系,添加部分碳源后铜绿微囊藻可与异养微生物、原生动物等形成生物絮团,从而降低水中微囊藻生物量[22-24]。
4 结论
通过比较不同含碳载体及其吸附产朊假丝酵母后制备的固体菌剂对水体中氮磷去除率的影响,优选出以膨化玉米粉为载体制备的固体菌剂对水中氮磷去除率和生物絮团的形成效果最佳。
向天然加富水样中投加活性固体菌剂和菌液,相比灭活试验组均有明显降低水中氨氮、总磷含量的作用,其中投加活性固体菌剂效果最明显,通过相差显微镜观察可知,投加固体菌剂、菌液与灭活固体菌剂处理组水样中的生物絮团、原生藻类和原生动物的数量均有所增加。
在室内、室外培养条件下分别投加10 mg/L的固体菌剂培养14 d后,室外处理组水样中氨氮与总磷去除率分别比室内处理组高25.56%和25.47%。室外培养条件下水中细菌总数一直处于增长阶段并在培养第14天时达到最大值,为7.2×103 CFU/mL,而室内培养条件下细菌总数在第8天达到最高值后开始下降,最终细菌总数为4.2×103 CFU/mL。
在人工添加铜绿微囊藻的水样中投加10 mg/L固体菌剂培养10 d后,铜绿微囊藻生长受到明显抑制,氨氮与总磷去除率分别达98.70%与40.48%。
参考文献:
[1]Chen Y W,Qin B Q,Teubner K,et al. Long-term dynamics of phytoplankton assemblages:microcystis-domination in lake Taihu,a large shallow lake in China[J]. Journal of Plankton Research,2003,25(4):445-453.
[2]盧炳国. 生物絮团技术在草鱼养殖中的应用研究[D]. 上海:上海海洋大学,2013:14-17.
[3]de Schryver P,Crab R,Defoirdt T,et al. The basics of bio-flocs technology:the added value for aquaculture[J]. Aquaculture,2008,277(3/4):125-137.
[4]李 涛,杨平凹,白海锋,等. 生物絮团对锦鲤生长及养殖水体水质的影响[J]. 河北渔业,2017,23(8):18-20,38.
[5]龙丽娜,李 源,管崇武,等. 生物絮团技术在水产养殖中的作用研究综述[J]. 渔业现代化,2013,40(5):28-33.
[6]谢 航,邱宏端,林 娟,等. 假丝酵母菌降解养殖水体氨氮的特性研究[J]. 农业工程学报,2005,21(8):142-145.
[7]李志斐,王广军,余德光,等. 生物絮团对养殖水体水质和微生物群落功能的影响[J]. 上海海洋大学学报,2015,24(4):503-512.
[8]陈海兵. 以稻壳粉为碳源利用生物絮团技术对养殖水体的净化效果研究——以南美白对虾养殖为例[D]. 扬州:扬州大学,2006:18-24.
[9]叶建勇,单洪伟,王贤丰,等. 添加甘蔗渣悬浮颗粒和芽孢杆菌对凡纳滨对虾生长和养殖环境的影响[J]. 中国海洋大学学报(自然科学版),2016,46(4):43-49.
[10]Kong Y,Xu X Y,Zhu L,et al. Control of the harmful alga microcystis aeruginosa and absorption of nitrogen and phosphorus by candida utilis[J]. Applied Biochemistry and Biotechnology,2013,169(1):88-99.
[11]陈 雪,甄玉国,赵小丽. 以糖蜜为碳源的酿酒酵母培养基的优化[J]. 中国酿造,2014,33(4):35-38.
[12]曾德霞,缪礼鸿,周凤鸣,等. 利用氨基酸废液发酵制备酵母蛋白饲料的工艺[J]. 粮食与饲料工业,2016,12(7):39-43.
[13]孔 赟,缪礼鸿,朱 亮,等. 溶藻放线菌对铜绿微囊藻和小球藻竞争生长的影响[J]. 生态环境学报,2010,19(11):2657-2662.
[14]魏复盛. 水和废水监测分析方法[M]. 4版.北京:中国环境科学出版社,2002:234-268.
[15]李 丽,孙 杰,李军国,等. 膨化玉米品质评价指标的研究[J]. 饲料工业,2014,35(3):21-26.
[16]Cai S Q,Hu C Q,Du S B. Comparisons of growth and biochemical composition between mixed culture of alga and yeast and monocultures[J]. Journal of Bioscience and Bioengineering,2007,104(5):391-397.
[17]史明明,刘 晃,龙丽娜,等. 碳源供给策略对水产养殖废水生物絮团处理效果的影响[J]. 农业机械学报,2016,47(6):317-323.
[18]夏 耘,邱立疆,郁二蒙,等. 生物絮团培养过程中养殖水体水质因子及原核与真核微生物的动态变化[J]. 中国水产科学,2014,21(1):75-83.
[19]王 蓉,黄天寅,吴 玮. 典型城市河道氮、磷自净能力影响因素[J]. 湖泊科学,2016,28(1):105-113.
[20]贡丹丹,刘德富,张佳磊,等. 周期性的温度扰动对藻类群落结构演替的影响[J]. 环境科学,2016,37(6):2149-2157.
[21]徐华兵,王龙乐,曾权辉,等. 水下LED光照对凡纳滨对虾养殖水体环境因子和浮游植物群落变化的影响[J]. 生态科学,2017,36(5):24-27.
[22]张晶晶,周 进,张怀瑾,等. 不同营养条件下铜绿微囊藻(Microcystis aeruginosa)和小球藻(Chlorella vulgaris)的生长竞争行为[J]. 海洋与湖沼,2016,47(5):1013-1023.
[23]Spolaore P,Joannis-Cassan C,Duran E,et al. Commercial applications of microalgae[J]. Journal of Bioscience and Bioengineering,2006,101(2):87-96.
[24]汤佩武,李勤慎,刘 哲,等. 基于生物絮团技术的糖蜜添加对西北盐碱池塘水质和浮游生物的影响[J]. 淡水渔业,2014,44(2):83-88.
- 温泉旅游发展对策研究
- 基于体验经济视角休闲旅游的开发与营销推广
- 基于扎根理论的自驾车营地游客满意度影响因素研究
- 旅游纪念品开发中地方元素的融入探讨
- 乡村旅游产品开发存在的问题和对策研究
- “互联网+”背景下乡村可持续发展旅游模式的研究
- 哈尔滨节庆旅游发展存在的问题及对策分析
- 旅游资源与旅游产品的关系辨析
- 大庆市休闲观光农业发展研究
- 案例教学法在旅游教学中的应用探讨
- 开放教育旅游专业模拟训练环节的研究与实践
- 中职旅游管理专业实践教学改革之我见
- 中职学校模拟导游课程建设探索
- 自媒体与大学生旅游动机的调查分析
- 基于现代学徒制下的高职酒店管理专业建设
- 高职旅游管理专业人才培养模式的建构与相关问题阐述
- 关于高职旅游类专业礼仪教育的思考
- 拓展训练在旅游教学中的应用研究
- 拓展训练在旅游教学中的应用研究
- 职业技能大赛推动酒店专业内涵式发展作用研究
- 终身教育理念下的酒店管理专业中高职衔接探讨
- 中职旅游管理专业工学交替存在的问题及对策
- 大学生创业教育对创业自我效能的影响
- 湘江新区深度对接高职院校服务类专业合作办学的思考与实践
- 高职旅游课程信息技术化教学应用的思考
- semicolon
- semicolonially
- semicolons
- semi-column
- semicomical
- semicomically
- semicommercially
- semi-commoner
- semicommunicative
- semiconcealed
- semi-conductor
- semiconductor
- semiconductors
- semiconfinement
- semiconfinements
- semiconformist
- semiconformists
- semiconformities
- semiconformity
- semiconically
- semi-conscious
- semi-conservative
- semi-conservatively
- semicontinuously
- semiconventional
- 波委雾合
- 波尔·罗瓦亚尔语法
- 波尔卡
- 波尔布特
- 波属云委
- 波属雾委
- 波峭
- 波峰
- 波希米亚
- 波平
- 波平如镜
- 波平浪静
- 波平风静
- 波形编辑合成
- 波影晃动的样子
- 波德莱尔
- 波心
- 波恩
- 波恩条约
- 波惜枯鳞
- 波扇
- 波手
- 波折
- 波拿巴新闻管制
- 波文