刘雪 关丽杰

摘要:初步探究苯丙烯菌酮对水稻稻瘟病病菌的抑菌机制。采用紫外分光光度法测定参与水稻稻瘟病病菌细胞壁降解的2个关键酶(几丁质酶和β-1,3-葡聚糖酶)活性以及菌体细胞外的磷浓度;采用荧光分光光度法测定PI-DNA复合物(碘化吡啶)荧光强度;采用气质联用法(GC-MS)测定甾醇类物质含量变化。结果表明,用10 mg/L苯丙烯菌酮处理水稻稻瘟病病菌后,菌体内的几丁质酶和β-1,3-葡聚糖酶活性均升高,药剂处理1 h后酶活性明显升高,分别是对照组的1.69倍和3.76倍,细胞外的磷浓度在1 h后明显升高,3 h时是对照组的1.29倍,24 h时PI-DNA复合物荧光强度急剧升高,为对照组的19.71倍,然后用10 mg/L苯丙烯菌酮处理6 h后6-乙酰氨基麦角甾醇含量与对照组相比减少了96.83%,酵母甾醇则消失。结果表明,苯丙烯菌酮可以破坏水稻稻瘟病菌细胞壁和细胞膜功能结构,起到抑菌作用。
关键词:水稻稻瘟病菌;杀真菌剂;苯丙烯菌酮;作用机制;植物病原真菌
中图分类号: S435.111.4+1 ?文献标志码: A ?文章编号:1002-1302(2019)22-0117-04
水稻稻瘟病是一类重要的水稻病害,并且水稻稻瘟病病菌侵染能力强,能在短时间内快速传播[1-2],同时易发生菌丝融合现象,形成多核体,这种变异增加了水稻病害防治工作的难度[3]。全球每年因为水稻减产造成很大的经济损失,迫切需要一种新型环境友好的杀菌剂来解决水稻病害[4]。苯丙烯菌酮别称异补骨脂查尔酮,是天然植物补骨脂提取物中的一个重要活性成分。有研究表明,二聚黄酮类化合物对人类致病酵母菌和丝状真菌均有较好的抑菌效果[5],查尔酮类化合物也具有优良的抗细菌真菌活性[6]。据报道,异补骨脂查尔酮具有多种药理活性,包括抗细菌、抗真菌、抗病毒、抗炎和抗肿瘤作用[7]。Zhang等在抑菌试验中发现,枯草芽孢杆菌 KB-1122对稻瘟病菌生长有明显的抑制作用,经过二维聚丙烯酰胺凝胶电泳和蛋白组分析试验发现,甘油醛-3-磷酸脱氢酶和丝氨酸蛋白激酶与枯草杆菌KB-1122的抑菌作用密切相关[8]。柠檬醛可以提高几丁质酶活性,从而破坏水稻稻瘟病菌细胞壁完整性,达到抑菌目的[9]。硝基苯乙烯类化合物能明显抑制稻瘟病菌的黑色素合成相关酶3HNR的活性,显示出抑菌效果[10]。
盆栽试验和田间试验已经证实了苯丙烯菌酮乳油剂对稻瘟病菌有较好的防治效果[11]。扫描电镜结果显示,经 10 mg/L 苯丙烯菌酮处理后,水稻稻瘟病菌菌丝界限变得模糊,且相互交连发生融合,菌体形态发生了明显变化。本试验为进一步明确苯丙烯菌酮对水稻稻瘟病菌的杀菌机制,通过测定细胞壁水解酶(几丁质酶和β-1,3葡聚糖酶)活性[12-13]、细胞膜通透性试验、PI荧光检测和甾醇类物质成分分析试验,探究苯丙烯菌酮对稻瘟病菌菌体细胞壁和细胞膜的作用[14-15],为苯丙烯菌酮杀菌作用提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 主要试剂 苯丙烯菌酮(异补骨脂查尔酮),购自成都普菲德生物技术有限公司;丙酮,购自福晨(天津)化学试剂厂;葡萄糖,购自天津市大茂化学试剂厂;酵母浸粉,购自安琪酵母股份有限公司;琼脂,购自福建省金燕海洋生物科技股份有限公司。
1.1.2 供试菌种 水稻稻瘟病菌(Pyricularia oryzae Cav.),由沈阳化工研究院生物测定中心提供。
1.1.3 培养条件 稻壳培养基(1 000 mL):稻壳30 g,葡萄糖5.0 g,酵母浸粉1.4 g,琼脂20~25 g,MgSO4 0.25 g。
PDA液體培养基(1 000 mL):马铃薯200 g,葡萄糖20 g。
1.1.4 主要仪器 DHG-9149A型电热恒温鼓风干燥箱,购自上海精宏实验设备有限公司;MPLR-702四孔恒温水浴锅,购自金坛市大地自动化仪器厂;SHZ-DZⅢ循环水式真空泵,购自河南省巩义市予华仪器有限责任公司;SZ-93自动双重纯水蒸馏器,购自上海亚荣生化仪器厂;SCIENTZ-ⅡD超声波细胞破碎仪,购自宁波新芝生物科技股份有限公司;SPX-250B-Z生化培养箱,购自上海博迅实业有限公司医疗设备厂;SW-CJ-IG单人净化工作台,购自苏州净化设备有限公司;TBL-16G-A高速冷冻离心机,购自上海安亭科学仪器厂;TSQ-280振荡培养箱,购自上海精宏实验设备有限公司。
1.2 试验方法
1.2.1 苯丙烯菌酮对稻瘟病菌细胞壁的影响
1.2.1.1 菌丝的制备 取5 mL水稻稻瘟病菌孢子悬液接入PDA培养液中,置于28 ℃、150 r/min振荡培养6 d后进行处理,苯丙烯菌酮处理浓度为10 mg/L,对照加等量丙酮,每个处理设3次重复。药剂处理后,在时间为0、1、3、6、12、24 h收集菌丝,抽干水分后在-20 ℃下保存。
1.2.1.2 酶液的提取 称取1 g菌丝,加入5 mL Tris-HCl(0.05 mol/L,pH值7.5)缓冲液,超声破碎30 min(工作5 s间歇3 s)。然后将破碎的细胞匀浆转移至EP管中,4 ℃、12 000 r/min 离心15 min,取上清液置于-80 ℃储存备用。
1.2.1.3 几丁质水解酶含量测定 向洁净的试管中加入 0.2 mL 胶状几丁质,用0.1 mL乙酸钠缓冲液(浓度为 0.1 mol/L,pH值4.5)和不同时间处理酶液0.3 mL,于40 ℃下水浴1 h(空白用三蒸水代替酶液),流水冷却至室温。12 000 r/min 离心10 min,移取上清液0.25 mL,加40 μL 10%脱盐蜗牛酶,37 ℃保温存1 h,冷却。然后加0.1 mL硼酸钾溶液(0.8 mol/L),沸水浴3 min,冷却至室温,加2 mL 1%二甲基胺硼烷(DMAB)溶液于37 ℃水浴20 min,冷却,于波长585 nm处测定吸光度。根据N-乙酰葡萄糖胺标准曲线y=0.059x-0.007(r2=0.997)进行计算。以单位鲜质量样品在单位时间内产生的N-乙酰葡萄糖胺为1个酶活力单位。
U=(D-Do)×VtFW×Vs×t。
式中:D为样品中几丁质酶水解生成的N-乙酰葡萄糖胺含量;Do为空白组N-乙酰葡萄糖胺含量;Vt为酶液总体积,mL;Vs为反应酶液体积,mL;FW为样品的鲜质量,g;t为反应时间,h。
1.2.1.4 β-1,3-葡聚糖水解酶含量测定 β-1,3-葡聚糖水解酶含量测定的反应体系包括0.05 mol/L pH值5.0的乙酸钠缓冲液(含1%昆布多糖)、0.16 mL 0.05 mol/L乙酸钠(pH值5.0)缓冲液和300 μL各处理酶液(空白用三蒸水代替酶液),充分混匀,37 ℃保温1 h,使其充分水解为葡萄糖,采用DNS法测定还原糖的量,向各反应体系中加入 3,5-二硝基水杨酸试剂沸水浴5 min,流水立即冷却,定容至 3 mL,于540 nm波长下测D值[16]。根据葡萄糖标准曲线计算酶活性:y=0.173x-0.009,r2=0.998。以单位鲜质量样品在单位时间内产生的还原糖为1个酶活力单位。
U=(D-Do)×VtFW×Vs×t。
式中:D为样品中β-1,3葡聚糖水解酶水解生成的还原糖含量;Do为空白组还原糖含量;Vt为酶液总体积,mL;Vs为反应酶液体积,mL;FW为样品的质量,g;t为反应时间,h。
1.2.2 苯丙烯菌酮对稻瘟病菌细胞膜的影响
1.2.2.1 菌悬液的制备 取5 mL水稻稻瘟病菌孢子悬液接入PDA培养液中,于28 ℃、150 r/min振荡培养6 d后进行处理,苯丙烯菌酮处理浓度为10 mg/L,对照加等量丙酮,每个处理设3个重复。药剂处理后0、1、3、6、12、24 h取样。
1.2.2.2 磷浓度标准曲线 磷浓度标准曲线的制备:准确称取经100 ℃干燥至恒质量的磷酸二氢钾43.9 g,加水溶解并定容至250 mL,精确量取10 mL于100 mL容量瓶中,稀释至刻度,得到0.004 mg/mL的参比溶液。分别取参比试剂0、1、3、5、7、9 mL于25 mL具塞试管中,加6 mL定磷试剂[水 ∶ 3 mol/L 硫酸 ∶ 2.5%钼酸铵 ∶ 10%维生素C为 2 ∶ 1 ∶ 1 ∶ 1],加水稀释至25 mL,摇匀,45 ℃水浴20 min,冷却至室温,在660 nm波长处测定吸光度,并以磷浓度为横坐标、吸光度为纵坐标绘制标准曲线y=0.242 8x+0.009 6,r2=0.996。
1.2.2.3 胞外磷浓度含量测定 分别在药剂处理后0、1、3、6、12、24 h取菌悬液8 mL,3 000 r/min离心10 min,精确量取上清液5 mL于平底烧瓶中,加9 mol/L硫酸溶液5 mL,直火缓慢加热15 min,冷却至室温,滴加过氧化氢5 mL,继续加热15 min,冷却,转移至100 mL容量瓶中,稀释至刻度,精确量取5 mL,余下步骤同“1.2.2.2”节磷浓度标准曲线测定方法。根据标准曲线计算磷浓度,磷浓度单位为μg/mL。
1.2.2.4 PI-DNA荧光检测 用灭菌后的超纯水配制 50 μg/mL 的PI溶液,置于棕色瓶内,4 ℃下避光保存。取 5 mL 菌悬液于离心管中,加入1 mL PI溶液和1 mL药剂,充分混合,在37 ℃下进行温育反应,分别在反应0、1、3、6、12、24 h时测定其荧光值(激发波长和发射波长分别为535、615 nm)。
1.2.2.5 甾醇成分分析 取菌丝0.5 g于50 mL具塞试管中,加2.5 mL PBS和6 mL新鲜配制的皂化剂,充分混匀,80 ℃ 水浴皂化1 h。加6 mL石油醚60 ℃提取3次,收集馏分,加水洗涤。醚层60 ℃水浴挥干石油醚,得到未皂化脂,加色谱纯环己烷(1 mL/g湿菌)后于-20 ℃保存[17]。
色谱条件:5% HP-5MS(Phenyl Siloxane)30.0 m×0.250 mm×0.25 μm;柱温:初温度100 ℃,最终温度300 ℃,进样口温度250 ℃;载气:氦气1.0 mL/min。质谱标准库:NBS谱库。
2 结果与分析
2.1 苯丙烯菌酮对水稻稻瘟病菌细胞壁的影响
2.1.1 苯丙烯菌酮对水稻稻瘟病菌几丁质酶活性的影响 由图1可知,经10 mg/L苯丙烯菌酮处理后,菌体内几丁质酶活性明显高于对照组。药剂处理1 h,几丁质酶活性为对照组1.69倍,处理3、6、12、24 h后分别是对照组的1.41倍、1.54倍、1.33 倍、1.43倍。几丁质是真菌细胞壁的主要成分,是由N-乙酰葡糖胺通过β连接聚合而成的结构同多糖。几丁质酶活性升高导致几丁质水解速度加快,细胞壁几丁质层受损,其功能受到影响,使菌体无法正常生长。
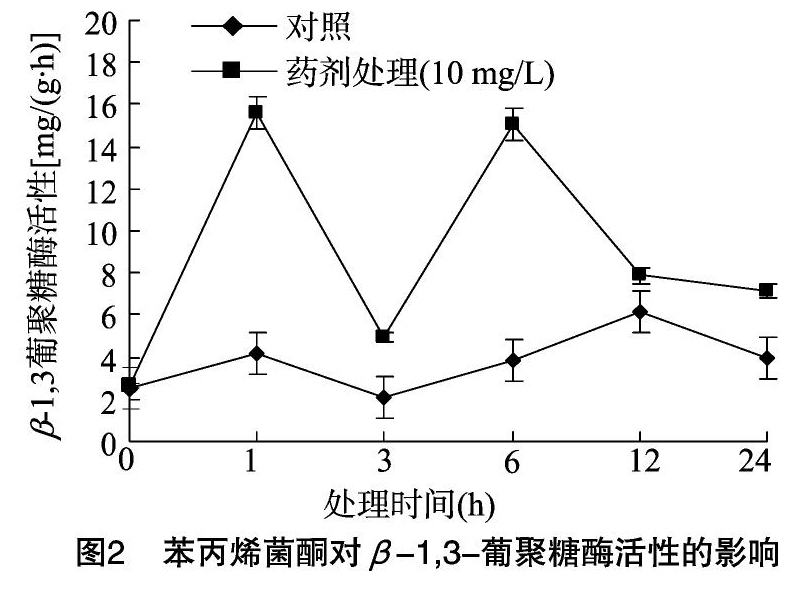
2.1.2 苯丙烯菌酮对水稻稻瘟病菌β-1,3-葡聚糖酶活性的影响 由图2可知,药剂处理组菌体内β-1,3-葡聚糖酶活性明显高于对照,在药剂处理后1、3、6、12、24 h后分别是对照组的3.76倍、2.33倍、3.91倍、1.29倍、1.81倍。葡聚糖是以葡萄糖为单糖组成的同型多糖,葡萄糖单元之间以糖苷键连接,是真菌细胞壁的重要组成部分。经苯丙烯菌酮处理后,菌体内β-1,3葡聚糖酶活性升高,葡聚糖发生水解,引起稻瘟病菌细胞壁降解,所以药剂通过破坏真菌细胞壁达到抑菌目的。
2.2 苯丙烯菌酮对稻瘟病菌细胞膜的影响
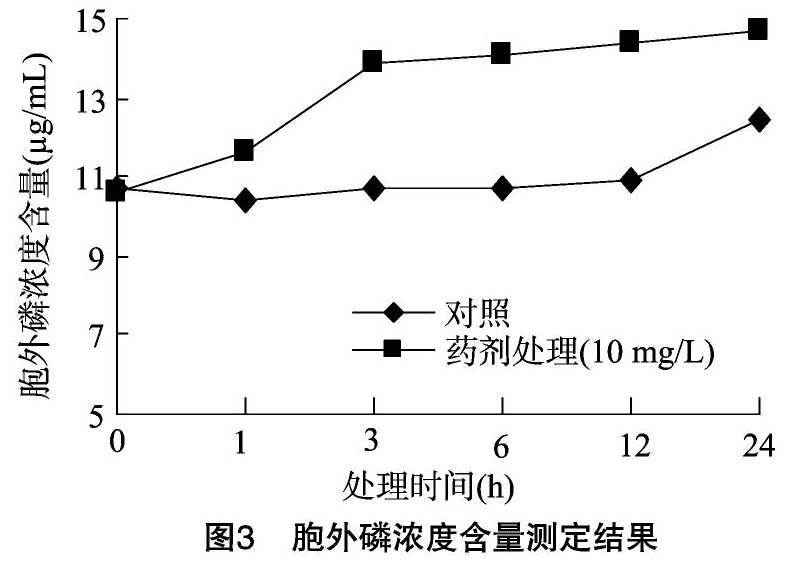
2.2.1 苯丙烯菌酮对稻瘟病菌细胞膜通透性的影响 磷是真菌细胞内的重要营养物质,主要以多磷酸盐形式存在,正常细胞胞外磷浓度远远小于胞内磷浓度,但当细胞膜受到损伤时,胞液渗漏可使胞外磷浓度升高,分别在药剂处理菌悬液0、1、3、6、12、24 h后取菌悬液测定胞外磷浓度,结果如图3所示。
由图3可知,在药剂处理1 h后胞外磷濃度明显升高,药剂处理1、3、6、12、24 h后胞外磷浓度分别是对照组的1.12倍、1.29倍、1.31倍、1.31倍、1.17倍。由此可知,杀菌剂苯丙烯菌酮处理菌体细胞后,真菌细胞膜发生一定程度的破损,导致营养物质泄露。
2.2.2 PI-DNA荧光检测结果 PI是一种可对DNA染色的细胞核染色剂,它是一种溴化吡啶的类似物,在嵌入双链DNA后释放红色荧光。PI不能穿透完整细胞膜,只有当细胞处于凋亡晚期或者死亡时,染色剂才可以进入细胞并与核酸物质结合形成PI-DNA复合物,结果如图4所示。
由图4可以看出,在药剂处理菌悬液1 h内,复合物荧光值没有明显变化,处理1 h后荧光值缓慢上升,处理3、6、12 h时分别是对照组的6.35倍、3.24倍、8.30倍,24 h时复合物荧光值急剧升高为对照组的19.71倍。由此可以推测,苯丙烯菌酮处理稻瘟病菌后,菌体胞膜严重受损,染色剂进入细胞内1 h后,菌体开始慢慢凋亡,24 h时细胞达到凋亡晚期,细胞膜完全破裂,细胞最终死亡。
2.2.3 苯丙烯菌酮对甾醇类物质含量的影响 由图5至图7可知,10 mg/L苯丙烯菌酮处理后菌体酵母甾醇消失,6-乙酰氨基麦角甾醇成分减少。表1显示,苯丙烯菌酮处理组与空白组、对照组相比分别减少了96.83%、97.07%。麦角甾醇是真菌细胞膜的重要成分,与细胞膜流动性和稳定性密切相关。麦角甾醇含量降低,细胞膜会形成小孔,而酵母甾醇是麦角甾醇的前体物质。由此可见,苯丙烯菌酮可能作用于麦角甾醇合成途径,破坏稻瘟病菌细胞膜结构,起到抑菌作用。
3 结论
通过对真菌细胞壁水解相关酶活性的测定,结果表明,用10 mg/L苯丙烯菌酮处理稻瘟病菌后几丁质酶和β-1,3葡聚糖酶,其活性均升高,药剂处理1 h,几丁质酶活性为对照组1.69倍;β-1,3葡聚糖酶在药剂处理1、3、6、12、 24 h后分别是对照组的3.76倍、2.33倍、3.91倍、1.29倍、1.81倍。几丁质和葡聚糖都是真菌细胞壁的重要组成部分,其水解酶活性升高会加快细胞壁降解,导致细胞壁结构受损,进而影响其功能。稻瘟病菌胞外磷浓度在药剂处理1 h后含量增加,是对照组的1.12倍;PI-DNA复合物荧光强度在药剂处理24 h时显著升高为对照组的19.71倍;膜通透性试验和PI荧光检测试验表明,苯丙烯菌酮可以破坏菌体细胞膜功能,导致营养物质泄露,并且细胞膜完整性遭到破坏,菌体最终死亡。甾醇成分分析结果显示,细胞膜上麦角甾醇合成途径受阻,细胞膜形成小洞,流动性和稳定性下降。综上,苯丙烯菌酮可以破坏稻瘟病菌细胞壁和细胞膜结构功能及其完整性,从而达到抑菌目的。
参考文献:
[1]戴余有,邢 海,裘珺琳,等. 吡唑醚菌酯·稻瘟灵防治水稻稻瘟病应用研究[J]. 绿色科技,2017(23):154-156.
[2]周志伟. 水稻稻瘟病发生情况及综合防治现状[J]. 农民致富之友,2016(5):53.
[3]李 杨,王耀雯,王育荣,等. 水稻稻瘟病菌研究进展[J]. 广西农业科学,2010,41(8):789-792.
[4]Lee W,Lee D G. An antifungal mechanism of curcumin lies in membrane-targeted action within Candida albicans[J]. IUBMB Life,2014,66(11):780-785.
[5]Wang S Y,Sun Z L,Liu T,et al. Flavonoids from Sophora moorcroftiana and their synergistic antibacterial effects on MRSA[J]. Phytotherapy Research,2014,28(7):1071-1076.
[6]Kulkarni R R,Tupe S G,Gample S P,et al. Antifungal dimeric chalcone derivative kamalachalcone E from Mallotus philippinensis[J]. Natural Product Research,2014,28(4):245-250.
[7]Kuete V,Sandjo L P. Isobavachalcone:an overview[J]. Chinese Journal of Integrative Medicine,2012,18(7):543-547.
[8]Zhang C X,Zhang X X,Shen S H. Proteome analysis for antifungal effects of Bacillus subtilis KB-1122 on Magnaporthe grisea P131[J]. World Journal of Microbiology and Biotechnology,2014,30(6):1763-1774.
[9]Li R Y,Wu X M,Yin X H,et al. Naturally produced citral can significantly inhibit normal physiology and induce cytotoxicity on Magnaporthe grisea[J]. Pesticide Biochemistry Physiology,2015,118:19-25.
[10]Chen H,Han X,Qin N,et al. Synthesis and biological evaluation of novel inhibitors against 1,3,8-trihydroxynaphthalene reductase from Magnaporthe grisea[J]. Bioorganic & Medicinal Chemistry,2016,24(6):1225-1230.
[11]关丽杰,姜翠杰,赵礼慧,等. 0.1%异补骨脂查耳酮乳油防治水稻稻瘟病药效试验[J]. 农药,2012,51(3):228-230.
[12]Dalonso N,Goldman G H,Miranda Gern R M. β-(1→3),(1→?6)-Glucans:medicinal activities,characterization,biosynthesis and new horizons[J]. Applied Microbiology and Biotechnology,2015,99(19):7893-7906.
[13]Walker S S,Xu Y,Triantafyllou I,et al. Discovery of a novel class of orally active antifungal β-1,3-D-glucan synthase inhibitors[J]. Antimicrobial Agents and Chemotherapy,2011,55(11):5099-5106.
[14]Leconte O,Bonfils J P,Sauvaire Y. Protetive of iridals from saponin injury in Candida albicans cells[J]. Phytochemistry,1997,44(4):575-579.
[15]于 洋,孔繁翔,王美林,等. 应用流式细胞技术研究铜对藻细胞膜完整性及脂酶活性的影响[J]. 应用与环境生物学报,2006,12(5):706-709.
[16]陳见晖,周 卫. 钙对苹果果实过氧化物酶、β-1,3-葡聚糖合成酶和β-1,3-葡聚糖分解酶活性的影响[J]. 中国农业科学,2004,37(3):400-405.
[17]张军东. 抗真菌天然产物的筛选与分子机制研究[D]. 上海:第二军医大学,2006.
- 继承扶养合同研究
- 上市公司私有化法律问题研究
- 理工科大学生人文素质调查分析
- J.K罗琳演讲的积极话语态度评价
- 西安皮影的可持续发展策略
- 以萨满艺术为例谈黑龙江少数民族民间美术的文化内涵
- 运用新媒体创新企业思想政治工作的新途径
- 基于AHP的铁路物资供应商选择评价研究
- 试论提高当代高校教师职业道德修养的途径与方法
- 不当得利返还请求权案例评析
- 改革过程中的渐进决策研究
- 浅析中国农民工社会保障体系问题及对策
- 代物清偿的性质与效力分析
- 浅析中原地域文化在品牌设计中的应用
- 我国新型职业农民培育模式研究
- 高校防诈骗教育的研究与对策
- 论本土资源在民法典编纂中的重要性
- 解读日本企业文化特点与利弊
- 再论审判程序正义的价值与功能
- 江西省农村自来水工程规划编制的若干问题及对策
- 以需求为导向的景德镇市应用型物流人才培养体系构建
- 买受人期待权及其执行制度探讨
- 计算机网络安全面临的问题及对策探究
- 新形势下计算机网络信息安全存在的威胁及对策分析
- 防垃圾乱扔、垃圾溢出新型垃圾桶软件系统设计与实现
- self-oppressor
- self-oppressors
- self-ordainer
- self-ordainers
- self-oriented
- self-origination
- self-originations
- self-oscillate
- self-oscillating
- self-outlaw
- self-outlaws
- self-ownership
- self-ownerships
- self-paid
- self-pampered
- self-pampering
- self-parodies
- self-parodist
- self-parodists
- self-peace
- self-peaces
- self-penetration
- self-penetrations
- self-penned
- self-perceiving
- 转致
- 转舵
- 转莲花卫足葵
- 转萍
- 转蓬
- 转蓬身
- 转薄
- 转行
- 转衔
- 转街
- 转视,回视
- 转角
- 转角梁
- 转角沙发
- 转解
- 转计
- 转让
- 转让帝位
- 转讽
- 转诊
- 转词
- 转译
- 转详
- 转语
- 转语二十章序