陈欣瑜 周荃 罗梅
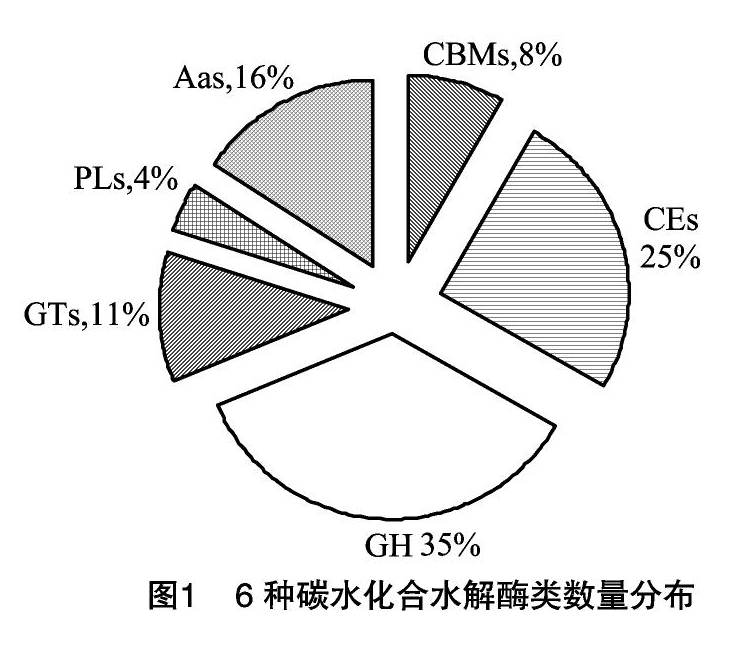

摘要:花生黑腐病(Cylindrocladium black rot of peanut,简称CBR)是由寄生帚梗柱孢霉(Cylindrocladium parasiticum Crous,Wingfield & Alfenas)侵染引起的一种严重的检疫性病害,给农业生产造成了巨大的经济损失。以笔者所在实验室前期获得的花生黑腐病菌全基因组18 366个蛋白序列为基础,利用CAZymes Analysis Toolkit预测程序进行注释,共获得注释碳水化合水解酶(CAZymes)1 197个,分为6个家族,分别为191个辅助酶(auxiliary activities,简称AAs)、137个糖基转移酶(glycosyl transferases,简称GTs)、422个糖苷水解酶(glycoside hydrolases,简称GHs)、48个多糖裂解酶(polysaccharide lyases,简称PLs)、300个碳水化合物酯酶(carbohydrate esterases,简称Ces)、99个碳水化合物绑定结构(carbohydrate-binding modules,简称CBMs)。根据Blast2GO对花生黑腐病菌CAZymes蛋白的功能分析结果,将CAZymes分为3大类分别为生物进程、细胞成分、分子功能类。该研究可为进一步解析CAZymes的功能奠定基础,为深入研究该致病菌侵染植物的作用机制提供了一定的理论依据。
关键词:花生黑腐病菌;寄生帚梗柱孢霉;水化合水解酶;全基因组;分析
中图分类号: S435.652 ?文献标志码: A ?文章编号:1002-1302(2019)22-0052-04
花生黑腐病(Cylindrocladium black rot of peanut,简称CBR),别称圆锥黑斑病或大豆红顶腐烂病,是一种由寄生帚梗柱孢霉(Cylindrocladium parasiticum Crous,Wingfield & Alfenas)侵染引起的真菌性病害[1-2]。该病害最早于1965年在美国乔治亚州的花生产区被发现[1],目前已蔓延到美国东南部、日本、印度及澳大利亚的花生产区[1-4]。该病害可侵染花生的果针、荚果和根系,罹病部位变黑腐烂,并导致植株萎蔫和死亡,是一种毁灭性的病害[5]。由于其潜在危险性,我国于2007年将寄生帚梗柱孢霉列入《中华人民共和国进境植物检疫性有害生物名录》中[6-7]。花生黑腐病是一种典型的土传和种传病害。其中,种子传播是病害迅速蔓延的最主要原因,这也加大了其防治难度。农业防治采取3~5年轮作的防治方法,该方法仅能控制微小菌核数量,不能有效控制病害的发生;化学防治方面,目前没有有效的杀菌剂可以使用;在发病严重区域,土壤熏蒸可起到一定作用,但是费用昂贵[7-8]。目前,我国对花生黑腐病病害防治的主要方法是培养抗性品种,但目前还没有培育出高抗品种,只有一些中抗的花生品种[9]。因此,从分子生物学角度进一步研究花生黑腐病菌致病机制对于该病的防治具有重要意义。
碳水化合水解酶类(carbohydrate active enzymes,簡称CAZymes)在病原真菌的致病过程中具有重要的作用。病原真菌分泌的碳水化合水解酶参与了侵染寄主植株的过程,是植物病原菌侵染过程中突破寄主细胞第1道屏障的关键因素。碳水化合水解酶类尤其是植物细胞壁降解酶对病原菌的侵染能力和特性具有重要作用[10-11]。近年来,随着越来越多病原菌全基因组测序的完成,CAZymes的注释和比较分析成为了重要的研究方向[12]。近年来,碳水化合物结构与功能活性酶类(carbohydrate-active enzymes database,简称CAZy)数据库的建立[13]极大地推进了国内外学者对于植物病原菌细胞壁降解酶活性基因的注释与聚类分析工作。目前CAZymes主要分为6大类分别为辅助酶类家族(auxiliary activities,简称AAs)、糖基转移酶(glycosyl transferases,简称GTs)、糖苷水解酶(glycoside hydrolases,简称GHs)、多糖裂解酶(polysaccharide lyases,简称PLs)、碳水化合物酯酶(carbohydrate esterases,简称CEs)、碳水化合物绑定结构家族(carbohydrate-binding modules,简称CBMs)[14]。目前,已经有多种病原菌的CAZymes得到分析[10,15-16]。但是迄今为止,对帚梗柱孢霉CAZymes的分析仍未见报道。笔者所在实验室前期测定并组装了花生黑腐病菌Cylpar14017菌株的全基因组序列,本研究在此基础上利用生物信息学手段对其CAZymes进行注释分析,揭示CAZymes家族的分类情况,以期为今后深入开展其CAZymes的功能研究提供参考。
1 材料与方法
1.1 基因组数据来源
本研究分析所用基因组数据来源于仲恺农业工程学院植物病理学研究所前期测序获得的花生黑腐病菌Cylpar14017菌株的全基因组拼接序列,共包含18 366个蛋白序列。
1.2 方法
CAT(CAZymes Analysis Toolkit,http://cricket.ornl.gov/cgi-bin/cat.cgi)数据包是专门用于CAZymes注释和分析的程序[14]。基于dbCAN数据库,用Hmmer 3.0搜索CAZymes的编码基因,采用hmmscan-parser和all.hmm.ps.len进行处理,然后通过CAT程序进行CAZymes比对预测,获得花生黑腐病菌的CAZymes蛋白。用Blast2GO分析花生黑腐病菌CAZymes蛋白,结合WEGO整理分析结果。
2 结果与分析
2.1 花生黑腐病菌CAZymes总体分布
将“1.1”节中获得的18 366个序列和CAT数据包进行比对,共有 1 114 个蛋白序列,获得注释水解酶家族总数为1 197个。其中CBM为99个、CE为300个、GH为422个、GT为137个、PL为48个、AA为191个。GHs含量最高,占总数的35%,CEs、AAs、GTs、CBMs、PLs分别占总数的25%、16%、11%、8%、4%(图1)。而CBM的99个基因归类于22个基因家族;CE的300个基因归类为12个基因家族;GH的422个基因归类在64个基因家族;GT的137个基因归类为37个基因家族;PL则为8个家族,而AA的191个基因归类于9个家族中。
2.2 花生黑腐病菌中含有的GHs
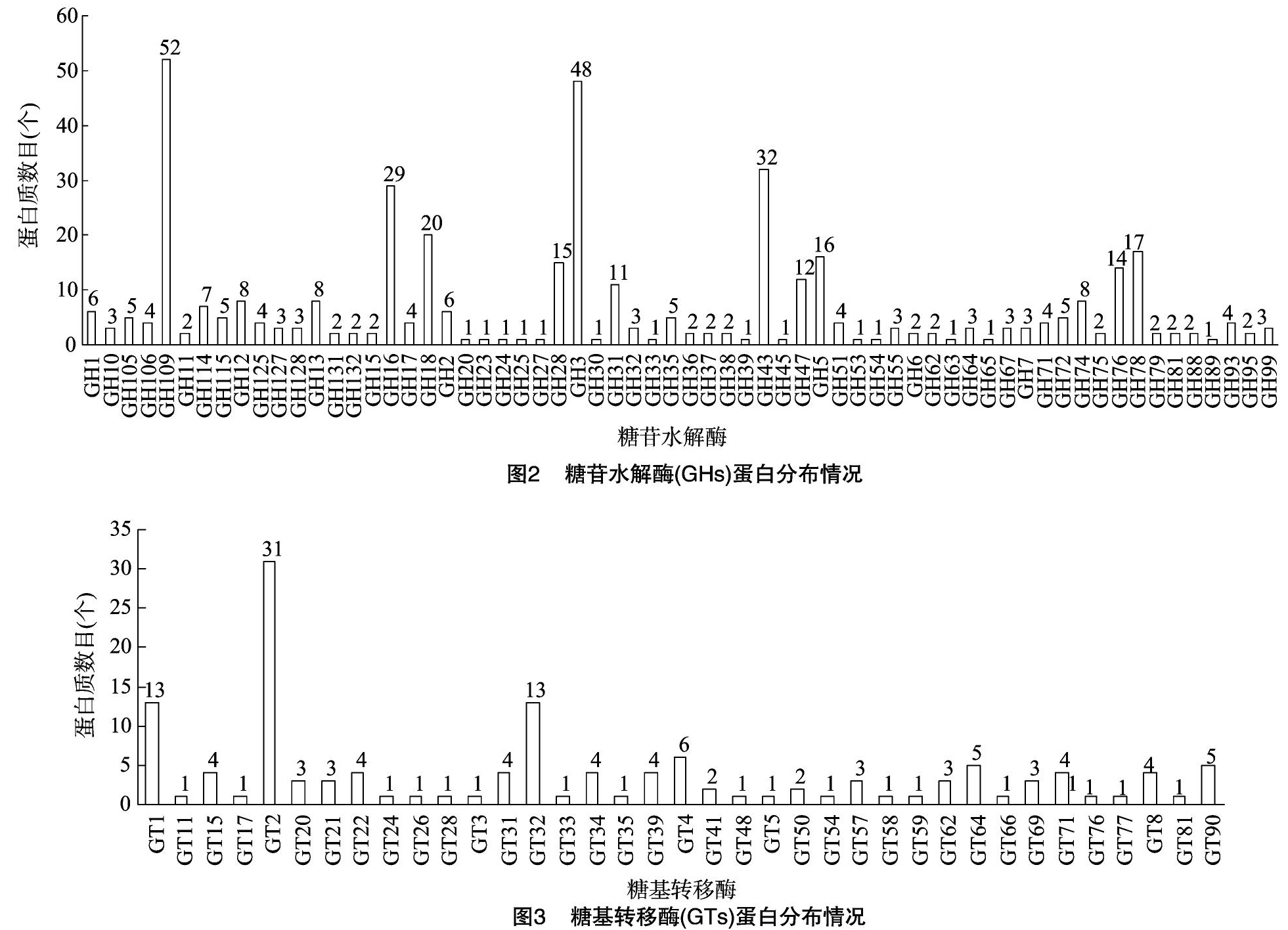
根据糖苷水解酶数据进行分析结果(图2)显示GH109数量最多,为52个,紧随其后为GH3,为48个,同时GH16、GH18、GH28、GH31、GH43、GH47、GH5、GH76、GH78数量较多,均超过了10个。该类别为六大水解酶类中亚家族数最多的类别,共有64个亚家族类别。
2.3 花生黑腐病菌中含有的GTs
根据糖基转移酶数据进行分析结果(图3)发现,GT2数量远远多于其他亚家族,为31个,约占GTs总数量的23%。其次,GT1和GT32的数量也较多,都为13个。除此之外,还含有GT4、GT64、GT90等34类蛋白。该类别为六大水解酶类中亚家族数第2多的类别。
2.4 花生黑腐病菌中含有的CBMs
根据碳水化合物绑定结构家族数据进行分析结果(图4)表明,数量最多的蛋白类别为CBM50,为20个,约占CBMs总数的20%,其次是CBM1,约占CBMs总数的15%。除此之外,还含有CBM18、CBM67、CBM24等20类蛋白。
2.5 花生黑腐病菌中含有的CEs
根据碳水化合物酯酶数据进行分析结果(图5)发现,CE10数量远远多于其他亚家族,为164个,约占CEs总数量的55%。其次,CE1数量较多,为51个。除此之外,还含有CE4、CE5、CE8、CE16等10类蛋白。
2.6 花生黑腐病菌中含有的AAs
根据辅助酶类家族数据进行分析结果(图6)发现,数量最多的蛋白类别为AA7,为82个,约占AAs总数的43%,其次是AA3,约占AAs总数的26%。除此之外,还含有AA1、AA2、AA4、AA9等7类蛋白。
2.7 花生黑腐病菌中含有的PLs
根据多糖裂解酶数据进行分析结果(图7)发现,数量最多的蛋白类别为PL1,为20个,约占PLs总数的42%,其次是PL3,约占总数的27%。除此之外,还含有PL22、PL4、PL9等6类蛋白。该类别为6大水解酶类中亚家族数最少的类别。
2.8 花生黑腐菌CAZymes蛋白Blast2GO分析结果
根据Blast2GO对花生黑腐病菌CAZymes蛋白的功能分析结果,将CAZymes分为三大类,分别为生物进程、细胞成分、分子功能类(图8)。在生物进程大类中数量最多的为代谢进程类,为311个,约占生物进程大类总数的69%, 除此之外,还含有未进化、细胞生源或组织成分、细胞进程、生物調节进程、刺激反应、生物调节、信号命令、排毒等8小类。在细胞成分大类中数量最多的为细胞外区域类,为58个,约占细胞成分大类总数的33%,除此之外,还含有细胞部分、细胞器部分、细胞膜、大分子复合物、细胞器、细胞膜部分、细胞外区域部分等7小类。在分子功能大类中数量最多的为催化活性类,为426个,约占分子功能大类总数的73%,除此之外,还含有联结、转录活性调节剂、转运活性、抗氧化活性、营养储存活性等5小类。
3 结论与讨论
随着大量真菌基因组测序的完成,先后有人利用基因组信息开展CAZymes家族的预测分析。韩长志等分析了黏绿木霉(Trichoderma virens)Gv29-8的377个分泌蛋白,并进行进一步的CAZymes家族分析,共得到201个CAZymes[16]。本研究并未对花生黑腐病菌Cylpar 14017全基因组进行分泌蛋白的筛选,共有1 114个花生黑腐病菌蛋白序列获得注释,得到的水解酶家族总数为1 197个。通过分析可知,所得的CAZymes里包含有大量的非分泌蛋白。
本研究分析得到在花生黑腐病菌CAZymes家族类别中,GHs含量最高,占总数的35%;其次是CEs、AAs为16%、GTs、CBMs,分别占总数的25%、16%、12%、8%,PLs的含量最少,只有4%。GH在大多数真菌CAZymes里的含量通常最高。韩长志等通过分析了黏绿木霉Gv29-8的分泌蛋白发现,GHs在CAZymes中含量最多,占了46.27%[16]。韩长志分析的禾谷炭疽菌[Colletotrichum graminicola(Cesati) Wilson]中也是GH最高,占33.33%[18]。而其他种类往往有所差异,在本研究中,CE总数仅次于GH,CBM的数量仅为总数的8%。而在黏绿木霉Gv29-8菌株中CBM占了 25.87%,CE数量较少。在禾谷炭疽菌中CBM为总数的 19.85%,GT数量占总数的0.75%[16-17]。这种数量上的差异可能是因为花生黑腐病菌和黏绿木霉、禾谷炭疽菌等病原菌遗传背景存在差异,也可能是因为这些病原菌的寄主植物不同,对寄主植物致病所需产生的水解酶家族和数量也会有不同。
在真菌CAZymes家族中往往都存在着复合类别。本研究中共有1 114个花生黑腐病菌蛋白序列获得注释,得到的水解酶家族总数为1 197个。其中部分单个蛋白序列会获得1个或多个蛋白注释,称之为复合型。韩长志等研究发现,在多个真菌的基因组中均存在着此类现象。黏绿木霉Gv29-8中发现了4个CBM35/GH27,包括2个CE4/CBM18、1个GH18/CBM1、1个GH7/CBM1。而禾谷炭疽菌中则发现了30个GH/CBM、10个AA/CBM、1个CE/CBM等。同一蛋白具有复合型酶注释功能,推测此类蛋白在发挥功能方面具有复合性。
植物病原真菌通过产生大量的CAZymes来降解植物的多糖类物质,以利于其对植物的侵染并获取其自身所需的营养[18]。本研究通过大规模数据处理的方法,对其进行CAZymes注释和比较分析。本研究可为花生黑腐病菌的致病因子研究提供材料和基础,且为其他植物病原真菌CAZymes基因家族的分析建立了初步的筛选方法。
参考文献:
[1]Bel D K,Sobers E K. A peg,pod,and root necrosis of peanuts caused by a species of Calonectria[J]. Phytopathology,1966,56(12):1361-1364.
[2]Wheele T A,Black M C. First report of Cylindrocladium black rot caused by Cylindrocladium parasiticum on peanut in texas[J]. Plant Disease,2005,89(11):1245.
[3]Wright L P,Davis A J,Wingfield B D,et al. Population structure of Cylindrocladium parasiticum infecting peanuts(Arachis hypogaea) in Georgia[J]. European Journal of Plant Pathology,2010,127(2):199-206.
[4]Tazawa J,Takahashi M,Usuki K,et al. Nodulation during vegetative growth of soybean stage does not affect the susceptibility to red crown rot caused by Calonectria ilicicola[J]. Journal of General Plant Pathology,2007,73(3):180-184.
[5]刘会梅,王向军,封立平. 花生黑腐病研究进展[J]. 中国植保导刊,2010(5):19-21.
[6]盖云鹏,潘汝谦,徐大高,等. 进境检疫性有害生物——寄生帚梗柱孢霉[J]. 植物检疫,2014(4):76-81.
[7]潘汝谦,关铭芳,徐大高,等. 警惕花生黑腐病菌的入侵[J]. 植物保护,2011,37(1):164-165.
[8]潘汝谦,关铭芳,徐大高,等. 花生黑腐病菌的生物学特性[J]. 华中农业大学学报,2011,30(6):701-706.
[9]蓝国兵,何自福,佘小漫,等. 广东花生主要品种对黑腐病菌的抗性水平鉴定[J]. 生物安全学报,2016,25(3):214-217.
[10]陈相永,陈捷胤,肖红利,等. 植物病原真菌寄生性与分泌蛋白组CAZymes的比较分析[J]. 植物病理学报,2014,44(2):163-172.
[11]van den Brink J,de Vries R P. Fungal enzyme sets for plant polysaccharide degradation[J]. Applied microbiology and biotechnology,2011,91(6):1477.
[12]Lombard V,Golaconda Ramulu H,Drula E,et al. The carbohydrate-active enzymes database (CAZy) in 2013[J]. Nucleic Acids Research,2014,42(1):490-495.
[13]Cantarel B L,Coutinho P M,Rancurel C,et al. The carbohydrate-active enzymes database (CAZy):an expert resource for glycogenomics[J]. Nucleic Acids Research,2009,37:233-238.
[14]Park B H,Karpinets T V,Syed M H,et al. CAZymes analysis toolkit (CAT):web service for searching and analyzing carbohydrate-active enzymes in a newly sequenced organism using CAZy database[J]. Glycobiology,2010,20(12):1574-1584.
[15]韓长志. 全基因组预测希金斯炭疽菌中碳水化合物酶类蛋白[J]. 江苏农业科学,2017,45(2):24-28.
[16]韩长志,许 僖. 黏绿木霉Gv29G8的碳水化合物活性酶类蛋白预测及遗传关系分析[J]. 华中农业大学学报,2017,36(5):39-44.
[17]韩长志. 基于全基因组测序的禾谷炭疽菌中碳水化合物酶类蛋白预测[J]. 河南师范大学学报(自然科学版),2016,44(4):118-124.
[18]Zhao Z T,Liu H Q,Wang C F,et al. Comparative analysis of fungal genomes reveals different plant cell wall degrading capacity in fungi[J]. BMC Genomics,2013,14(1):1-15.
- 初探演示法在初中数学课堂的创新和应用
- 高中物理反思式教学的实践与研究
- 初中物理基于兴趣的分享式科学探究的实践研究
- 高中物理项目式教学的实施策略
- 让初中学生数学思维走向灵动
- 如何教会学生读题
- 中学化学教学中学生问题意识的培养
- 浅谈将学科核心素养与教学评一致性进行统一的教学实践
- 浅谈高中数学教学中创造性思维能力的培养
- 电教手段在初中数学教学中的应用
- 夯实基础厚积薄发
- 提高初中物理教学有效性的策略
- 基于新高考背景下高中物理课走班制教学的研究
- 浅谈如何有效提高初中学生二次函数素养
- 运用信息技术提升高中化学教学
- 多元变式教学在高中数学新课改的实践研究
- 关于静电场、电场力做功与电势能改变的教学探讨
- 高中化学教学中研究性学习方法的研究
- 高中化学实验绿色化的实施途径研究
- 初中物理教学中激发学生兴趣的有效策略
- 初中物理实验教学与学生创新能力的培养方法浅谈
- 刍议提高初中数学课堂教学效率
- 论新课程标准改下的初中化学教学方法研究分析
- 激发学生兴趣的初中物理教学
- 初中化学实验教学中激发学生兴趣的有效策略
- insectan
- insecticidal
- insecticide
- insecticides
- insectiferous
- insectivore
- insectivores
- insectivorous
- insectlike
- insect-like
- insectologist
- insects
- insect's
- insecty
- insecure
- insecurely
- insecureness
- insecurenesses
- insecurer
- insecurest
- insecurities
- insecurity
- insecurity's
- insemination
- in-sense
- 会合账目结算
- 会合贯通
- 会合,巧合
- 会同
- 会同关系
- 会同四译馆
- 会同审理
- 会同审问
- 会同推荐
- 会同查勘
- 会同研究
- 会同馆
- 会吹会扯
- 会员
- 会员制
- 会员卡
- 会哨的鸟儿没有肉
- 会唱
- 会唱的碰到会说的
- 会商
- 会喜
- 会噎
- 会圣
- 会场
- 会垓