李倩 郭九峰 高海荣

摘要:为探究高压静电场对甘草生长过程中RNA含量的影响,本试验以甘草幼叶、嫩茎和种子为研究材料,依次采用十二烷基苯磺酸钠(SDS)法、十六烷基三甲基溴化铵(CTAB)法、异硫氰酸胍(Trizol)法提取甘草幼叶、嫩茎、种子的RNA,并进行比较分析。并通过紫外分光光度法,分析检测经不同强度高压静电场(0、12、15、18 kV)处理之后生长过程中甘草不同组织RNA含量。结果表明,3种方法均能从甘草中提取出RNA。SDS法是适用于甘草组织RNA提取的最佳方法。经不同强度高压静电场处理,甘草RNA含量增加,降解含量降低。高压静电场影响最明显的是处理电场强度为18 kV时,甘草生长9 d时,RNA含量最高。本研究初步探究了高压静电场对甘草生长过程中RNA含量的影响,为甘草RNA的研究和高压静电场与分子生物学的研究提供了基础参考。
关键词:甘草;高压静电场;RNA提取;SDS法;RNA含量
中图分类号:S567.7+10.1 文献标志码: A文章编号:1002-1302(2020)13-0076-04
收稿日期:2019-08-10
基金项目:国家自然科学基金(编号:51467014)。
作者简介:李倩(1993—),女,河北张家口人,硕士,主要从事环境生物物理和分子技术研究。E-mail:934192500@qq.com。
通信作者:郭九峰,博士,教授,硕士生导师,主要从事生物物理与生物技术研究。E-mail:guojf101@sina.com。甘草(Glycyrrhiza uralensis Fisch.)作为我国传统的大宗中药材,本身也是一种可综合利用的经济型植物。但迄今为止,有关甘草不同组织总RNA的提取报道甚少。这主要是由于甘草叶片、茎干中蛋白质、脂肪、多糖等含量均很高,刺毛状腺体中还含有大量黏液质[1]。根和根茎中有甘草酸等丰富的次生代谢产物,致使提取甘草的RNA比一般的植物要困难,通过这些方法提取的RNA多适用于后期的逆转录PCR(PT-PCR)等试验,很少用于转录组测序[1-3]。针对这类植物,相关学者通过调整试验方式,结合不同方法以及加入不同的物质来提高植物RNA的提取率,例如陈华等使用改良Trizol法结合LiCl法提取了番茄叶片的RNA[4]。
高压静电技术是近几十年兴起的一种重要的处理种子的方法[5]。利用其能够击穿组织细胞壁和细胞膜的特征,从而提高种子的活化能,调节内部水分子、腺嘌呤核苷三磷酸(ATP)含量、酶活性等,优化原有性质,增强种子的生理生化反应[6-7],提高种子活力,与此同时降低植物的发病率并提高其抗逆能力[8]。本试验以甘草幼叶、嫩茎、种子为材料,选用十二烷基苯磺酸钠(SDS)法、Trizol法、十六烷基三甲基溴化铵(CTAB)法提取总RNA,期望找到一种提取甘草RNA的最佳方法,并能达到转录测序要求,并探究高压静电场对甘草RNA含量的影响,以便为后续相关分子水平研究提供科学参考。
1材料与方法
1.1材料及处理采集
1.1.1试剂材料甘草种子,选用人工栽培的乌拉尔甘草,购自内蒙古赤峰生态甘草种植基地;甘草完整苗株取自笔者所在课题组实验室组织培养的甘草苗。供试试剂:Trizol[天根生化科技(北京)有限公司],CTAB、焦碳酸二乙酯(DEPC)、SDS、酚-三氯甲烷、异戊醇、异丙醇、乙醇、无RNA酶水(内蒙古鸿之惠商贸有限公司)。
1.1.2材料处理挑选饱满的甘草种子,于98%浓硫酸溶液中处理10 min,用无菌水洗涤3~4次,洗净种子表面残留酸液,晾干。将经浓硫酸处理过的种子分成若干份,进行高压静电场处理。高压静电场电压的选取是在笔者所在课题组研究基础上进行筛选的,电压依次为0(CK)、12、15、18 kV,处理时间为 25 min(CK处理为0 min)。高压静电场处理完之后,置于10%次氯酸钠溶液中15 min,用无菌水洗涤数次,晾干备用。播种于MS培养基中
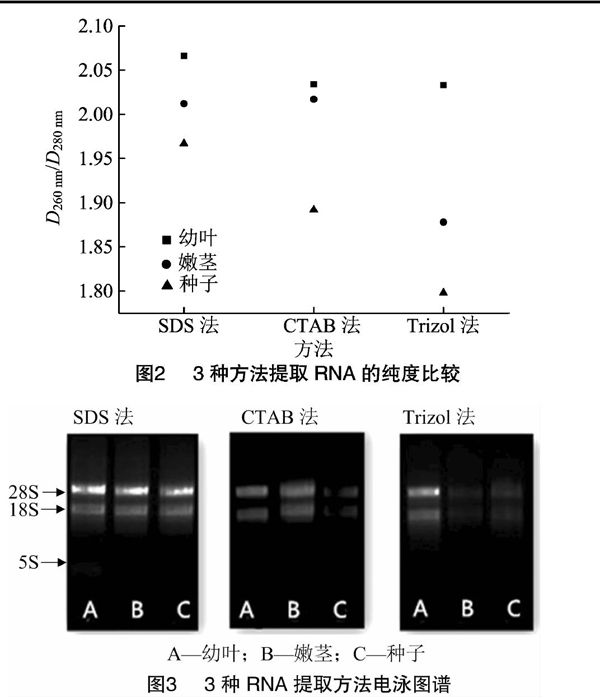
表明提取的总RNA完整性好。CTAB法得到的凝胶电泳图谱中,幼叶的整体效果不错,但嫩茎的条带有些许弥散,可能是DNA污染造成的;种子的条带完整但亮度偏暗,可能是沉降过程不完全所致,或有其他物质轻微干扰所致。Trizol法提取甘草幼叶、嫩茎和种子总RNA过程中,出现溶液褐化现象,幼叶的最终提取产物中稍有影响,但整体影响不大。而嫩茎和种子中RNA存在量微乎其微,整体完整性略低,质量差。因此,通过3种方法分析比较,SDS法是提取甘草RNA的最佳方法。
2.2SDS法提取不同高压静电场处理甘草苗的RNA检测
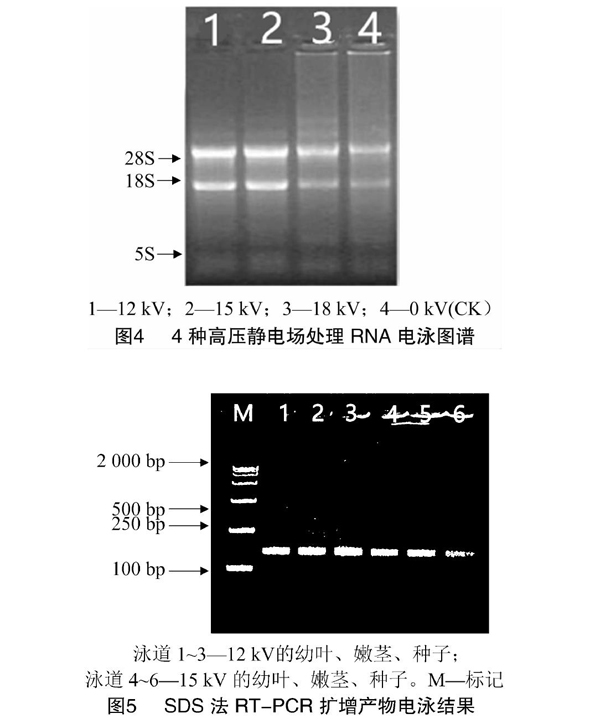
采用SDS法提取经由不同高压静电场处理的甘草苗的RNA,电泳结果见图4,条带清晰、明亮。18 kV和CK条件下(泳道3和泳道4)条带孔位有些明亮,考虑可能有沉淀未洗脱完全。经电场处理的泳道条带比CK清晰明亮,说明经高压静电场处理对甘草RNA的提取起到了一定的促进作用。
2.3SDS法的PCR验证
采用SDS法得到的不同高壓静电场处理的甘幼叶、嫩茎和种子RNA进行逆转录反应,以RT-PCR得到的第一链CDNA作为模板,以甘草Actin基因设计引物对,进行PCR扩增,结果见图5。不同高压静电场处理的甘草的幼叶、嫩茎和种子都出现了目的条带,扩增效果理想,条带清晰明显,没有一点拖带,进一步说明SDS法是甘草RNA提取的最佳方法,同时高压静电场的加入也优化了高质量RNA的获得。
2.4RNA含量与电场强度的关系
使用SDS法提取甘草种子经电场处理和对照组分别生长1、3、5、7、9、11 d的RNA,检测不同高压静电场对甘草RNA的影响(图6)。
不同高压静电场处理在不同生长时间里,RNA含量呈现不同的变化趋势。随着生长时间的延长,经高压静电场处理的RNA含量出现不同程度的波动变化,在15、18 kV条件下整体波动上升,12 kV条件下,在一定范围之内波动下降,而CK组出现大范围波动下降。随着电场强度增加,RNA的含量也出现波动变化,综合观察来看,当处理所用高压静电场强度为18 kV时,甘草生长到9 d时,RNA含量最大,并且此时RNA降解量最少。因此,确定 18 kV 为最佳电场强度。
3讨论与结论
纯度高、完整性好的RNA是进行RT-PCR、荧光定量Real-time PCR、转录组测序、基因表达分析等的基础[22-23]。甘草是一种经济型综合利用的植物,由于其本身有大量蛋白质、多糖,茎叶的刺毛状腺体中还含有大量黏液质,根和根茎中又有丰富的
次生代谢产物,提取甘草RNA面临一定的困难。Trizol法是一种简单快速提取RNA的方法,试验中溶液褐化现象,可能与试剂中含有氧化性物质有关,在去除杂质的同时也会造成RNA的损失,所以Trizol法不适合甘草这类植物RNA的提取。CTAB法能够摒弃试验过程中的部分氧化还原情况,但是其操作复杂,操作过程温度区间涉及广,容易造成降解。因此,并不是提取甘草RNA的最佳方法。SDS法既能克服Trizol法的一些弊端,又比CTAB法操作简单,且成本不高,能够获得高质量的RNA。因此,SDS法是甘草不同组织RNA提取的最佳选择。高压静电场是近几十年来兴起的且用途广泛的一门技术[5],本试验通过加入高压静电场的处理,结果表明,甘草组织中RNA的获得率确有提高,说明高压静电场处理促进了RNA的提取。目前为止,有关电场对植物的处理效应详尽的机制尚未有明确的定论,可能的分析方向类型有细胞膜电穿孔模型、电崩解模型、影响酶的活性[24-27]、影响遗传物质[28-29]等。本研究结果表明,高压静电场处理甘草之后,组织中RNA发生了明显的变化,这也验证了高压静电场影响遗传物质的说法。
本试验研究了不同RNA提取方法对甘草的适用性,并以此为基础探究高压静电场处理对甘草生长过程中RNA含量的影响。存在于自然界的所有生物体都拥有特异的生理特性和电磁效应,试验證明,高压静电场处理对甘草RNA的提取有促进作用,这可能也为高质量RNA的获得提供一种可能。想要全面、深层次地探究高压静电场对甘草RNA的影响机制,未来学者可以以此为切入点从不同层次进行探究。
参考文献:
[1]刘春生,王文全. 甘草不同器官RNA提取方法研究[J]. 北京中医药大学学报,2006,29(10):705-707.
[2]张卉,王文全,杨全. 甘草RNA提取方法研究[J]. 时珍国医国药,2007,18(12):3051-3052.
[3]许恒飞. 胀果甘草细胞培养及查尔酮合成酶基因的cDNA克隆[D]. 保定:河北大学,2008.
[4]陈华,昌伟,杨瑞,等. 番茄叶片小RNA提取方法的优化[J]. 北京农学院学报,2012,27(3):4-6.
[5]周盛祥,李法德,张春庆,等. 高压静电场处理种子研究现状与发展对策[J]. 农业工程,2016,6(4):88-91.
[6]黄洪云,杜宁,张璇. 高压静电处理对种子萌发的生理生化影响[J]. 种子,2017,36(12):74-76.
[7]韩德恩. 静电场处理植物种子和植株的效应[J]. 湖北农业科学,1999(5):26-27,37.
[8]吴宗汉. 基础静电学[M]. 北京:北京大学出版社,2010:254-255.
[9]满淑丽,刘延涛,张咪,等. 甘草组培与栽培主要成分的提取及活性比较[J]. 天津科技大学学报,2015,30(4):17-20.
[10]苏姗. 优质甘草组培快繁及遗传稳定性分析[D]. 石家庄:河北科技大学,2015.
[11]梁玉勇,李雪娇,尹双双,等. 甘草组培苗的培养基优化及其有效成分分析[J]. 贵州农业科学,2012,40(11):29-33.
[12]杨瑞,王礼强,刘颖. 甘草组织培养的研究进展[J]. 中草药,2014,45(12):1796-1802.
[13]王杰,王全,田娜,等. 不同植物组织RNA提取方法的比较分析[J]. 北京农学院学报,2015,30(1):76-80.
[14]陶倩,范慧艳,张水利,等. 南方红豆杉不同组织总RNA提取方法研究[J]. 中华中医药杂志,2018,33(8):3336-3341.
[15]尹慧,陈莉,李晓艳,等. 百合叶片总RNA提取方法比较及优化[J]. 中国农业大学学报,2008,13(4):41-45.
[16]张志勇,阳静,齐泽民. 铁皮石斛总RNA提取方法的比较研究[J]. 江苏农业科学,2017,45(4):33-35.
[17]王芳. 甘草肌动蛋白基因GuActin2的克隆和表达分析[J]. 植物生理学通讯,2009,45(10):995-1000.
[18]宋大伟. 啤酒废酵母提取RNA工艺研究[D]. 长春:吉林大学,2006.
[19]林松毅,李海霞,平红,等. 超声波破壁释放啤酒废酵母细胞中核糖核酸的实验研究[J]. 食品科技,2009,34(5):107-109.
[20]刘静波,于一丁,王睦,等. 高压脉冲电场促进啤酒酵母细胞RNA快速溶出的技术[J]. 吉林大学学报(工学版),2010,40(4):1171-1176.
[21]徐燚. 5′-核苷酸制备工艺的研究[D]. 南京:南京工业大学,2002.
[22]张玉刚,成建红,韩振海,等. 小金海棠总RNA提取方法比较及cDNA的LD-PCR扩增[J]. 生物技术通报,2005(4):50-53.
[23]关玲,赵密珍,王庆莲,等. 改良CTAB方法提取果树不同组织的RNA[J]. 江苏农业科学,2018,46(15):19-22.
[24]张佰清,郭佳佳. 脉冲强光对大肠杆菌细胞膜损伤及胞内酶活性的影响[J]. 食品与机械,2010,26(5):62-64,83.
[25]王婷,何荣海,马海乐. 物理场对酶活力的影响[J]. 食品工业科技,2010,31(6):401-403,407.
[26]田美玲. 高压脉冲电场(PEF)激活α-淀粉酶/葡萄糖淀粉酶/果胶酶的比较研究[D]. 重庆:西南大学,2016.
[27]黄薇. 物理场作用下的蛋白质折叠和酶催化研究[D]. 天津:南开大学,2014.
[28]刘瑶. 电场处理柠条种子对干旱胁迫下幼叶基因表达影响的初步研究[D]. 呼和浩特:内蒙古大学,2013.
[29]刘翔宇. 不同电场条件处理巧条种子对干旱条件下幼叶基因表达的影响[D]. 呼和浩特:内蒙古大学,2015.李志红,徐静雅,旦真次仁,等. 白芨工厂化育苗组培快繁技术体系的构建[J]. 江苏农业科学,2020,48(13):80-83.doi:10.15889/j.issn.1002-1302.2020.13.016
- 恢复中小学劳动课的理论和现实分析
- 论新形势下高校辅导员在学生管理工作中的新角色
- 心理健康教育在教育教学中的重要性
- 示范性高职院校建设档案的管理
- 构建社会主义和谐社会背景下初中生生态道德教育研究
- 赏识教育在初中思想政治课程中的应用策略研究
- 高校以自媒体为载体的思政教育探析
- 美丽中国背景下初中生生态道德教育研究
- 浅谈初中《道德与法治》课堂教学中的情感教育
- 浅谈“翻转课堂”在初中道德与法治教学中的应用
- 初中生生态道德教育策略研究
- 浅谈初中思想品德课中的快乐教学
- “参与”四方式激活思品课堂
- 高中政治教学中微课教学法的运用策略
- 以科技创新为载体促进高中政治教育创新能力的培养
- 浅析高中政治课堂简约高效的教学策略
- 低碳经济视域下初中生生态道德教育研究
- 文学话语与政治话语
- 初探情境教学在初中地理教学中的应用
- 高中地理教学的四个注重
- 时事新闻在高中地理教学中的应用
- 在高中地理教学中渗透环境教育
- “双体互动”教学模式在高中地理教学中的应用
- 浅谈高中地理素质教育
- 高中地理教育中情感价值观的渗透研究
- more large scale
- more last ditch
- more law abiding
- more left hand
- more left wing
- more life and death
- more life size
- more life threatening
- more like minded
- more live in
- more long distance
- more long lived
- more long range
- more long sighted
- more long suffering
- more long term
- more long wave
- more long winded
- more loose leaf
- more low key
- more low level
- more low lying
- more low pitched
- more machine tooled
- more make believe
- 极难得到的珍贵食品
- 极难得的人才
- 极难成功的事
- 极难解决的问题
- 极难遇到
- 极顶
- 极颂
- 极颠
- 极饮
- 极高
- 极高之处
- 极高地直立
- 极高尚的德行
- 极高尚的操守
- 极高明的言论
- 极高的义行
- 极高的天空
- 极高的山峰
- 极高的才智
- 极高的才识与声望
- 极高的文学才能
- 极高的权位
- 极高的样子
- 极高的楼
- 极高的观察鉴别力