陆宏达 赵欢 张小俊
摘要:为探讨正常与低品质中华绒螯蟹的肠道菌群结构差异,采用高通量测序技术,测定细菌16S rDNA V3 V5区基因序列,通过生物信息学方法,分析比较肠道菌群结构和多样性以及可培养菌群结构的特点。结果表明,中华绒螯蟹正常组(NG)肠道中绝对优势菌群为厚壁菌门(93.54%),而其他门的丰度均很低(2.81%以下),其中以厚壁菌门的乳球菌属丰度最高(86.00%);低品质组(LG)以厚壁菌门(62.60%)、变形菌门(22.42%)、拟杆菌门(5.74%)和软壁菌门(5.69%)为主,其中以厚壁菌门的尚无属名的ZOR0006(46.20%)和变形菌门的Caedibacteraceae uncultured(21.33%)丰度最为优势,厚壁菌门的乳卵属(5.81%)和乳球菌属(4.63%)以及软壁菌门的Candidatus Bacilloplasma属(526%)丰度较高。低品质组肠道中与营养代谢和生长相关的厚壁菌门显著降低和拟杆菌门显著增加,通过提高肠道中厚壁菌门和减少拟杆菌门丰度从而降低两门间的丰度比,有望减少低品质河蟹的出现。可培养菌群的分析,正常培养组(NCG)绝对优势菌群为变形菌門(95.86%),其中以变形菌门的柠檬酸杆菌属(61.40%)和气单胞菌属(3167%)为主,同样低品质培养组(LCG)类似于正常培养组,绝对优势菌群也为变形菌门(99.91%),以柠檬酸杆菌属(50.02%)和气单胞菌属(36.16%)为主,但这2属在正常组和低品质组肠道中丰度很低,分别在0.01%~0.19%范围内,表明这2属在培养基上极易培养,生长繁殖快,但在肠道中生长繁殖可能受到高丰度其他菌群的抑制作用,而处于低丰度状态。研究结果可为调节低品质中华绒螯蟹肠道菌群结构和制定减少低品质中华绒螯蟹措施提供理论依据。
关键词:中华绒螯蟹;低品质;肠道;菌群结构;高通量测序
中图分类号: S917;S182? 文献标志码: A? 文章编号:1002-1302(2020)20-0170-08
中华绒螯蟹(Eriocheir sinensis)俗称河蟹,20世纪90年代规模化人工繁殖成功,为河蟹大规模养殖奠定了基础,经过20多年的发展,养殖技术、河蟹规格、产量和品质不断提高,病害不断减少,但在河蟹养成过程中,还经常出现一些非病原引起的低品质河蟹,不同的年份低品质河蟹出现率不一样,最高年份有些养殖区出现低品质河蟹的池塘可达20%左右,一般养殖区出现低品质河蟹的池塘在5%左右。这些河蟹主要表现为蟹体消瘦、肉质鲜美度差、特有风味减弱、肥满度和肝胰腺指数显著降低以及几乎无死亡现象等特征,直接影响河蟹的商品价值和经济效益。患生物性疾病河蟹特征,除活力低和死亡率高外,很少全面地涉及到类似于低品质河蟹的肉质鲜美度差、肥满度和肝胰腺指数低等特征的报道,患细菌性等生物性疾病的河蟹,通常属于急性型或亚急性型疾病,一般死亡率50%左右,严重时在短期内死亡率可高达80%以上[1-3],与低品质河蟹几乎无死亡现象具有本质的区别。造成低品质河蟹的相关因素鲜有报道,只有影响河蟹风味方面的研究,如养蟹塘中种植伊乐藻组的河蟹肌肉鲜味氨基酸含量和几种肝胰腺脂肪酸含量等均显著高于无伊乐藻组,但肝胰腺指数差异不显著[4],河蟹在8‰低盐度海水暂养1~2周可以提高河蟹肌肉鲜味和甜味2个主要滋味[5]。已有研究表明生物肠道内菌群结构对机体的营养代谢、吸收和生长等有重要影响[6-8],河蟹肠道菌群结构与出现低品质河蟹是否存在一定关系未见研究报道,本研究通过正常和低品质河蟹肠道菌群结构以及它们的可培育菌群结构的比较分析,探讨肠道菌群的差异性,有助于掌握低品质河蟹肠道菌群结构的特点,为改变河蟹肠道菌群结构,从而减少低品质河蟹的产生提供理论依据,对提高河蟹品质、商品价值、经济效益和河蟹养殖业健康持续发展等方面都具有重要意义。
1 材料与方法
1.1 试验蟹和肠道菌群的采集
1.1.1 试验蟹 河蟹采用地笼的方式于2018年9月下旬采于江苏省兴化市安丰镇的成蟹养殖塘,用地笼方法获得的低品质河蟹采自面积约为 0.52 hm2 且几乎没有发现正常河蟹的蟹塘,用相同方法获得的正常河蟹采自面积约为0.50 hm2且没有发现低品质河蟹的蟹塘,这2个蟹塘的水深、水草种类和覆盖率、水质清澈度、透明度等养殖环境和养殖方法相似,蟹种来源于同一个蟹种养殖场。正常河蟹和低品质河蟹各取20只,河蟹洗净晾干后分别进行体质量和壳长测定,再置于解剖盘中用70%的乙醇棉球擦拭河蟹体表进行消毒,无菌操作打开河蟹甲壳,取出肝胰腺称质量。正常河蟹和低品质河蟹的体质量、壳长、肥满度和肝胰腺指数采用SPSS 19.0 统计软件作方差分析,数据用“平均值±标准差”表示,并用t检验法作差异性分析。
1.1.2 肠道菌群 每个河蟹甲壳打开后,无菌条件下取出河蟹整个肠道置于无菌培养皿中,用无菌眼科剪剪开肠道,挑去粪便,将剖开的肠道在存有无菌生理盐水(4 ℃冰箱预冷)的3只离心管中分别进行刮洗后,菌液合并,离心浓缩,正常河蟹肠道洗下的所有菌群液合并于灭菌离心管中作为正常组(normal quality group,简称NG),低品质河蟹采用相同方法得到的菌群液作为低品质组(low quality group,简称LG)。取少量浓缩菌群液用作肠道的可培养菌群分析,其他保存于-80 ℃冰箱备用。
1.1.3 肠道可培养菌群 分别取正常组和低品质组的少量浓缩菌群液,进行10倍倍比稀释后,稀释105以上的各稀释度分别设3个平行,在胰蛋白胨大豆琼脂(tryptic soy agar,简称TSA)平板培养基和血琼脂平板培养基上28 ℃培养120 h,将2种培养基所有生长的菌落用灭菌牙签逐个挑出,洗入灭菌的生理盐水中,离心浓缩后的菌群液分别作为正常培养组(normal quality culturable group,简称NCG)和低品质培养组(low quality culturable group,简称LCG),保存于-80 ℃冰箱备用。
1.2 细菌DNA提取和PCR扩增
分别将正常组、低品质组、正常培养组和低品质培养组的浓缩菌群液进行DNA提取,300 μL菌群液中分别加入250 μL Buffer ATL和5 μL蛋白酶K,涡旋振荡1 min至彻底混匀,55 ℃水浴30 min,95 ℃水浴20 min,加入250 μL Buffer DL和250 μL无水乙醇,涡旋混匀15 s;混合液转入吸附柱HiPure gDNA Micro Colunm中,12 000 r/min离心1 min,倒弃收集管中的滤液,吸附柱装回收集管中,加入 500 μL Buffer GW2,12 000 r/min离心1 min,倒弃滤液,再重复上一步骤1次,吸附柱装回收集管中,12 000 r/min离心2 min;吸附柱装在新的1.5 mL离心管中,加入300 μL Buffer AE于吸附柱中央,放置3 min,12 000 r/min离心1 min,得到白色絮状物质,晾干15 min,滴加100 μL dd H2O,用1%琼脂糖凝胶电泳检测抽提的基因组DNA,并将各组细菌DNA提取液分别保存于-80 ℃冰箱备用。
采用上游引物341F:5′-CCTAYGGGRBGCASCAG-3′和改進的下游引物806R:5′-GGACTACNNGGGTATCTAAT-3′,对提取的各组细菌DNA进行16S rDNA序列的V3 V5可变区PCR扩增(PCR仪:ABI GeneAmp 9700型)。反应体系为10 ng Template DNA,5 μmol/L上下游引物各0.8 μL,4 μL 5×FastPfu Buffer,2 μL 2.5 mmol/L dNTPs,04 μL FastPfu DNA Polymerase,补ddH2O至20 μL。反应条件为95 ℃预变性5 min;95 ℃变性30 s,55 ℃ 退火30 s,72 ℃延伸45 s,共27个循环;最后72 ℃延伸10 min。将每组PCR产物用2%琼脂糖凝胶电泳检测,使用AxyPrep DNA凝胶回收试剂盒[爱思进生物技术(杭州)有限公司]切胶回收PCR产物,Tris-HCl洗脱,2%琼脂糖电泳检测后,用QuantiFluorTM-ST蓝色荧光定量系统进行检测定量。之后进行文库构建,连接“Y”形接头,用磁珠筛选去除接头自连片段,按照每个样本测10 000条序列加入1 ng PCR产物的标准富集PCR产物,然后用NaOH溶液变性,获得单链 DNA片段,测序工作由上海德培生物科技有限公司完成。
1.3 16S rDNA高通量测序及数据分析处理
用Illumina MiSeg高通量测序技术进行测序,原始数据通过质控过滤、拼接和去除嵌合体,得到有效数据。利用Usearch 7.1(http://drive5.com/uparse/)软件平台对有效数据进行操作分类单元(operational taxonomic unit,简称OTU)聚类,作为分类和计算的依据,采用RDP classifier 贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并在各分类水平上统计每组样品的菌群组成,覆盖率(coverage)、物种丰富度(Chao)指数、香农(Shannon)指数和辛普森(Simpson)指数公式计算细菌多样性指数,利用Excel、Venny 2.1、Canoco 5.0软件分别分析制作稀释性曲线和属水平的相对丰度图、韦恩(Venn)图和主成分分析(principal component analysis,简称PCA)。
2 结果与分析
2.1 正常河蟹与低品质河蟹的特征
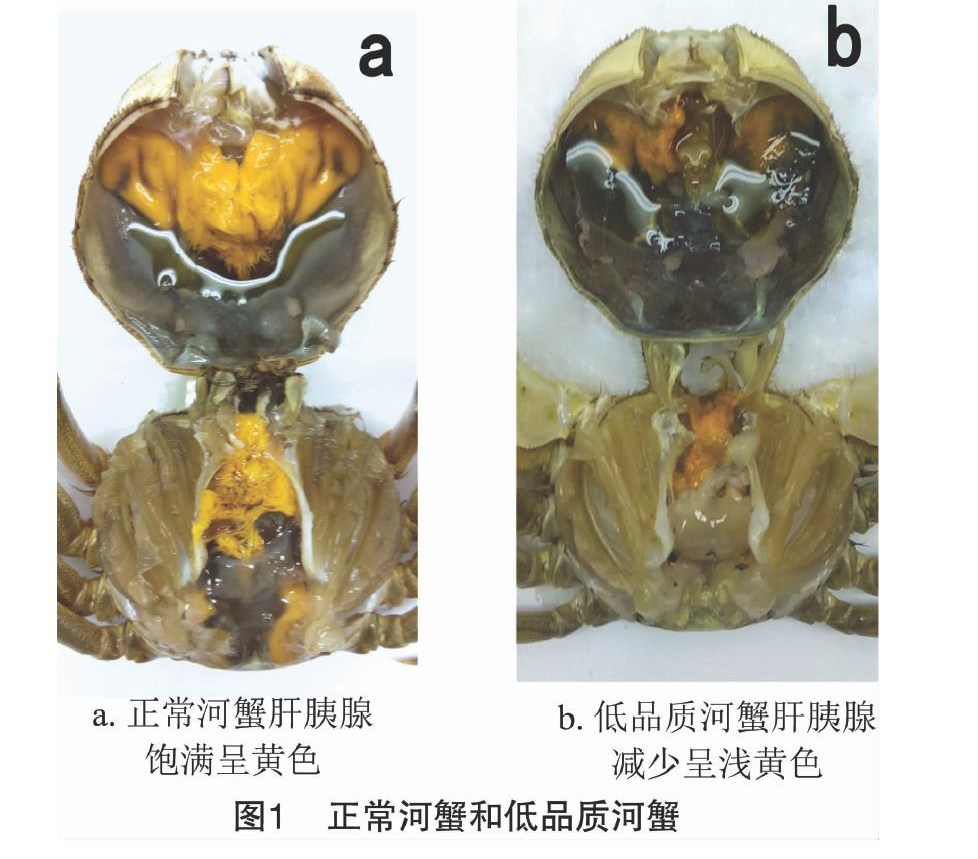
正常河蟹与低品质河蟹经显微镜检查只发现极少量钟形虫寄生,肌肉和血淋巴液中的致病菌分离培养和回感试验结果均未发现致病菌,电镜观察检查未见病毒和螺原体等细胞内病原生物,表明低品质河蟹不是由生物性病原引起。河蟹的特征见图1,正常河蟹蟹壳坚硬,肝胰腺呈黄色或橘黄色,煮熟后具独特的蟹腥香味口感,肝胰腺丰满,低品质河蟹消瘦,蟹壳软,肝胰腺呈浅黄色或浅橘红色,甚至有些河蟹肝胰腺呈乳白色,口感滋味和蟹腥香味差,肝胰腺明显减少。正常河蟹与低品质河蟹的壳长分别为(5612 5±0.172 0) cm、(5.602 3±0.333 9) cm,2组河蟹壳长无显著差异(P>0.05),它们的体质量分别为(10394±8.63) g和(87.09±10.22) g,体质量有显著差异(P<0.05),肥满度分别为59.05±325和48.29±3.26,呈现极显著差异(P<001),肝胰腺指数分别为0.102 5±0.012 6和0.053 2±0.007 3,呈现极显著差异(P<0.01)。
2.2 OTU聚类、分类学分析、多样性指数分析
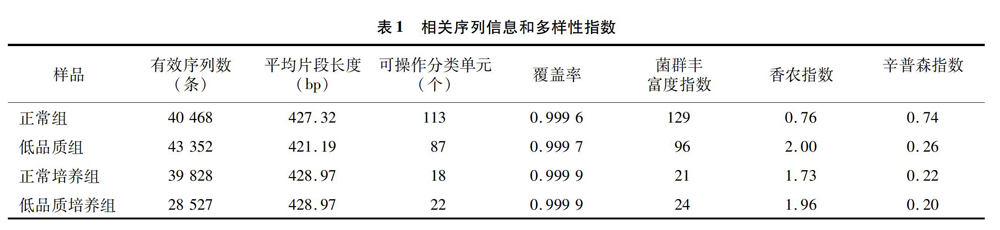
高通量扩增分析生成的原始数据,根据序列末端的box序列校正序列方向,然后按照barcode标签序列识别并区分样本得到正常组和低品质组的有效序列分别为40 468条和43 352条,正常培养组和低品质培养组的有效序列分别为39 828条和 28 527 条。细菌序列平均片段长度无明显差异,99.92%的序列长度聚集在420~430 bp之间,少数小于400 bp或者大于450 bp,以97%相似性水平为标准划分可操作分类单元(OTU),正常组和低品质组河蟹肠道中菌群OTU数量分别为113、87个,而相对应的正常培养组和低品质培养组菌群OTU数量分别为18、22个,分别低于它们相对应的正常组和低品质组菌群OTU数量(表1)。
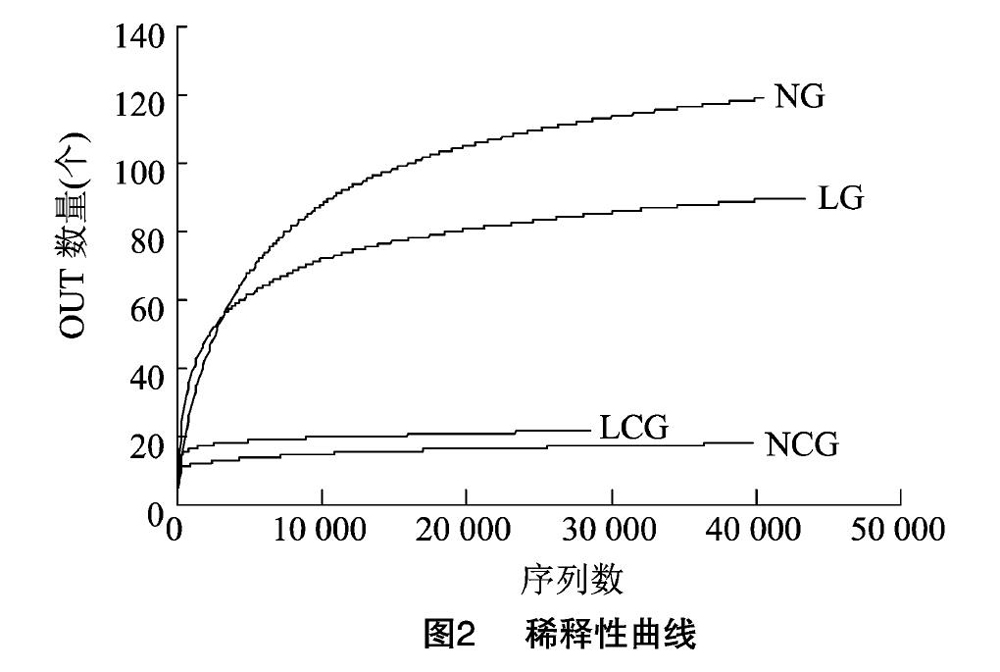
基于随机选取一定数量的测序序列及其对应的OTU种类得到的稀释性曲线(图2),随着测序深度的增加,各组曲线逐步趋于平坦,说明细菌序列和测序数据量合理并达到饱和,所进行的菌群多样性分析结果可信,测序结果能够真实地完整反映样本中优势菌群的数量关系和菌群种类。在相同序列数时,正常组菌群OTU数量最多,说明其菌群丰富度最高,其次是低品质组,再次是低品质培养组,正常培养组最低。
由表1可见,无论是河蟹正常组和低品质组菌群的序列,还是正常培养组和低品质培养组菌群的序列,被测出的覆盖率均达到了0.999 6以上,被测出的概率极高,反映本次测序结果代表了样本中菌群真实情况。Chao指数通常用于估计OTU数目指数,正常组菌群的Chao指数高于低品质组,表明正常河蟹菌群丰富度高于低品质河蟹,但正常培养组菌群的Chao指数低于低品质培养组,表明其菌群丰富度低于低品质培养组。Shannon指数、Simpson指数则用于估计微生物多样性,Shannon值越大而Simpson指数越小反映了样品中微生物多样性越丰富。正常组菌群的Shannon指数为0.76,小于低品质组的Shannon指数2.0,而Simpson指数相反,正常组菌群的Simpson指数074,高于低品质组的Simpson指数0.26,说明低品质组菌群多样性高于正常组,低品质河蟹微生物多样性更为丰富,其肠道内有更多的细菌种类,菌群结构更为复杂。
正常培养组菌群的Chao、Shannon、Simpson指数与低品质培养组菌群的指数比较接近,反映了正常河蟹肠道中培养出的菌群结构类似于低品质河蟹肠道中培养出的菌群结构。
2.3 菌群结构组成及相对丰度
对各组的肠道菌群全部有效序列进行归类操作分析,统计不同OTU所对应的细菌门类及相对丰度,优势菌门类和相对丰度见表2。正常组和低品质组河蟹肠道中前9个优势菌门类分别为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、软壁菌门(Tenericutes)、梭杆菌门(Fusobacteria)、Patescibacteria group、放线菌门(Actinobacteria)、蓝藻菌门(Cyanobacteria)、浮霉菌门(Planctomycetes)。正常组和低品质组河蟹肠道菌群结构都以厚壁菌门优势度最高,相对丰度分别为93.54%和62.60%,前者丰度显著高于后者;其次是变形菌门,分别为2.65%和22.42%,前者丰度显著低于后者,2组的这2个门合计丰度分别占各自组总丰度的93.07%、86.18%;正常组拟杆菌门和软壁菌门丰度分别为0.01%、0.13%,分别低于低品质组5.74%、5.68%的丰度;2组在放线菌门、蓝藻菌门和Patescibacteria group均只有极低的丰度;正常组的梭杆菌门和低品质组的浮霉菌门均没有丰度。2组的菌群结构在门水平上具有较大的差异。
正常培养组和低品质培养组河蟹肠道中培养菌群的优势菌群均是变形菌门,分别为95.86%和99.91%。前者的厚壁菌门丰度仅为4.14%,而其他7个门类均没有丰度,无可培养菌群,后者的厚壁菌门、拟杆菌门和梭杆菌门丰度极低,有极少量的可培养菌群,软壁菌门等其他5个门类均没有丰度,无可培养菌群,2组的可培养菌群结构在门水平上具有相似性。
筛选出每组丰度最高的前14种OTU所对应的菌属,在属水平上对每组肠道菌群结构及分布进行统计分析(图3)。正常组肠道中乳球菌属(Lactococcus)丰度最高,达到86.00%,低品质组肠道中乳球菌属丰度较低,为4.63%,后者丰度最高的菌属是尚无属名的ZOR0006,相对丰度达4620%,归属于厚壁菌门的韦荣球菌科(Erysipelotrichaceae),前者的ZOR0006相对丰度只有3.64%。低品质组的Caedibacteraceae uncultured、乳卵属(Lactovum)、Candidatus Bacilloplasma、Roseimarinus的丰度分别为21.33%、5.81%、5.26%和3.95%,均分别高于正常组只有0.01%、0.01%、0.12%、0.01%的丰度。除乳杆菌属(Lactobacillus)在正常组丰度外,梭杆菌属等其他8个属在属水平上均有一定的丰度,但均低于3.0%,2组的菌群结构在属水平上具有较大的差异。
正常培养组与低品质培养组可培养菌群的优势菌群均为柠檬酸杆菌属(Citrobacter),丰度分别为61.40%、50.02%,其次是气单胞菌属(Aeromonas),丰度分别为31.67%、36.16%,2组这2个属合计丰度分别为93.07%、86.18%。正常培养组乳球菌属有4.14%的可培养菌群丰度,优势度较低,正常培养组假单胞菌属(Pseudomonas)和低品质培养组梭杆菌属(Fusobacterium)、假单胞菌属和肠球菌属(Enterococcus)丰度均为0.01%,可培养菌群很少。2组的ZOR0006和乳卵属等其他8个属均没有丰度,无可培养菌群。2组的可培养菌群结构在属水平上具有相似性。
2.4 河蟹肠道中菌群相关性分析
基于各组全部的OTU,通过构建文恩(Venn)图进一步比较和分析正常河蟹和低品质河蟹肠道中细菌物种间差异性的相互关系。正常组和低品质组河蟹肠道菌群共鉴定出OTU数量分别为113个和87个,其中前者特有的OTU数量为62个,占全部OTU数量的41.6%,后者特有的OTU数量为36个,占全部OTU数量的24.2%,二者共有的OTU數量为51个,占全部OTU数量的34.2%(图4)。正常培养组和低品质培养组河蟹肠道中培养菌群鉴定出OTU数量分别为18个和22个,前者特有的OTU数量为6个,占全部OTU数量的21.4%,后者特有的OTU数量为10个,占全部OTU数量的357%,二者培养菌群共有的OTU数量为12,占全部OTU数量的42.9% (图5),以上数据表明正常河蟹和低品质河蟹肠道中菌群结构和种类有较大差别,正常培养组和低品质培养组的培养菌群结构和种类也有一些差别。
2.5 肠道中菌群差异性分析
各组间的关系主成分分析见图6,PC1轴对样品的贡献率为67.04%,PC2轴对样品的贡献率为32.96%。正常组与低品质组之间在PC1轴上和PC2轴上均相距较远,它们间具有明显的差异性。正常培养组和低品质培养组之间距离很近,差异性不明显,具有较高的相似性,它们在PC1轴上与正常组距离较远,而在PC2轴上与低品质组距离较远,具有明显的差异性。
3 討论
3.1 肠道菌群的分析方法
水生动物肠道内细菌种类繁多, 包括可培养细菌和目前尚不为人知的大量不可培养细菌。对菌群的分析,从最初主要为了确定细菌性疾病的致病菌分析,采用传统的分离培养技术,再通过回感实验和生理生化实验鉴定致病菌的种类,例如王德铭等对草鱼和青鱼肠炎致病菌的分析[9];API20E系统鉴定[10]等技术,使细菌鉴定更为方便,但离不开细菌分离培养;酶联免疫吸附法(Enzyme-linked immunosorbent assay,简称ELISA)[11-12]等免疫酶技术在细菌检测上得到了广泛的应用,但也必须首先通过细菌分离培养得到被检测的细菌,通过制备对应的抗体才能建立免疫酶检测技术,因此这些技术都无法对不能培养的菌群进行检测。PCR-DGGE分子生物学技术[13-14],对可培养和不可培养菌群都可检测,但还存在一定的局限性,如不能分析痕量微生物,电泳条带强弱判断微生物的丰度也不是非常准确,条带中会包含1种以上16S rDNA序列,要获悉具体的菌种信息,还需克隆和测序等繁琐操作。随着分子生物学的进一步发展,高通量测序技术的出现,以其高的检测性、准确性和测序深度等特点,目前已在水生动物肠道菌群结构的分析研究中得到应用,对包括痕量的可培养菌群和不能培养的未知菌群都能检测,并可精确确定它们的丰度等信息[15]。采用高通量测序技术对河蟹肠道菌群分析,具有明显的分析优势,能更准确地反映河蟹肠道微生物菌群结构的特点。
3.2 肠道菌群的影响因素
已有报道的养殖鱼类肠道菌群影响因素的研究主要采用PCR-DGGE的方法,研究表明,不同月份[16]、食物[17-18]、养殖方式[19]等都会影响肠道菌群结构的组成。河蟹肠道菌群影响因素鲜有研究报道,由于河蟹养殖类似于鱼类养殖,河蟹肠道菌群同样会受到所处的养殖水环境、饵料和养殖方式等因素的影响,河蟹经过育苗、蟹种培育和成蟹养殖各个阶段,生活周期长达2年左右,自蚤状幼体从外界摄食起,肠道菌群开始定殖和微生态便开始逐步建立,蟹种肠道中的菌群主要受到蟹种培育池中的因素影响,在成蟹养殖过程中,成蟹肠道会在成蟹养殖池中重新建立菌群结构,不同的养殖方法和养殖场条件,会使得成蟹肠道菌群产生差异,各自形成一个比较稳定的菌群微生态系统。为了客观地反映低品质河蟹肠道菌群结构的特点,作为对照的正常河蟹采自于塘大小、水深、种植水草的种类和覆盖率、水质清澈、高透明度等养殖环境和养殖方法等措施与低品质河蟹的养殖条件和方法类似的池塘。
3.3 肠道菌群结构特点和减少低品质河蟹的途径
正常河蟹和低品质河蟹肠道的主要优势菌门为厚壁菌门、变形菌门、拟杆菌门和软壁菌门,与人工感染白斑综合征病毒(white spot syndrome virus)的河蟹[20]和太湖河蟹[21]肠道的主要优势菌门为厚壁菌门、变形菌门、软壁菌门和拟杆菌门以及与饵料中添加果糖等成分的河蟹肠道主要优势菌门为厚壁菌门、变形菌门、拟杆菌门和梭杆菌门[22]相似;与上海崇明养殖河蟹肠道中只有变形菌门和拟杆菌门菌群[23]以及养殖河蟹肠道中只发现属于变形菌门γ-变形菌纲Gammaprotebacteria的菌群[24]有很大差异。不同报道中出现的这些差异,可能与试验方法、试验样本数量、河蟹来源等不同存在一定的关系。正常河蟹与低品质河蟹肠道菌群相对丰度比例上具有明显差异性,主要表现在厚壁菌门、变形菌门、拟杆菌门、软壁菌门和梭杆菌门等菌门,其中厚壁菌门和拟杆菌门相对丰度的差异是最值得注意的。报道的肥胖小鼠与瘦小鼠肠道菌群的比较研究中,肥胖小鼠厚壁菌门菌群丰度较大但拟杆菌门菌群丰度非常小,而瘦小鼠相反,认为厚壁菌门与拟杆菌门的比例与能量吸收有很大关系,比例的降低影响小鼠能量吸收和生长[6],猪肠道菌群研究的报道中,与瘦猪比较,肥胖猪的体质量增加与厚壁菌门菌群丰度存在正相关关系,而与拟杆菌门菌群丰度存在负相关关系[7]。在正常组和低品质组河蟹肠道中这2个门的菌群丰度情况与肥胖小鼠和瘦小鼠以及肥胖猪和瘦猪肠道中的情况有着相似性,河蟹正常组厚壁菌门丰度达93.54%,拟杆菌门菌群丰度只有0.01%,二者的丰度比达9 000倍,而低品质组厚壁菌门丰度为62.60%,拟杆菌门菌群丰度为5.74%,二者的丰度比只有10多倍,丰度比降低类似于肥胖小鼠和瘦小鼠以及肥胖猪和瘦猪的厚壁菌门与拟杆菌门丰度比降低的趋势。厚壁菌门丰度减少,拟杆菌门丰度增加,推测对河蟹营养吸收和生长具有类似的负面影响,会引起河蟹养殖生产中出现肥满度和肝胰腺指数低为主要特征的低品质河蟹。通过调节这2个门的属级菌群结构,增加低品质河蟹肠道中的厚壁菌门丰度,降低拟杆菌门的丰度,提高厚壁菌门与拟杆菌门丰度比,有望成为减少低品质河蟹发生和发展的途径之一。河蟹肠道中厚壁菌门由乳球菌属、尚无属名的ZOR0006、乳卵属、乳杆菌属和链球菌属构成,其中正常组最优势的菌属为乳球菌属,占86.00%的相对丰度,而低品质组最优势的菌属为无属名的ZOR0006,占46.20%的相对丰度,除乳球菌属在正常培养组中出现4.14%的可培养菌群丰度外,厚壁菌门的其他菌属在正常培养组和低品质培养组均为不可培养的菌群。拟杆菌门的优势菌属主要是Roseimarinus属,在正常组和低品质组分别占001%和3.95%,为不可培养的菌群。现有的细菌种名一般是以往通过分离培养后确定的,这些不可培养的菌群因无或缺乏相对应的菌种名和核酸等数据资料,目前无法通过比对的方法确定它们的种名。厚壁菌门和拟杆菌门中绝大多数菌群的不可培养性和目前缺乏不可培养菌群的种级分类资料,无法通过培养方法得到大量菌群,使得采用口喂等人为的方法提高厚壁菌门丰度从而改善低品质河蟹肠道菌群结构变得困难,而降低拟杆菌门丰度相对容易,可通过深入研究使用药物等方法得以实现。
益生菌具有提高食物消化吸收、促进生长和肥满度,调节改善肠道菌群的结构和平衡,提高机体免疫力、抗病率和抑制致病菌等作用。益生菌种类繁多,作用较为复杂和多样,不同的益生菌种类作用有很大差异。在促进生长和提高肥满度方面,可选择提高食物消化吸收促进生长的那些益生菌,能够将不能或不易降解消化吸收的大分子物质转化成小分子,便于机体的吸收和利用,提高饲料转化率,其次益生菌本身富含营养物质,添加到饲料中可作为营养物质被摄取吸收利用,同时益生菌在肠道内生长繁殖能够产生如维生素、氨基酸以及促生长因子等营养物质参与机体的新陈代谢和生长。如已有报道在饲料中添加属于乳杆菌属的嗜酸乳杆菌(Lactobacillus acidophilus) [25]和属于芽孢杆菌属的地衣芽孢杆菌(Bacillus licheniformis)和枯草芽孢杆菌(Bacillus subtilis) [26],可增加凡纳滨对虾(Litopenaeus vannamei)肠道中的蛋白酶和淀粉酶等酶的活性,提高生长率。厚壁菌门的乳杆菌属在正常组河蟹肠道中相对丰度为3.69%,是低品质组河蟹肠道中相对丰度(2.15%)的1.7倍,尽管不知其对消化吸收和生长有多大程度的影响,但通过饲料中添加乳杆菌和芽孢杆菌等提高食物消化吸收促进生长的益生菌,是减少低品质河蟹值得探索的途径之一。
[13]李可俊,管卫兵,徐晋麟,等. PCR-DGGE对长江河口八种野生鱼类肠道菌群多样性的比较研究[J]. 中国微生态学杂志,2007,19(3):268-269,272.
[14]郝耀彤,吴山功,王桂堂,等. 草鱼肠道微生物对食物改变适应性变化的研究[J]. 淡水渔业,2015,45(3):46-51,101.
[15]李小义,张效平,赵 凤,等. 鲟鱼肠道微生物多样性的研究[J]. 江苏农业科学,2018,46(24):164-167.
[16]倪加加,余育和. 不同月份养殖草鱼幼鱼消化道微生物群落动态变化研究[J]. 水产学报,2013,37(10):1558-1563.
[17]郁二蒙,张振男,夏 耘,等. 摄食不同饵料的大口黑鲈肠道菌群分析[J]. 水产学报,2015,39(1):118-126.
[18]钟 蕾,向建国,曾 丹,等. 饵料对鳡肠道微生物多样性的影响[J]. 水生生物学报,2016,40(4):830-835.
[19]夏 耘,余德光,谢 骏,等. 不同养殖方式对鳙肠道细菌群落结构的影响[J]. 南方农业学报,2017,48(5):907-912.
[20]Ding Z F,Cao M J,Zhu X S,et al. Changes in the gut microbiome of the Chinese mitten crab (Eriocheir sinensis) in response to white spot syndrome virus (WSSV) infection[J]. Journal of Fish Diseases,2017,40(11):1561-1571.
[21]Chen X,Di P P,Wang H M,et al. Bacterial community associated with the intestinal tract of Chinese mitten crab (Eriocheir sinensis) farmed in Lake Tai,China[J]. PLoS One,2015,10(4):e0123990.
[22]吴韬,张振龙,蔡春芳,等. 果胶和木聚糖对中华绒螯蟹肠道菌群结构的影响[J]. 基因组学与应用生物学,2015,34(4):745-753.
[23]Li K,Guan W,Wei G,et al. Phylogenetic analysis of intestinal bacteria in the Chinese mitten crab (Eriocheir sinensis)[J]. Journal of Applied Microbiology,2007,103(3):675-682.
[24]狄盼盼,陈小兵,孙国伟,等. 养殖中华绒螯蟹肠道内优势细菌群组成分析[J]. 微生物学杂志,2014,34(1):58-61.
[25]王国霞,黄燕华,周 晔,等. 乳酸菌对凡纳滨对虾幼虾生长性能、消化酶活性和非特异性免疫的影响[J]. 动物营养学报,2010,22(1):228-234.
[26]胡 毅,谭北平,麦康森,等. 饲料中益生菌对凡纳滨对虾生长、肠道菌群及部分免疫指标的影响[J]. 中国水产科学,2008,15(2):244-251.
[27]周沛辉. S·S培养基和血琼脂培养基联合应用的意义[J]. 现代中西医结合杂志,1998,7(2):3-5.
[28]苏加云. 腹泻患者粪便病原微生物培养方法的探讨[J]. 检验医学与临床,2011,8(8):924-925,327.
[29]田佳琪,董文龙,王巍,等. 猪源解鸟氨酸拉乌尔菌分离鉴定与大环内酯耐药基因检测[J]. 中国预防兽医学报,2018,40(1):1-4.
[30]Reneerkens J,Versteegh M A,Schneider A M,et al. Seasonally changing preen-wax composition:red knots(Calidris Canutus) flexible defense against feather-degrading bacteria[J]. Auk,2008,125(2):285-290.
[31]林 伟,彭新亮,杨治国.招财鱼红斑病病原——诺卡氏菌的分离与鉴定[J]. 信阳农业高等专科学校学报,2012,22(2):99-101.
[32]Yano Y,Hamano K,Satomi M,et al. Diversity and characterization of oxytetracycline-resistant bacteria associated with non-native species,white-leg shrimp (Litopenaeus vannamei),and native species,black tiger shrimp (Penaeus monodon),intensively cultured in Thailand[J]. Journal of Applied Microbiology,2011,110(3):713-722.
[33]Mirbakhsh M,Akhavansepahy A,Afsharnasab M,et al. Screening and evaluation of indigenous bacteria from the Persian Gulf as a probiotic and biocontrol agent against Vibrio harveyi in Litopenaeusvannamei post larvae[J]. Iranian Journal of Fisheries Sciences,2013,12(4):873-886.
[34]Hwang S H,Kim Y J. Meropenem-resistant bacteria in hospital effluents in Seoul,Korea[J]. Environmental Monitoring and Assessment,2018,190(11):1-8.
[35]Mwirichia R,Muigai A W,Tindall B,et al. Isolation and characterisation of bacteria from the haloalkaline Lake Elmenteita,Kenya[J]. Extremophiles,2010,14(4):339-348.
[36]陳 峰,张丹丽,宛宝山,等. 不同培养基与前处理方法对副溶血弧菌MALDI-TOFMS鉴定结果的影响评估[J]. 临床检验杂志,2017,35(4):264-267.毕振威,徐立波,夏兴霞,等. 鉴别犬瘟热病毒强弱毒株中和单克隆抗体的制备[J]. 江苏农业科学,2020,48(20):178-182.
- 盐碱地南美白对虾精养池塘套养吉富罗非鱼试验
- 野生牙鲆驯化养殖技术
- 盐碱地黄颡鱼池塘生态养殖技术研究
- 微生态制剂防控南美白对虾病害试验
- 零污染、反季节工厂化养殖凡纳滨对虾技术研究
- 从一起购销纠纷事件解析淡水小龙虾的正确运输
- 济南市观赏渔业发展现状调查与前瞻性研究
- 浙江衢山岛附近海域沉积物化学特征
- 虹鳟鱼三倍体的人工繁育试验
- 利用地下水孵化三倍体海鳟鱼苗技术
- 不同密度下“长丰鲢”夏花苗种的生长效果及成活率
- 聚维酮碘对南美白对虾虾苗的毒性试验
- 鲈鱼骨酸溶性和酶溶性胶原的性质比较
- 几种常见海藻饵料对虾夷扇贝增重效果的影响
- 四种鲤鱼对柱形病抗病能力的差异
- 不同规格圆口铜鱼幼鱼的化学组成和能量密度
- 魁蚶蛋白胰蛋白酶酶解产物的抑菌活性
- 渔用共混改性MMWPE/PP单丝和普通PE单丝拉伸力学性能的比较
- 不同养殖环境中的中华绒螯蟹组织抗氧化剂水平和抗氧化酶活力
- 济南流域春季浮游植物多样性的研究
- 秦皇岛海域夜光藻种群密度与环境因子的关系
- 腌制大白鱼的工业化生产工艺
- 欢迎订阅2016年《河北渔业》
- 欢迎订阅2016年《水产养殖》
- 欢迎订阅2016年《渔业现代化》
- unqueried
- unquested
- unquestionability,unquestionableness
- unquestionable
- unquestionablenesses
- unquestionably
- unquestioned
- unquestioningly
- unquick
- unquickened
- unquicker
- unquickest
- unquickly
- unquickness
- unquicknesses
- unquieted
- unquieter
- unquieting
- unquiets
- unquilt
- unquilted
- unquitted
- unquivered
- unquivering
- unquizzable
- 共同庆贺
- 共同度过
- 共同或国家资助
- 共同承受
- 共同承担
- 共同抚育
- 共同拥戴一个人
- 共同拯救
- 共同掌权
- 共同推荐
- 共同核心成分
- 共同检举
- 共同治理
- 共同热爱
- 共同犯罪
- 共同犯罪中的首要分子
- 共同犯罪的人中直接实施犯罪行为者
- 共同生活
- 共同生活或一起共事而各有各的打算
- 共同用手或肩膀搬东西
- 共同的准则
- 共同的愿望
- 共同的敌人
- 共同的旨趣
- 共同的祸患