刘春芬 慕金超
摘要:利用三孢布拉氏霉菌发酵生产番茄红素,并对其发酵条件进行探讨,确定其最佳发酵条件。结果表明,番茄红素最大吸收波长为508 nm;活化的冻干粉菌种在斜面培养基上于25 ℃培养5 d后,呈较好生长状态,菌丝粗壮,孢子生长状态饱满,镜检显示,其个体生长状态良好;扩大培养120 h时孢子数量达到最高峰;发酵至36 h时添加阻断剂效果最好,发酵至72 h时添加增氧剂效果最好。通过发酵条件优化的正交试验发现,三孢布拉氏霉菌发酵产番茄红素的最优发酵工艺为发酵温度25 ℃、pH值5.0、发酵时间5 d、接种量10.0%。
关键词:番茄红素;三孢布拉氏霉菌;发酵;工艺条件
中图分类号: TQ920.6;S182? 文献标志码: A? 文章编号:1002-1302(2020)20-0214-04
番茄红素主要存在于植物细胞的有色体中,因具有抗癌、降低心血管疾病发病率、预防动脉粥样硬化、提高免疫力等生理功能,国内外对其研究热度逐年递增,目前国内外生产番茄红素的方法有以下几种:有机溶剂提取法、超临界萃取法、化学合成法等,利用这些方法合成的番茄红素存在化学物残留问题,品质不高。采用生物合成中的微生物合成法,利用三孢布拉氏霉菌发酵产出番茄红素,和其他的方法相比,具有不受季节控制、操作工艺简单、用时短、生产成本较为低廉等优势。另外相对其他几种方法来说,生物合成法可以获得较高的番茄红素得率,是生产番茄红素的一种理想途径。
本试验研究利用生物发酵法生产番茄红素时发酵条件、培养基成分、各类抑制剂等对成品产量及品质的影响,并对工艺进行优化,初步建立通过微生物发酵生物合成番茄红素的基本工艺。
1 试验材料
1.1 试验时间及地点
试验于2019年6—10月进行,试验地点为学院微生物实训中心。
1.2 材料及试剂
GM3.560三孢布拉氏霉(中国微生物菌种保藏中心,编号:ATCC 14059);玉米粉、玉米淀粉(在超市或农贸市场购买);番茄红素标准品(CAS:502-65-8,有效成分含量>98%,规格:20 mg/支);可溶性淀粉、硫酸镁、磷酸二氢钾、淀粉均为分析纯;琼脂、维生素B1、酵母膏为生化試剂。
1.3 培养基
活化用培养基:磷酸二氢钾1 g、七水硫酸镁 0.5 g、可溶性淀粉15 g、酵母膏4.0 g,溶于 1 000 mL 蒸馏水中,加入琼脂15 g,充分溶解。121 ℃ 灭菌20 min,制备斜面。
扩大培养用培养基:除不添加琼脂外,其他成分同活化用培养基。
发酵培养基:玉米粉40 g、淀粉糖化液40 g、可溶性淀粉50 g、磷酸二氢钾0.5 g、七水硫酸镁 0.25 g、维生素B1少量,溶于1 L蒸馏水中,加热至完全溶解,调节pH值为6.5,分装在10个锥形瓶中标号1~10,冷却备用。
2 试验方法
ATCC 14059→活化→扩大培养→计孢子数→接种至发酵培养基中→发酵→添加阻断剂和增氧剂→发酵条件的优化→发酵醪→过滤→滤液→减压浓缩→成品
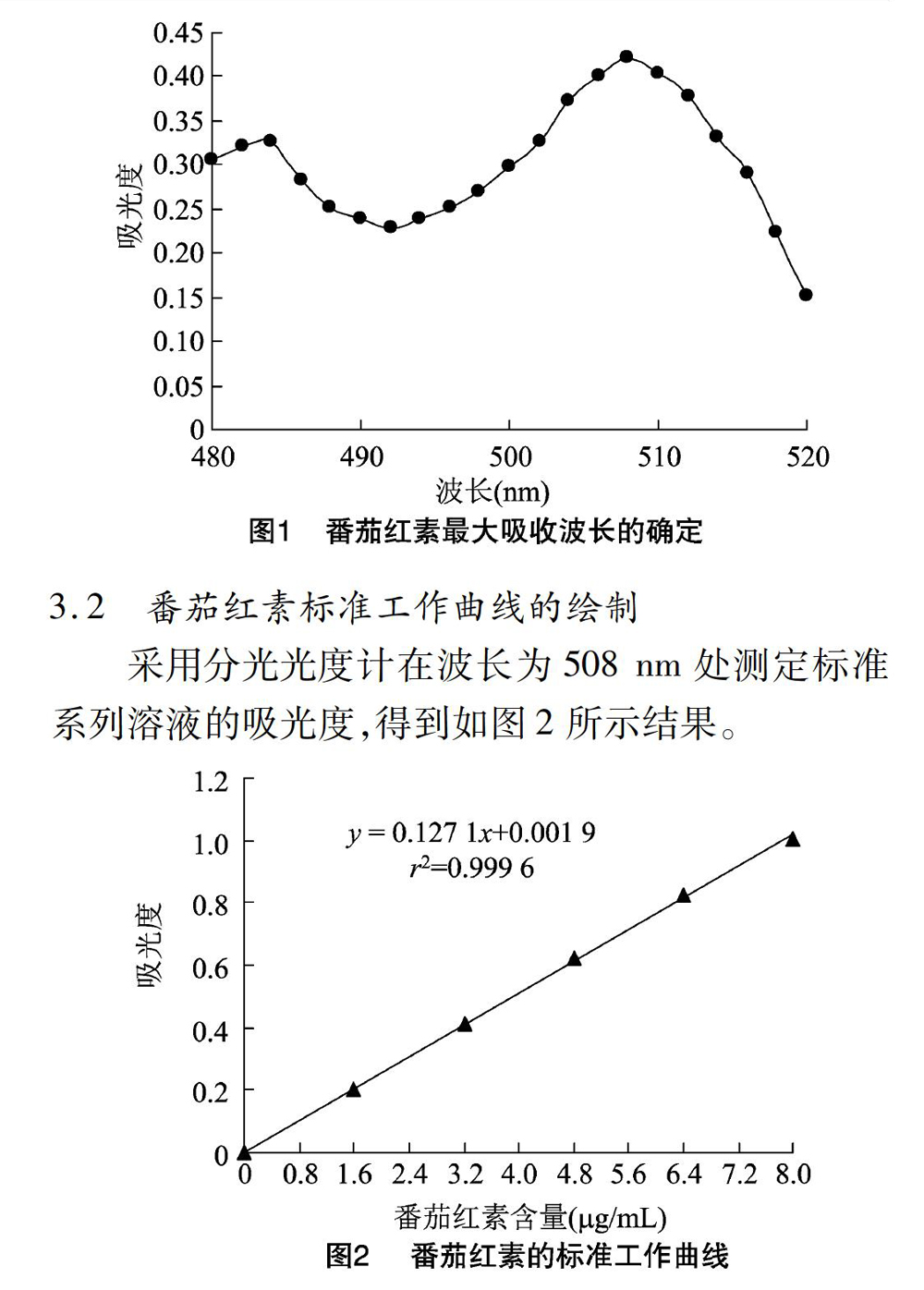
2.1 番茄红素最大吸收波长的确定
对番茄红素标准品在480~520 nm范围内进行最大吸收波长的扫描[1-3],找到番茄红素标准品最大吸收峰,由此确定番茄红素的最大吸收波长。
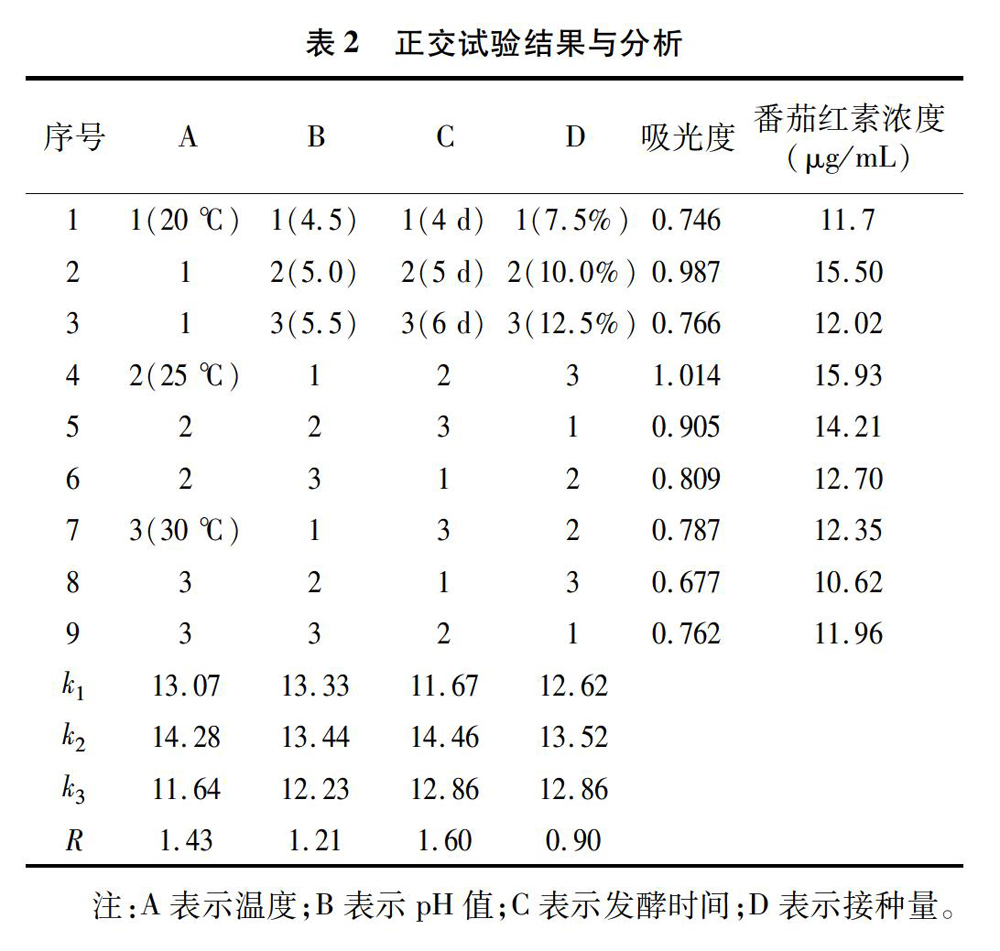
2.2 番茄红素标准线性范围的确定
取20 mg番茄红素标准品置于50 mL容量瓶中,用乙酸乙酯定容至刻度,将其作为储备液。用移液管移取1 mL储备液置于50 mL容量瓶中,同样用乙酸乙酯定容至刻度,作为标准使用液。分别吸取标准使用液0.00、2.50、5.00、7.50、10.00、12.50 mL 置于 25 mL 容量瓶中,并用乙酸乙酯定容至刻度,然后于最大吸收波长处分别测定其吸光度,绘制标准曲线。
2.3 菌种的活化及扩大培养
将0.1 mL无菌生理盐水加入到冻干菌粉的安瓿瓶中,振荡成悬浮状,吸取全部菌体悬浮液,移至4支斜面培养基上,在25 ℃培养5~7 d[4-7]。将活化后的菌种接种到扩大培养用培养基中,在25 ℃振荡培养,转速为150 r/min。自培养48 h开始每隔24 h取菌液计数,当培养基中孢子数达109~1010个/mL 时,停止培养,此培养液备用。
2.4 发酵培养
向发酵培养基中接种10%种子液,摇匀,在 25 ℃ 振荡培养,转速为150 r/min[8]。
2.5 阻断剂及增氧剂添加时间的确定
选用烟草废弃物作为阻断剂,在发酵培养24、30、36、42、48 h时分别向1~5号瓶中加入阻断剂007 g,均进行5 d发酵培养。过滤发酵液,弃去滤渣,将滤液减压浓缩,分析确定阻断剂添加时间。以不添加阻断剂为空白对照。
分别在发酵培养的48、60、72、84、96 h时向6~10号瓶中各加入增氧剂30% H2O2 0.5 g,均进行 5 d 发酵培养,分析确定增氧剂最佳添加时间。以不添加增氧剂为空白对照。
2.6 发酵条件的优化
探讨温度(20、25、30 ℃)、pH值(4.5、5.0、55)、发酵时间(4、5、6 d)、接种量(7.5%、10.0%、125%)等因素[9-14]对发酵结果的影响,分析确定采用三孢布拉氏霉菌发酵生产番茄红素的最佳条件。
3 结果与分析
3.1 番茄红素最大吸收波长的确定
如图1所示,番茄红素标准品在508 nm处有最大吸收峰,因此番茄红素的最大吸收波长为508 nm。
3.2 番茄红素标准工作曲线的绘制
采用分光光度计在波长为508 nm处测定标准系列溶液的吸光度,得到如图2所示结果。
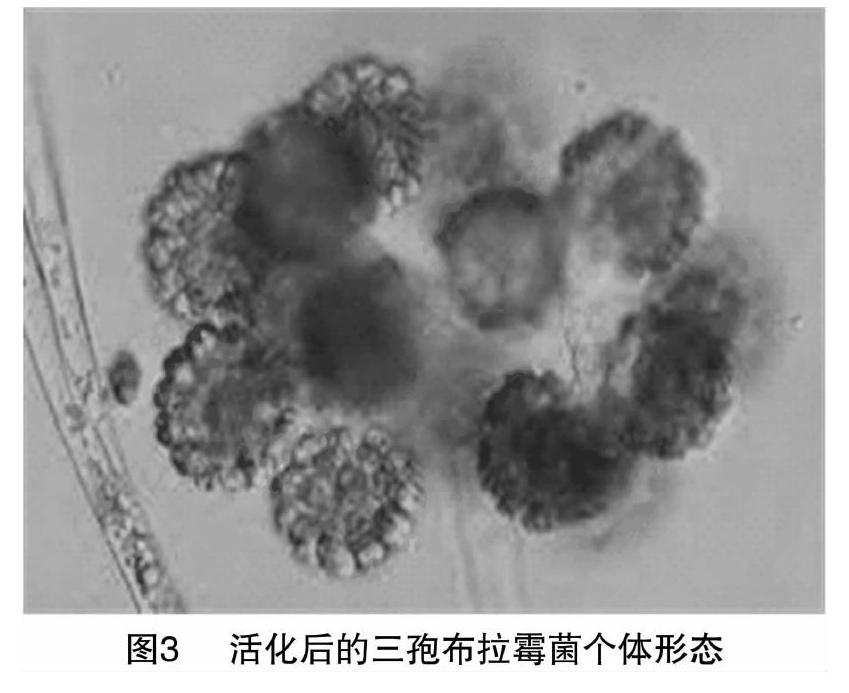
3.3 菌种的活化培养
在斜面培养基上于25 ℃培养5 d后的冻干粉菌种呈较好的生长状态,菌丝粗壯,孢子生长状态饱满。图3显示,该菌菌丝非常粗壮且长度较大,菌丝无横膈膜,属于单细胞,具有多个细胞核,未发现假根。
3.4 种子的扩大培养时间
从表1可以看出,从培养48 h开始,随着培养时间的延长,孢子数呈对数递增趋势,到培养120 h时,孢子数量达到最高峰,随后再延长培养时间,孢子数量没有明显的增加,说明此时扩大培养基中营养成分已经较少,代谢产物积累较多,菌体开始由对数生长期转向稳定生长期,新生细胞数与死亡细胞数保持动态平衡,孢子数量出现减少趋势,可以推论,此后霉菌将进入衰亡期,因此,选择在培养120 h时终止培养,得到种子培养液。
3.5 阻断剂添加时间的确定
在508 nm处分别测定减压浓缩后滤液的吸光度[15],由于测得的吸光度过大,不在番茄红素标准工作曲线的线性范围内,因此测定之前分别将5瓶发酵液稀释2倍,得到图4所示结果。空白对照组发酵5 d后,经测定吸光度为0.295。由图4可见,比较试验组的吸光度与对照组发现,发酵过程中添加阻断剂能有效阻断胡萝卜素的生成,从而使得产物仍为番茄红素。当发酵进行至36 h时添加阻断剂效果最好,因此,选择添加时间为发酵 36 h 时。
3.6 增氧剂添加时间的确定
在508 nm处分别测定减压浓缩后滤液的吸光度,由于测得吸光度过大,不在番茄红素标准工作曲线的线性范围内,因此测定之前分别将5瓶发酵液稀释2倍,得到图5所示结果。空白对照组发酵5 d后,经测定吸光度值为0.287。由图5可见,比较试验组的吸光度与对照组发现,发酵过程中添加增氧剂能有效增加番茄红素的生成量。当发酵进行至72 h时添加增氧剂效果最好,因此,选择添加时间为发酵72 h时。
3.7 发酵条件的优化
3.7.1 发酵温度的确定 由图6可知,在一定范围内当发酵温度升高时,番茄红素的浓度也随之增加;当温度上升到25 ℃时,番茄红素的浓度达到最高值;如果温度继续升高,番茄红素的浓度反而下降,这是因为三孢布拉氏霉菌的最适发酵温度为 25~28 ℃,因此选择25 ℃为其发酵最佳温度。
3.7.2 发酵液pH值的确定 由图7可知,当发酵液pH值上升至5时,番茄红素的浓度达到最高值;继续升高pH值,番茄红素的浓度反而下降,说明三孢布拉氏霉菌的最适发酵pH值在5左右。
3.7.3 发酵时间的确定 由图8可知,当发酵进行至5 d时,番茄红素含量达到最大值,其后,随着时间的延长,产物含量不增反降,可能是由于番茄红素本身不稳定,发生了部分分解,因此,选择最佳发酵时间为5 d。
3.7.4 接种量的确定 由图9可知,在一定范围内番茄红素产量随着接种量增加逐渐递增,当接种量增加到10%时,番茄红素产量达到最大,其后随着接种量的持续增加,番茄红素产量没有明显变化,从经济角度考虑,选择接种量为10%。
3.7.5 发酵条件优化的正交试验结果 由于测得吸光度不在番茄红素标准工作曲线的线性范围内,因此测定之前分别稀释2倍,得到表2所示结果。由正交试验结果可知,影响三孢布拉氏霉菌发酵产番茄红素各因素的主次顺序是C>A>B>D,即发酵时间>发酵温度>pH值>接种量。由k值可得,最佳组合方案为A2B2C2D2,即发酵温度25 ℃、培养基pH值5.0、发酵时间5 d、接种量10.0%。
因为最佳组合方案没有在9组正交试验中出现,所以根据正交试验所得到的最佳条件因素做验证试验。经过试验测定得出,在最佳组合方案下吸光度为1.121,对照标准曲线计算得到的番茄红素浓度为 17.61 μg/mL,比正交试验4号的 15.93 μg/mL 大。结果表明,发酵温度25 ℃、培养基pH值5.0、发酵时间5 d、接种量10.0%是发酵最佳工艺参数。
4 结论
本试验确定了番茄红素的最大吸收波长为 508 nm;活化的冻干粉菌种在斜面培养基上于25 ℃培养5 d后,呈较好的生长状态,菌丝粗壮,孢子生长状态饱满,镜检显示,其个体生长状态良好;扩大培养120 h时孢子数量达到最高峰;当发酵进行至36 h时添加阻断剂效果最好,发酵进行至 72 h 时添加增氧剂效果最好;通过发酵条件优化的正交试验发现,三孢布拉氏霉菌发酵产番茄红素的最佳发酵条件为发酵温度25 ℃、培养基pH值5.0、发酵时间5 d、接种量10.0%。
参考文献:
[1]吴 灿,夏延斌,唐 鑫. 响应面法优化莲子黄酒的发酵工艺条件[J]. 现代食品科技,2013,29(7):1675-1679.
[2]吴军林,吴清平,张菊梅,等. 番茄红素的微生物合成及发酵生产研究进展[J]. 食品科学,2013,34(19):336-340.
[3]王 敏,杨 慧,高俊莲,等. 高产番茄红素链霉菌选育及摇瓶发酵研究[J]. 中国生物工程杂志,2009,29(12):64-68.
[4]马永强,韩春然. 三孢布拉霉生产番茄红素发酵条件的研究[J]. 食品研究与开发,2007,28(4):54-57.
[5]万红贵,吴启赐,蔡 恒,等. 基于三孢布拉霉菌番茄红素的提取工艺研究进展[J]. 安徽农业科学,2010,38(10):5315-5317,5424.
[6]黄 进,高伟欣,乔汉桢,等. 从新鲜番茄中提取番茄红素的条件优化[J]. 饲料研究,2019,42(9):86-90.
[7]陈文静,张 欢,董 旭,等. 番茄红素的研究现状及应用前景[J]. 安徽农业科学,2015,43(27):29-32,99.
[8]巴宁宁,王 瑞,王英明,等. 提取方法不同对番茄红素油树脂抗氧化活性的影响[J]. 粮食与油脂,2019,32(8):83-86.
[9]张玉丹,杨 阳,刘沐霖. 番茄红素生产工艺研究进展[J]. 中国食物与营养,2016,22(4):38-41.
[10]蔡文杰,汤华成,温丹旭. 阻断剂对三孢布拉霉菌产番茄红素的影响[J]. 黑龙江八一农垦大学学报,2017,29(3):45-48,69.
[11]庞昆云,吴嘉琦,王泽建,等. 三孢布拉霉菌发酵番茄红素提取工艺的优化[J]. 华东理工大学学报(自然科学版),2016,42(3):343-350.
[12]姜 丰,王 颖,汤华成,等. 三孢布拉霉菌发酵生产番茄红素的最佳条件的筛选[J]. 黑龙江八一农垦大学学报,2013,25(2):48-52.
[13]范 超,洪 皓,李 妍,等. 三孢布拉霉发酵生产类胡萝卜素的产业化关键点探讨[J]. 食品与发酵工业,2018,44(5):284-290.
[14]闫 兴,向梦雄,王常高,等. 代谢调节剂对三孢布拉氏霉菌发酵的影响[J]. 湖北工业大学学报,2016,31(1):85-88.
[15]向梦雄,闫 兴,王常高,等. 发酵促进剂对三孢布拉氏霉菌发酵产β-胡萝卜素的影响[J]. 氨基酸和生物资源,2015,37(1):56-60.肖亚冬,杨慧珍,李大婧,等. 不同护色预处理对铁棍山药热风干燥特性及品质变化的影响[J]. 江苏农业科学,2020,48(20):218-223.
- LMDI法与STIRPAT模型下京津冀碳排放影响因素研究
- 提升乡村旅游从业者业务素质的对策
- “后扶贫时代”返贫问题及对策
- 居然之家借壳上市绩效实证研究
- 新证券法下上市公司信息披露制度变化研究
- 利润操纵视角下关联交易对公司价值的影响
- 基于VAR和GARCH模型的新能源股价研究
- 浅析我国普惠金融数字化转型的影响
- 区块链技术下互联网金融的风险防范
- 促进南京自贸区跨境人民币业务创新发展的思考
- P2P网贷对银行信贷利息多重效应分析
- 基于VAR模型的新疆城镇化影响因素研究
- 青岛市发展智能网联汽车产业研究
- 上海:强化科技自立自强战略支撑加快发展现代产业体系
- 2021年湖北力争新开工亿元以上项目4274个
- 黑龙江省大数据中心产业发展分析
- 我国资源税改革与地方税制绿化
- 着力推动积极应对人口老龄化国家战略
- 落实生产者责任延伸制度的又一重要举措
- 落实生产者延伸责任推动饮料纸基复合包装行业绿色发展
- 饮料纸基复合包装生产者责任延伸制度实施方案
- 部分地方深化公共资源交易平台整合共享工作典型做法
- 内蒙古:创新地方规划管理实践科学编制“十四五”规划
- 黑龙江:统筹发展和安全更好服务国家战略大局
- 广东:深入推进粤港澳大湾区建设打造新发展格局战略支点
- gas meter
- gasolene
- gasolenes
- gasoline
- gasolineless
- gasolines
- gasolinic
- gasp
- gasped
- gasp-forth
- gasping
- gasps'
- gasps
- gas's
- gassed
- gassed-up
- gasses
- gasses'
- gassing
- gassing-up
- gas station
- gas stations
- gastric
- gastritic
- gastritides
- 晚甲
- 晚登
- 晚盖
- 晚睡
- 晚睡早起
- 晚秋
- 晚秋季节
- 晚秋的天气
- 晚秋的秋色是最美好的
- 晚种的作物
- 晚稻
- 晚稼
- 晚空
- 晚笋
- 晚笑
- 晚粟
- 晚红
- 晚练
- 晚翠
- 晚耄
- 晚耆
- 晚膳
- 晚色
- 晚艳
- 晚节