吕蒙蒙 陈宇 林思祖

摘要:以杉木实生苗为试验材料,选择萘乙酸(NAA)、吲哚-3-乙酸(IAA)、6-苄氨基嘌呤(6-BA)等3种生长调节剂,采用单因素试验,各因素设置3个浓度,研究不同生长调节剂对铝胁迫下杉木幼苗叶绿素荧光特性的影响。结果表明,铝胁迫对杉木幼苗的叶绿素荧光参数造成了影响,与CK(无Al3+、pH值为4.5的Hoagland-Arnon营养液)相比,CKAL处理(有Al3+、pH值为4.5的Hoagland-Arnon营养液)下的初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、PSⅡ实际光化学效率(QY)、PSⅡ最大光化学效率(Fv/Fm)和PSⅡ潜在光化学活性(Fv/Fo)总体呈现先升高后降低又升高的趋势。总的来说,生长调节剂在一定程度上提高了杉木叶片的Fv、Fm、Fv/Fm、Fv/Fo、光化学猝灭系数(qP)、QY,降低了Fo、非光化学猝灭系数(NPQ)。
关键词:杉木;生长调节剂;铝胁迫;叶绿素荧光
中图分类号:S791.270.1文献标志码:A
文章编号:1002-1302(2020)22-0116-06
作者简介:吕蒙蒙(1993—),男,河南灵宝人,硕士研究生,主要从事森林培育研究。E-mail:1257044523@qq.com。
通信作者:林思祖,博士,教授,主要从事森林培育及林木遗传育种研究。E-mail:Szlin53@126.com。
杉木(Cunninghamialanceolata)别称沙木、沙树等,为杉科乔木,是亚热带地区优质速生针叶树种,林业价值高,分布广阔,是我国南方地区经营历史最长的用材树种之一[1-2]。目前,杉木人工林面积分别占全国人工林面积和森林总面积的18.2%、37.4%,且扩增趋势明显[3-4]。叶绿素荧光分析技术是一种快速、高效、精确且无损伤测定植物叶片荧光参数以反映植物光合过程动态变化的技术,在测定叶片光合作用过程中光系统对光能的吸收、传递、耗散、分配等方面具有独特的作用,具有反映内在特性的特点[5-7]。通过观测植物叶绿素荧光参数的变化,可以研究和分析植物利用光能的一般规律及其在不同外界因素影响下的动态响应,因此叶绿素荧光参数被广泛应用于植物光合生理、抗性育种以及林木引种等方面[8-11]。
植物生长调节剂对植物具有重要的生理调节作用,适当浓度的生长调节剂对植物抵抗逆境胁迫的作用也较显著[12-14]。目前,关于铝胁迫及叶绿素荧光参数方面已经有不少研究[15-18],但是关于植物生长调节剂对铝胁迫下杉木荧光特性的影响尚未见报道,因此相关研究具有重要的理论意义和应用价值。
本研究以杉木实生苗为材料,分析植物生长调节剂萘乙酸(NAA)、吲哚-3-乙酸(IAA)和6-苄氨基嘌呤(6-BA)对铝胁迫下杉木幼苗叶绿素荧光特性的影响,从而丰富杉木耐铝机制的研究结果,为进一步改善杉木在酸性土壤中的生长状况及之后的分子生物学研究提供一定的理论基础。
1材料与方法
1.1试验地点
试验地点位于福建农林大学林学院实验室,育苗及试验于2019年8—10月开展。
1.2试验设计
以福建尤溪国有林场提供的杉木三代种子园种子为原始材料,经培育后获得的长势较一致的实生苗。种子用去离子水清洗3遍后,置于初始温度为45℃的超纯水中浸泡24h,其间用玻璃棒搅动。然后去掉浮于水面的瘪粒、涩粒,用3g/LKMnO4消毒0.5h,再用去离子水清洗干净,静置待用。将浸泡好的种子放在滤纸板上,置于光照—黑暗周期为14h(25℃)—10h(22℃)、光照度为110μmol/(m2·s)、相对湿度为75%的气候箱中。萌发15d后,挑选长势良好的幼苗移栽至盛有Hoagland-Arnon营养液(pH值为5.5)的培养框中,于温室内进行水培。控制温度为25℃,光照时间为12h/d,光照度为12000lx。7d更换1次营养液,培养1个月后选取长势一致的幼苗进行处理。胁迫开始后的pH值均为4.5,在胁迫10、20、30d时采样测定各项指标[19]。
本研究采用单因素试验,根据前期预试验及参考前人的研究成果,选择NAA、IAA、6-BA等3种生长调节剂,并各设置3个质量浓度,铝浓度为1mmol/L(铝源为AlCl3·6H2O)。同时设置2个对照,分别为无Al3+、pH值为4.5的Hoagland-Arnon营养液(CK)和有Al3+、pH值为4.5的Hoagland-Arnon营养液(CKAL)[20]。具体处理见表1。
1.3测定指标
将杉木叶片置于暗箱中进行充分暗反应,至少20min,用PSI公司生产的叶绿素荧光成像仪(HandyFlu0rCam)测定初始荧光(Fo)、最大荧光(Fm)、可变荧光(Fv)、PSⅡ潜在光化学活性(Fv/Fo)、PSⅡ最大光化学效率(Fv/Fm)、PSⅡ实际光化学效率(QY)、光化学猝灭系数(qP)和非光化学猝灭系数(NPQ)等相关参数。每株杉木幼苗取3张叶片为1次重复,做3次重复[21-22]。
2结果与分析
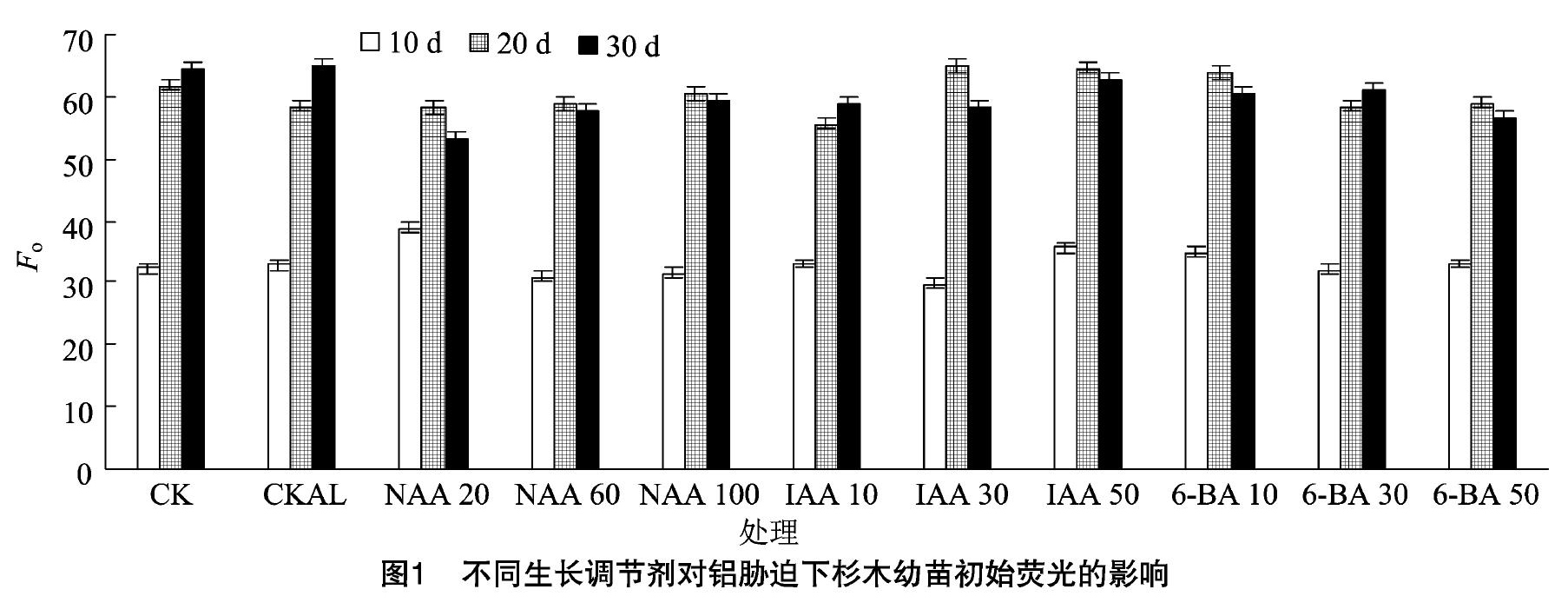
2.13种生长调节剂对铝胁迫下杉木幼苗初始荧光的影响
由图1可知,与CK相比,CKAL处理的Fo总体上呈升高趋势。胁迫10d时,60mg/LNAA、30mg/LIAA、30mg/L6-BA处理的Fo分别较CKAL处理降低了5.9%、9.2%、2.4%;脅迫20d时,20mg/LNAA、10mg/LIAA处理的Fo分别较CKAL处理降低了0.1%、4.5%,而30mg/L6-BA处理的Fo与CKAL处理相比提升了0.1%;胁迫30d时,20mg/LNAA、30mg/LIAA、50mg/L6-BA处理的Fo分别较CKAL处理降低了18.5%、10.7%、13.0%。
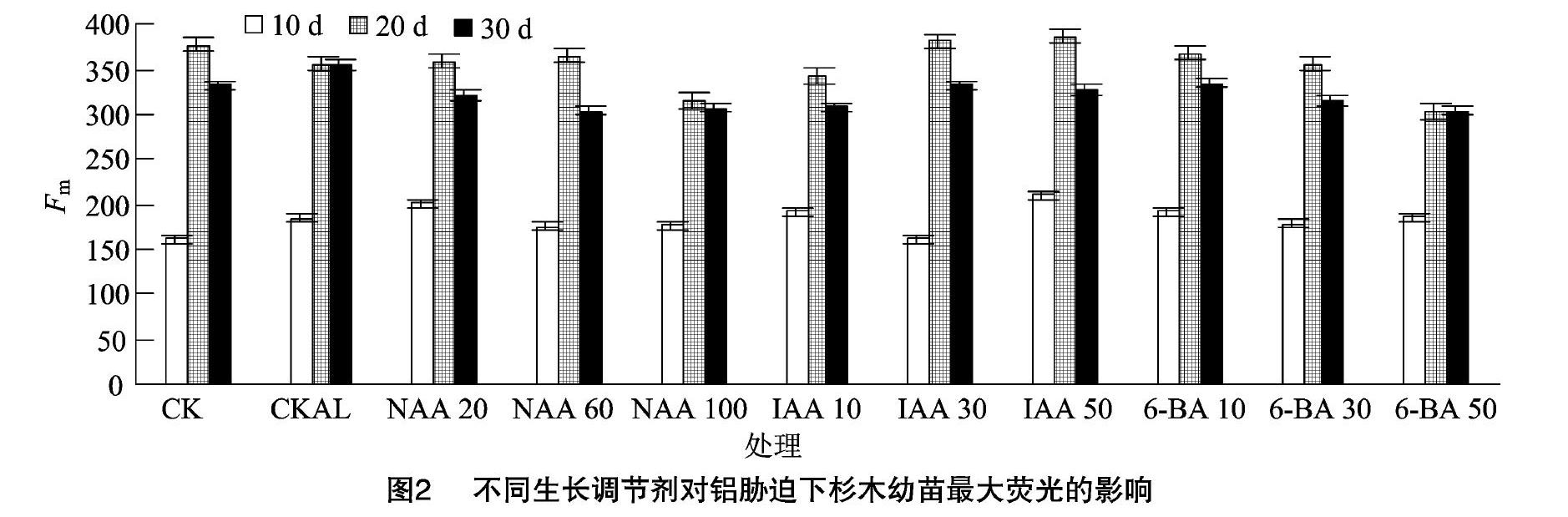
2.2不同生长调节剂对铝胁迫下杉木幼苗最大荧光的影响
由图2可知,与CK相比,CKAL处理的Fm总体上呈升高趋势。胁迫10d时,20mg/LNAA、50mg/LIAA、10mg/L6-BA处理下的Fm分别比CKAL处理提高了9.2%、14.4%、4.0%;胁迫20d时,60mg/LNAA、50mg/LIAA、10mg/L6-BA处理的Fm分别比CKAL处理提高了2.7%、8.7%、3.7%;胁迫30d时,与CKAL处理相比,不同生长调节剂处理的Fm总体上明显下降,其中60mg/LNAA、10mg/LIAA、50mg/L6-BA处理的Fm分别比CKAL处理降低了14.3%、13.1%、14.5%。
2.3不同生长调节剂对铝胁迫下杉木幼苗可变荧光的影响
由图3可知,与CK相比,CKAL处理的Fv总体上呈升高趋势。胁迫10d时,不同生长调节剂处理的Fv与CKAL处理相比总体上明显升高,其中20mg/LNAA、50mg/LIAA、10mg/L6-BA处理的Fv分别比CKAL处理提高了7.4%、15.7%、3.5%;胁迫20d时,60mg/LNAA、50mg/LIAA、10mg/L6-BA处理的Fv分别比CKAL处理提高了3.1%、8.3%、2.6%;胁迫30d时,不同生长调节剂处理的Fv与CKAL处理相比总体上明显下降,其中60mg/LNAA、10mg/LIAA、50mg/L6-BA处理的Fv分别比CKAL处理降低了14.9%、13.8%、14.8%。
2.4不同生长调节剂对铝胁迫下杉木幼苗PSⅡ潜在光化学活性的影响
由图4可知,与CK相比,CKAL处理的Fv/Fo总体上明显升高。胁迫10d时,60mg/LNAA、50mg/LIAA、50mg/L6-BA处理的Fv/Fo分别比CKAL处理提高了1.3%、6.7%、0.4%;胁迫20d时,60mg/LNAA、10mg/LIAA处理的Fv/Fo分别比CKAL处理提高了2.1%、1.1%,而30mg/L6-BA处理的Fv/Fo则CKAL处理降低了0.3%;胁迫30d时,20mg/LNAA、30mg/LIAA、10mg/L6-BA处理的Fv/Fo分别比CKAL处理提高了12.6%、5.5%、0.9%。
2.5不同生长调节剂对铝胁迫下杉木幼苗PSⅡ最大光化学效率的影响
由图5可知,与CK相比,CKAL处理的Fv/Fm总体上明显升高。胁迫10d时,60mg/LNAA、50mg/LIAA处理的Fv/Fm分别比CKAL处理提高了0.3%、1.2%,而50mg/L6-BA处理的Fv/Fm比CKAL处理降低了0.1%;胁迫20d时,60mg/LNAA、10mg/LIAA处理的Fv/Fm分别比CKAL处理提升了0.4%、0.2%,而30mg/L6-BA处理的Fv/Fm比CKAL处理降低了0.1%;胁迫30d时,20mg/LNAA、30mg/LIAA、10mg/L6-BA处理的Fv/Fm分别比CKAL处理提高2.2%、1.1%、0.2%。
2.6不同生长调节剂对铝胁迫下杉木幼苗PSⅡ实际光化学效率的影响
由图6可知,与CK相比,CKAL处理的QY总体上明显提高。胁迫10d时,60mg/LNAA、50mg/LIAA处理的QY分别比CKAL处理提高了0.4%、1.1%,而50mg/L6-BA处理的QY无变化;胁迫20d时,60mg/LNAA、10mg/LIAA处理的QY分别比CKAL处理提高了0.3%、0.4%,而30mg/L6-BA处理的QY与CKAL处理相比无明显变化;胁迫30d时,20mg/LNAA、30mg/LIAA、10mg/L6-BA处理的QY与CKAL处理相比分别提高了2.3%、1.1%、0.3%。
2.7不同生长调节剂对铝胁迫下杉木幼苗非光化学猝灭系数的影响
由图7可知,与CK相比,CKAL处理的NPQ总体上明显升高。胁迫10d时,不同生长调节剂处理的NPQ与CKAL处理相比总体上明显降低,其中60mg/LNAA、10mg/LIAA、30mg/L6-BA处理对NPQ的影响最大,分别较CKAL处理降低了23.8%、15.1%、9.4%;胁迫20d时,60mg/LNAA、10mg/LIAA、50mg/L6-BA处理的NPQ分别较CKAL处理降低了17.3%、22.0%、11.2%;胁迫30d时,60mg/LNAA、10mg/LIAA、50mg/L6-BA處理的NPQ分别较CKAL处理降低了33.7%、22.7%、16.7%。
2.8不同生长调节剂对铝胁迫下杉木幼苗光化学猝灭系数的影响
由图8可知,与CK相比,CKAL处理的qP明显降低。胁迫10d时,不同生长调节剂处理的qP与CKAL处理相比总体上明显降低,60mg/LNAA、10mg/LIAA、10mg/L6-BA处理的qP分别较CKAL处理降低了10.8%、5.2%、5.4%;胁迫20d时,100mg/LNAA、50mg/L6-BA处理的qP分别较CKAL处理提高了3.8%、0.4%,而50mg/LIAA处理的qP与CKAL处理相比降低了2.4%;胁迫30d时,不同生长调节剂处理的qP与CKAL处理相比总体上有所提高,100mg/LNAA、10mg/LIAA、30mg/L6-BA处理的qP分别较CKAL处理提高了3.3%、6.8%、6.8%。
3讨论与结论
植物叶片是光合作用的主要部位和铝毒害的关键位点之一,植物通过叶绿素捕获光能获得能量,这一过程所产生的荧光信号可以对植物的生理变化产生敏感反应,因此可以把叶绿素荧光参数作为衡量植物体在逆境胁迫条件下耐受性的一项重要指标[23-26]。
一般而言,Fo主要指初始荧光,用于表征PSⅡ反应中心的基本状态,逆境胁迫下该值的增加通常与PSⅡ反应中心受到不可逆的破坏或可逆的失活有关。Fm和Fv分别指最大荧光和可变荧光,用来表示光系统PSⅡ的电子传递情况和PSⅡ反应中心活性的高低[27-28]。QY为实际最大光量子产率,可以反映植物光合电子传递速率的快慢,指植物目前的实际最大光合效率。Fv/Fm主要指光系统PSⅡ的光化学效率,而且该值与植物光合速率密切相关,Fv/Fo主要指PSⅡ的潜在光化学活性,该值越高,表示具有活性的反应中心数量越多,能更有效地将光能转化为化学能。铝胁迫下Fo的增加及Fm、Fv、QY、Fv/Fm、Fv/Fo的下降表明铝胁迫处理导致PSⅡ反应中心受损,降低了电子传递速率,从而导致光合能力下降[29]。本试验发现,与CK相比,铝胁迫下的Fo、Fm、Fv、QY、Fv/Fm和Fv/Fo总体上呈现先升高后降低又升高的趋势,这可能与试验条件及时间周期造成的差异有关。总的来说,生长调节剂能够在一定程度上提高杉木叶片的Fv、Fm、Fv/Fm、Fv/Fo、qP、QY,降低Fo。
叶绿素荧光耗散途径分为非光化学淬灭、光化学淬灭2种形式。qP主要指光化学淬灭,是光合作用引起的荧光淬灭,可以反映植物光合活性的高低,与光系统PSⅡ电子传递活性密切相关。NPQ主要指非光化学淬灭,反映了植物将多余的光能以热能形式耗散的能力,是逆境胁迫下植物防止过剩光能对光合机构造成破坏的一种重要保护机制。铝胁迫下光化学淬灭值降低和非光化学淬灭系数增加,表明铝胁迫下光系统PSⅡ电子传递活性受到显著抑制,导致更多光能通过非光化学淬灭的形式耗散,从而使植物叶片对光能的利用效率显著降低[30-31]。本试验中的结论与之基本一致,即生长调节剂可以有效降低NPQ,提高qP。
总的来说,铝胁迫影响了杉木幼苗的叶绿素荧光参数的变化情况,生长调节剂在一定程度上提高了杉木叶片的Fv、Fm、Fv/Fm、Fv/Fo、qP、QY,降低了Fo、NPQ。本研究关于生长调节剂对杉木铝胁迫下叶绿素荧光方面的探索是一次初步尝试,在试验设计和方法中可能还有一些不足之处,在之后的研究中将进一步完善。
参考文献:
[1]俞新妥.中国杉木研究进展(2000—2005)Ⅰ.杉木生理生态研究综述[J].福建林学院学报,2006,26(2):177-185.
[2]吴承祯,洪伟.杉木数量经营学引论[M].北京:中国林业出版社,2000:1-10.
[3]周丽丽.不同发育阶段杉木人工林养分内循环与周转利用效率的研究[D].福州:福建农林大学,2014.
[4]国家林业局森林资源管理司.第七次全国森林资源清查及森林资源状况[J].林业资源管理,2010(1):1-8.
[5]张守仁.叶绿素荧光动力学参数的意义及讨论[J].植物学通报,1999,16(4):444-448.
[6]KullO,KruijtB.Leafphotosyntheticlightresponse:amechanisticmodelforscalingphotosynthesistoleavesandcanopies[J].FunctionalEcology,1998,12(5):767-777.
[7]SchreiberU,BilgerW,NeubauerC.Chlorophyllfluorescenceasanonintrusiveindicatorforrapidassessmentofinvivophotosynthesis[J].EcophysiologyofPhotosynthesis,1995,100:49-70.
[8]GentyB,BriantaisJM,BakerNR.Therelationshipbetweenthequantumyieldofphotosyntheticelectrontransportandquenchingof[JP3]chlorophyllfluorescence[J].BiochimicaetBiophysicaActa-GeneralSubjects,1989,990(1):87-92.
[9]MurchieEH,LawsonT.Chlorophyllfluorescenceanalysis:aguidetogoodpracticeandunderstandingsomenewapplications[J].JournalofExperimentalBotany,2013,64(13):3983-3998.
[10]賀立红,贺立静,梁红.银杏不同品种叶绿素荧光参数的比较[J].华南农业大学学报,2006,27(4):43-46.
[11]刘宝,陈存及,林达定,等.21个闽楠种源叶片光合色素含量及叶绿素荧光参数分析[J].江西农业大学学报,2014,36(1):115-121.
[12]RinellaMJ,HaferkampMR,MastersRA,etal.Growthregulatorherbicidespreventinvasiveannualgrassseedproduction[J].RangelandEcology&Management,2010,3(1):12-16.
[13]周雅卓.低温胁迫下不同生长调节剂对玉米主要生理特性及产量的影响[D].延吉:延边大学,2018.
[14]王金强,李欢,刘庆,等.干旱胁迫下喷施外源植物激素对甘薯生理特性和产量的影响[J].应用生态学报,2020,31(1):189-198.
[15]AkayaM,TakenakaC.Effectsofaluminumstressonphotosynthesis[JP3]ofQuercusglaucaThumb[J].Plant&Soil,2001,237(1):137-146.
[16]MaxwellK,JohnsonGN.Chlorophyllfluorescence-apracticalguide[J].JournalofExperimentalBotany,2000,51(345):659-668.
[17]冉瑞兰,赛闹汪青,孙坤,等.阿魏酸和凹土对党参种子萌发、生长及幼苗叶绿素荧光参数的影响[J].西北植物学报,2019,39(12):2244-2252.
[18]钟秋生,林郑和,郝志龍,等.氟铝互作对茶树叶片叶绿素荧光特性的影响[J].茶叶科学,2019,39(5):537-546.
[19]张家君,吕蒙蒙,武忆寒,等.剪根和植物生长调节剂对杉木幼苗生长的影响[J].亚热带农业研究,2019,15(3):157-162.
[20]闫雯,张兴兴,安渊.二种生长调节剂对紫花苜蓿铝胁迫和恢复生长的影响[J].上海交通大学学报(农业科学版),2011,29(2):75-82.
[21]XiaQ,TanJL,ChengSY,etal.SensingplantphysiologyandenvironmentalstressbyautomaticallytrackingFjandFifeaturesinPSⅡchlorophyllfluorescenceinduction[J].PhotochemistryandPhotobiology,2019,95(6):1495-1503.
[22]熊日荣.不同杉木无性系在若干逆境下叶绿素荧光参数的比较分析[D].福州:福建农林大学,2011.
[23]理挪,王培,马志慧,等.酸铝复合胁迫对杉木苗叶绿素荧光的影响[J].福建农林大学学报(自然科学版),2018,47(6):686-690.
[24]陈建明,俞晓平,程家安.叶绿素荧光动力学及其在植物抗逆生理研究中的应用[J].浙江农业学报,2006,18(1):51-55.[HJ2mm]
[25]BakerNeilR.Chlorophyllfluorescence:aprobeofphotosynthesisinvivo[J].AnnualReviewofPlantBiology,2008,59(1):89-113.
[26]徐建伟,张小均,李志博,等.幼苗期大田棉花耐旱性的叶绿素荧光和光合特性辅助鉴定[J].江苏农业学报,2019,35(1):1-8.
[27]iekN,PekcanV,Arslan,etal.Assessingdroughttoleranceinfield-grownsunflowerhybridsbychlorophyllfluorescencekinetics[J].BrazilianJournalofBotany,2019,42(2):249-260.
[28]郑阳霞,贾松涛,赵英鹏,等.铝胁迫对西瓜幼苗光合及叶绿素荧光特性的影响[J].华北农学报,2015,30(4):150-156.
[29]ZhengZY,LinHR,CuiHM,etal.Effectofexogenoushydrogensulfideonphotosynthesisparametersandchlorophyllfluorescencecharacteristicsofprocessingtomato(LycopersiconesculentumMillssp.subspontaneumBrezh)seedlingsunderNaClstress[J].JournalofAgriculturalSciences,2017,31(7):1426-1435.
[30]叶义全,洪凯,张家君,等.铝胁迫对杉木幼苗生长、叶片光合特性和叶绿体超微结构的影响[J].东北林业大学学报,2020,48(2):7-11,16.
[31]杜尧东,李键陵,王华,等.高温胁迫对水稻剑叶光合和叶绿素荧光特征的影响[J].生态学杂志,2012,31(10):2541-2548.
- 无托槽隐形矫正技术在成人口腔正畸中的应用效果
- 早期肠内营养对肝胆疾病术后患者胃肠功能恢复的影响
- 辛伐他汀联合低分子肝素治疗肾病综合征的疗效观察
- 单次不同血液净化方式对慢性肾脏病患者骨及矿物质代谢的影响
- 血清同型半胱氨酸水平与老年冠心病相关性分析
- 可吸收螺钉与金属螺钉内固定修复踝关节骨折疗效比较
- 多层螺旋CT三维重建后处理在骨肿瘤影像诊断中的应用研究
- 乙型肝炎患者248例肝功能和凝血四项指标改变的相关分析要点构架
- 疏肝健消汤治疗脾虚肝郁证功能性消化不良的效果
- 运动康复改善老年慢性心衰患者心功能和生活质量的研究
- 经阴道三维超声宫腔造影对子宫内膜息肉的诊断价值研究
- Pembrolizumab联合标准化疗方案加贝伐珠单抗治疗晚期非鳞非小细胞肺癌的疗效
- 感染性疾病患者中应用微生物形态学检验的价值分析
- 一次性根管治疗牙隐裂伴牙髓炎的疗效观察
- 脑卒中颈部动脉狭窄介入术后血管再狭窄程度与术前血清炎症指标的关系
- 冠心病患者颈动脉粥样硬化超声相关参数与病变严重程度的关系
- 双重引导下肌间沟臂丛神经阻滞麻醉在上臂骨折手术中的应用
- 观察精液放置时间对精子冷冻复苏率的影响
- 我国地方医疗体制改革方案的调查研究
- 床边早期锻炼对ICU患者康复的影响
- 68例急性冠脉综合征院前急救经验
- 多索茶碱联合噻托溴铵治疗慢阻肺的效果观察
- 厄贝沙坦+美托洛尔在高血压治疗中的效果观察及有效率影响分析
- 阿司匹林在心脑血管疾病预治中的地位和作用分析
- 知信行模式对尘肺病患者健康教育干预应用研究
- stake sth on
- stake sth out
- stake sth ↔ out
- stake your claim
- stake²
- stake¹
- staking
- stalactital
- stalactite
- stalactited
- stalactites
- stalactitically
- stalagmite
- stalagmites
- stalagmitically
- stale
- staled
- stalely
- stalemate
- stalemated
- stalemates
- stalemating
- staleness
- stalenesses
- staler
- 好良心就是软枕头
- 好色
- 好色不淫
- 好色之徒
- 好色之心,人皆有之
- 好色或轻浮放荡的人
- 好色的人
- 好色的光棍
- 好花
- 好花不向街头卖
- 好花不好折
- 好花不常开,好景不常在
- 好花也得勤浇水
- 好花也得要水浇
- 好花从泥土里出来
- 好花偏逢三更雨,明月忽来万里云
- 好花常戴美人头
- 好花开不败,好事说不坏
- 好花开在一树
- 好花开在篱笆外
- 好花插在牛屎上
- 好花插在牛粪上
- 好花插在牛粪上——可惜
- 好花易落
- 好花易落,红颜易衰