付龙威 汤晓娟 林授锴 王春花 张艳珍 刘云国


摘要:福建莆田地区是我国枇杷的主产地之一。为探讨复合肥对莆田地区枇杷根际土壤微生物的影响,利用高通量测序技术(IlluminaHiseq)研究4个采样点的根际土壤细菌多样性与土壤理化性质的相关性。结果显示,在12份枇杷根际土壤样品中共得到35371个细菌操作分类单元(OTU),属于31个门,617个属;共有12个优势门(丰度>1%),其中丰度>6%的是变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria),25个优势属(丰度>1%)。在不同处理的根际土壤中各优势菌门、属所占比例存在明显差异。土壤细菌群落结构和主要理化性质存在显著相关性,其中pH值和全氮、有效磷、总磷含量是影响土壤细菌丰度的主要因素。
关键词:枇杷;复合肥;高通量测序;根际土壤细菌多样性;土壤理化性质
中图分类号:S147.2;S182文献标志码:A
文章编号:1002-1302(2020)22-0261-07
作者简介:付龙威(1993—),男,河南周口人,硕士,主要从事应用微生物研究。E-mail:445322966@qq.com。
通信作者:刘云国,博士,教授,主要从事食品微生物学研究。E-mail:yguoliu@163.com。
枇杷[Eriobotryajaponica(Thunb.)Lindl]是一种原产于我国的常绿蔷薇科果树,广泛分布于亚热带地区。福建省莆田市是我国枇杷的主产区之一,该地区枇杷产量占全国枇杷总产量的1/3,枇杷栽培历史悠久,其果肉柔软多汁,营养丰富,酸度适中,风味极佳。由于连年大面积单一种植枇杷,土壤连作障碍问题日益突出;长期施用化肥导致了土壤板结、有效磷含量低[1]、微生物群落改变等一系列问题。土壤微生物是影响土壤生态过程的一个重要因素,与土壤养分循环[2]、有机质分解以及碳、氮等元素的转化紧密关联[3-4],在维持土壤的质量和生态系统的稳定性方面发挥着重要作用。因而,研究莆田地区枇杷根际微生物的多样性十分重要。
近年来,国内外在盐爪爪[5-6]、翅碱蓬[7]、香蕉[8]、森林[9-10]等的根際微生物多样性方面取得了一定研究进展。然而,莆田地区作为我国重要的枇杷产区之一,针对其枇杷根际微生物的研究鲜有报道。为研究施用复合肥对微生物群落造成的影响,本研究以福建省莆田地区的枇杷根际土壤为试验对象,利用高通量测序技术(llluminaHiseq)对根际土壤微生物的菌群结构进行比较分析,以期为进一步了解莆田地区枇杷根际土壤微生物多样性,探究微生物与土壤性质间的关系,以及解决莆田地区过度使用复合肥的问题,开发枇杷专用生物菌肥奠定基础。研究结果将服务于“三农”,推进精准农业在枇杷种植方面的实施。
1材料与方法
1.1试验设计
根据长期种植枇杷的果农的经验,枇杷树不能施用过多复合肥,否则会造成根部腐烂。本研究设制A、B、C、D4个采样点,每年A采样点每棵树共施500g复合肥和20kg有机肥,B采样点每棵树共施400g复合肥和20kg有机肥,C采样点每棵树共施300g复合肥和20kg有机肥,D采样点每棵树共施200g复合肥和20kg有机肥,每年每个采样点分4次施肥,连续施肥3年,第4年采样1次。
1.2土样采集
于2019年4月在莆田地区枇杷集中区根据不同的化肥施用量选取A、B、C、D4个采样点。分别从4个取样点选取间隔约10m的3棵编号依次为1、2、3,树龄5年以上的枇杷(共12棵)的根部土壤进行5点取样,每次取样的土层厚度为0~30cm。每份土样分为2个部分,一部分用于测定土壤理化性状,另一部分提取DNA用于测序。
1.3土壤理化性质检测
土壤pH值用pH计(土壤∶水=1g∶5mL)测定;有效钾(AK)含量用乙酸铵提取,原子吸收分光光度法测定;有效磷(AP)含量、总磷(TOP)含量用碳酸氢钠提取,钼蓝法测定;总钾(TOK)含量用氢氟酸提取,原子吸收分光光度法测定;总氮(TON)含量用凯氏定氮法测定。
1.4土壤微生物的16SrRNA基因测序
1.4.1土样DNA提取
称取200mg土壤样品,利用OMEGA土壤总DNA抽提试剂盒(E.Z.N.ATMMag-BindSoilDNAKit)提取土壤总DNA。
1.4.216SrRNA文库构建
利用Qubit3.0DNA检测试剂盒对提取的基因组DNA进行精确定量,以确定聚合酶链式反应(PCR)加入的DNA量。PCR引物为515F:CCCTACACGACGCTCTTCCGATCTNGTGCCAGCMGCCGCGGTAA;806R:GACTGGAGTTCCTTGGCACCCGAGAATTCCAGGACTACHVGGGTWTCTAAT,利用该引物对16SrRNA基因的V4区进行扩增。PCR结束后,通过琼脂糖凝胶电泳检测PCR产物。
利用Qubit3.0DNA检测试剂盒对回收的DNA进行精确定量,以便按照1∶1等量混合后测序。等量混合时,每个样品DNA量取10ng,最后使用IlluminaHiseqTM进行测序。
1.5生物信息学分析
对高通量测序得到原始数据进行拼接、过滤得到有效数据,然后基于有效数据进行操作分类单元(OTU)聚类和物种分类分析。采用QIIME(v.2.0-10)软件进行α-多样性分析,分析指标包括Chao1指数、Shannon指数、ACE指数。
1.6数据分析
利用Excel2010完成数据标准化处理及作图,SPSS22.0软件完成数据统计分析。
2结果与分析
2.1土壤理化性质分析
如表1所示,4个采样点的根际土壤都呈弱酸性。A、B采样地的土壤TON、AP、AK、TOP含量显著高于C、D采样地,D采样地的TOK显著低于A、B、C采样地。
2.2样本的有效序列数据量
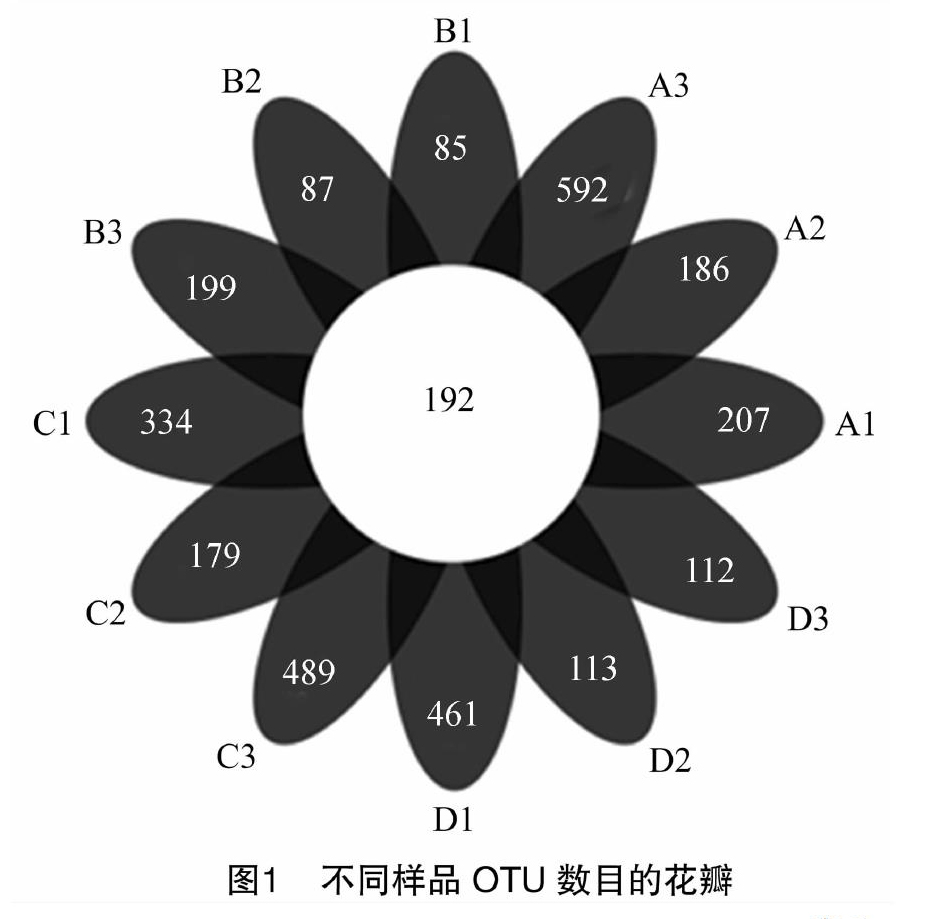
使用Mothur软件删除了短小和质量低的序列后,在12个样品中获得614697条高质量序列,分配到35371个OTU(序列同一性为97%),利用R软件处理得到OTU数目花瓣图,从图1可以看出,样本间共有的有代表性的OTU有192个,不同样本的代表OTU数量不一,其中,A3样品的OTU数目最多,为592个;B1样品的OTU数目最少,为85个。
2.3土壤细菌群落丰富度和多样性分析
通过对16SrRNA基因的V4区进行测序,得到各采样点土壤样品的细菌群落多样性数据。如表2所示,4个采样点的OTU数目、ACE指数、Chao1指数均无显著性差异,A采样点的Shannon指数显著低于B、C、D采样点。
2.4多样性指数与土壤理化因子相关性
如表3所示,Shannon指数与土壤pH值呈极显著正相关,与TON、AP、TOP含量呈极显著负相关;ACE指数与TOK含量呈显著负相关;Chao1指数与pH值以及TON、AP、AK、TOP、TOK含量的相关性均不显著。
2.5土壤微生物物种分类及样本间差异
4个采样点的土壤微生物共属31个门,其中优势门(除去未分类和其他,丰度均>1%)共有12个,如表4所示,A采样点优势菌门为变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、厚壁菌门(Firmicutes)、放线菌门(Actinobacteria)、浮霉菌门(Planctomycetes)、疣微菌门(Verrucomicrobia)、拟杆菌门(Bacteroidetes)、绿弯菌门(Chloroflexi),占比86.46%。B采样点优势菌门比A采样点多了芽单胞菌门(Gemmatimonadetes)、奇古菌门(Thaumarchaeota),占比之和为86.90%;C采样点优势菌门比A采样点多了芽单胞菌门、奇古菌门、Latescibacteria,占比87.16%,D采樣点优势菌门比A点多了芽单胞菌门、奇古菌门、Latescibacteria、candidatedivisionWPS-1,占比88.39%。4个采样点优势菌门平均丰度以变形菌门(36.45%)和酸杆菌门(23.46%)较高。A采样点变形菌门的丰度显著高于C、D采样地,A采样点的酸杆菌门、疣微菌门、拟杆菌、芽单胞菌门、candidatedivisionWPS-1、Latescibacteria丰度低于B、C、D采样点。
4个采样点共有617个属的土壤微生物,其中根际土壤微生物群落优势菌属共有25个(单个优势菌属的丰度均>1%),4个采样点共同含有的优势菌属有5个。如表5、表6、表7、表8所示,A采样点的优势菌属有Gp6、Gp2、Gp1、Gp3、Subdivision3generaincertaesedis、Gp4、伯克霍尔德氏菌属(Burkholderia)、罗思河小杆菌属(Rhodanobacter)、Massilia、鸟氨酸芽孢杆菌属(Ornithinibacillus)、芽孢八叠球菌属(Sporosarcina)、副球菌属(Rhizomicrobium)、节杆菌属(Arthrobacter)和假单胞菌属(Pseudomonas),占细菌总类群的28.31%。B采样点的优势菌属有芽孢杆菌属(Gemmatimonas)、Gp6、Gp2、Spartobacteriageneraincertaesedis、Gp1、Subdivision3generaincertaesedis、Gp4、伯克霍尔德氏菌(Burkholderia)、鞘氨醇单胞菌属(Sphingomonas)、假单胞菌属(Pseudolabrys)和亚硝化球菌属(Nitrososphaera),占细菌总类群的31.01%。C采样点的优势菌属有芽孢杆菌属(Gemmatimonas)、Gp6、Gaiella、Gp2、Spartobacteriageneraincertaesedis、[JP3]Gp1、Subdivision3generaincertaesedis、Gp4、硝化螺菌属(Nitrospira)、鞘氨醇单胞菌属(Sphingomonas)、出芽菌属(Gemmata)和Latescibacteriageneraincertaesedis,占细菌总类群的35.32%。D采样点的优势菌属有芽孢杆菌属(Gemmatimonas)、Gp6、Gaiella、Gp2、[JP3]Spartobacteriageneraincertaesedis、Gp1、Subdivision3generaincertaesedis、Gp4、WPS-1generaincertaesedis、鞘氨醇单胞菌属(Sphingomonas)、亚硝化球菌属(Nitrososphaera)、Gp7和Latescibacteriageneraincertaesedis,占细菌总类群的38.16%。优势菌属的丰度与复合肥的用量呈负相关,说明复合肥的过度使用会降低微生物多样性。
2.6细菌门丰度与土壤理化性质的相关性分析
4个采样点共同含有的8种优势细菌门(丰度>1%)丰度和根际土壤的理化性质相关性如表9所示,变形菌门丰度与pH值呈极显著显著负相关,与氮、磷、钾含量呈正相关,其中与TON、AP、AK、TOP含量呈显著正相关。酸杆菌门是所有土壤样品中丰度位居第2的菌门,与pH值呈极显著正相关,与TON、AP、TOP含量呈极显著或显著负相关。厚壁菌门丰度与总氮含量呈显著正相关。浮霉菌门丰度与TON含量呈显著负相关。疣微菌门与pH值呈显著正相关,与TON、AP、TOP含量呈极显著负相关,与AK、TOK含量呈显著负相关。拟杆菌门丰度与pH值呈显著正相关,与TOP含量呈显著负相关。
3讨论
不同的施肥处理主要影响了土壤pH值以及全氮、有效磷、总磷含量等指标,4个试验点通过连续4年的不同施肥处理,不同无机肥施用量下土壤pH值有显著差异,其中无机肥施用量最多的处理pH值最低,这是因为长期大量施用复合肥能降低土壤pH值[11-12]。有机肥处理对土壤的氮、磷、钾含量的影响不大[13-14],所以无机肥的施用量是造成土壤pH值以及氮、磷、钾含量不同的主要因素。
大量无机肥料特别是氮肥的投入,通常会导致旱地土壤细菌多样性减少[15]。本研究结果显示,A采样点的Shannon指数最低,且与其他地区差异显著,这与Geisseler等的研究结果[16-17]相符。土壤pH值常被认为是长期施用无机肥土壤中影响细菌生物多样性的主要因素[11,16]。总体来看,细菌生物丰度与TON、AP、AK、TOP、TOK含量呈显著负相关,说明长期施用无机肥后,氮、磷、钾对根基微生物有一定的抑制作用。Delgado-Baquerizo等的研究结果表明,土壤理化指标对细菌生物多样性有一定的驱动作用[18]。土壤氮、磷是决定细菌群落结构的重要因素,本研究中总氮含量与Shannon指数呈显极著负相关,表明氮肥的过度使用降低了土壤微生物多样性[19-20];在我国亚热带地区,由于风化和土壤流失,酸性水稻土壤中的磷含量很低[15,21],枇杷生长过程中不需要很多水分,因此土壤中磷的流失较少,含量相对丰富。已有研究报道,施加高磷肥料直接改变了植物土壤微生物群落结构[21-22]。综合来看,本研究中Shannon指数与pH值呈极显著正相关,与TON、AP、TOP含量均呈极显著负相关,与AK、TOK含量呈负相关,说明长期施用复合肥会降低土壤微生物多样性。
本研究通过对不同施肥处理下土壤微生物门丰度进行聚类分析发现,施用复合肥量最多的A采样点的优势门个数最少,且优势菌门较为集中,变形菌门丰度为48.51%,明显高于其他处理。变形杆菌门细菌具有固氮功能,变形杆菌门丰度增加有利于土壤氮素的有效转化[23],氮循环过程对土壤pH值存在影响[24]。枇杷根际土壤细菌群落中变形菌门和酸杆菌门占主导地位,与该土壤呈酸性有关。河北省中南部地区耕地[25]、苹果园土壤[26]、酸性土壤[27]的根际微生物优势菌门一致。变形菌门被认为是世界上微生物最丰富的菌门,是多数土壤中的优势门类,与碳循环有关[28]。酸杆菌门多存在于营养贫瘠的土壤环境中[29],Barns等研究表明,酸杆菌门是土壤细菌群落第2优势门,仅次于变形菌门[30],与本研究结果与之一致。
采样地土壤微生物在属水平上的差异很大,莆田地区4个采样点共同的菌属有Gp6、Gp2、Gp1、Subdivision3generaincertaesedis、Gp4。随着复合肥用量的增加,优势菌属丰度在减少,但是由于A采样点长期施肥量较多,导致Massilia、鸟氨酸芽孢杆菌属、芽孢八叠球菌属、副球菌属、节杆菌属、假单胞菌属细菌出现适应现象,成为A采样点的优势菌属。芽孢杆菌属广泛存在于土壤、水、植物及动物活动环境中,营养要求低,代谢能力强,可以耐受不良环境条件,部分芽孢杆菌对病原菌有一定的拮抗作用[31]。芽孢杆菌属对洋葱遭受铜胁迫具有缓解作用[32],该属除了具有良好的解磷能力,还具有良好的固氮作用和生防作用[33]。后续可有目的性地筛选优势菌,制成生物菌肥解决莆田地区过度施复合肥的问题。
相关性分析发现,土壤pH值对变形菌门和酸杆菌门细菌丰度影响明显,总氮、速效磷、总磷含量对变形菌门丰度有显著影响。在迄今已知的与土壤中酸性细菌丰度相关的环境因素中,pH值为影响最为突出的因素[34-35],本研究相关性分析结果与之一致。pH值和氮、磷、钾含量会影响细菌的分布,罗旦等对沙漠环境植物根际微生物的研究结果表明,变形菌门的丰度与有效氮、AP含量显着正相关[36]。土壤全氮、全磷含量是影响土壤变形菌的关键因子[37],本研究结果与之一致。厚壁菌门分布与TON含量呈显著正相关,与pH值以及磷、钾含量的相关性不显著,与Navarrete等对大豆根际土壤的研究结果[38]类似。相关性分析发现,土壤pH值对变形菌门、酸杆菌门、拟杆菌门和疣微菌门影响显著。
本研究充分了解了短期内使用大量复合肥引起pH值下降对枇杷根际土壤微生物多样性、结构以及功能造成的影响,为以后研发生物菌肥以及解决土壤板结、酸化问题提供理论依据。
参考文献:
[1]傅丽君,杨文金,林文郴,等.莆田市常太枇杷园土壤肥力與果树营养状况测定[J].莆田学院学报,2005,12(5):41-43.
[2]NannipieriP,Ascher-JenullJ,CeccheriniMT,etal.Microbialdiversityandsoilfunctions[J].EuropeanJournalofSoilScience,2003,54(4):655-670.
[3]TeboBM,JohnsonHA,McCarthyJK,etal.Geomicrobiologyofmanganese(Ⅱ)oxidation[J].TrendsMicrobiol,2005,13(9):421-428.
[4]李小霞,靳鲲鹏,曹晋军,等.轮作制度对土壤生态的影响研究进展[J].现代农业科技,2019(6):154-155,159.
[5]陈禹竹,唐琦勇,顾美英,等.盐爪爪根部微生物分布特征及盐浓度对碳源代谢分析的影响[J].微生物学通报,2019,46(11):2900-2908.
[6]木尼热木·阿力木江,楚敏,唐琦勇,等.辐射污染区盐爪爪根际可培养细菌群落组成及功能特性[J].微生物学通报,2018,45(7):1416-1425.
[7]李志杰,郭长城,石杰,等.高通量测序解析多环芳烃污染盐碱土壤翅碱蓬根际微生物群落多样性[J].微生物学通报,2017,44(7):1602-1612.
[8]游曉朝.香蕉枯萎病拮抗菌株筛选及生防菌肥研发[D].泉州:华侨大学,2018.
[9]NaveedM,MubeenS,KhanSU,etal.Identificationandcharacterizationofrhizosphericmicrobialdiversityby16SribosomalRNAgenesequencing[J].BrazilianJournalofMicrobiology,2014,45(3):985-993.
[10]MengMJ,LinJ,GuoXP,etal.Impactsofforestconversiononsoilbacterialcommunitycompositionanddiversityinsubtropicalforests[J].Catena,2019,175:167-173.
[11]DaiZM,SuWQ,ChenHH,etal.Long-termnitrogenfertilizationdecreasesbacterialdiversityandfavorsthegrowthofActinobacteriaandProteobacteriainagro-ecosystemsacrosstheglobe[J].GlobalChangeBiology,2018,24(8),3452-3461.
[12]ZhouJ,GuanDW,ZhouBK,etal.Influenceof34-yearsoffertilizationonbacterialcommunitiesinanintensivelycultivatedblacksoilinnortheastChina[J].SoilBiologyandBiochemistry,2015,90:42-51.
[13]LiuEK,YanCG,MeiXR,etal.Long-termeffectofchemicalfertilizer,straw,andmanureonsoilchemicalandbiologicalpropertiesinnorthwestChina[J].Geoderma,2010,158(3/4):173-180.
[14]李想,刘艳霞,陈风雷,等.长期不同施肥处理对贵州植烟土壤酶活及微生物群落的影响[J].中国烟草学报,2019,25(6):50-59.
[15]ZhengSX,CaoHC,HuangQY,etal.Long-termfertilizationofPcoupledwithNgreatlyimprovedmicrobialactivitiesinapaddysoilecosystemderivedfrominfertileland[J].EuropeanJournalofSoilBiology,2016,72:14-20.
[16]GeisselerD,ScowKM.Long-termeffectsofmineralfertilizersonsoilmicroorganisms-Areview[J].SoilBiologyandBiochemistry,2014,75:54-63.
[17]LiuYX,ShiJX,FengYG,etal.Tobaccobacterialwiltcanbebiologicallycontrolledbytheapplicationofantagonisticstrainsincombinationwithorganicfertilizer[J].BiologyandFertilityofSoils,2013,49(4):447-464.
[18]Delgado-BaquerizoM,ReichPB,KhachaneAN,etal.Itiselemental:soilnutrientstoichiometrydrivesbacterialdiversity[J].EnvironmentalMicrobiology,2017,19(3),1176-1188.
[19]刘倩倩.长期秸秆还田配施氮肥对砂姜黑土肥力及细菌多样性的影响[D].阜阳:阜阳师范学院,2019.
[20]聂江文,王幼娟,吴邦魁,等.双季稻田冬闲期土壤细菌数量及结构对施氮的响应[J].植物营养与肥料学报,2019,25(6):889-896.
[21]SuJQ,DingLJ,XueK,etal.Long-termbalancedfertilizationincreasesthesoilmicrobialfunctionaldiversityinaphosphorus-limitedpaddysoil[J].MolecularEcology,2015,24(1),136-150.
[22]WeiXM,HuYJ,PengPQ,etal.EffectofPstoichiometryontheabundanceofnitrogen-cyclegenesinphosphorus-limitedpaddysoil[J].BiologyandFertilityofSoils,2017,53(7),767-776.
[23]MoulinL,MuniveA,DreyfusB,etal.Nodulationoflegumesbymembersoftheβ-subclassofproteobacteria[J].Nature,2001,411(6840):948-950.
[24]RingE,HogbomL,JanssonG.Effectsofpreviousnitrogenfertilizationonsoil-solutionchemistryafterfinalfellingandsoilscarificationattwonitrogen-limitedforestsites[J].CanadianJournalofForestResearch,2013,43(4):396-404.
[25]张翔,宋水山,黄亚丽,等.基于高通量测序分析河北省中南部地区耕地土壤细菌多样性[J].华北农学报,2018,33(4):196-203.
[26]WangL,LiJ,YangF,etal.Applicationofbioorganicfertilizersignificantlyincreasedappleyieldsandshapedbacterialcommunitystructureinorchardsoil[J].MicrobialEcology,2017,73(2),404-416.
[27]任庆水.三峡库区消落带不同人工植被土壤微生物群落多样性[D].重庆:西南大学,2018.
[28]LiuJJ,SuiYY,YuZH,etal.HighthroughputsequencinganalysisofbiogeographicaldistributionofbacterialcommunitiesintheblacksoilsofNortheastChina[J].SoilBiologyandBiochemistry,2014,70:113-122.
[29]ZhangYG,CongJ,LuH.CommunitystructureandelevationaldiversitypatternsofsoilAcidobacteria[J].JournalofEnvironmentalScience,2014,26(8):1717-1727.
[30]BarnsSM,TakalaSL,KuskeCR.WidedistributionanddiversityofmembersofthebacterialkingdomAcidobacteriumintheenvironment[J].AppliedandEnvironmentalMicrobiology,1999,65(4):1731-1737.[HJ2.08mm]
[31]姚丽瑾,王琦,付学池,等.小麦纹枯病生防芽孢杆菌的筛选及鉴定[J].中国生物防治,2008,24(1):53-57.
[32]任彩婷,王鲁,庞亚琴,等.2种芽孢杆菌属细菌对洋葱根系遭受铜胁迫的缓解作用[J].天津师范大学学报(自然科学版),2018,38(6):36-41.
[33]張艳群.功能型生物肥料优良芽孢杆菌的筛选及其作用机理研究[D].杨凌:西北农林科技大学,2013.
[34]JonesRT,RobesonMS,LauberCL,etal.AcomprehensivesurveyofsoilAcidobacterialdiversityusingpyrosequencingandclonelibraryanalyses[J].ISMEJ,2009,3(4):442-453.
[35]GrifthsRI,ThomsonBC,JamesP,etal.ThebacterialbiogeographyofBritishsoils[J].EnvironmentalMicrobiology,2011,13(6):1642-1654.
[36]罗旦,陈吉祥,程琳,等.陕北沙化区3种主要植物根际土壤细菌多样性与土壤理化性质相关性分析[J].干旱区资源与环境,2019,33(3):151-157.
[37]刘洋,黄懿梅,曾全超.黄土高原不同植被类型下土壤细菌群落特征研究[J].环境科学,2016,37(10):3931-3938.
[38]NavarreteAA,KuramaeEE,deHollanderM.AcidobacterialcommunityresponsestoagriculturalmanagementofsoybeaninAmazonforestsoils[J].FEMSMicrobiolEcology,2013,83(3):607-621.
- 应准许重罪轻判的被告人撤回上诉
- 基层检察室开展刑事和解的探索
- 刑事判决被害人过错分析
- 论刑事回避程序的不足与完善
- 行政诉讼起诉期限疑难问题简析
- 审查起诉阶段非法证据排除的研究
- 非法集资的成因及防范
- 我国破产法中破产原因设计的反思与改进
- 同命同价问题分析
- 浅谈《票据法》第十条的意义与适用性
- 市场准入负面清单制度的法律问题与意义分析
- 环保税:让税制更绿化
- 法律不确定性与反避税规则
- 论船东保赔协会特别补偿条款
- 韩澳自贸协定规则及战略分析
- 地方政府规范性文件审查标准研究
- 分析建筑法律法规对提高建筑工程质量的作用
- 郑州市环境污染治理的有效措施分析
- 从府际契约模式看武汉城市圈的区域府际合作
- 行政救济介入物业管理领域研究
- 浅析当前看守所不安全因素问题及对策
- 浅谈新时期基层经侦队伍建设
- 论行政违法行为的检察监督
- 检察机关案件管理部门流程监控常见问题分析与解决机制研究
- 论未成年人国家监护体系的构建
- rat¹
- raucities
- raucous
- raucously
- raucousness
- raucousnesses
- raunchier
- raunchiest
- raunchily
- raunchiness
- raunchinesses
- raunchy
- ravage
- ravaged
- ravagement
- ravagements
- ravager
- ravagers
- ravages
- ravaging
- rave
- rave about
- raved
- raven
- ravened
- 推燥去湿
- 推燥居湿
- 推爱
- 推爱之所及
- 推爱及树
- 推爱屋乌
- 推牛子
- 推特控
- 推理
- 推理小说
- 推理小说的鼻祖
- 推理思维
- 推理情节法
- 推理片
- 推瓷(辞)
- 推用
- 推病
- 推盘
- 推目
- 推着碾子占着磨
- 推瞎子落河
- 推知
- 推研穷究
- 推磨的上台——转起来看
- 推磨绕圈子