王银杰 张永侠 刘清泉 刘凉琴 黄苏珍 原海燕
摘要:对德国鸢尾不同生育时期的早花品种93E41076-17和晚花品种Elizabeth花瓣中可溶性蛋白含量、丙二醛含量、脯氨酸含量、超氧化物歧化酶(SOD)活性及过氧化物酶(POD)活性等生理指标进行测定。结果表明,不同发育期93E41076-17与Elizabeth可溶性蛋白含量的变化趋势基本一致,呈持续下降趋势;MDA含量呈总体上升的趋势;脯氨酸含量在蕾期最高,初花期后趋于平缓,在衰败期有所上升;SOD活性呈总体下降趋势,但开始下降的起始花期有所不同,93E41076-17从初花期开始下降,而Elizabeth从蕾期开始下降;POD活性也隨着花期进程的延长其活性呈现不断上升的趋势。
关键词:德国鸢尾;生理指标;花瓣衰老;可溶性蛋白含量;丙二醛含量;脯氨酸含量;SOD活性;POD活性
中图分类号: S682.1+90.1 ?文献标志码: A ?文章编号:1002-1302(2020)24-0153-03
德国鸢尾(Iris germanica L.)是鸢尾属最具观赏价值的种类,花形奇特、花色丰富、一支多花以及常绿(长江以南地区)等特性使其在园林配植、地被绿化、盆栽观花等方面具有广阔的应用前景。但其单朵花花期仅3~5 d,单一品种群体花期一般不超过20 d[1]。因此,德国鸢尾花期的长短直接影响其经济价值和市场效益。随着人们对鲜切花的需求,目前国内对德国鸢尾花衰老的研究仅集中在切花保鲜上[2],但有关其自然开花过程中体内生理变化的研究至今尚未见报道。本研究以德国鸢尾早花品种93E41076-17和晚花品种Elizabeth为供试材料,对德国鸢尾自然开花进程中花瓣的可溶性蛋白含量、丙二醛含量、脯氨酸含量、超氧化物歧化酶(SOD)活性及过氧化物酶(POD)活性等生理生化指标进行测定,通过对德国鸢尾自然衰老过程中生理生化变化的研究,以期为延长德国鸢尾花期奠定理论基础。
1 材料与方法
1.1 试验材料
供试材料德国鸢尾品种93E41076-17和Elizabeth均采集自江苏省中国科学院植物研究所中国鸢尾属种质资源保存中心。93E41076-17为德国鸢尾早花品种,自然花期为4月中旬;Elizabeth为德国鸢尾晚花品种,自然花期为5月上旬。试验于2019年春季进行,每天8:00采集不同开花时期(蕾期、初花期、盛花期和衰败期)的花瓣,用去离子水洗净后迅速放入液氮中速冻,然后放入-80 ℃超低温冰箱中保存待用。
1.2 试验方法
可溶性蛋白含量的测定采用考马斯亮蓝G-250比色法[3];丙二醛(MDA)含量的测定采用硫代巴比妥酸法[4];脯氨酸含量的测定采用酸性茚三酮法[5];超氧化物歧化酶(SOD)和过氧化物酶(POD)活性检测采用北京索莱宝科技有限公司生产的SOD、POD试剂盒进行测定。所有生理指标测定均重复3次,用Excel 2010求平均值和标准差。
2 结果与分析
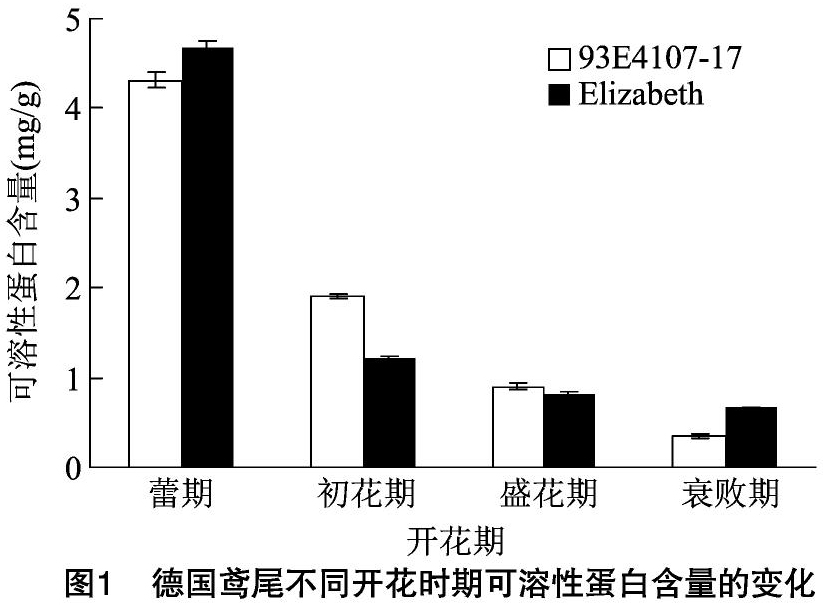
2.1 不同开花时期可溶性蛋白含量的变化
可溶性蛋白质是花开放过程中的主要物质基础,其含量一直是衡量植物衰老的重要指标[6]。蛋白质影响植物衰老可分为2个方面:一方面是降低蛋白质的周转,这是蛋白质合成机制老化的结果;另一方面是蛋白质含量随着蛋白的水解而降低。蛋白质水解产生大量乙烯的合成前体蛋氨酸,从而促进内源乙烯的合成,引起衰老[7]。由图1可见,德国鸢尾93E41076-17和Elizabeth不同时期可溶性蛋白含量的变化趋势基本一致,呈持续下降趋势。其中晚花品种Elizabeth蕾期至初花期可溶性蛋白含量较早花品种93E41076-17下降明显,两者初花期可溶性蛋白含量分别为蕾期的25.90%、44.36%,而初花期至盛花期、盛花期至衰败期可溶性蛋白含量下降相对平稳。
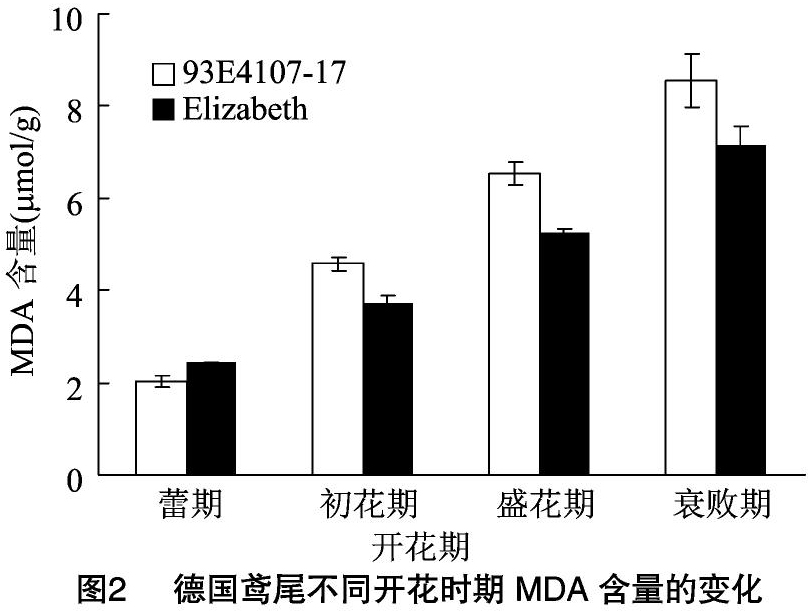
2.2 丙二醛含量的变化
丙二醛是具有细胞毒性的物质,是由膜脂中不饱和脂肪酸发生膜脂过氧化作用而产生的,它的积累会造成细胞内酶和膜系统的损害,从而引起衰老[8],因此丙二醛含量与花瓣的衰老密切相关。德国鸢尾不同开花时期MDA含量的变化如图2所示,Elizabeth和93E41076-17花瓣中MDA含量均呈总体上升的趋势,且随着花期进程的延长上升幅度基本一致,说明花瓣中MDA含量上升是其衰老的重要指标。早花品种93E41076-17花瓣中的MDA含量高于晚花品种Elizabeth。
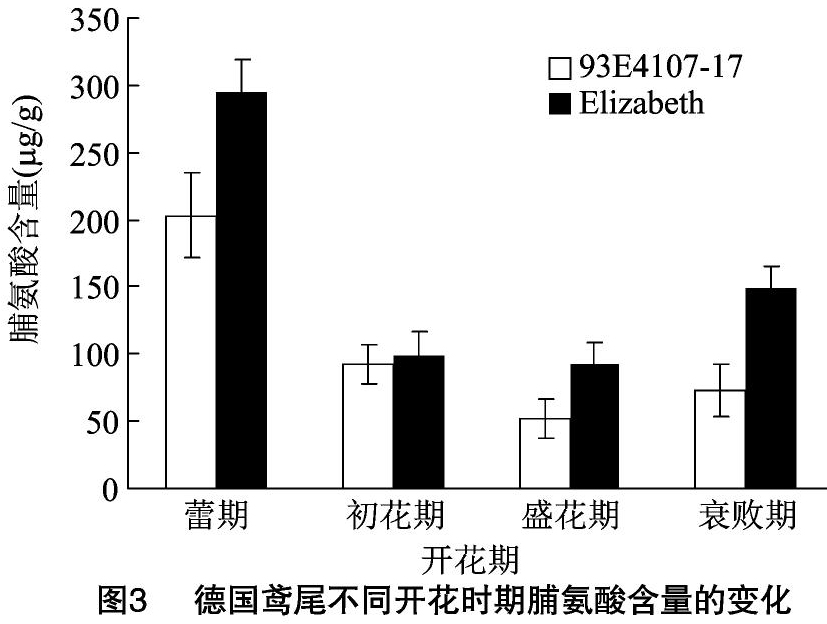
2.3 脯氨酸含量的变化
生物体内,脯氨酸不仅是细胞内的渗透调节物质,而且还是植物面对逆境时的重要调节物质,在一定程度上反映了植物的抗逆性[9]。德国鸢尾不同开花时期脯氨酸含量的变化如图3所示,4个测定时期晚花品种Elizabeth脯氨酸的含量均高于早花品种93E41076-17,且呈下降趋势,蕾期最高,初花期后趋于平缓,在衰败期脯氨酸含量有所上升。初花期93E41076-17和Elizabeth花瓣中脯氨酸的含量分别是蕾期的45.14%、33.35%。
2.4 超氧化物歧化酶活性的变化
SOD是生物体内酶清除活性氧系统的重要成分,它通过清除过高的活性氧来维持活性氧平衡,是抵御活性氧毒害的第一道防线[10]。德国鸢尾不同开花时期SOD活性变化如图4所示,2个品种花瓣中的SOD活性均呈总体下降趋势,但开始下降的起始花期有所不同。93E41076-17从初花期开始下降,而Elizabeth从蕾期开始下降。不同花期93E41076-17花瓣的SOD活性均高于Elizabeth。2个德国鸢尾品种花瓣的SOD活性随着花期进程的延长而下降,说明随着花期进程的延长,花瓣不断受到活性氧的毒害。不同品种花瓣中SOD活性开始下降的初始花期不同,表明清除氧自由基的能力存在差异。
2.5 过氧化物酶活性的变化
POD是植物体内另一重要的抗氧化酶,通常与SOD协调发挥作用[11-12]。本研究中2个德国鸢尾品种不同开花时期花瓣中的POD活性表现出一致的变化规律,都随着花期进程的延长其活性呈现不断上升的趋势,由蕾期到衰老期,其活性约增加了近1倍,且不同花期93E41076-17花瓣中的POD活性均高于Elizabeth(图5)。
3 讨论
长期以来,花瓣衰老一直是人们关注和研究的热点。有关花瓣衰老的机制,目前研究较多的是乙烯诱导作用及自由基伤害作用。但在花瓣衰老过程中,无论是乙烯敏感型还是非乙烯敏感型花卉,其衰老过程都与降解代谢有关的蛋白质和酶类等指标相关。
细胞中可溶性蛋白含量与衰老的关系密切,其含量下降是植物组织器官衰老过程中普遍存在的现象,是植物进入衰老的重要标志之一[13-14]。本研究表明,德国鸢尾花瓣的衰老与内含物质代谢紧密联系,细胞内可溶性蛋白含量与花瓣衰老呈明显的负相关关系,该结果表明随着衰老的加剧细胞内含物被大量消耗,这与百合和地被菊花发育和衰老的研究结果[15-16]基本一致。与此同时,随着花瓣衰老进程的延长,德国鸢尾花瓣中脯氨酸的含量在蕾期最高,初花期后趋于平缓,在衰败期脯氨酸含量有所升高。这可能与花在衰败期渗透调节有关。此外,脯氨酸还可能在花发育过程中提供某些营养物质促进或延长花期。这与前人的研究结果[17]基本一致。MDA是由自由基反应使膜脂过氧化的终产物之一,它的产生和积累主要会引起膜蛋白的变性[18],MDA含量越高膜脂过氧化作用越强,多种酶和膜系统受到的损伤越严重,衰老程度越强。本研究发现,德国鸢尾在花瓣衰老过程中MDA含量呈现由平稳缓慢上升至快速增加的趋势,表明随着衰老的加剧,MDA对膜造成不可恢复的损伤,从而宏观表现为花瓣的衰老[18],这与许多切花如玫瑰[19-20]等的研究结果基本一致。另外,早花品种的MDA含量高于晚花品种,说明前者细胞膜受损伤的程度要高于后者,这可能也是导致两者花期不同的原因之一。过氧化物酶(POD)和超氧化物歧化酶(SOD)能够参与生物体内酶清除活性氧系统,它通过清除过高的活性氧来维持平衡同时防止细胞受活性氧胁迫伤害,从而在植物抗衰老和抗胁迫中发挥作用[21]。前人的研究发现,香石竹花瓣的线粒体及过氧化物体中存在2种SOD同工酶,其在花瓣衰败期,线粒体2种SOD总活性均显著下降[22]。本研究中,随着花瓣的开放和衰老,SOD活性表现为先上升后下降,SOD活性的增加可及时清除代谢过程中形成的活性氧,有助于花的正常开放,随着花的盛开和衰老,SOD活性降低,从而削弱了保护系统,使花内活性氧代谢失调,引起花瓣的衰老。舒祯研究发现,在香雪兰花朵衰老过程中POD活性一直呈上升趋势[23]。本研究也证实了这一点,随着花朵发育进程的延长POD活性明显提高。
由此可见,德国鸢尾花瓣的衰老是一个十分复杂的过程。在不同品种中除了本身的遗传特性不同外,还由于维持花朵生命结构的蛋白质降解,SOD和POD活性水平的差异,从而造成膜系统稳定性不同,最终导致衰老进程不同。因此,通过一定措施增强酶活性,维持活性氧的代谢平衡可能是延长德国鸢尾花期的有效途径。对于致使德国鸢尾花瓣衰老加速的其他原因以及延长花期的具体有效途径,还有待进一步研究。
参考文献:
[1]常钟阳,张金政,孙国峰,等. 德国鸢尾‘常春黄花芽分化的形态观察及两种代谢产物的动态变化 [J]. 植物研究,2008,28(6):741-745.
[2]郭彩霞,董艳芳,周 媛,等. 外源NO对德国鸢尾切花生理指标的影响[J]. 西北农林科技大学学报,2014,42(11):56-60.
[3]李如亮.生物化学實验 [M]. 武汉:武汉大学出版社,1998:57-58.
[4]赵世杰,许长成,邹 琦.植物组织中丙二醛测定方法的改进[M]. 植物生理学通讯,1994,30(3):207-210.
[5]张志良,翟伟菁.植物生理学实验指导[M]. 北京:高等教育出版社,2003.
[6]乔永旭.蝴蝶兰花衰老过程中主要生理指标的变化[J]. 西南农业学报,2014,27(3):1045-1048.
[7]邵莉楣.花卉化学促控技术[M]. 北京:北京金盾出版社,1993.
[8]唐秀梅,陈 元,钟瑞春,等. 广西花生品种(系)苗期生长耐旱性及相关生理特性研究[J]. 广东农业科学,2014,41(14):9-13.
[9]Kishor P B K,Kumari P H,Sunita M S,et al. Role of proline in cell wall synthesis and plant development and its implications in plant?ontogeny[J]. Frontiers in Plant Science,2015,6:544.
[10]吴永波,叶 波.高温干旱复合胁迫对构树幼苗抗氧化酶活性和活性氧代谢的影响[J]. 生态学报,2016,36(2):403-410.
[11]王宏民,李亚芳,张仙红,等. 几种杀虫剂胁迫对黄瓜幼苗抗氧化酶活性和相关生理指标的影响[J]. 中国生态农业学报,2015,23(9):1185-1190.
[12]黄雪妮,屈 凡,马名立,等. 镉胁迫对2个宁夏主栽水稻品种幼苗期抗氧化同工酶亚基及其活性的影响[J]. 江苏农业科学,2016,44(7):107-112.
[13]朱 诚,曾广文.桂花花衰老过程中的某些生理生化变化[J]. 园艺学报,2000,27(5):356-360.
[14]Halevy A H,Mayak S.Senescence and postharvest physiology of cut flowes [J]. Horticulture Review,1981 (3):59-143.
[15]刘雅莉,王 飞,张恩让,等. 百合花不同发育期生理变化与衰老关系的研究[J]. 西北农业大学学报,2000,28(1):109-112.
[16]沈 漫,高遐虹,程继鸿,等. 地被菊开花过程中生理生化变化的初步研究[C]//中国园艺学会第七届青年学术讨论会论文集,2006:610-614.
[17]吴桂容,王上伟,苏德生,等. 3个牡丹品种花期进程中花瓣的生理生化特征[J]. 江苏农业科学,2018,46(1):85-87.
[18]季 成,王崇效,余权文.风眼莲超氧化酶活性与抗寒性的关系[J]. 植物生理学报,1989,15(2):133-136.
[19]Coorts G D. Internal metabolic changes in cut flower [J]. Horticulture Science.1975 (8):195-198.
[20]严景华,蔡永萍,李东林.保鲜剂对玫瑰切花衰老指标的影响简报[J]. 植物生理学通讯,1997,33(2):109-111.
[21]李雅洁,张其安,陆晓民. 不同外源物质对低温弱光次生盐渍化复合逆境下黄瓜幼苗生长、抗氧化系统及光合作用的影响[J]. 江苏农业学报,2018,34(2):404-410.
[22]张 云,郭维明,陈发棣,等. N-月桂酰乙醇胺对香石竹开放和衰老进程中花瓣微粒体膜组分和功能的调节[J]. 中国农业科学,2007,40(10):2303-2308.
[23]舒 祯.香雪兰花朵衰老的生理生化研究[D]. 上海:上海交通大学,2010.王 雪. AA3型连续流动分析仪测定植株全氮的方法研究与优化[J]. 江苏农业科学,2020,48(24):215-219.
- 高职院校开展现代学徒制试点实施方案
- 根据学生需求授之以“渔”
- 关于《工程监理》课程教学的思考
- 农村初中的生存困难与破局策略探究
- 学历留学生移动通信专业课教学模式探索
- 3—6岁留守儿童隔代教育的现状及原因分析
- 高校辅导员职业能力提升路径浅析
- 会计转型背景下《管理会计学》课程教学存在的问题分析
- 国外少儿阅读推广模式比较研究及对我国的启示
- 对新时期党校教育管理中加强心理疏导的思考
- “工匠精神”融入大学生思想政治教育的向度及培育研究
- 高职大学生就业焦虑、心理弹性与社会支持的关系
- 生活事件对青少年生活满意度的影响:希望感的中介作用
- 高职旅游英语课程教学方法探究
- 微分学中几个常见的基本概念与分析
- 大数据视野下档案管理思维方式的转变
- 中俄公共图书馆阅读推广对比分析
- 高职院校图书馆电子资源的建设与推广
- 关于图书馆资料员
- 大数据时代高校档案与校园文化建设探究
- 免费开放以后提高博物馆服务社会能力的方法分析
- 档案信息化、数字化、网络化及三者的关系
- 档案信息化建设与档案管理的几点思考
- 地质勘探单位档案资料工作规范化管理探讨
- 浅谈事业单位档案管理信息化建设的提升策略
- waylaying
- waylays
- way off
- way of life
- way of thinking
- way-out
- way out
- way-outness
- way outs
- ways
- ways and means
- wayside
- waysides
- way to go
- wayward
- waywardly
- waywardness
- waywardnesses
- way²
- way¹
- wb
- wc
- wc's
- wcs
- wdv
- 文字简短,意味深长
- 文字精练、严谨
- 文字紧凑简练
- 文字线条凹入的款识
- 文字老到
- 文字脱漏和错误
- 文字脱漏讹误
- 文字艺术方面的成品
- 文字著作
- 文字蒙求
- 文字表面上的意义
- 文字言语拙劣
- 文字言辞之外的情味
- 文字训诂
- 文字记载清清楚楚,可以查考
- 文字语
- 文字起源于图画
- 文字辈
- 文字辨证
- 文字造词
- 文字释要
- 文字错误
- 文字错误、脱落
- 文字雄健
- 文字集略