栗志
摘 要:本文设计并讨论了一种通过液体MS培养基剧烈振荡培养的方式,由大豆成熟胚诱导产生愈伤组织的思路,通过实验确定了其可行性,并通过实验和统计,寻找到一种比较适宜的优化培养条件:培养温度为25±1℃、光照1000~1500lx 12h/d、 蔗糖浓度30g/L、 pH 5.8~6.0、1mg/L 2,4-D和0.25mg/L 6-BA、 100r/min振荡培养。
关键词:大豆;成熟胚;愈伤组织;植物组织培养;液体培养基;剧烈振荡;实验设计
中图分类号:S-3 ? ? ? 文献标识码:A
DOI:10.19754/j.nyyjs.20201030021
引言
用植物组织制备愈伤组织是植物组织培养过程中非常重要也非常典型的步骤,也是后续研究步骤的基础 [1],传统的愈伤组织制备方法是将消毒后的植物组织接种在生长素、细胞分裂素等植物激素的固体或半固体培养基上,让植物组织细胞在生长分裂的同时逐步脱分化,生长出愈伤组织,随后这些愈伤组织可用于固体培养或液体悬浮培养等实验操作。
植物组织作为外植体,需要和在植物体内相似的环境来保证生存需要,在传统方法中之所以接种在含琼脂的固体、半固体培养基,而非接种在液体培养基上,原因是植物组织组织需要充足的氧气来满足持生理活动的需要,如果在静止的液体培养基中沉没,会因缺氧会导致生长抑制,甚至导致植物组织死亡,Heller(1953)曾采用纸桥法让植物组织在接触液态培养基的同时漂浮在液体培养基表面,以免沉没缺氧死亡[2]。
大豆(Glycine max)是重要的粮食作物和经济作物,大豆成熟胚是常用于诱导愈伤组织的材料,常用的大豆胚愈伤组织诱导方法使用的是固体培养基[3]。本文尝试通过液体培养基剧烈振荡培养的方法,让大豆成熟胚在无琼脂、无纸桥的情况下,保证氧气供应,于液相环境生长,并设置不同的条件组合,寻找较为适合液相直接培养法制备愈伤组织的参数,以期打开一条制备原生质体的新思路。
1 实验准备
1.1 试验材料
新鲜的大豆(Glycine max)种子(品系为南农46)。
1.2 试剂及设备
有效氯含量为5.5%~6.5%的次氯酸钠溶液、75%乙醇溶液、无菌水、MS培养基、蔗糖、植物生长素2,4-D、细胞分裂素6-BA、1mol·L-1NaOH溶液、精密pH试纸、锥形瓶、棉塞、培养皿、解剖剪、解剖刀、镊子、超净工作台、恒温摇床。
2 实验步骤
挑取新鲜、饱满、种皮完整、含水量高、未经过干燥处理的大豆种子,在75%乙醇溶液中浸泡1min,随后在5.5%~6.5%次氯酸钠溶液中浸泡5min,用无菌水冲洗4次,于无菌状态下用解剖剪和镊子剥去种皮,去除子叶,取出完整的成熟胚作为外植体,用无菌水冲洗后,接种于高温蒸汽灭菌冷却后的加入不同激素浓度的液态MS培养基上,以不同振荡转速在恒温摇床上培养。
选用MS作为培养基,用1mol·L-1 NaOH溶液调节pH。
4个固定参数为:培养温度25±1℃、光照1000~1500lx 12h·d-1、蔗糖浓度30g·L-1、pH 5.8~6.0[3-5]。
2个变动参数为:
振荡转速分为6档: 25r·min-1,50r·min-1,75r·min-1,100r·min-1,125r·min-1,150r·min-1。
植物激素浓度分为5档:无激素、0.5mg·L-1 2, 4-D + 0.125mg·L-1 6-BA、 1mg·L-1 2, 4-D + 0.25mg·L-1 6-BA、 2mg·L-1 2, 4-D + 0.5mg 6-BA、4mg·L-1 2, 4-D + 1mg 6-BA 。
每份液体培养基的体积为50mL,接种的大豆胚数量为3个,相同条件重复样本数量为3个,每24h观察1次胚形态的变化和愈伤组织的诱导状况,接种14d后称取、计算愈伤组织的平均重量。
3 实验结果
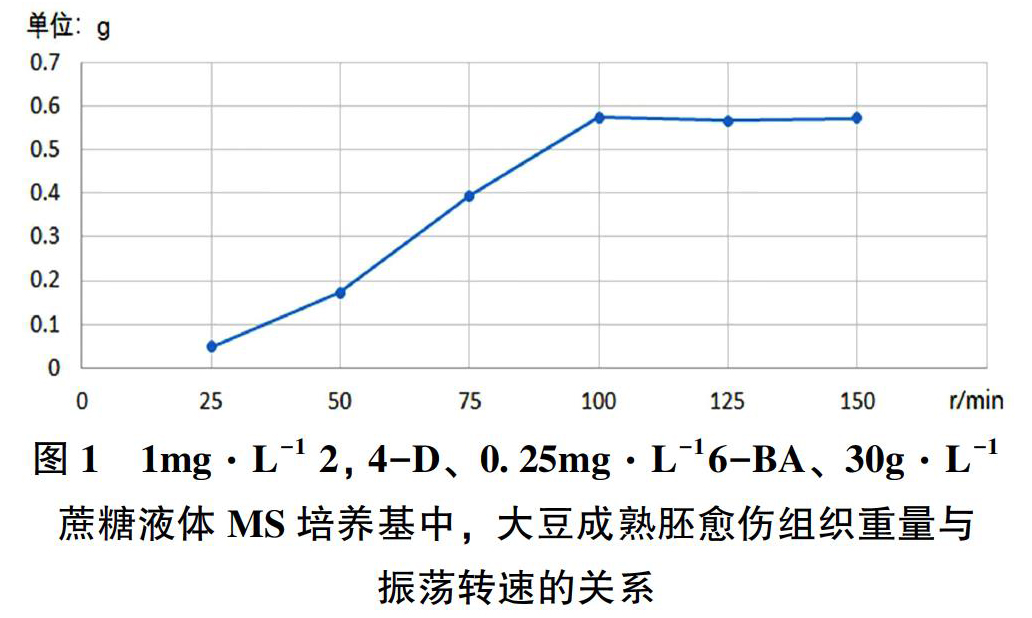
振荡转速和大豆成熟胚愈伤组织生长情况存在显著的相关性(参见图1)。在25r·min-1转速情况下,大豆成熟胚呈现一定程度的浸没缺氧状态,生长速度较为缓慢甚至逐步停滞,愈伤组织诱导效率很低;在50r·min-1转速下,大豆成熟胚浸没缺氧状态明显减轻,生长速度显著加快,愈傷组织诱导效率提升;75r·min-1转速下,大豆成熟胚基本不表现出浸没缺氧状态,生长速度和愈伤组织诱导效率继续提升;100r·min-1转速下,大豆成熟胚不表现出浸没缺氧状态,生长速度和愈伤组织诱导效率趋于顶峰;125r·min-1和150r·min-1转速下,大豆成熟胚不表现出浸没缺氧状态,生长速度和愈伤组织诱导效率相比于100r·min-1只有轻微波动,显示出近似“饱和”的状态,但过于剧烈的振荡状态不仅耗费更多能量,也会产生较多泡沫,不利于下一步的实验操作。
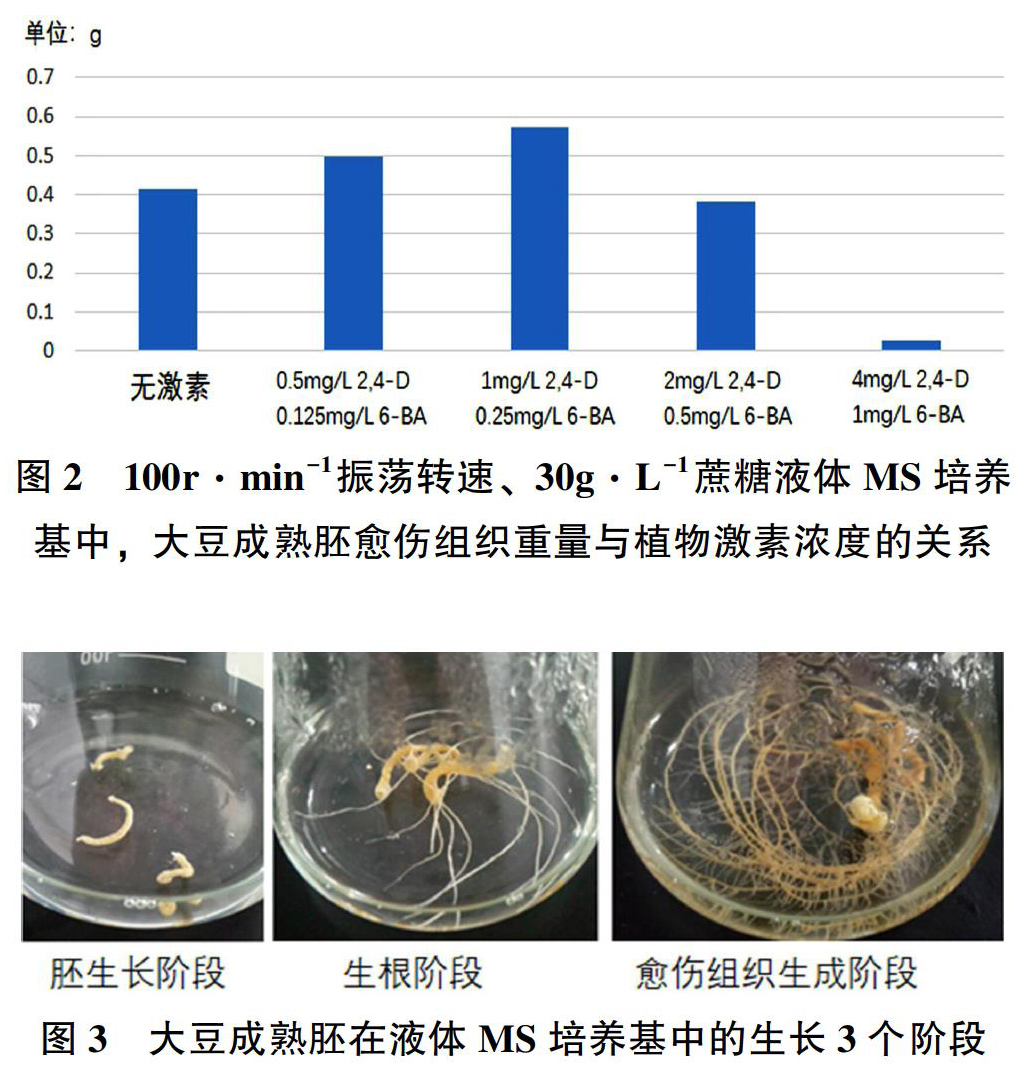
根据文献资料,在固体MS培养基上,大豆成熟胚愈伤组织诱导最适的2,4-D和6-BA浓度为2mg·L-1和0.5mg·L-1[3-5],但在液体培养基中,最适2,4-D和6-BA浓度有所不同(参见图2),相比于无激素组,添加0.5mg·L-1 2, 4-D和0.125mg·L-16-BA、1mg·L-1 2, 4-D和0.25mg·L-16-BA可以在一定程度上增加愈伤组织的诱导效率,但2mg·L-1 2, 4-D和0.5mg·L-16-BA、4mg·L-12, 4-D和1mg·L-16-BA对愈伤组织诱导有抑制效果,其中4mg·L-12, 4-D和1mg·L-16-BA的抑制效果尤为明显。
根据逐日观察的记录,大豆成熟胚在液体MS培养基中的生长可分为3个阶段(参见图3):
1~3d:胚生长阶段,胚不断膨胀、伸长,体积显著增加,但形态不发生明显变化。
4~8d:生根阶段,胚开始长出根系,根系随着时间推移不断延伸,形态发生明显变化。
9~14d:愈伤组织生成阶段,形态进一步变化,在上胚轴的位置开始出现愈伤组织,呈现白色到淡黄色不规则团块状、质地较为坚实,随着时间推移显著膨胀。
4 结论与分析
以大豆成熟胚作为外植体,通过液体MS培养基剧烈振荡培养得到愈伤组织的方法被证明具有一定可行性,可作为一种和固体培养基法、纸桥法平行存在的愈伤组织诱导方法,值得进一步的研究和实验。目前得到的比较适合的培养优化条件是:培养温度为25±1℃、光照1000-1500lx 12h·d-1、 蔗糖浓度30g·L-1、 pH 5.8~6.0、1mg·L-1 2,4-D和0.25 mg·L-1 6-BA、 100r·min-1振荡培养。
参考文献
[1] 安利国,杨桂文.细胞工程[M].第3版.科学出版社,2015:155,160.
[2] 张郁松.影响大豆愈伤组织的诱导因素研究[J].大豆科学,2007(01):66-70.
[3] 何恩铭, 齐香君, 陈秀清,等. 大豆愈伤组织的诱导与离体培养[J]. 陕西科技大学学报:自然科学版, 2005, 023(05):29-31.
[4] 张郁松, 寇炜材. 大豆愈伤组织继代培养的最佳条件研究[J]. 大豆科学, 2007, 26(02):190-193.
(责任编辑 周康)
- 信息化手段在中职英语课中的作用
- 信息化环境下报社文书档案管理工作优化分析
- 新课改形势下高中信息技术教学优化措施探讨
- 如何提高高中信息技术教学的有效性
- 互联网+时代思想政治工作队伍建设研究
- “互联网+”时代的经贸韩语课程教学模式分析
- 探究大数据时代下的高校教育管理变革
- 建设健康中国视域下大学生健康意识培育有效对策研究
- 信息技术背景下初中化学教学的研究与实践
- 大数据在高中政治教学中的运用
- 基于微课的高中英语词汇教学模式
- 信息技术在幼儿足球故事剧中的运用研究
- 新课改下高中物理实验教学中创新培养与实践
- 小学语文作文教学方法的创新思考分析
- 浅析思维导图在高中信息技术教学中的应用
- 高中英语教学中多媒体辅助教学的现状与研究
- 浅析汽车驾驶技能与安全驾驶
- 人工智能背景下职业院校信息技术课程改革与教材建设探讨
- 多媒体对幼儿园教育教学中的价值研究
- 浅谈教育信息化20时代技工院校信息化建设实践与发展趋势
- 信息化教学手段在中职计算机组装与维修课中的应用
- 先学后教在初中信息技术教学中的应用
- 探析移动互联网下的小学语文家校合作学习
- 生命教育理论视域下小学校园安全教育初探
- 少先队组织的政治启蒙分析
- corrodes
- corrodibilities
- corroding
- corrosion
- corrosive
- corrosively
- corrosiveness
- corrosivenesses
- corrosives
- corrosivities
- corrosivity
- corrugated
- corrupt
- corrupted
- corruptedly
- corruptedness
- corruptednesses
- corrupter, corruptor
- corrupters
- corruptest
- corruptful
- corruptibilities
- corruptibility,corruptibleness
- corruptible
- corruptiblenesses
- 蓝田猿人
- 蓝田生玉
- 蓝田种玉
- 蓝田美玉
- 蓝田食蛋
- 蓝痣
- 蓝皮书
- 蓝皮户口
- 蓝盔部队
- 蓝盾
- 蓝眼儿
- 蓝眼珠
- 蓝矾
- 蓝空
- 蓝立方
- 蓝筹股
- 蓝箱
- 蓝精灵
- 蓝精灵体
- 蓝紫色
- 蓝绿
- 蓝绿色
- 蓝绿色的硬玉
- 蓝缕
- 蓝罗