李德文 杜丹丹 于莉莉 刘英 于雪莹 赵雨森


摘要?[目的]探明環境紫外线-B(UV-B)辐射强度对东北地区主要树种蒙古栎挥发性有机化合物(VOCs)排放速率和主要光合生理特征的影响规律,以期为蒙古栎的定向培育和大气环境质量的调控与相关预测模型的建立提供基础数据。[方法]以5年生蒙古栎为研究对象,在自然光照基础上,人工增加0(CK)、1.40(T1)和2.80 kJ/(m2·d)(T2)3个不同强度UV-B辐射的处理,应用热解析气相色谱-质谱(GC-MS)联用技术测定蒙古栎异戊二烯和单萜类物质的排放速率,并结合叶片气体交换参数、叶绿素荧光参数、光合色素含量、苯丙氨酸解氨酶(PAL)活性和次生代谢产物含量进行差异研究和相关性分析。[结果]随UV-B辐射强度的增加,蒙古栎异戊二烯排放速率显著降低,单萜类化合物排放速率显著提高(P<0.05);增强UV-B辐射显著降低蒙古栎叶片净光合速率(Pn),提高胞间二氧化碳浓度(Ci),蒸腾速率(Tr)在低强度UV-B辐射下增加,高强度UV-B辐射下降低(P<0.05),UV-B辐射对气孔导度(Gs)无显著影响(P<005);UV-B辐射下叶绿素荧光参数、叶绿素含量、PAL活性及黄酮类化合物含量显著降低,类胡萝卜素(Car)含量显著上升(P<0.05);增强UV-B辐射显著提高蒙古栎叶片部分次生代谢物绿原酸、桃叶珊瑚苷、京尼平苷酸含量,绿原酸与桃叶珊瑚苷含量在T2处理组达到最高,分别为4.84、84.75 μg/g,T1处理组京尼平苷酸含量最高7.44 μg/g。相关分析结果表明:蒙古栎叶片异戊二烯排放速率与Fv/Fm、Φ(Ⅱ)、Pn、PAL活性、黄酮、单宁及多酚含量呈显著或极显著正相关,α-蒎烯与Fv/Fm、Pn、Chl呈极显著负相关(P<0.01);β-蒎烯与Chl呈显著正相关,与PAL活性呈显著负相关(P<0.05)。[结论]UV-B辐射增强能提高蒙古栎叶片单萜化合物的排放速率,降低异戊二烯排放速率、光合速率和次生代谢产物总量,改变树木VOCs的组成特征。
关键词?蒙古栎;UV-B辐射;挥发性有机物(VOCs);光合作用;次生代谢物
中图分类号?S?792.186文献标识码?A文章编号?0517-6611(2020)17-0139-07
doi:10.3969/j.issn.0517-6611.2020.17.036
开放科学(资源服务)标识码(OSID):
Effects of UV?B Radiation on the Release of Volatile Organic Compounds in Quercus mongolica
LI De?wen1,2,DU Dan?dan1,YU Li?li1 et al
(1.Key Laboratory of Forest Plant Ecology, Ministry of Education, Northeast Forestry University, Harbin,Heilongjiang 150040; 2.Forestry College, Northeast Forestry University, Harbin,Heilongjiang 150040)
Abstract?[Objective]To find out the effect of environmental ultraviolet?B (UV?B) radiation intensity on the emission rate of volatile organic compounds (VOCs) and photosynthetic physiological characteristics of Quercus mongolica in northeast China, so as to provide basic data for the directional cultivation, the regulation of atmospheric environmental quality and the establishment of related prediction model of QM. [Method]The five?year?old QM was taken as the research object,on the basis of natural light,adding 3 intensity UV?B radiation treatments of 0 (CK), 1.40 (T1) and 2.80 kJ/(m2·d) (T2), the thermal decomposition gas chromatography?mass spectrometry (GC?MS) technique was used to determine the emission rate of QM isoprene and monoterpenes, combined with leaf gas exchange parameters, chlorophyll fluorescence parameters, photosynthetic pigment content, phenylalanine aminolytic enzyme (PAL) activity and secondary metabolite content were analyzed and correlated.[Result]With the increase of UV?B radiation intensity, isoprene emission rate of QM decreased significantly, and monoterpene emission rate increased significantly (P<0.05); enhanced UV?B radiation significantly reduced net photosynthetic rate (Pn) of QM leaves, intercellular carbon dioxide concentration was increase (Ci), transpiration rate (Tr) increased under low intensity UV?B radiation, and decreased under high intensity UV?B radiation (P <0.05), UV?B radiation had no significant effect on stomatal conductance (Gs) (P <0.05). Under UV?B radiation, the chlorophyll fluorescence parameters, chlorophyll contents, PAL activity and flavonoid contents decreased significantly, while carotenoid (Car) content increased significantly (P <0.05). The contents of chlorogenic acid, aucubin and geniposide in some secondary metabolites of QM leaves were significantly increased by enhanced UV?B radiation, the contents of chlorogenic acid and aucubin were the highest in T2 treatment group (4.84 and 84.75 μg/g, respectively), and geniposide was the highest in T1 treatment group (7.44 μg/g). The results of correlation analysis showed that: there was a significant or extremely significant positive correlation between isoprene emission rate of QM leaves and Fv/Fm, Φ(Ⅱ), Pn, PAL activity, flavone, tannin and polyphenol contents, α??pinene was negatively correlated with Fv/Fm, Pn and Chl (P<0.01), β??pinene was positively correlated with Chl and negatively correlated with PAL activity (P<0.05). [Conclusion]Enhanced UV?B radiation could increase the emission rate of monoterpenes from QM leaves, reduce isoprene emission rate, photosynthetic rate and total amounts of secondary metabolites, and change VOCs composition characteristics of trees.
Key words?Quercus mongolica;UV?B radiation;Volatile organic compounds (VOCs);Photosynthesis;Secondary metabolites
植物源揮发性有机物(volatile organic compounds,VOCs)是植物体内通过次生代谢途径合成的低沸点、易挥发的碳氢化合物,对全球碳循环[1]、大气环境与气候变化具有深远影响[2]。植物在遭受到机械损伤或昆虫取食后可释放出诱导型VOCs从而抵御胁迫,其除了具有防御功能外,还有利于植物的伤口愈合,亦可作为伤害信息在植株间传递以引起群体诱导抗性的产生[3]。此外,研究者认为植物可以通过释放VOCs来提高其对环境胁迫的抵抗力,大量研究已经表明异戊二烯能提高植物抗臭氧的能力,李用宇等[4]和安俊琳等[5]分别研究了南京北郊VOCs的光化学特征和体积分数,发现烯类物质对臭氧生成的贡献最大。异戊二烯和单萜类次生代谢物质是植物源VOCs的主要成分,该类物质大多含有不饱和化学键,具有较高的化学活性,释放到大气中能够与羟基自由基(·OH)及硝酸根自由基(·NO3-)快速反应,并在适宜的外部条件下形成臭氧(O3)、二次有机气溶胶(SOA)和PAN等二次污染物,显著影响大气光化学反应和全球气候变化进程,因而受到广泛关注[6]。
臭氧层破坏变薄引起到达地面的紫外线-B(UV-B)辐射增强已得到充分证实,且被公认为是重大的全球环境问题,将对人类及全球生态系统产生深远的效应[7]。虽然自蒙特利尔公约执行以来,平流层臭氧消耗物浓度开始下降,但臭氧层厚度仍比20世纪70年代低,且未来几十年内也难以很快恢复[8]。研究表明增强UV-B辐射能够破坏叶片组织和细胞叶绿体的形态与结构,导致光合作用下降[9]。UV-B可诱导苯丙氨酸解氨酶(PAL)和查尔酮合成酶(CHS)等植物次生代谢过程的关键酶活性及基因表达变化,进而改变次生代谢产物(例如黄酮类和酚醛类等化合物)含量,屏护UV所引起的伤害作用[10]。此外,高剂量的UV-B辐射可破坏氨基酸残基,导致参与生化过程的蛋白质和酶失活[11],进而影响植物初生和次生代谢过程[12]。由于VOCs作为植物重要的次生代谢产物,其组成及释放量势必受到环境UV-B辐射变化的强烈影响,然而目前为数不多的关于UV-B辐射强度变化对植物VOCs释放影响的研究结果并不一致[3]。
蒙古栎(Quercus mongolica),又称柞木、柞树,为国家二级珍贵树种,是我国温带地区落叶阔叶林及针阔混交林的主要树种[13],也是营造防风林、水源涵养林及防火林的优良树种,在我国主要分布于东北地区和华北地区。前期研究发现蒙古栎幼树叶片单位干重的VOCs排放速率显著高于银杏、华山松及油松,且其VOCs排放速率和组成受环境影响显著[14]。以蒙古栎为研究对象,采用环境模拟控制试验,应用热解析气相色谱-质谱(GC-MS)联用技术对蒙古栎异戊二烯和单萜类物质的排放速率进行测定,结合叶片气体交换参数、叶绿素荧光参数、光合色素含量、苯丙氨酸解氨酶(PAL)活性和次生代谢产物含量,探讨环境UV-B辐射增强对蒙古栎树木VOCs排放速率的影响机制,以期为大气环境质量的调控与相关预测模型的建立提供基础数据。
1?材料与方法
1.1?试验设计
试验于2018年9月在东北林业大学森林植物生态学教育部重点实验室实验园内进行,选取60株长势一致的株高约1 m的5年生蒙古栎随机分为3组,每组20株,在自然光照基础上,根据试验要求,人工增加0 kJ/(m2·d)(CK)为对照、1.40 kJ/(m2·d)(T1)和2.80 kJ/(m2·d)(T2)3个不同强度UV-B辐射处理。UV-B辐射处理通过悬在植株上方的UV-B灯管产生(280~320 nm,40 W,北京电光源研究所),每日处理时间为09:00—16:00。UV-B辐射强度通过光谱仪AvaSpec 2048-2(Avantes BV,新西兰)进行测定。处理期间常规管理,保证水分、养分供应。处理7 d后测定植株VOCs释放速率,并选取植株顶端已完全展开的生长状况及叶龄和叶位一致的叶片,测定各项生理指标,每个处理均随机取样,3次重复。
1.2?VOCs排放速率的测定
选取不同处理长势良好的蒙古栎叶片进行VOCs的收集,采用QC-1B型气体采样仪(北京市劳动保护科学研究所)按照活体植物动态顶空套袋法对植株向阳部位的叶片进行VOCs的采集[15]。采气袋容积为0.5 m3,采气流速为200 mL/min,采样时间为5 min,分别于封闭后0、30 min采集气体样品。气体样品填充于Tenax-TA不锈钢吸附管内,采集样品前,采样管用流速为50 mL/min的高纯氮气在280 ℃下老化1 h。样品采集后,立即带回实验室进行分析测定。
采用Tekmar 6000型热解析仪(Dohrmann,美国)进行样品解析,热解析条件:225 ℃下脱附20 min,一次冷阱温度165 ℃,240 ℃下二次脱附4 min,二次冷阱温度150 ℃,二次冷阱进样温度225 ℃。采用气质联用仪(GC-MS,QP2010 Ultra型,日本岛津公司)进行VOCs的定性及定量分析,色谱柱为DB-624(30 m×1.8 μm×0.32 mm),载气高纯He气,柱流量1.5 mL/min;程序升温条件:初始柱温为50 ℃,停留5 min,以15℃/min升温至250 ℃,保留5 min;离子源温度:200 ℃,接口温度:250 ℃,进样口温度:180 ℃。VOCs标准品购买于Sigma公司,纯度大于99.99%。采样后将叶片放在60 ℃下烘干至恒重,称量干重,根据王志辉等[16]方法计算各化合物释放速率[μg/(g·h)]。
1.3?气体交换参数的测定及主要光合生理参数的计算
于晴天09:30—11:00,采用Li-6400型便携式光合仪,使用6400-02BLED光源,在气温(Tair)25 ℃,相对湿度(RH)60%,CO2浓度为400 μmol/mol,光合有效辐射(PAR)为800 μmol/mol的条件下测定供试植株叶片净光合速率(Pn)、气孔导度(Gs)、胞间CO2浓度(Ci)及蒸腾速率(Tr),并按照董晓颖等[17]的方法计算水分利用效率(g/kg)、叶片羧化效率[(μmol/(m2·s)]和气孔限制值。
水分利用效率(WUE)=Pn/Tr;
叶片羧化效率(CE)=Pn/Ci;
气孔限制值(Ls)= 1-Ci/C0,C0为400 μmol/mol。
1.4?叶绿素荧光参数的测定
参考Cen等[18]方法,采用便携式PAM-2500叶绿素荧光仪测定叶绿素荧光参数,具体步骤为在植株叶片暗适应20 min后测量暗适应状态下的最小荧光(F0),然后在0.6 s时发出8 000 μmol/(m2·s)的强光,瞬间降低塑料醌池和主要醌受体QA,从而记录暗适应状态下的最大荧光(Fm);打开作用光[600 μmol/(m2 · s)],待叶片光合作用达到稳态后记录光合稳态荧光(Fs),打开饱和脉冲光[8 000 μmol/(m2· s),0.6 s]记录最大荧光Fm′,关闭作用光,打开远红光,约8 s后关闭,得到最小荧光F0′。根据此方法得到基本的叶绿素荧光数据,计算公式按照Yao等[19]方法,分别计算最大光合效率(Fv/Fm)、实际光合效率[Φ(Ⅱ)]、非光化学淬灭系数(NPQ)、光化学淬灭系数(qP)、PS Ⅱ调节性能量耗散的量子产量[Y(NPQ)]、PS Ⅱ非调节性能量耗散的量子产量[Y(NO)]、PS Ⅱ的相对电子传递速率[ETR(Ⅱ)]。
Fv/Fm=(Fm-F0)/Fm(1)
Φ(Ⅱ)=(Fm′-Fs)/Fm′(2)
NPQ =(Fm-Fm′)/Fm′(3)
qP = 1-(Fs′-F0′)/(Fm-F0)(4)
Y(NPQ)=Fs/Fm′-Fs/Fm(5)
Y(NO)=Fs/Fm(6)
ETR(Ⅱ)= PAR×Φ(Ⅱ)×0.84×0.5(7)
1.5?光合色素含量的測定
光合色素含量参考Jiang等[20]方法测定,稍作修改:称取0.2 g蒙古栎叶片鲜样,加入预冷的80%丙酮研磨成匀浆,5 000 r/min离心10 min,取上清液采用紫外分光光度计于665、649和480 nm下测定其吸光值,并计算叶绿素a(Chl a)、叶绿素b(Chl b)、总叶绿素(Chl)及类胡萝卜素(Car)含量和叶绿素a/b值(Chl a/b)。
1.6?苯丙氨酸解氨酶(PAL)活性的测定
苯丙氨酸解氨酶(PAL)活性参照Koukol[21]的测定方法,通过测定肉桂酸的形成来确定苯丙氨酸脱氨酶活性。精确称取1 g新鲜蒙古栎叶子,充分研磨后,加入3 mL 200 μmol/L硼酸盐缓冲液(内含0.1 g PVP,pH 8.8)研磨成匀浆,10 000 r/min离心15 min,上清液备用。取1 mL上清液,依次加入1 mL 20 μmol/L L-苯丙氨酸和2 mL 200 μmol/L硼酸盐缓冲液(pH 8.8),最终体积为3 mL。将混合液置于40 ℃水浴1 h,反应结束,取出后迅速冷却,再加入0.1 mL 5 mol/L HCl,读取290 nm处的吸光度值。
计算公式:
PAL活性=A290×Vt/(0.01×Vs×FW×t)
式中,FW代表样品鲜重;t为反应时间(min);Vt是总的提取液体积(mL);Vs是测定时所用酶液体积(mL)。
1.7?次生代谢物含量的测定
黄酮、总酚、单宁样品提取参考魏晓雪等[22]的方法:称取新鲜叶片0.5 g,加10 mL酸性甲醇溶液(甲醇∶水∶盐酸=79∶20∶1),室温下研磨,于55 ℃水浴提取30 min,3 000 r/min离心10 min,取上清液定容至10 mL待测。黄酮含量采用尉芹等[23]测定方法,于分光光度计510 nm处检测吸光值;总酚的检测采用Chaovanalikit等[24]方法于分光光度计765 nm处检测吸光值;单宁含量采用王杰兴等[25]测定方法,于分光光度计442 nm处检测吸光值。
桃叶珊瑚苷、绿原酸及京尼平苷酸的提取方法:取鲜样1 g加入7.5 mL 80%甲醇(色谱级)于高通量组织研磨器(宁波新艺超声设备有限公司)70 Hz 10 min,超声提取10 h,漩涡3次,8 000 r/min离心15 min,取上清残渣用上述方法重提2次,合并上清液弃去残渣。上清液在35 ℃下浓缩至3 mL,甲醇定容至10 mL,超声1 h后12 000 r/min离心10 min,取上清液,将样品保存在-20 ℃冰箱待色谱分析。色谱条件:GC-MS(美国Waters CORTECS),C18色谱柱(2.1 mm×100 mm,16 μm),柱温:25 ℃;流动相:溶剂A(62%水)与溶剂B(38%甲醇),流速为0.25 mL/min;进样量:5 μL。Negative模式,离子喷雾电压5 500 V。待测物质谱分析条件参数(m/z)分别为桃叶珊瑚苷(345.1/183.1)、绿原酸(353.0/191.0)、京尼平苷酸(373.2/211.1)。绿原酸、桃叶珊瑚苷及京尼平苷酸标准品均购于Sigma公司,纯度≥ 98%。
1.8?数据处理
应用SPSS 19.0和Excel 2010 软件进行数据分析,并采用单因素方差分析(One-way AVONA)检验各处理组间差异显著性(P<0.05)和相关分析法进行各指标间的相关性分析,图表中数值为平均值±标准误(mean ± SE)。
2?结果与分析
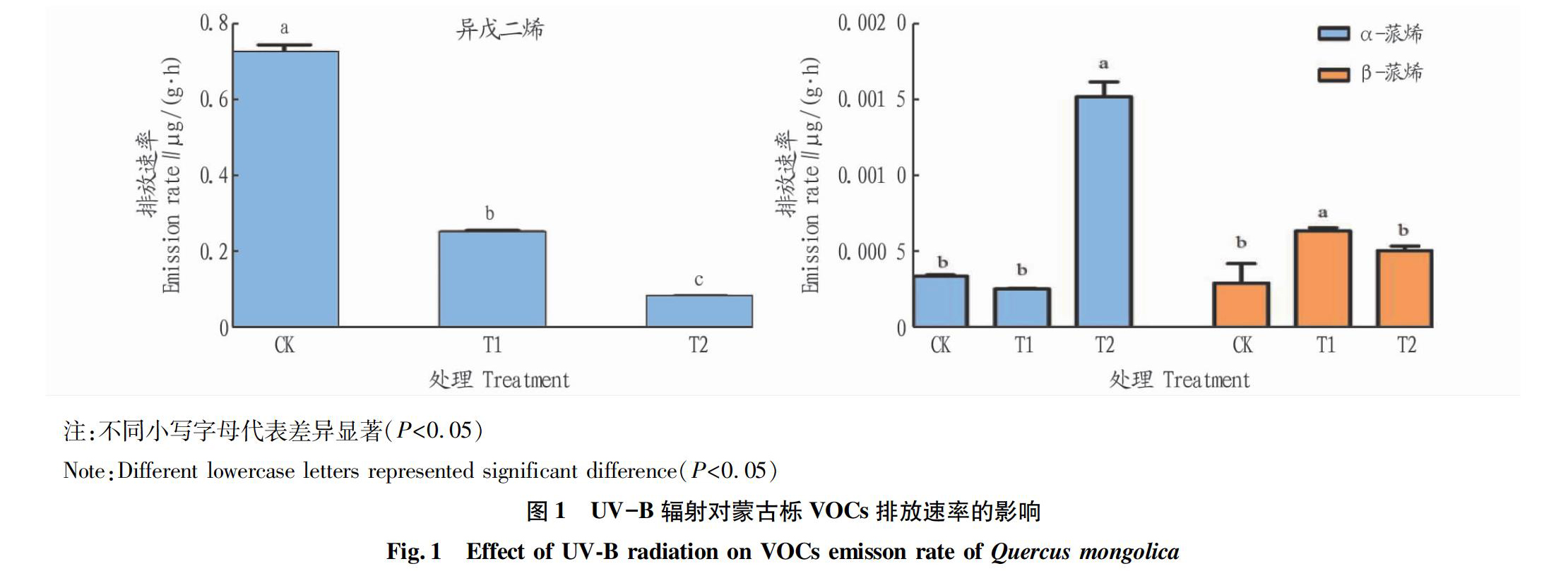
2.1?UV-B辐射对蒙古栎叶片VOCs排放速率的影响
由图1可知,蒙古栎异戊二烯排放速率显著高于单萜类化合物,对照处理下异戊二烯释放速率达0.74 μg/(g·h),且异戊二烯排放速率随UV-B辐射强度增加显著降低(P<005),高强度UV-B辐射下蒙古栎异戊二烯排放速率与CK相比降低了88.6%。增加UV-B辐射强度显著提高了α-蒎烯与β-蒎烯的释放速率(P<0.05),T2处理下α-蒎烯释放速率显著高于其他处理,为对照条件下α-蒎烯释放速率的446倍;β-蒎烯在T1处理下释放速率达到最大,较CK处理增加了2.16倍,T2处理下β-蒎烯与CK相比增加但不显著(P>0.05)。
2.2?UV-B辐射对蒙古栎叶片光合作用的影响
由表1可知,蒙古栎叶片Pn在高强度UV-B辐射下显著降低(P<0.05),在低强度UV-B辐射下与CK无显著差异;UV-B辐射对蒙古栎叶片Gs无影响(P<0.05);Ci随UV-B辐射强度的增加而增加,与CK相比T2处理下蒙古栎叶片Ci增加了78.8%;Tr在T1处理下显著提高,T2处理下显著降低;WUE、CE和Ls随UV-B辐射强度的增加显著降低,与CK相比,T2处理下分别显著降低了45.5%、80.0%、46.2%(P<0.05)。
2.3?UV-B辐射对蒙古栎叶片叶绿素荧光参数的影响
由表2可知,高强度UV-B辐射显著降低蒙古栎叶片最大光合效率Fv/Fm、实际光合效率Φ(Ⅱ)和非光化学淬灭系数NPQ(P<0.05);光化学淬灭系数qP随UV-B辐射强度的增强而增大;调节性能量耗散量子产量Y(NPQ)在UV-B辐射下与CK无显著差异;非调节性能量耗散量子产量Y(NO)在高强度UV-B辐射下显著高于CK;PS Ⅱ电子传递速率ETR(Ⅱ)随UV-B辐射的增强显著降低(P<0.05)。
2.4?UV-B辐射对蒙古栎叶片光合色素含量的影响
由表3可知,低强度UV-B辐射(T1处理)下蒙古栎叶片Chl a、Chl b、Chl及Chl a/b值与CK相比无显著差异(P<0.05),而高强度UV-B辐射(T2处理)则显著降低(P<0.05),T2处理下Chl a、Chl b及Chl含量分别较CK降低了19.1%、14.3%及16.2%。随UV-B辐射强度增加,Car含量显著提高(P<005)。
2.5?UV-B辐射对蒙古栎叶片PAL活性和次生代谢产物含量的影响
由表4可知,增加环境UV-B辐射显著降低蒙古栎叶片PAL活性、黄酮、总酚和单宁含量(P<0.05);桃叶珊瑚苷含量在T2处理下显著增加;绿原酸含量随UV-B辐射强度的增加显著提高(P<0.05);京尼平苷酸含量在低强度UV-B辐射下达到最大,为CK的3.41倍(P<005)。
2.6?VOCs排放速率、叶绿素荧光参数、气体交换参数、光合色素和PAL活性间的相关性分析
在环境UV-B辐射增强条件下,蒙古栎叶片VOCs排放速率、叶绿素熒光参数、气体交换参数、光合色素含量和PAL活性间存在显著相关性(表5),相关分析结果表明,异戊二烯排放速率与Fv/Fm、Φ(Ⅱ)、ETR和Pn呈显著正相关(P<0.05),与Y(NO)、Chl呈显著负相关(P<0.05),与黄酮、总酚、单宁含量及PAL活性呈极显著正相关(P<0.01),与Ci呈极显著负相关(P<0.01);α-蒎烯与Y(NO)和Ci呈极显著正相关,与Fv/Fm、Pn、Tr、Chl a、Chl a/b呈极显著负相关,与Car和Chl b呈显著负相关(P<0.05)(相关系数分别为0.705和0.670);β-蒎烯与Chl呈显著正相关,与PAL活性呈显著负相关(P<0.05)(相关系数>0.9)。
3?讨论
3.1?蒙古栎叶片VOCs排放速率对UV-B辐射的响应
不同植物种属排放VOCs种类不同,阔叶树主要排放异戊二烯,针叶树主要排放单萜类化合物[16],与此相同,该研究发现各处理条件下蒙古栎叶片主要排放异戊二烯。异戊二烯的合成途径已知有甲羟戊酸(MVA)途径和丙酮酸/磷酸甘油醛(MEP)途径,由于异戊二烯在植物体内的储库很小,即时合成与排放,当植物从光照条件转向黑暗处时,异戊二烯的排放量明显减少,说明植物光合作用合成的碳明显有利于异戊二烯的合成[26]。
研究表明,水分胁迫、盐胁迫、干旱气候和氧化应激等可以影响VOCs的释放速率[27]。Maja等[28]发现增强UV-B辐射显著增加了欧洲白杨(Populus tremula L.)VOCs的排放速率。Llusia等[29]发现UV-B辐射下乳香黄连木的异戊二烯排放速率增加。而该试验表明蒙古栎叶片异戊二烯排放速率随UV-B辐射的增强而减少,相关分析结果显示UV-B辐射增强条件下,蒙古栎异戊二烯排放速率与PAL活性、黄酮类化合物含量、总酚含量及单宁含量呈极显著正相关。这表明异戊二烯排放量具有明显的树种差异,UV-B吸收化合物含量与异戊二烯排放量受相同的信号因子调控[30]。该研究发现UV-B处理显著提高蒙古栎单萜化合物的排放速率,改变其VOCs的组成特征。这与Blande等[31]研究相似,UV-B辐射增强可导致α-蒎烯、莰烯、桧烯、β-蒎烯、月桂烯和柠檬烯等单萜类化合物排放量的增加;Maja等[32]研究发现,补充UV-B 辐射增加了罗勒叶片中萜类化合物,尤其是芳樟醇、1,8-桉油醇和反式-β-罗勒烯等主要挥发油含量。Gil等[33]研究表明,单萜作为防御葡萄浆果对UV-B的响应具有特定的作用。可见,UV-B胁迫是不同树种VOCs排放速率和组成成分不同的原因之一。
3.2?蒙古栎叶片光合系统对UV-B辐射的响应
由于近年臭氧层破坏,使得太阳光中中波UV-B辐射到达地表剂量加大,叶片是直接接受光源的植物器官,故UV-B直接作用到植物叶片上,未迅速启动自身防御系统就会遭受UV-B辐射迫害,引起光合作用减弱。研究报道,植物光合系统是UV-B辐射伤害的主要靶子[34]。影响光合作用的因素除了非气孔因素外,还有气孔因素。该试验表明,随UV-B辐射增强Ci显著增加,Gs无显著变化,说明CO2供应没有被限制,导致Pn下降的原因是非气孔因素[35]。与众多试验结果一致,祁虹等[36]设定增加环境UV-B辐射的20%和40%作为处理组,辐射剂量为10 h/d,观测棉花对增强UV-B的响应,结果表明增强UV-B辐射降低了Pn,提升了Ci,Gs无显著变化;李俊等[37]探究几种马铃薯叶片光合参数响应UV-B的报道表明不同品系马铃薯叶片在UV-B辐射下会抑制其Pn。
叶绿素荧光好比光合作用与外界环境间的探针,通过对其测定和分析探究植物光合系统对环境变化做出的响应机制[38]。Fv/Fm代表PSⅡ原初光能转换效率[39]。在不受光抑制的情况下(且不受生长条件的影响),Fv/Fm一般介于0.75~085[40]。当植物受到水分胁迫、极端温度和盐胁迫等逆境胁迫后 Fv/Fm值会不同程度下降,因此Fv/Fm是逆境生理研究的重要指示性参数。该试验表明,蒙古栎Fv/Fm在对照中处于正常范围,说明自然光下蒙古栎叶片没有受到明显的光胁迫。增加UV-B辐射显著降低了蒙古栎叶绿素荧光参数指标,与张美萍等[41]探讨UV-B辐射降低了水稻叶绿素荧光参数的结果一致,导致其降低的原因是UV-B影响了PS Ⅱ光化学能的转换,破坏了电子传递体,酶活性下降,从而降低光能转换效率。
光合色素参与光合作用中光能的吸收、传递和转化,其含量的高低在一定程度上能反映植物利用光能及制造有机物的能力。光合色素是色素蛋白的复合物,蛋白质对UV-B辐射的强烈吸收决定了光合色素对UV-B辐射损伤的敏感性,不同植物的叶绿素对UV-B辐射的敏感性存在较大差异[42]。该研究结果表明UV-B辐射下蒙古栎叶片Chl a,Chl b和Chl含量显著下降,这与韩发等[43]研究不同海拔植物适应性中测得叶绿素下降结果一致。这可能是UV-B辐射增强导致叶绿体超微结构受到破坏,PS Ⅱ电子传递活性下降,叶绿素合成受阻、降解增加,或者是二者共同作用的结果[42]。Car是光系统的重要组成部分,同时是非常重要的結合于生物膜上的抗氧化剂[44],作为高能量短波辐射的猝灭剂,Car既可以防止超氧阴离子的产生,又可将已经产生的超氧阴离子转变成基态氧分子,因而能保护光系统免受光氧化的损害。UV-B辐射处理下,蒙古栎叶片Car含量显著升高,可以在一定程度上保护光系统,也是植物对UV-B强辐射适应的结果[45]。
3.3?蒙古栎叶片PAL活性和次生代谢物对UV-B辐射的响应
PAL在次生代谢中是连接初级代谢和苯丙烷类代谢、催化苯丙烷类代谢第一步反应的关键酶和限速酶[46],黄酮因其具有屏蔽UV-B和清除UV-B诱发活性氧功能而被作为植物对抗UV-B辐射的“过滤剂”和“淬灭剂”[47],另外暴露在高强度UV-B辐射下的植物,其表皮细胞酚类化合物水平可能增高,而酚类化学物质含量增加被认为是植物保护自身免受UV-B辐射的一种适应性特征[48]。研究发现增强UV-B辐射可增加卷心菜类黄酮、总酚和花青素含量[49]。唐文婷等[50]研究发现UV-B辐射降低了黄芩茎中类黄酮、不饱和脂类,内酯、醇及酚类物质的含量,与根和叶中次生代谢物质含量的升高相反,并推测植物在各部分次生代谢方面存在权衡。该研究发现随着UV-B辐射强度增加,蒙古栎叶片PAL活性、黄酮、单宁和总酚含量显著降低,这与魏晓雪等[22]报道一致。目前,已有为数不少的试验结果证实UV-B辐射并不总是导致黄酮类化合物含量增加,这可能与UV-B对植物细胞造成的不可逆伤害有关,这种伤害可以导致细胞类黄酮降解加速而合成困难[51]。该研究发现增强环境UV-B辐射显著增加了蒙古栎叶片绿原酸含量,绿原酸含量增加是UV-B辐射促进了合成绿原酸通路上羟基化肉桂酰转移酶(hydroxycinnamoyl CoA quinate hydroxycinnamoyl transferase,HQT)的合成导致[52]。桃叶珊瑚苷和京尼平苷酸是环烯醚萜类化合物,具有显著的抗氧化作用。该研究发现高剂量UV-B辐射下蒙古栎叶片桃叶珊瑚苷和京尼平苷酸含量显著上升,UV-B辐射激活了蒙古栎叶片次生代谢产物合成的防御系统,合成了更多的次生代谢物。这与李双明等[53]研究UV胁迫下东北红豆杉鲜叶内萜类化合物的代谢酶活性及二萜类物质含量增加结果一致。史利平等[54]发现盐胁迫处理过的玉米中萜类合成途径上的萜烯合酶基因2(Terpene synthase 2,TPS2)、萜烯合酶基因3(Terpene synthase 3,TPS3)、牻牛儿基牻牛儿基焦磷酸合成酶基因4(Geranylgeranyl diphosphate synthase 4,GGPS4)的表达会随着胁迫处理时间的延长表现出先上调后下调的变化规律。这表明不同环境因子对次生代谢产物合成途径上相关基因的表达具有深度影响,从而决定了植物次生代谢产物的总含量和相对比例[55]。
4?结论
各处理条件下蒙古栎叶片主要排放异戊二烯,增强环境UV-B辐射显著提高蒙古栎叶片单萜化合物的排放速率,降低异戊二烯排放速率,改变树木VOCs的组成特征;UV-B辐射对蒙古栎叶片光合作用的影响主要表现为光合速率降低及光合色素含量的改变,高强度UV-B辐射造成光合速率下降的原因是由于非气孔因素的限制,改变了有机合成中碳素的流向与流量,从而使植物次生代谢生物合成系统效率降低,以致类黄酮和酚类等物质含量的降低;增强UV-B辐射可激活蒙古栎体内抗氧化防御系统,使绿原酸、桃叶珊瑚苷及京尼平苷酸含量显著提高。在全球变化的背景下,采用环境调控措施为东北地区主要树种蒙古栎的定向培育和大气环境质量的调控与相关预测模型的建立提供了基础数据。
参考文献
[1] PEUELAS J,LLUSI J.BVOCs:Plant defense against climate warming?[J].Trends in plant science,2003,8(3):105-109.
[2] 白建辉,王庚辰,BRAD BAKER,等.内蒙古草原异成二烯排放通量的测量[C]//中国气象学会大气环境学委员会.新世纪气象科技创新与大气科学发展——中国气象学会2003年年会“农业气象与生态环境”分会论文集.北京:气象出版社,2003.
[3] 路洋,郭阳,杜再江,等.植物释放VOCs的研究[J].化工科技,2013,21(1):75-79.
[4] 李用宇,朱彬,安俊琳,等.南京北郊秋季VOCs及其光化學特征观测研究[J].环境科学,2013,34(8):2933-2942.
[5] 安俊琳,朱彬,李用宇.南京北郊大气VOCs体积分数变化特征[J].环境科学,2013,34(12):4504-4512.
[6] PACIFICO F,HARRISON S P,JONES C D,et al.Isoprene emissions and climat[J].Atmospheric environment,2009,43(39):6121-6135.
[7] CASADEVALL R,RODRIGUEZ R E,DEBERNARDI J M,et al.Repression of growth regulating factors by the micro RNA396 in hibits cell proliferation by UV?B radiation in Arabidopsis leaves[J].The plant cell,2013,25(9):3570-3583.
[8] BAIS A F,MCKENZIE R L,BERNHARD G,et al.Ozone depletion and climate change:Impacts on UV radiation[J].Photochemistry and photobiology science,2015,14:19-52.
[9] 袁孟玲,岳堃,王红,等.‘台农一号芒果成年树在增强UV-B辐射处理下的损伤及其抗氧化响应[J].热带作物学报,2018,39(9):1724-1731.
[10] 吴颖,梁月荣,董俊杰,等.UV-B诱导拟南芥查耳酮合成酶(CHS)基因表达及其信号传导途径[J].农业生物技术学报,2006,14(5):736-741.
[11] 王红,杨成坤,岳堃,等.杧果树在增强UV-B辐射处理下果实的品质变化及其抗氧化响应[J/OL].热带作物学报,2019,40(10):1-11[2019-11-17].http://kns.cnki.net/kcms/detail/46.1019.S.20191030.0910.004.html.
[12] 唐文婷.增强UV-B辐射对黄芩生长、生理生化及化学成分的影响[D].西安:西北大学,2011.
[13] 殷晓洁,周广胜,隋兴华,等.蒙古栎地理分布的主导气候因子及其阈值[J].生态学报,2013,33(1):103-109.
[14] 李德文,史奕,何兴元.O3浓度升高对银杏及油松BVOCs排放的影响[J].环境科学,2008,29(2):300-304.
[15] 陈颖,李德文,史奕,等.沈阳地区典型绿化树种生物源挥发性有机物的排放速率[J].东北林业大学学报,2009,37(3):47-49.
[16] 王志辉,张树宇,陆思华,等.北京地区植物VOCs排放速率的测定[J].环境科学,2003,24(2):7-12.
[17] 董晓颖,李培环,王永章,等.水分胁迫对不同生长类型桃叶片水分利用效率和羧化效率的影响[J].灌溉排水学报,2005,24(5):67-69.
[18] CEN H Y,WENG H Y,YAO J N,et al.Chlorophyll fluorescence imaging uncovers photosynthetic fingerprint of citrus Huanglongbing[J].Frontiers in plant science,2017,8:1-11.
[19] YAO J N,SUN D W,CEN H Y,et al.Phenotyping of Arabidopsis drought stress response using kinetic chlorophyll fluorescence and multicolor fluorescence imaging[J].Frontiers in plant science,2018,9:1-15.
[20] JIANG M Y,ZHANG J H.Effect of abscisic acid on active oxygen species,antioxidative defence system and oxidative damage in leaves of maize seedlings[J].Plant and cell physiology,2001,42(11):1265-1273.
[21] KOUKOL J,CONN E E.The metabolism of aromatic compounds in higher plants.IV.Purification and properties of the phenylalanine deaminase of Hordeum vulgare[J].Journal of biological chemistry,1961,236:2692-2698.
[22] 魏曉雪,于景华,李德文,等.UV-B辐射增强对红松幼苗针叶脂质过氧化及抗氧化系统的影响[J].林业科学,2011,47(5):54-59.
[23] 尉芹,王冬梅,马希汉,等.杜仲叶总黄酮含量测定方法研究[J].西北农林科技大学学报(自然科学版),2001,29(5):119-123.
[24] CHAOVANALIKIT A,WROLSTAD R E.Total anthocyanins and total phenolics of fresh and processed cherries and their antioxidant properties[J].Journal of food science,2004,69(1):67-72.
[25] 王杰兴,王全杰,杜山山,等.分光光度法测定板栗刺壳、核桃青皮及葡萄皮中的单宁含量[J].西部皮革,2013,35(6):20-23.
[26] 蔡志全,秦秀英.植物释放挥发性有机物(VOCs)的研究进展[J].生态科学,2002,21(1):86-90.
[27] VALLAT A,GU H N,DORN S.How rainfall,relative humidity and temperature influence volatile emissions from apple trees in situ[J].Phytochemistry,2005,66(13):1540-1550.
[28] MAJA M M,KASURINEN A,HOLOPAINEN T,et al.The effect of warming and enhanced ultraviolet radiation on gender?specific emissions of volatile organic compounds from European aspen[J].Science of the total environment,2016,547:39-47.
[29] LLUSIA J,LLORENS L,BERNAL M,et al.Effects of UV radiation and water limitation on the volatile terpene emission rates,photosynthesis rates,and stomatal conductance in four Mediterranean species[J].Acta physiologiae plantarum,2012,34(2):757-769.
[30] KALING M,KANAWATI B,GHIRARDO A,et al.UV?B mediated metabolic rearrangements in poplar revealed by non?targeted metabolomics[J].Plant,cell & environment,2015,38(5):892-904.
[31] BLANDE J D,TURUNEN K,HOLOPAINEN J K.Pine weevil feeding on norway spruce bark has a stronger impact on needle VOC emissions than enhanced UV?B radiation[J].Environmental pollution,2009,157(1):174-180.
[32] MAJA M M,KASURINEN A,HOLOPAINEN T,et al.The effect of warming and enhanced ultraviolet radiation on gender?specific emissions of volatile organic compounds from European aspen[J].Science of the total environment,2016,547:39-47.
[33] GIL M,PONTIN M,BERLI F,et al.Metabolism of terpenes in the response of grape (Vitis vinifera,L.) leaf tissues to UV?B radiation[J].Phytochemistry,2012,77(15/16):89-98.
[34] REYES T H,SCARTAZZA A,POMPEIANO A,et al.Physiological responses of Lepidium meyenii plants to ultraviolet?B radiation challenge[J].BMC Plant Biology,2019,19(1):1-12.
[35] 李新国,许大全,孟庆伟.银杏叶片光合作用对强光的响应[J].植物生理学报,1998(4):354-360.
[36] 祁虹,段留生,王树林,等.全生育期UV-B辐射增强对棉花生长及光合作用的影响[J].中国生态农业学报,2017,25(5):708-719.
[37] 李俊,杨玉皎,王文丽,等.UV-B辐射增强对马铃薯叶片结构及光合参数的影响[J].生态学报,2017,37(16):5368-5381.
[38] MURCHIE E H,LAWSON T.Chlorophyll fluorescence analysis:A guide to good practice and understanding some new applications[J].Journal of experimental botany,2013,64(13):3983-3998.
[39] HERAUD P,BEARDALL J.Changes in chlorophyll fluorescence during exposure of Dunaliella tertiolecta to UV radiation indicate a dynamic interaction between damage and repair processes[J].Photosynthesis research,2000,63(2):123-134.
[40] 何炎红,郭连生,田有亮.白刺叶不同水分状况下光合速率及其叶绿素荧光特性的研究[J].西北植物学报,2005,25(11):2226-2233.
[41] 张美萍,王勇,韩榕,等.增强UV-B辐射对水稻叶绿素荧光参数的影响[J].山西师范大学学报(自然科学版),2014,28(1):66-70.
[42] 钟楚,陈宗瑜,王毅,等.UV-B辐射对植物影响的分子水平研究进展[J].生态学杂志,2009,28(1):129-137.
[43] 韩发,贲桂英,师生波.青藏高原不同海拔矮嵩草抗逆性的比较研究[J].生态学报,1998,18(6):654-659.
[44] 刘敏,李荣贵,范海,等.UV-B辐射对烟草光合色素和几种酶的影响[J].西北植物学报,2007,27(2):291-296.
[45] 周党卫,韩发,滕中华,等.UV-B辐射增强对植物光合作用的影响及植物的相关适应性研究[J].西北植物学报,2002,22(4):280-286.
[46] 李惠华,谢志南,赖瑞云,等.不同番木瓜品种植株感染环斑花叶病毒后PAL、PPO、POD活性的变化[J].亚热带植物科学,2007,36(4):1-4.
[47] SCHWALM K,ALONI R M,HELLER W,et al.Flavonoid?related regulation of auxin accumulation in Agrobacterium tumefaciens?induced plant tumors[J].Plant,2003,218:163-178.
[48] 齐学会,陈沁,刘媛媛,等.紫外光-B对大豆芽苗菜下胚轴酚类物质合成的影响[J].营养学报,2016,38(4):397-401.
[49] VIDOVIC'M,MORINA F,MILIC'S,et al.Ultraviolet?B component of sunlight stimulates photosynthesis and flavonoid accumulation in variegated Plectranthus coleoides leaves depending on background light[J].Plant,cell & environment,2015,38(5):968-979.
[50] 唐文婷,刘晓,房敏峰,等.傅里叶变换红外光谱法分析紫外线-B(UV-B)辐射对黄芩不同部位化学成分的影响[J].光谱学与光谱分析,2011,31(5):1220-1224.
[51] 董新純.UV胁迫下苦荞类黄酮代谢及其防御机制研究[D].泰安:山东农业大学,2006.
[52] BARTLEY G E,AVENA?BUSTILLOS R J,DU W X,et al.Transcriptional regulation of chlorogenic acid biosynthesis in carrot root slices exposed to UV?B light[J].Plant gene,2016,7:1-10.
[53] 李双明,孙蕊,骆浩,等.紫外辐射对东北红豆杉鲜叶中紫杉醇及三尖杉宁碱含量的影响[J].植物研究,2007,27(4):500-503.
[54] 史利平,季静,王罡,等.盐胁迫条件下玉米萜类合成相关基因的表达分析[J].中国生物工程杂志,2016,36(8):31-37.
[55] ZU Y G,PANG H H,YU J H,et al.Responses in the morphology,physiology and biochemistry of Taxus chinensis var.mairei grown under supplementary UV?B radiation[J].Journal of photochemistry & photobiology B:Biology,2010,98:152-158.
- 医院会计信息化背景下财务人员的内部培训研究
- 浅析新形势下的银行安全保卫工作
- 建筑电气设计中消防设计要点的相关研究
- 火电企业招标采购发展趋势及优化方法研究
- 京津冀矿业人才信息与企业技术需求交流平台构想
- 健康中国背景下医学院校师生健康素养水平现状调查研究
- 浅谈新乡贤助力乡村道德建设研究
- 校企双主体育人视域下的高职院校实践育人机制研究
- 黔西南“精神扶贫”工作开展的现状与不足
- 教学竞赛成果转化中存在的问题及解决途径
- 中职学生就业意向现状及提升策略研究
- 规范企业会计基础工作的重要性及措施探究
- 欠发达地区民间借贷的对策研究
- 探讨“营改增”对相关行业成本控制的作用
- 医院药房财务管理相关问题分析
- 大数据背景下基于财务报表的税收风险管理
- 企业财务管理中财务分析的作用研究
- 基于大数据时代下企业推进财务信息化的研究
- 试论管理会计在实际应用中的问题及对策
- 试论企业内控管理与财务风险防范
- 乡镇政府财务收支状况改善路径研究
- 试论全面预算管理下的企业内部控制
- 试论企业财务审计监督的问题与策略
- 分析我国行政事业单位财务管理中的问题和解决措施
- 新会计制度下财务管理的创新路径探索
- emanates
- emanating
- emanation
- emanatist
- emanator
- emanators
- emanatory
- emancipate
- emancipated
- emancipates
- emancipating
- emancipation
- emancipative
- emancipators
- emas
- embalm
- embalmed
- embalmer
- embalmers
- embalming
- embalmment
- embalmments
- embalms
- embankment
- embankments
- 驱遣出发
- 驱遣神灵
- 驱邪
- 驱邪逐妖
- 驱镳
- 驱除
- 驱除寒冷
- 驱除寒气
- 驱除机心
- 驱除清扫
- 驱除瘟神
- 驱除行人使避开
- 驱除遏止
- 驱除邪恶
- 驱除邪祟
- 驱除风寒
- 驱除驱散
- 驱除,铲除
- 驱雷掣电
- 驱雷策电
- 驱霆策电
- 驱霆策电驱雷掣电
- 驱风掣电
- 驱风掣电电掣风驰
- 驱马