短期饥饿对杂交石斑鱼(Epinephelus fuscogutatus♀×E. polyphekadion♂)幼鱼消化酶活性与血清生化指标的影响
邓文鑫 张健东 黄建盛 王忠良 潘传豪 施钢 汤保贵 陈刚

摘 要:为了解短期饥饿对杂交石斑鱼 (Epinephelus fuscogutatus♀×E. polyphhekadion♂) 幼鱼消化酶活性和血清生理生化指标的影响,对杂交石斑鱼幼鱼进行短期饥饿处理(0 d、5 d、10 d、15 d),分别为S0组、S1组、S2组和S3组,并以S0组为对照组。结果表明,随着饥饿时间的延长,各种消化酶活性呈下降趋势,淀粉酶活性呈先上升后下降趋势。血清碳水化合物、胆固醇、甘油三酯、总蛋白、白蛋白等生化指标在饥饿前期显著降低(P< 0.05),随后维持在相对稳定的水平。AST、ALT、ALP活性呈“下降-上升-下降”趋势。分析表明,在短期饥饿过程中,杂交石斑鱼幼鱼早期主要消耗碳水化合物和脂肪物质,后期主要以蛋白质代谢能量来维持生命活动,短期饥饿并没有对杂交石斑鱼造成不可逆转的肝脏损伤。
關键词:杂交石斑鱼(Epinephelus fuscogutatus♀×E. polyphhekadion♂);饥饿;消化酶活性;血清生理生化指标
自然环境下,由于季节更迭、环境变化或者是食物散布不均匀等影响,鱼类在实际成长中存在显著的食物缺口,进而导致饥饿的困境[1]。人工养殖的场景之中,鱼类也会因饵料不足、养殖密度过大等问题导致饥饿[2]。饥饿胁迫下,鱼类会依靠调控机体之中的酶活性、生化代谢等多种模式,降低耗能从而维持生命活动[3]。消化酶活性影响鱼类最终的消化与吸收效果,进一步决定鱼类的发育状况,因此关于消化酶活性的相关研究一直是鱼类消化生理的重要研究内容[4]。而研究鱼类的血液生理生化指标可直接反映鱼类健康状态、生理和营养状况[5]。
石斑鱼(Epinephelus spp.)隶属鲈形目(Perciformes),鲈亚目(Percoidei),鮨科(Serranidae),石斑鱼亚科(Epinephelinae)。其味道鲜美,营养丰富,为我国沿海地区广泛养殖鱼种[6]。本试验鱼为杂交石斑鱼,是褐点石斑鱼(E.fuscogutatus♀)和清水石斑鱼(E.polyphekadion♂)杂交子代,目前对杂交石斑鱼的研究较少,研究的内容包括盐度对受精卵孵化和卵黄囊仔鱼形态及活性的影响[7];子代幼鱼形态性状对体质量影响的通径分析[8];干扰素调节因子3(IRF3)基因的克隆及表达分析[9];生长激素、生长激素受体及雌激素受体的分子识别、生物信息学和表达谱分析[10]等。短期饥饿对杂交石斑鱼幼鱼消化酶活性的影响的研究尚未有学者涉足,所以论文计划分析该场景中的消化酶活性以及血液生化指标的具体变动规律,同时初步研究饥饿场景中的鱼体代谢指标、能源运用的次序与营养状态,为杂交石斑鱼养殖生产提供科学且有价值的参考资料。
1 材料和方法
1.1 试验材料
试验用鱼为取自广东海洋大学湛江海洋高新科技园养殖所培育的褐点石斑鱼(♀)×清水石斑鱼(♂)杂交子一代幼鱼,运回实验室后在50 cm×70 cm×60 cm的养殖桶内暂养一周。暂养期间,养殖用水为经24 h曝气的自然海区海水,盐度(27±1.0)‰,水温(28±1.0) ℃,溶氧质量浓度保持在6 mg/L以上,自然光照。每日于8:00、12:00、18:00三个时间点投喂配合饲料(“粤海牌”石斑鱼配合饲料4#,颗粒直径5 mm),每次达到饱食,投喂半个小时后通过虹吸清理残饵和粪便,每天换水1~2次,每次1/3~1/2,换水温差不超过1 ℃,保持水质清新。
1.2 试验设计
暂养结束后,选用200尾体表无伤、体格健壮、体长为(12.42±0.93) cm、体重为(52.23±11.17)g的杂交石斑鱼幼鱼,进行短期饥饿处理(0、5、10、15 d),分别为S0组、S1组、S2组和S3组,并以S0组为对照组,各个组别设置3个平行,单个平行涉及15尾幼鱼,实际数量为180尾。同时选择20尾鱼作为相应的连续饥饿备用。
1.3 样品的制备及测定
1.3.1 血样制备及测定 各个试验组别饥饿完成的情况下,针对多个组别各个平行,运用随机的方式选择5尾鱼,取样操作之前用 MS-222 进行麻醉操作。用 2.5 mL 注射器取用相应的血液1~2 mL,放入到离心管内在4 ℃环境下存储12 h,后续再置于4 000 r/min离心处理 10 min,取相应的上层血清运用深圳雷杜生命科技Chemray 800分析仪开展后续的指标测试。
1.3.2 酶液的制备及测定
针对麻醉取血处理之后的幼鱼,迅速解剖剥离获取肠胃及肝脏,剔除内容物及肠系膜后,用预冷的生理盐水冲净,迅速放入液氮中冷藏,待所有鱼取样完成后,按编号转入冰箱(-80 ℃)储存备用。从冰箱中取出待测样品,4 ℃下解冻,用剪刀剪成小块,加入10倍体积预冷生理盐水,在高速组织匀浆机中冰浴匀浆,匀浆液经2 500 r/ min的速率离心10 min后取上清液,并置于4 ℃冰箱中保存,进行酶活性检测。用试剂盒测试肝、肠、胃3 类组织的三类酶活性指标,并且用考马斯亮蓝染色法来确认其中具体的蛋白浓度指标。
蛋白酶活性:37 ℃状态下,实际取用的每mg组织蛋白,持续1 min分解获得相应的1 mg氨基酸,代表其拥有1个酶活单位(U);淀粉酶活性:37 ℃状态下,实际取用的每mg组织蛋白和底物之间产生作用30 min水解10 mg淀粉,代表其拥有1个酶活单位(U);脂肪酶活性:37 ℃状态下,实际取用的每mg组织蛋白在该反应系统之中和底物之间反应1 min,每消耗相应的1 μmol底物,代表其拥有1个酶活单位(U)。酶活性运用相应的比活性(每mg蛋白活性单位,U·mg-1)的方式进行表述。
1.4 数据处理
用SPSS19.0软件进行生物统计分析,采用单因素方差分析和Duncan检验法进行多重比较。结果用“平均值±标准差(Meant±SD) ”表示,P<0.01表示具有极显著性差异,P<0.05 表示具有显著性差异。
2 结果
2.1 短期饥饿对杂交石斑鱼幼鱼消化酶活性的影响
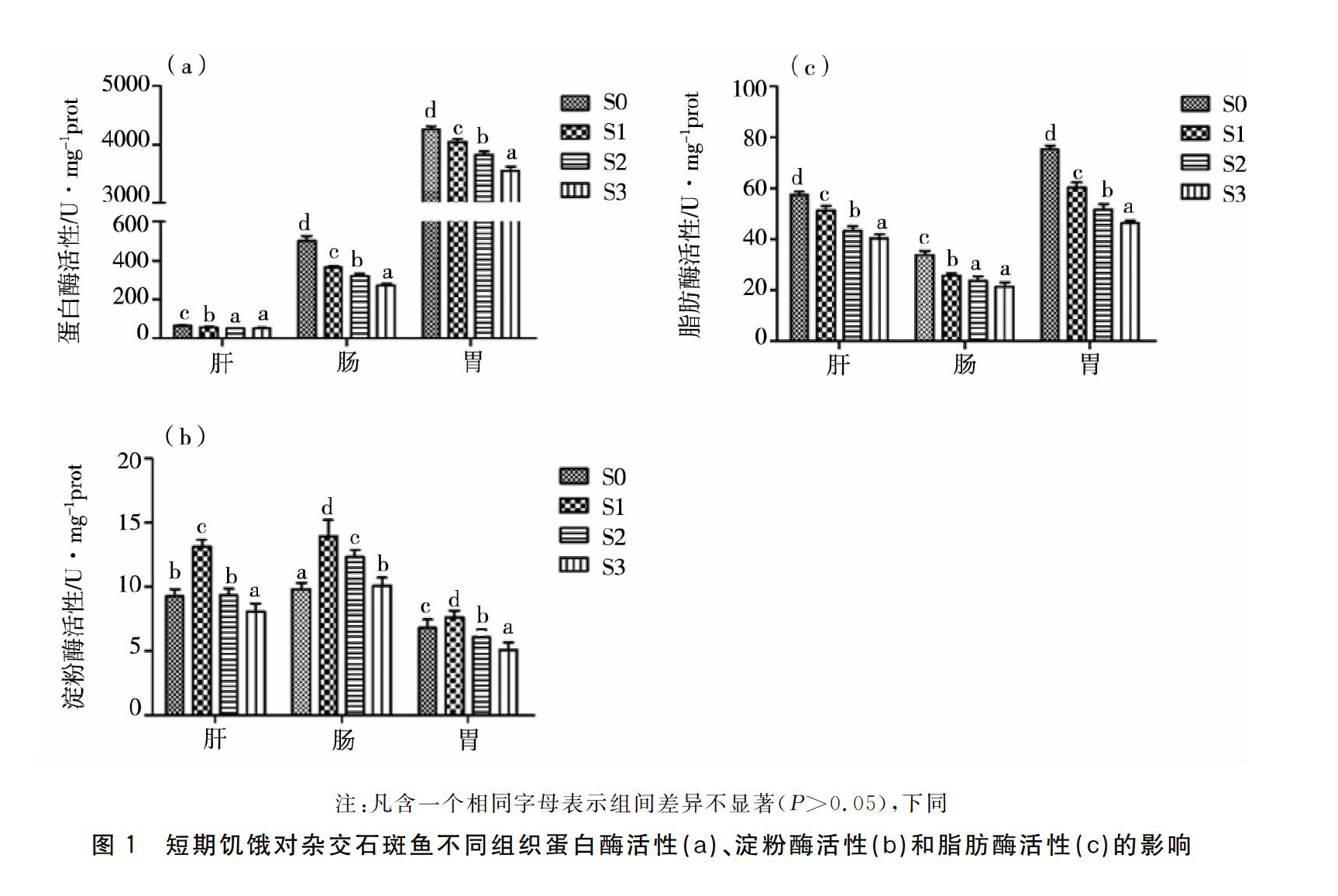
测定结果见图1。各饥饿组蛋白酶活性和脂肪酶活性变化明显,均随饥饿时间的延长持续降低,饥饿处理S0组的肠、肝、胃的蛋白酶活性均高于其它各组(P<0.05),肝脏中的蛋白酶变化最小。脂肪酶活性饥饿前期下降幅度显著(P<005),后期降幅缓慢(P<0.05)。肠、肝、胃三个组织的淀粉酶活性较低,整体随饥饿时间的延长呈现先上升后下降的趋势,肠淀粉酶活性S1组显著高于其它各组(P<0.05)。
2.2 短期饥饿对杂交石斑鱼幼鱼能量代谢指标的影响
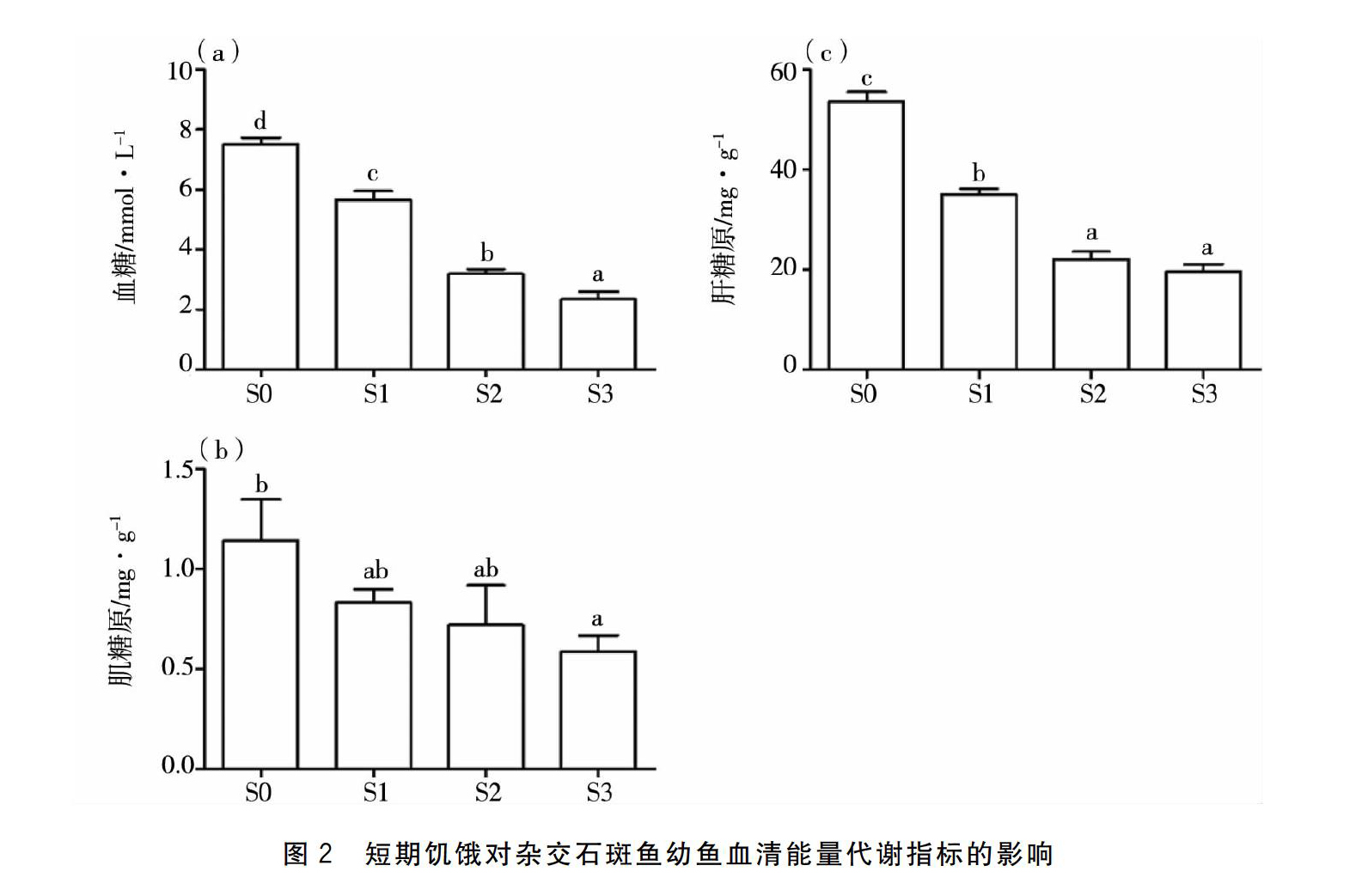
各饥饿组对杂交石斑鱼幼鱼能量代谢测定结果见图2。糖类物质代谢总体随饥饿时间的延长而持续下降,之后维持在相对稳定的水平。杂交石斑鱼的血糖对饥饿比较敏感,饥饿5 d后,血糖含量显著降低(P<0.05)。随饥饿时间的延长,血糖一直处于显著低于对照组的水平(P<005);肝糖原含量S2与S3组差异不显著(P>0.05);肌糖原含量S1与S2组差异不显著(P>0.05)。
2.3 短期饥饿对杂交石斑鱼幼鱼肝功能指标的影响
在饥饿胁迫下,杂交石斑鱼幼鱼肝功能指标的变化情况见图3。碱性磷酸酶(ALP)和谷丙转氨酶(ALT)活性随饥饿时间延长呈现先降低再升高后下降的趋势;谷草转氨酶(AST)则随饥饿时间延长而持续下降(P<0.05),S1组与S2组差异不显著(P>0.05)。
2.4 短期饥饿对杂交石斑鱼幼鱼血清脂代谢和蛋白质代谢指标的影响
饥饿胁迫对杂交石斑鱼幼鱼血清生化指标的变化情况见图4。胆固醇和白蛋白随饥饿时间延长而不断下降,S1与S2组间差异不明显(P>005);总蛋白和甘油三酯随饥饿时间延长下降幅度显著(P<0.05),呈现阶梯性下降。
3 讨论
3.1 短期饥饿对杂交石斑鱼幼鱼消化酶活性的变化分析
饥饿胁迫下的鱼类,依靠调控消化酶活性的方式来调动身体中的营养,进而适应环境的改变和维持机体的正常生理活动[1]。因此,消化酶活性的变化在一定程度上反应鱼类生长与环境条件之间的关联[11]。本试验中,杂交石斑鱼幼鱼的肝、肠和胃中3种消化酶(蛋白酶、脂肪酶、淀粉酶)活性均随饥饿时间的延长而逐渐下降,此结果与千年笛鲷幼鱼(Lutjanus sebae)[12]饥饿实验结果相一致。原因是在饥饿胁迫下,杂交石斑鱼幼鱼为了维持生命所需的各种基本生理需要,从而降低能量损耗。而淀粉酶整体呈现先上升后下降的趋势,分析可能为杂交石斑鱼幼鱼受到饥饿的胁迫,为了更好地吸收体内残留的淀粉和糖原而导致淀粉酶活性上升。蛋白酶活性变化明显,肠、肝、胃三个组织的蛋白酶活性对照组(饥饿处理0 d)始终高于其它各组,总体呈现下降的趋势。这与钱云霞13]的研究结果一致,与苏慧等[2]研究结果相反,这说明饥饿对不同鱼类蛋白酶活性的影响也不同。本试验中胃蛋白酶活性顯著高于肠和肝,肝蛋白酶活性最低; Das等[14]看来肝胰腺重点分泌蛋白酶原,所以活性相对较低乃至于不存在活性。本研究结果与此相符合,杂交石斑鱼蛋白酶活性胃最高,肠次之,肝脏最低,这说明可能胃是杂交石斑鱼幼鱼蛋白酶消化的主要部位。饥饿前期,脂肪酶活性下降显著;饥饿10 d后,杂交石斑鱼肠、肝、胃三个组织的脂肪酶活性基本趋于平缓,试验结果与Furné[15]和张怡波等[16]相一致,分析可能是杂交石斑鱼幼鱼为了适应饥饿胁迫以及配合其它种类的消化酶,对脂肪酶活性作出了调整,以便长时间适应饥饿胁迫环境并生存下去。
鱼类在受到饥饿胁迫时,由于只能利用消耗体内的残留物质和自身能源物质,为了适应饥饿环境,继续生存,需要通过调节自身各种消化酶活性来消耗体内贮藏的营养物质,以维持生命。本试验中,消化酶活性呈总体下降状态,分析原因有三种,一是在饥饿胁迫环境下,鱼类的消化系统没有接收到食物的机械刺激信号,所以消化酶的分泌会减少[1];二是饥饿胁迫下的鱼类,因没有受到视觉、嗅觉、味觉等感觉的刺激,中枢神经系统不分泌激素促使消化腺分泌[17];三是饥饿胁迫损伤了鱼类消化道组织结构,致使组织结构萎缩,消化功能衰退[18-19]。
3.2 短期饥饿对杂交石斑鱼幼鱼血清生理生化的变化分析
鱼类生化指标可判断适应状况与营养信息[20]。恒定的血糖浓度对维持鱼类正常生命活动有重要的作用。饥饿 5 d后血糖大幅降低,后续保持相对平稳的状态,和刀鲚(Coilia nasus)[21]的数据基本相同,主要原因为鱼体中有保持血糖固定的调节体系。在遭遇饥饿的情况下,鱼类无法通过食物获得相关碳水、脂质等营养,因此血糖重点依靠糖异生来维持稳定[22]。通常情况下,脂肪与糖原作为核心的储能,禁食场景中重点耗费两类物质[23],鱼体糖类运用糖原的模式位于肝脏与肌肉。鱼的饥饿场景之中,并不存在外部供养,饥饿最开始阶段耗费的能源源自糖原以及内脏周边所存储的脂肪[24]。
血清实际的甘油三酯以及总胆固醇指标,用于表述具体的利用脂质信息[25]。分析得出,短期饥饿胁迫下,杂交石斑鱼幼鱼血清总胆固醇和甘油三酯水平显著下降。该结果表明,饥饿胁迫下杂交石斑鱼可能持续利用体内存储的脂肪为机体提供能量,随饥饿时间延长,存储脂肪含量下降,可利用的甘油三酯含量降低,杂交石斑鱼难以通过脂肪代谢为机体提供充足能量。
鱼体中血液蛋白含量与新陈代谢、能量消耗以及免疫强弱有关。当受到外界胁迫时新陈代谢加强,能量消耗加快,导致血液中的蛋白含量下降,免疫能力也随之下降[26]。饥饿5 d,杂交石斑鱼幼鱼血清白蛋白下降显著,之后缓慢下降,组间差异不显著。白蛋白含量的减少可能会导致整体免疫水平的下降,总蛋白含量的相对稳定是鱼体自身调节的表现,也与实验有关,因为除饥饿外并无其它胁迫,鱼体不需要维持高的代谢和能量消耗[27-28]。
血清中 AST、ALT 和 ALP 的活性一般被用作判斷肝功能是否正常的指标[29],当组织发生损伤或病变时,特别是肝损伤,其活性会迅速升高。相关分析得出血清转氨酶活性下降与维生素B6不足存在密切联系,碱性磷酸酶的下降和锌缺乏存在密切联系[30]。关于鱼类饥饿的分析得出,饥饿造成哲罗鱼[31]和南方鲇[32]的这三种酶活显著降低,与本试验的研究结果一致,表明短期饥饿胁迫尚未造成杂交石斑鱼肝损伤。亦有和试验结果有所区别的分析,类似于饥饿对鲑鱼血浆AST指标并未产生影响[33];饥饿对鲇血清ALP指标并没有产生影响[34],代表多种鱼类所遭遇的影响有区别,原因或许是不同种类的鱼类实际蓄积的营养与承受饥饿的能力有所区别。
参考文献:
[1]
谢小军,邓利,张波.饥饿对鱼类生理生态学影响的研究进展[J].水生生物学报,1998(2):181-188.
[2] 苏慧,区又君,李加儿,等.卵形鲳鲹消化酶活力的研究Ⅵ饥饿对幼鱼存活和消化酶活力的影响[J].海洋渔业,2012,34(1):45-50.
[3] MCCUE M D.Starvation physiology:Reviewing the different strategies animals use to survive a common challenge[J].Comparative Biochemistry & Physiology Part A Molecular & Integrative Physiology,2010,156(1):1-18.
[4] 江丽华,朱爱意,苑淑宾.饥饿对褐菖鲉消化道指数及消化酶活力的影响[J].水产科学,2011,30(4):187-191.
[5] 林浩然.鱼类生理学[M].广州:广东高等教育出版社,1999:185-188.
[6] 孙颖.棕点石斑鱼(♀)×鞍带石斑鱼(♂)杂交F1代生长优势的转录组学研究[D].广州:中山大学,2016.
[7] 黄建盛,陈刚,张健东,等.盐度对杂交石斑鱼受精卵孵化和卵黄囊仔鱼形态及活力的影响[J].中国水产科学,2017,24(3):507-515.
[8] 黄建盛,张敬威,陈刚,等.褐点石斑鱼(♀)×清水石斑鱼(♂)杂交子代幼鱼形态性状对体质量影响的通径分析[J].广东海洋大学学报,2017,37(3):23-28.
[9] 卢晓颖,黄宝松,马骞,等.杂交石斑鱼干扰素调节因子3(IRF3)基因的克隆及表达分析[J].生物技术通报,2019,35(10):144-151.
[10] AMENYOGBE E.杂交石斑鱼(褐点石斑鱼♀×清水石斑鱼♂)生长激素、生长激素受体及雌激素受体的分子识别、生物信息学和表达谱分析[D].湛江:广东海洋大学,2019.
[11] PEDRO N D,DELGADO M J,GANCEDO B,et al.Changes in glucose,glycogen,thyroid activity and hypothalamic cate-chola mines in tench by starvation and refeeding [J].Journal of Comparative Physiology B:Biochemical,Systemic,and Environmental Physiology,2003,173(6):475—481.
[12] 区又君,刘泽伟.饥饿和再投喂对千年笛鲷幼鱼消化酶活性的影响[J].海洋学报(中文版),2007(1):86-91.
[13] 钱云霞.饥饿对养殖鲈蛋白酶活力的影响[J].水产科学,2002,(3):6-7.
[14] DAS K M,TRIPATHI S D.Studies on the digestive enzymes of grass carp,Ctenopharyngodon idella(Val.)[J].Aquaculture,1991,92(1):21-32.
[15] FURN M,GARGA-GALLEGO M,HIDALO M C,et al.Effect of starvation and refeeding ondigestive enzyme activities in sturgeon(Acipenser naccarii)and trout(Oncorhynchusmykiss)[J].Comparative Biochemistry and Physiology,2008,149(4):420-425.
[16] 张怡波,吕慧明,袁子,等.饥饿再投喂对黑鱾幼鱼消化酶活性与血液生理生化指标的影响[J].宁波大学学报(理工版),2019,32(5):12-16.
[17] 钱国英.不同驯食方式对鳜鱼胃肠道消化酶活性的影响[J].浙江农业大学学报,1998(2):99-102.
[18] EHRLICH K F,BLAXTER J H S,PEMBERTON R.Morphological and histological changes during the growth and starvation of herring and plaice larvae[J].Marine Biology,1976,35(2):105-118.
[19] SUN S M, SU Y L, YU H,et al.Starvation affects the intestinal microbiota structure and the expression of inflammatory-related genes of the juvenile blunt snout bream,Megalobrama amblycephala[J].Aquaclture,2020,517:734764.
[20] 胡麟,吳天星.饥饿对鱼类生理生化的影响[J].水利渔业,2007,27(1):7-9.
[21] 金鑫,徐钢春,杜富宽,等.饥饿胁迫对刀鲚形体、体成分及血液生化指标的影响[J].动物学杂志,2014,49(6):897-903.
[22] GILLIS T E,BALLANTYNE J S.The effects of starvation onplasma free a mino acid and glucose concentrations in lake sturgeon[J].Journal of Fish Biology,1996,49(6):1306-1316.
[23] 杜震宇,刘永坚,田丽霞,等.饥饿对于鲈肌肉、肝脏和血清主要生化组成的影响[J].动物学报,2003,49(4):458-465.
[24] 程超,施光美.饥饿对鲫鱼血液生理生化指标和流变学性质的影响[J].中国农学通报,2008,24(1):516—519.
[25] 孙红梅.饥饿对黄颡鱼血液指标及免疫机能的影响[D].长春:吉林农业大学,2004.
[26] 封功能,杨文平,王爱民,等.饥饿胁迫对鲤形体、体成分及血液生理指标的影响[J].上海海洋大学学报,2011,20(6):814-819.
[27] 许源剑,孙敏.环境胁迫对鱼类血液影响的研究进展[J].水产科技,2010(3):27-31.
[28] 桂远明,吴垠,祝国芹,等.几种养殖鱼类越冬生理生化指标的变化Ⅰ─—血液指标及代谢率[J].大连水产学院学报,1994(3):15-27.
[29] GHOLIZDEH Z T B,BANAEE M,JOURDEHI Y A,et al.Effects of selenium (Sel-Plex) supplement on blood biochemical parameters of juvenile Siberian sturgeon (Acipenser baerii) [J].Iranian Journal of Fisheries Sciences.2018,17(2):300-312.
[30] WANER T,NYSKA A.The toxicological significance of decreased activities of blood alanine and aspartate a minotransferase [J].Veterinary Research Communications,1991,15(1):73-78.
[31] 杨成辉,蔡勋,刘霞,等.饥饿和再投喂对哲罗鱼幼鱼血液生理生化指标的影响[J].淡水渔业,2009,39(1):36-40.
[32] 陈晓耘.饥饿对南方鲶幼鱼血液的影响[J].西南农业大学学报,2000,22(2):167-169.
[33] 罗波,冯健,蒋步国,等.饥饿对太平洋鲑生长、机体组成及血浆相关生化指标变化研究[J].水生生物学报,2010,34(3):541-546.
[34] 乔志刚,张建平,牛景彦,等.饥饿和再投喂对鲇血液生理生化指标的影响[J].水生生物学报,2008,32(5):631-635.
Effects of short-term starvation on digestive enzyme activities and serum biochemical indexes of juvenile hybrid grouper (Epinephelus fuscogutatus♀×E. polyphekadion♂)
DENG Wenxin1, ZHANG Jiandong1,2,3, HUANG Jiansheng1,2,3, WANG Zhongliang1,2,3,PAN Chuanhao1, SHI Gang1, TANG Baogui1,2,3, CHEN Gang1,2,3
(1.Fishery College, Guangdong Ocean University, Zhanjiang 524088, China; 2.Southern Marine Science and Engineering Guangdong Laboratory (Zhanjiang), Zhanjiang 524025, China;3. Guangdong Provincial Key Laboratory of Pathogenic Biology and Epidemiology for Aquatic Economic Animals, Zhanjiang 524088, China)
Abstract:This experiment was conducted to study the effects of short-term starvation on digestive enzyme activities and serum physiological and biochemical indices of juvenile hybrid grouper (Epinephelus fuscogutatus♀×E. polyphekadion♂).Juvenile hybrid groupers were starved for a short time (0d,5d,10d,and 15d),the fish were grouped into two namely,control and experimental groups,with replicates of 3 per group and 15 fish per replicate (S0 as control,S1,S2 and S3 as experimental groups respectively).The digestive enzyme activities and serum indices of juvenile hybrid groupers were determined using S0 group as a control group.The results showed that digestive enzyme activities decreased with the prolonging of starvation time,and the activities of amylase increased first and then decreased.Serum carbohydrate,cholesterol,triglyceride,total protein,albumin,and other biochemical indices were significantly decreased in the early starvation period (P<0.05) and then maintained at a relatively stable level.AST,ALT,and ALP activities showed a serrated step decrease.According to the analysis,in the process of short-term starvation,juvenile hybrid grouper mainly consumed carbohydrate and fatty substances in the early stage and metabolized energy based on protein in the later stage to maintain life activities,and short-term starvation did not cause irreversible liver damage to hybrid grouper.
Key words:hybrid grouper;starvation;digestive enzyme activites;serum biochemical indices
(收稿日期:2021-01-26)

