渔用配合饲料中左旋肉碱含量的测定
马瑞欣 李同庆 张志华
摘要:建立了亲水作用色谱-串联质谱法(HILIC-MS/MS)检测渔用配合饲料中左旋肉碱含量的方法。样品用超纯水超声提取提取液稀释后经 HILIC色谱柱分离以乙腈和乙酸铵(含0.15%甲酸)溶液为流动相梯度洗脱三重四级杆串联质谱多反应监测(MRM)方式扫描外标法定量。结果表明左旋肉碱在0.2~100 ng/mL范围线性良好(r>0.999);检出限0.5 μg/kg定量限1.5 μg/kg。在20、50和100 mg/kg添加水平下回收率为75.2%~111%相对标准偏差RSD为3.4%~9.9%(n=6)。该方法前处理简单、快速定性定量准确适合于渔用配合饲料中左旋肉碱的准确定性定量。
关键词:亲水作用色谱-串联质谱;左旋肉碱;渔用配合饲料
左旋肉碱(L-carnitine)是一种促使脂肪转化为能量的类氨基酸广泛分布于自然界是生物体的基本成分其中肉类和乳制品中左旋肉碱的含量最高而蔬菜和水果类左旋肉碱的含量最低[1-2]。水产动物自身能在肝脏和组织中合成左旋肉碱但在幼体时期体内合成的肉碱远远不能满足水产动物快速生长的需要此时其饲料中必须添加一定量的左旋肉碱[3]。近年来国内外就左旋肉碱对水产动物生长性能的研究表明:左旋肉碱能明显提高鱼类增长速度提高饲料蛋白质的效率降低饲料系数提高鱼肉品质提高养殖成活率和繁殖率[3-5]。
文献中有关左旋肉碱的检测方法有很多[6]研究样品多数为血浆[7-8]、乳制品[9-11]、尿液[12]、食品[1-2,13]、保健品[14-15]、减肥产品[16-17]等, 未见到有关饲料中左旋肉碱的检测方法报道。笔者建立了亲水作用色谱-串联质谱法(HILIC-MS/MS)检测渔用配合饲料中左旋肉碱含量的方法该方法通过液相色谱柱分离质谱选择离子的方法进行定性和定量减少了干扰可快速准确地检测渔用配合饲料中左旋肉碱的含量。
1实验部分
1.1仪器、试剂与材料
LC-20AD液相色谱(日本岛津);QTRAP 4500三重四极杆质谱仪(美国AB SCIEX );十万分之一电子天平(赛多利斯CPA225D);千分之一电子天平(赛多利斯CP323S)涡旋振荡器(IKAMS3-digital);高速离心机(安徽科大创新股份有限公HC-3518);中草藥粉碎机(天津泰斯特FW135)。
左旋肉碱对照品(北京索莱宝科技有限公司纯度≥98%);实验所用超纯水由Milli-Q超纯水机制备;正己烷(色谱纯Honeywell)。
一次性针式滤器(Pall25 mm0.22 μm)。
1.2实验条件
1.2.1色谱条件色谱柱GOLDHILIC(50 mm×2.1 mm×1.9 umThermoscientific公司 )流动相5 mmol/L乙酸铵(含V/V 0.15%甲酸)(A)和乙腈(B);梯度洗脱:0~1 min 98% B; 1 min~3 min 98% B~10% B;3 min~3.1 min 10% B~98% B;3.1~6 min 98% B。流速0.5 mL/min;柱温40 ℃;进样体积2 μL。
1.2.2质谱条件电离模式:ESI+多反应离子检测(MRM)模式;喷雾电压5 500 V;气帘气40 PSi; 碰撞气Medium;离子源温度550 ℃;雾化气(GS1)55 PSi; 辅助加热气(GS2)55 PSi;去簇电压60 V;碰撞池出口电压(CXP)6.0 V。左旋肉碱母离子为m/z 162.0;定性离子对为m/z 162.0>85.0碰撞能26 eV;定量离子对为m/z 162.0>103.0碰撞能22 eV。
1.3样品前处理
饲料经粉碎机粉碎后称取1.000 g于50 mL离心试管中加入10 mL超纯水涡旋振荡2 min超声提取20 min4 000 r/min离心10 min ,上清液倒入25 mL比色管中;再加入10 mL超纯水重复提取一次合并上清液用超纯水定容至25 mL。取3 mL上清液于10 mL离心试管中加入3 mL正己烷涡旋30 s10 000 r/min离心10 min去掉上层正己烷层取下层清液过0.22 μm滤膜后用超纯水稀释200倍供上机测试。
2结果与讨论
2.1色谱柱的选择
实验中考察了左旋肉碱在Hypersil gold C18Accucore aQ, ZORBAX RX-C8和Kinetex F5Hypersil GOLD HILIC色谱柱上的保留和分离能力。结果表明左旋肉碱在Hypersil gold C18Accucore aQ和ZORBAX RX-C8上不保留在死时间出峰。在Kinetex F5上保留较差出峰时间0.94 min且峰形极差;在Hypersil GOLD HILIC色谱柱上能够得到峰形尖锐的色谱峰。这是因为左旋肉碱为小分子极性化合物在弱极性C18和 C8填料的反相色谱柱上不保留。亲水作用色谱(HILIC)采用极性固定相有机溶剂-水相缓冲液为流动相能有效地保留反相色谱中保留不完全或不保留的强极性样品并具有良好的分离效果[18]。
2.2流动相的选择
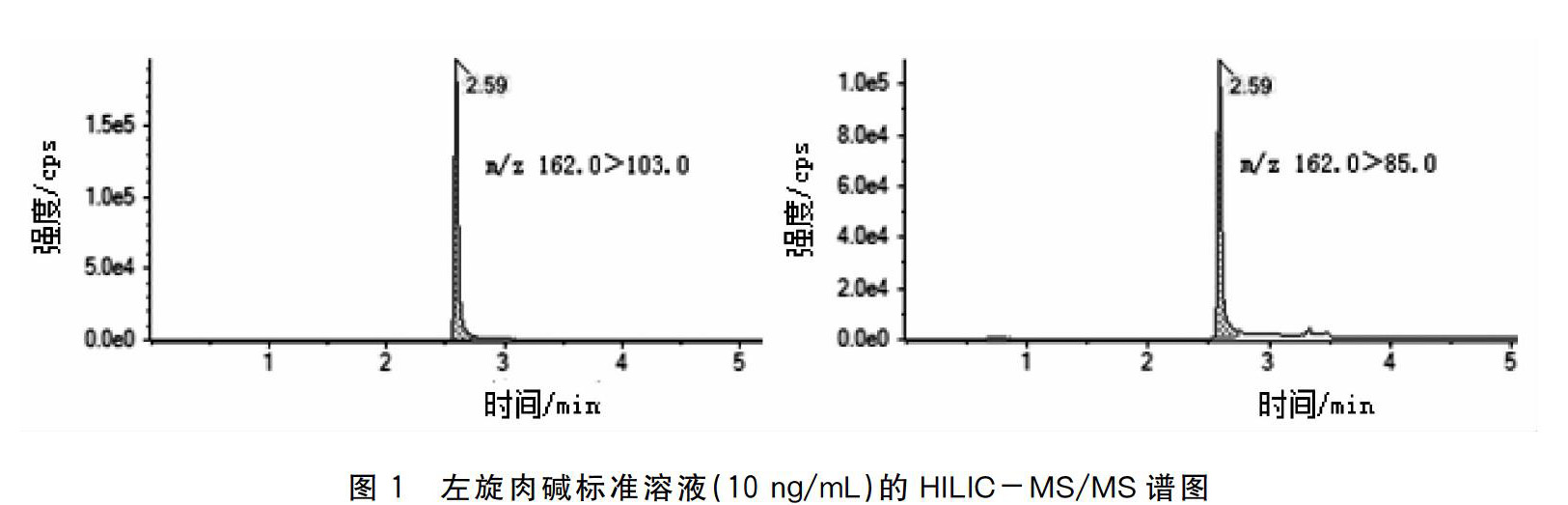
实验中考察了甲醇和水、乙腈和水、乙腈和乙酸铵溶液(含V/V0.15%甲酸)作为流动相时左旋肉碱在Hypersil GOLD HILIC色谱柱的洗脱分离情况。结果表明:使用甲醇和水作为流动相洗脱时保留时间0.27 min峰形扩散严重响应很低;使用乙腈和和水作为流动相洗脱时保留时间合理但峰形拖尾严重;使用乙腈和乙酸铵(含V/V0.15%甲酸)溶液作为流动相洗脱时峰形尖锐响应明显提高对称性增强。这是由于对HILIC色谱甲醇的洗脱能力强于乙腈且甲醇增加了分离的不确定性和较差的峰形[18]。因此在HILIC中一般采用乙腈-水作为流动相。水相中加入一定比例的乙酸铵和甲酸可以提高离子化效率改善峰形。故选用乙腈和乙酸铵(含V/V0.15%甲酸)溶液作为流动相进行梯度洗脱。标准溶液的HILIC-MS/MS谱图见图1。
2.3质谱条件的确定
将1.0 μg/mL的标准溶液通过蠕动泵注入质谱仪通过优化去簇电压、碰撞能等参数确定定性离子对为m/z 162.0>85.0和m/z 162.0>103.0m/z 162.0>103.0为定量离子对。
2.4样品前处理条件的确定
左旋肉碱易溶于水所以本实验中采用水作为提取剂。考察水、0.2 mol/L盐酸溶液、0.2%乙酸溶液的提取结果发现测试结果无差别所以采用超纯水作为提取剂直接提取。
由于左旋肉碱广泛分布于自然界是生物体的基本成分。它在植物性饲料干物质中的含量要低于其在动物性饲料中的含量但都在几~几百mg/kg数量级范围[4]。由于质谱的灵敏度高为防止对质谱造成污染同时为降低基质效应和保证测试液落在线性范围内对提取液进行了200倍稀释后上机测试。
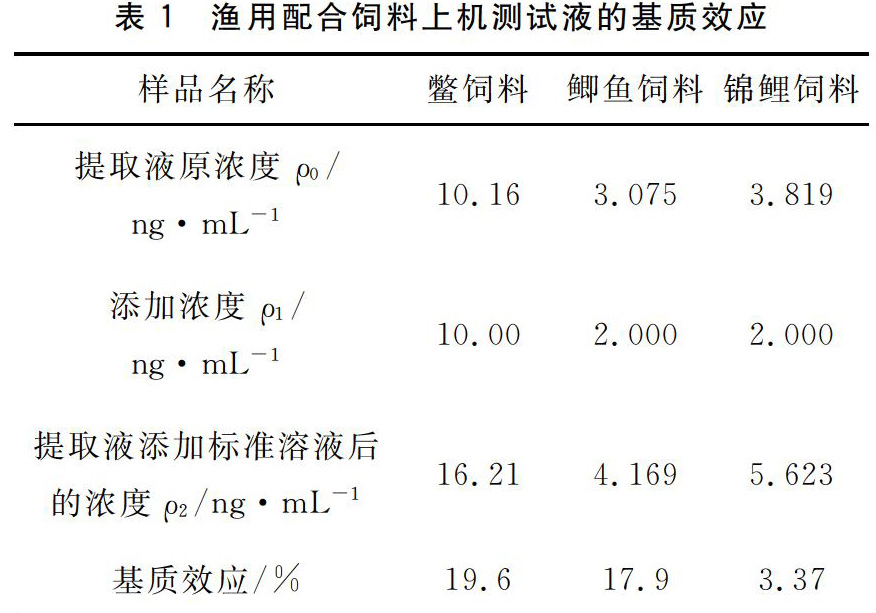
2.5基质效应
本方法为外标法采用了稀释和减小进样量的方法来减小基质效应。由于左旋肉碱天然存在无法获得饲料空白样品。本文取适量已知含量的稀释前提取液添加一定量(体积尽可能小)的标准溶液和适量超纯水使得最终得到的溶液中提取液稀释200倍且添加浓度和原浓度保持基本相当。通过上机测试由标准曲线给出提取液添加标准溶液前后左旋肉碱的含量。通过比较添加标准溶液前后左旋肉碱的含量变化来考察基质效应。实验中利用三种饲料考察了基质效应结果见表1。基质效应=1-[ρ2/(ρ0+ρ1)] ×100%。基质抑制呈现鳖饲料>鲫鱼饲料>锦鲤饲料的现象与饲料中动物源性成分的含量一致。由于基质抑制<20%且回收率>75%见表2故本测定方法忽略基质效应。
2.6标准溶液的配制、标准曲线和检出限
用十万分之一的电子天平称取适量标准品用超纯水溶解并定容配制成100 μg/mL的储备液用超纯水逐级稀释成0.2、0.5、1.0、2.0、5.0、10、20、50、100 ng/mL的标准系列按浓度由低到高进LC-MS/MS测试以左旋肉碱定量离子对m/z 162.0>103.0的峰面积y对质量浓度x做标准曲线得到线性方程y=6.469 26 x 104x+35 475.1相关系数r=0.999 73。根据鳖饲料、鲫鱼饲料和锦鲤饲料中左旋肉碱的信噪比得出检出限为0.5 μg/kg定量限为1.5 μg/kg。由于不同试样中所含的左旋肉碱含量水平有差异如果测定结果超出了本方法的线性范围需对样品溶液稀释后再测定。
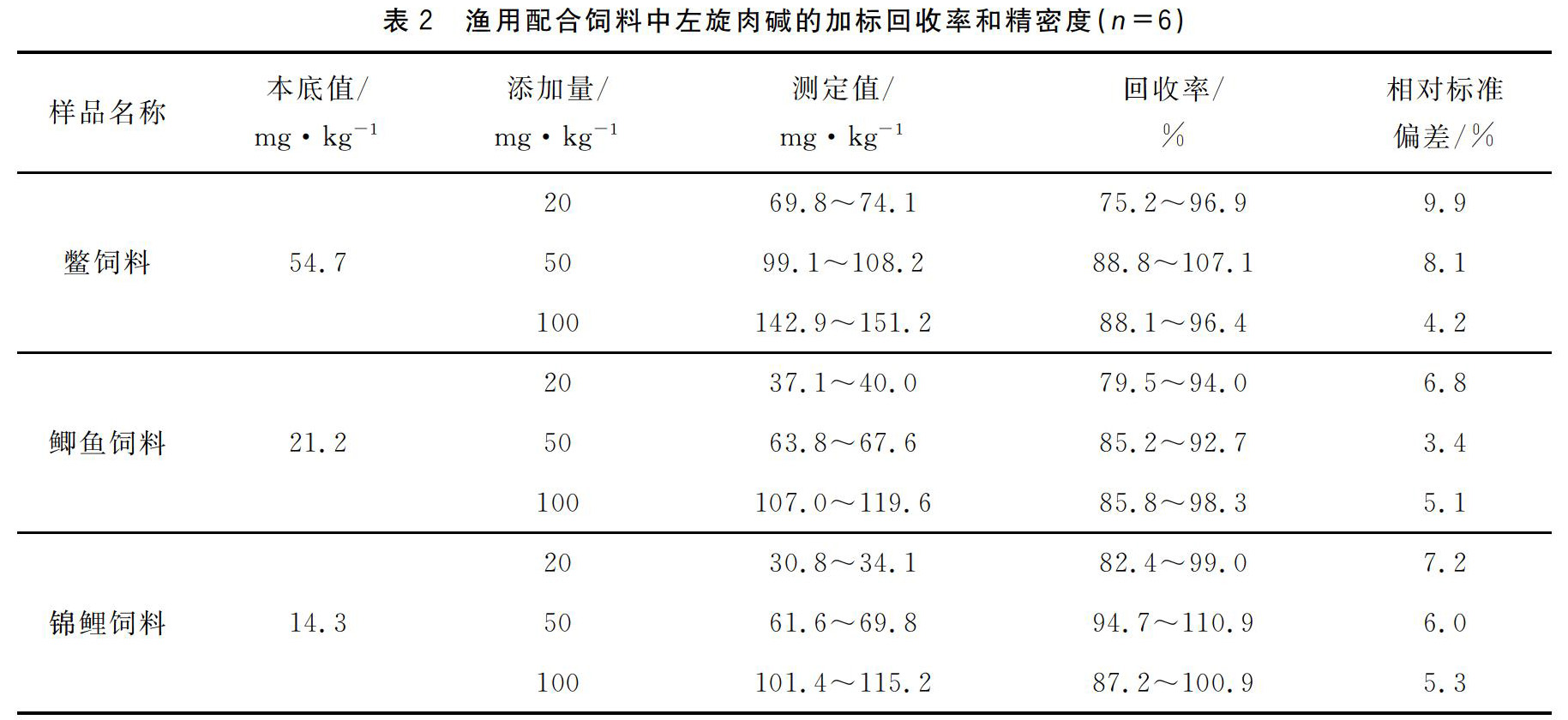
2.7精密度和回收率
称取鳖饲料、鲫鱼饲料、锦鲤饲料三种饲料样品各12份6份做本底6份做标准溶液添加。按照本文建立的方法进行前处理和测定考查方法的回收率和精密度结果见表2。
2.8实际样品的测定
用本文建立的实验方法对客户的6份样品进行测定测定值分别为562、51、168、360、466、288 mg/kg与客户预期值一致。实际样品的色谱图见图2。3结论
本研究建立了亲水作用色谱-串联质谱法测定渔用配合饲料中左旋肉碱的分析方法。该方法前处理简单精密度高、定性定量准确适合于渔用配合饲料中左旋肉碱的准确定性定量。
参考文献:
[1] Demarquoy J, Georges B, Rigault C,et al. Radioisotopic determination of L-carnitine content in foods commonly eaten in Western countries[J].Food Chemistry,2004,86(1):137-142.
[2] Knüttel- Gustavsen Seline, Harmeyer Johein. The determination of L-carnitine in several food samples[J]. Food Chemistry,2007, 105(2):793-804.
[3] 李海軍,邵庆均,聂月美.L-肉碱在水产动物中的应用[J].饲料工业,2006,27(10):56-58.
[4] 胡梦红,王有基.新型水产饲料添加剂-左旋肉碱[J].现代渔业信息,2006,21(6):18-20.
[5] 阿迪力江·阿布都热合曼.左旋肉碱在畜牧业生产中的应用研究[J].甘肃畜牧兽医, 2015,45(11):39-40.
[6] 马兴,高云,崔颖,等.左旋肉碱检测方法研究进展[J].食品安全质量检测学报,2015,6(2):399-404.
[7] 丁峰,朱秋毓,顾勇,等.高效液相色谱法测定血浆游离肉碱[J].药物分析杂志2005, 250(10):1195-1197.
[8] 唐笑,黄凯,杨淇龄,等.高效液相色谱法检测罗非鱼血浆中L-肉碱的方法研究[J].水产及科学,2018,37(3):354-360.
[9] 中华人民共和国国家卫生和计划生育委员会.婴幼儿食品和乳品中左旋肉碱的测定:GB 29989-2013[S].北京,中国标准出版社,2013:1-3.
[10] 唐吉旺,袁列江,肖泳,等.高效液相亲水作用色谱-串联质谱法同时测定婴幼儿配方乳粉中胆碱和左旋肉碱的含量[J].理化检验-化学分册,2019,55(6):621-625.
[11] 刘艳明,薛霞,刘国强,等.亲水作用色谱-串联质谱法测定乳及乳制品中左旋肉碱[J].色谱,2015,33(9):943-945.
[12] Laurence Vernez, Gérard Hopfgartner, Markus Wenk, et al.Determination of carnitine and acylcarnitines in urine byhigh- performance liquid chromatography– electrospray ionization ion trap tandem mass spectrometry[J]. Journal of Chromatography A,2003,984:203-213.
[13]? Laura Sánchez- Hernández, María Castro- Puyana, Carmen García- Ruiz, et al. Determination of L- and D- carnitine in dietary food supplements using capillary electrophoresis–tandem mass spectrometry[J].Food Chemistry,2010,120:921- 928.
[14] 莫紫梅,韦春梦.高效液相色谱法测定保健食品中左旋肉碱含量[J].食品安全质量检测学报,2016,7(5):2093-2096.
[15] 董军,陈成,勇艳华,等.亲水作用色譜法测定保健食品中的左旋肉碱[J].食品工业, 2013,34(9):191-193 .
[16] 龚尚于,刘明,朱辰瑶,等.高灵敏化学发光法检测减肥药中左旋肉碱的含量[J].中国卫生检验杂志,2015,25(11):1685-1688.
[17] 陈军,钟新林,余彦海.离子色谱法测定减肥食品中左旋肉碱[J].理化检验-化学分册, 2013(1):6-10.
[18] 王媛,顾惠新,路鑫,等.以亲水作用色谱为核心的液相色谱联用技术及其应用研究[J].色谱,2008,26(6): 649-657.
Abstract:An analytical method was developed for the determination of L-carnitine in fish formula feed by using hydrophilic interaction chromatography-tandem mass spectrometry (HILIC-MS/MS). The samples were extracted with ultrapure water by ultrasonic. The separation of L-carnitine was carried out on a Hypersil GOLD HILIC column using ammonium acetate (0.15% formic acid) and acetonitrile as mobile phases. The quantification analysis of the target compound was performed? under multiple reaction monitoring (MRM) mode by external standard method. A good linear relationship was obtained between the peak area and concentration of L-carnitine? in the range of 0.2~100 ng/mL with the correlation coefficient more than 0.999. The limit of detection (LOD)was 0.5 μg/kg and the limit of? quantification (LOQ)? was 1.5 μg/kg.? At spiked levels of 20,50 and 100 mg/kg, the? recoveries ranged from 75.2% to 111%, and the relative standard deviation ranged from 3.4% to 9.9%.The sample preparation was simple and rapid, and the results? were accurate. The developed? method is suitable for the determination of L-carnitine in in fish formula feed.
Key words:hydrophilic liquid chromatography-tandem mass spectrometry (HILIC-MS/MS); L-carnitine; fish formula feed
(收稿日期:2020-04-26)

