“酸、碱、盐反应”的多角度教学
王文娅
[摘要]初中化学中,“应用广泛的酸、碱、盐”是学生化学学习上的一个分水岭,是元素化合物知识中最后一项学习内容,容量较大,涉及面较广。文章从简化图形、物质分类以及微观本质的角度来归纳酸、碱、盐之间的反应,由表及里,层层深入,帮助学生记忆和理解酸、碱、盐反应的本质。
[关键词]酸?碱、盐;物质分类;多角度
[中图分类号]G633.8? [文献标识码]A? [文章编号]1674-6058(2020)02-0069-02
初中化学中,酸、碱、盐知识的学习位于所有元素化合物知识的最后,它建立在化学概念、基本理论及元素化合物知识基本学完的基础之上,是对整个初中化学知识的整合。通过对酸、碱、盐性质的学习,学生基本能总结出学习无机化学的规律。学好酸、碱、盐,对学生学习化学,尤其是进人高中后学好化学起着重要的作用。
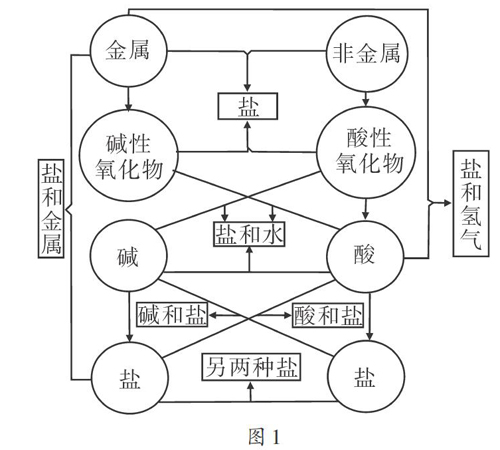
酸、碱、盐的教学中,酸、碱的通性和盐的化学性质是比较重要的知识点。教师往往会将这些性质总结为“8圈图”(如图1)让学生记忆。它虽然很好地概括了酸、碱的通性以及盐的化学性质,但由于其结构较为复杂、识记量较大,常常导致学生知识点混淆、记忆出错。例如,学生经常说不全酸(或碱)能与哪些物质发生反应;认为碱能与金属发生置换反应;等等。如何帮助学生更清晰地记忆并且灵活应用这些知识,是教学中教师需要解决的问题。
一、从简化图形的角度记忆酸、碱、盐之间的反应
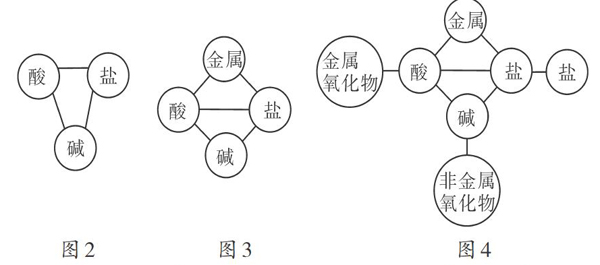
酸、碱的通性和盐的化学性质中,酸、碱与指示剂的反应较为简单,碱与非金属的反应在初中阶段不学,可以将它们暂时剔除出“8圈图”。在剩余性质中,酸、碱、盐之间能相互发生反应,由此构建出“酸、碱、盐之间相互反应”的主体三角(如图2);酸、盐均能与金属反应,由此构建出第二个三角(如图3);酸还能与金属氧化物反应,碱还能与非金属氧化物反应,盐还能与另一种盐反应,由此,在“酸、碱、盐”主体三角的顶点各延伸出一根“触角”,形成一个较为完整的酸、碱、盐反应的知识框架(如图4)。
将“8圈图”简化后,识记量减少了。教师在教学时边讲解边构建该知识框架,有助于学生在理解的基础上记忆酸、堿、盐之间的反应。但是该知识框架所呈现的知识点毕竟是不完整的,在学习酸、碱的通性时系统性不强,故在教学过程中仍需要对知识漏洞进行补充和完善。这一目标可以从学生已掌握的物质分类的角度去完成。
二、从物质分类的角度归纳酸、碱、盐之间的反应
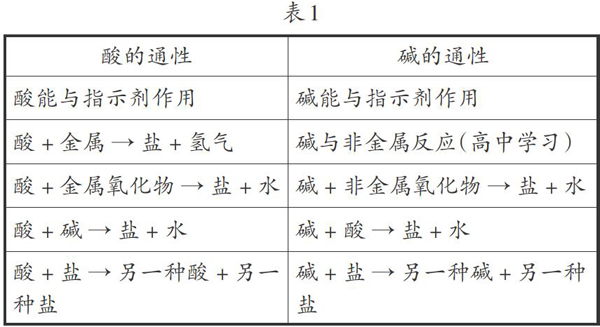
上教版教材中,“应用广泛的酸、碱、盐”位于第七章。学生在学习酸、碱、盐内容之前,对身边的化学物质(空气、水、金属矿物等元素化合物)已经有了初步的了解,对物质的分类也有了一定程度的认识。在此基础之上学习酸、碱、盐之间的反应,可以从物质分类的角度进行归纳(见表1)。
从表1中可以看出,酸的通性与碱的通性非常类似,能与它们反应的物质从物质分类的角度看,分别是单质、氧化物、碱(酸)、盐。在学习酸、碱、盐的性质之前,学生对于物质类别已经能非常熟练地掌握,如纯净物分为单质和化合物,化合物分为氧化物、酸、碱、盐等。因此让学生按照物质类别去记忆能与酸(或碱)反应的物质,不容易遗漏(见表2)。
从表2中可以看出,能与酸反应的是金属单质、金属氧化物、碱和盐,都含有金属元素;能与碱反应的是非金属单质、非金属氧化物、酸和盐,都含有(或能与水反应生成)酸根离子。为什么会有这样的规律呢?根据表1很容易发现,酸、碱的通性是所有的反应最终都能生成盐,而盐从结构上看都能电离产生金属离子和酸根离子。酸中本身含有酸根,所以与酸反应的物质要含有金属元素,最终才能生成盐;碱中本身含有金属离子,所以与碱反应的物质都要含有酸根离子(或能生成酸根离子),最终才能生成盐。在教学中,将酸的通性和碱的通性按照物质类别一对比,学生就不会再发生“碱能与金属发生置换反应”这样的错误了。
在学习酸、碱、盐的知识之前,学生除了能从宏观上初步认识身边化学物质的性质外,还能从微观的角度了解化学物质的结构和化学变化的奥秘。在上教版教材第三章和第六章的学习中,学生已经掌握“物质是由微粒构成的”“某些物质在溶液中是以离子形式存在的”等知识,从微观角度认识酸、碱、盐的知识基础已经具备。因此,可以利用学生已掌握的微观知识来层层深入地学习酸、碱、盐知识。
三、从微观本质的角度理解酸、碱、盐之间的反应
在酸、碱、盐溶液中,溶质都是以离子的形式分散在水中的,酸、碱、盐之间的反应,实质上就是离子之间的反应,离子的性质决定了物质的性质。从离子反应的角度去分析总结是学习酸、碱、盐的根本。
酸、碱、盐在溶液中发生复分解反应的微观实质是,溶液中某些离子发生反应生成了沉淀、气体或水,溶液中这些离子的数目在不断减少。由此,总结出初中阶段常用的会生成沉淀、水或气体的离子对,包括①生成水的离子对:H+和OH-;②生成气体的离子对:H+和CO32-,NH4+和OH-;③生成沉淀的离子对:Ag+和Cl-,Ba2+和SO42-,Ca2+和CO32-,Ba2+和CO32-,Ag+和CO32-,Fe3+和OH-,Cu2+和OH-,Mg2+和OH-;等等。
根据反应离子对就能发现,酸溶液中存在H+,它能与OH-、CO32-反应,所以酸能与碱、碳酸盐反应;碱溶液中存在OH-,它能与H+、NH4+反应,还能与Fe3+、Cu2+等金属离子反应,所以碱能与酸、某些盐反应。这一知识从本质上解释了酸、碱具有通性的原因,同时对酸、碱、盐反应的记忆及理解有很好的辅助作用。
掌握了复分解反应的微观实质,还能进一步利用该实质解决酸、碱、盐的检验、除杂等问题。
1.利用离子对的知识解决物质检验的问题
初中阶段需要检验的离子一般包括CO32-、SO42-、Cl-、NH4+等,学生只需掌握上述离子对就能解决这些离子的检验问题。CO32-遇到H+就会冒气泡,产生CO2气体,所以检验CO32-需要使用含有H+的试剂(即酸溶液),产生的气体再用澄清石灰水去检验。换个角度思考,要檢验溶液中是否存在大量H+,也可以向待测溶液中加入含有CO32-的物质,观察是否有气泡冒出。同样的,检验SO42-需要使用含有Ba2+的溶液,但因为Ba2+与CO32-也能生成沉淀,所以还要使用稀硝酸做进一步检验;检验Cl-需要使用含有Ag+的溶液;检验NH4+需要使用含有OH-的溶液,然后再检验产生的氨气。利用这样的方法解决离子检验问题,记忆对象只有上述离子对,减少了记忆量,减轻了学生的学习负担。
同时,离子对中还暗藏着反应现象,如生成气体即“冒气泡”,生成沉淀即“产生浑浊”,生成水即“无明显现象”。利用这些离子对的反应现象解决区分物质的题目既简便又准确。
2.利用离子对的知识解决酸、碱、盐除杂问题
关于酸、碱、盐的除杂问题,一般的思路是将杂质离子转变为沉淀、气体或水即可除去。根据反应离子对,再依据“换啥给啥,除啥对啥”的原则,就能解决除杂问题。
例如,除去NaCl中的少量Na2CO3,从离子角度看,就是要除去CO32-,换上Cl-。根据“除啥对啥”,除去CO32-可以对应H+生成气体(或对应Ca2+生成沉淀),再根据“换啥给啥”,还需要提供Cl-。两者一结合,所选择的试剂可以是HCl溶液或CaCl2溶液。
综上可知,酸、碱、盐反应是初中化学教学的重中之重,是初中生学习化学的一个难点,也是教师教学的一个关卡。化学教师在教学过程中只有不断地总结创新,才能让学生在减负的同时由表及里、层层深入地掌握酸、碱、盐反应的本质。
[参考文献]
[1]中学化学国家课程标准研制组.义务教育课程标准实验教科书·化学(九年级下册)[M].上海:上海教育出版社,2008.
[2]王祖浩.义务教育课程标准实验教科书化学教师教学指导书(九年级下册修订本)[M].上海:上海教育出版社,2008.

