基于珊瑚骨基质的凡纳滨对虾内循环养殖系统的构建与运行效果
牛原青 孙好芬 陆继哲 徐爱玲 宋志文
摘 要:采用珊瑚骨作为生物膜载体,利用海水素配制人工海水,构建盐度为15‰(海水)和5‰(淡水)的两个凡纳滨对虾内循环养殖系统,通过添加硝化细菌菌剂和氮源,分别用8 d和13 d建立硝化功能。按照500尾/m3密度投入虾苗后,海水系统和淡水系统分别运行97 d和83 d。在运行期间淡水和海水系统养殖水体氨氮浓度始终维持在较低水平,平均浓度分别为(0.015±0.008) mg/L和(0.014±0.008) mg/L;在海水系统运行前60 d,亚硝氮浓度维持在较低水平,在60~90 d,亚硝氮浓度呈缓慢上升趋势,在90 d后,海水系统亚硝氮浓度开始快速增加,最终达到3.43 mg/L;淡水系统在运行前40 d亚硝氮浓度维持在较低水平,40 d后开始小幅上升,运行至70 d后,亚硝氮浓度开始快速增加,最终达到0.52 mg/L。最终海水系统和淡水系统凡纳滨对虾存活率分别为51.5%和48.5%。
关键词:凡纳滨对虾;内循环养殖系统;生物膜;氨氮;亚硝氮
本研究采用珊瑚骨作为内循环养殖系统生物膜载体,利用海水素配制人工海水,构建了盐度为5‰和15‰的两个凡纳滨对虾内循环养殖系统,比较研究养水和养殖两个阶段的水质变化和养殖效果。
1 材料与方法
1.1 试验场地
试验在河南省长垣县志鸿农业水产养殖基地进行,选用两个4 m×4 m×1 m水泥池,有效水深0.85 m,养殖池底部中心区域布置6个曝气盘。
1.2 试验材料
试验菌剂为本试验自行制备的硝化细菌菌剂,为氨氧化功能微生物和亚硝酸盐氧化细菌的复合培养物。
人工海水由海水素(青岛海之绚海洋生物有限公司)人工配制而成,淡水池和海水池盐度分别为5‰和15‰。
选用珊瑚骨作为挂膜基质,将珊瑚骨置于大小为0.68 m×0.48 m×0.40 m的多孔隙塑料筐中,海水系统和淡水系统各放置4个,占养殖系统水体的4%。
海水系统选用海大集团淡化至15‰盐度的P5虾苗;淡水系统为同批次经20 d淡化至5‰盐度的虾苗,对虾平均体长1.5 cm。淡水和海水系统养殖密度均为500尾/m3。
1.3 试验方案
包括养水和养殖两个阶段。养水阶段向海水系统和淡水系统投加碳酸氢铵使氨氮初始浓度分别为2 mg/L和5 mg/L,分别加入20 L硝化细菌菌剂,至养殖系统内氨氮及由氨氮转化的亚硝氮降至检测不出,即可投放虾苗。
期间控制水温26~30 ℃,溶解氧大于6.5 mg/L。试验期间不换水,定期补水,并每日检测DO、氨氮浓度和亚硝氮浓度,每周检测硝酸盐氮浓度。
1.4 分析方法
淡水氨氮采用纳氏试剂光度法测定[1];亚硝酸盐氮采用N-(1-萘基)-乙二胺光度法测定[1];硝酸盐氮采用酚二磺酸光度法测定[1];海水氨氮采用次溴酸钠光度法测定[2]。
2 结果与分析
2.1 养水阶段水质变化
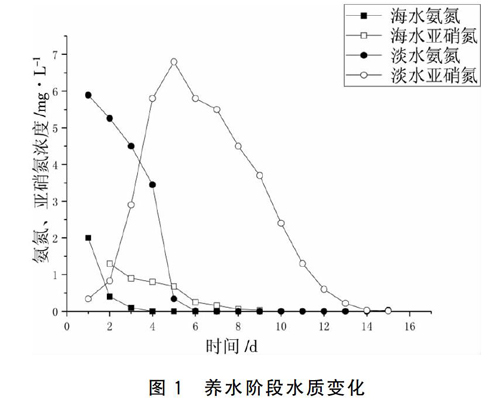
养水阶段海水和淡水系统中氨氮和亚硝酸盐氮浓度变化情况见图1。从图中可以看出,在投放碳酸氢铵之后,海水系统和淡水系统氨氮浓度均呈快速下降趋势,分别在第4天和6天降至检测不出;亚硝氮浓度均呈现先上升再降低的趋势,分别在第2天和第6天达到峰值,峰值浓度分别为1.3 mg/L和6.8 mg/L,在第8天和13天降至检测不出。
图1 养水阶段水质变化
2.2 养殖阶段水质变化
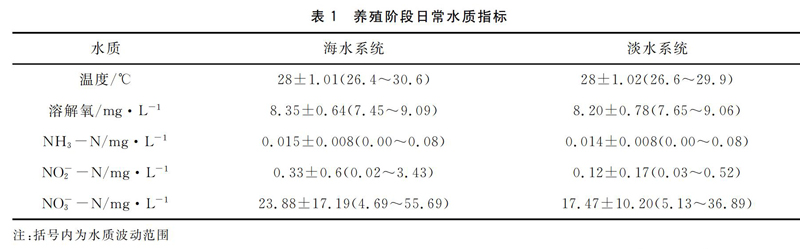
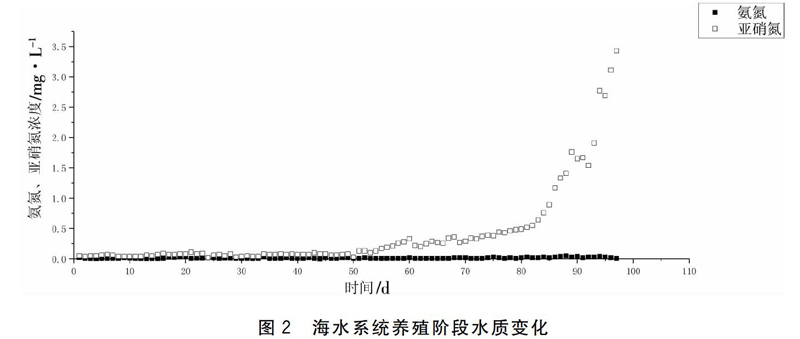
养水阶段日常水质指标和无机氮变化情况见表1和图2~图4。可以看出,海水和淡水系统运行程中,氨氮浓度始终处在较低水平,氨氮平均浓度分别为(0.015±0.008)mg/L和(0.014±0008) mg/L。
海水系统亚硝氮浓度在系统运行前60 d无显著变化,亚硝氮浓度维持较低水平,平均浓度为(0.017±0.06)mg/L;在系统运行60~90 d,亚硝氮浓度开始缓慢上升,在90 d后亚硝氮浓度增速加快,在系统运行末期达到3.43 mg/L。淡水系统在前40 d内亚硝氮浓度维持在较低水平,该阶段亚硝氮浓度最高值为(0.016±0.05)mg/L;在40~70 d,亚硝氮浓度有小幅度上升,该阶段亚硝氮平均浓度为(0.16±0.06)mg/L;在运行70 d后,亚硝氮浓度增长速度加快,在系统运行末期达到0.52 mg/L。
在海水系统运行前5周,硝酸盐氮浓度变化较小,平均浓度为(9.75±3.46)mg/L,第5周之后,亚硝氮浓度开始快速上升,在运行末期达到最大值55.7 mg/L;淡水系统硝酸盐氮浓度增长稳定,在运行末期达到最大值36.89 mg/L。
系统运行结束后对虾生长状况见表2,海水系统和淡水系统对虾成活率分别为51.5%和485%。海水系统养殖对虾平均长度为(15.1±1.2)cm,平均体重为(14.3±0.8)g。淡水系统所养殖对虾的平均长度为(14.9±0.8)cm,平均体重为(14.1±0.7)g,
3 讨论
水质是决定凡纳滨对虾养殖成功与否的关键因素,其中养殖水体中氨和亚硝酸盐的去除至关重要。由于凡纳滨对虾养殖密度大,容易造成水体中氨和亚硝酸盐积累,导致对虾生长缓慢,易受病害影响,成活率降低。
生物膜法通过投加生物膜载体,让硝化功能微生物附着生长[3-5],不仅可以有效去除含氮化合物,尤其是高毒性的氨和亚硝酸盐,提高对虾的存活率和生长率,而且形成的生物膜可作为虾的额外食物来源,提供必要营养素,如不饱和脂肪酸、氨基酸和维生素等。
硝化功能微生物主要包括氨氧化微生物[6](氨氧化细菌AOB和氨氧化古菌AOA)和亚硝酸盐氧化菌(NOB)[7],AOB和AOA将氨转化为亚硝酸盐,NOB则进一步将亚硝酸盐转化为低毒性的硝酸盐。由于AOB、AOA和NOB属自养型微生物,世代时间长,繁殖速度缓慢、对环境因子变化敏感,使其在与异养菌竞争中处于劣势,难以在水体环境中占据优势地位。如果将生物膜填料直接投加到养殖(标苗)池后,在其挂膜过程中水质会出现规律性变化。首先,养殖(标苗)池中存在一定数量的异养菌、氨氧化微生物和亚硝酸盐氧化菌,投加营养后,异养菌逐渐活跃起来,在吸收转化有机物的同时,释放出氨,氨氧化微生物再将氨转化为亚硝酸盐。由于这两类微生物的繁殖速率相差极大,氨氧化微生物世代时间为24~36 h,而異养菌仅约20 min,因而使其初期数量过于悬殊。随着异养菌繁殖,氨浓度也不断增加,当氨含量超出氨氧化微生物吸收消耗范围之外,氨在水体中迅速累积下来,并逐渐升高达到峰值。其后,随着氨氧化微生物不断增殖,氨氧化作用逐渐增强,氨浓度开始逐渐下降,随之亚硝酸盐浓度开始逐渐升高,亚硝酸盐氧化细菌开始发挥功效,进行硝化作用,将亚硝酸盐转化为相对无害的硝酸盐。与氨氧化细菌相比,亚硝酸盐氧化细菌代谢时间更长,因此亚硝酸盐的转化更为缓慢,导致亚硝酸盐逐渐积累并出现峰值。因此,依靠直接投加填料自然挂膜过程会出现氨和亚硝酸盐持续升高现象,导致对虾生病或死亡[8]。通过在养水阶段投加菌剂,使生物膜快速生长,可有效解决这个问题。
从我们的研究结果看,海水与淡水系统经过投加菌剂和碳酸氢铵后,可在短期完成基质挂膜过程,系统前期运行稳定,珊瑚骨生物膜能够有效去除养殖系统中产生的氨氮和亚硝氮,由于珊瑚骨的吸附性良好,会大量吸附系统水体中的微生物与悬浮颗粒,包括水体中的残饵与粪便,调控水质,使水体中的氨氮和亚硝氮浓度始终维持在一个较低的水平。在系统运行后期,珊瑚骨表面吸附了大量悬浮物,导致珊瑚骨内部和系统水体不能进行有效的互换流通,对内循环系统中的微生物群落组成造成冲击,影响系统的硝化功能。由于海水系统矿物质元素含量高、运行时间长,其吸附能力饱和发生早,导致系统的亚硝氮浓度快速升高。
对生物絮团[9]和循环水养殖[10]模式运行效果的研究表明,在其养殖系统运行中期,氨氮浓度均有不同程度的涨幅,亚硝氮浓度也开始迅速增长。而内循环系统运行过程中,氨氮浓度始终维持在较低浓度水平,说明在内循环系统运行中,控制亚硝氮的浓度更为关键。
在本课题组的前期研究[11]中,使用珊瑚骨作为生物膜载体的内循环养殖系统中,对虾成活率最高可以达到80%。而本次试验的对虾成活率较低,分析原因如下:(1)养殖系统盐度越低,对虾对于水体中有毒物质的耐受性越低[12]。由于淡水系统中低盐度的水体环境,对虾对于氨氮和亚硝氮的耐受性低于海水系统,导致淡水系统中的对虾抗风险和抗应激能力低于海水系统;(2)对虾死亡主要发生在养殖后期,分析主要是后期未及时排污,加上珊瑚骨吸附能力饱和,造成系统亚硝氮升高。
在内循环养殖系统中,高效人工基质的筛选至关重要。从课题组前期及本研究结果看,尽管珊瑚骨作为生物膜载体其挂膜时间明显较其他基质快,并且硝化强度也高于其他基质[13],但也存在着价格高、密度大,运输不便等缺点,特别是在系统运行末期,出现吸附能力饱和现象,致使养殖池水体悬浮物增多,并一步导致亚硝酸盐含量升高。由于其在养殖过程中无法实现吸附能力再生,使其使用受到限制。因此,进一步筛选适合内循环养殖系统的人工基质,并且从挂膜时间、硝化活性、价格、运输方式、使用周期、吸附能力能否再生等多方面对基质进行评价,是今后的工作重点,目前本课题组在应用聚氨酯泡沫作为内循环养殖系统人工基质方面已取得一些进展。
4 结论
采用珊瑚骨作为生物膜载体,仅用8 d和13 d完成海水和淡水系统硝化功能的建立。
内循环养殖系统在运行期间水体氨氮浓度始终维持在较低水平,淡水和海水系统氨氮平均浓度分别为分别为(0.015±0.008)mg/L和(0.014±0.008)mg/L。在海水系统运行前60 d,亚硝氮浓度维持在较低水平,在60~90 d,亚硝氮浓度呈缓慢上升趋势,在90 d后,海水系统亚硝氮浓度开始快速增加,最终达到3.43 mg/L;淡水系统在运行前40 d亚硝氮浓度维持在较低水平,40 d后开始小幅度的上升,运行至70 d后,亚硝氮浓度开始快速增加,最终达到0.52 mg/L。
养殖后期由于投饵量和对虾排泄物增加,加上珊瑚骨吸附能力饱和等原因,致使水体中悬浮物和亚硝氮浓度增加。凡纳滨对虾出现死亡,最后海水和淡水系统对虾存活率分别为51.5%和48.5%。
参考文献:
[1] 国家环境保护总局《水和废水监测分析方法》编委会.水和废水监测分析方法[M].4版.北京:中国环境科学出版社,2002:258-268.
[2] 张健,章文军,裘琼芬,等.氨氮次溴酸鈉氧化测定法的改良[J].环境科学与技术,2011,34(11):126-129.
[3] FERREIRA L M H,LARA G,Jr W W,et al.Biofilm versus biofloc:Are artificial substrates for biofilm production necessary in the BFT system.Aquacult Int,2016.4(24),921-930.
[4] FAN L,WANG Z,CHEN M,et al.Microbiota comparison of Pacific white shrimp intestine and sediment at freshwater and marine cultured environment[J].Sci.Total.Enbiron.2018(657),1194-1204.
[5] AHMAD I,RANI M B A,VERMA A K,et al.Biofloc technology: an emerging avenue in aquatic animal healthcare and nutrition[J].Aquacult Int,2017.25(3),1215-1226.
[6] 贺纪正,张丽梅.氨氧化微生物生态学与氮循环研究进展[J].生态学报,2008,29(1):406-415.
[7] 刘志培,刘双江.硝化作用微生物的分子生物学研究进展[J].应用与环境生物学报,2004,10(04):124-128.
[8] 宋余凤,杨宝圣.亚硝酸盐在水产养殖中的危害及解决方法[J].科学养鱼,2010(07):16-16.
[9] 张许光.生物絮团技术在凡纳滨对虾工厂化养殖中的应用与研究[D].中国海洋大学,2012:40-49.
[10] 付腾,郭志勋.全封闭循环水处理系统对凡纳滨对虾养殖水体的净化效果和调控作用[C].2014年中国水产学会学术年会论文摘要集,2014:240-240.
[11] 刘意康.基于基质筛选与微生态制剂组合的自循环对虾养殖系统的构建及运行效果[D].青岛理工大学,2018:32-43.
[12] 潘鲁青,姜令绪.盐度、pH突变对2种养殖对虾免疫力的影响[J].青岛海洋大学学报(自然科学版),2002,32(6):903-910.
[13] 周涛,刘意康,徐爱玲,等.不同基质构建海水养殖系统硝化功能的比较分析[J].河北渔业,2019(9):3-8.
(收稿日期:2019-10-30;修回日期:2019-11-20)
基金项目:山东省重点研发计划项目(公益性科技攻关类)(2018GSF117022)。

